Nuevas perspectivas en el tratamiento de la ... - SciELO España
Nuevas perspectivas en el tratamiento de la ... - SciELO España
Nuevas perspectivas en el tratamiento de la ... - SciELO España
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
108 Sanid. mil. 2011; 67 (2)<br />
INFORMES<br />
<strong>Nuevas</strong> <strong>perspectivas</strong> <strong>en</strong> <strong>el</strong> tratami<strong>en</strong>to <strong>de</strong> <strong>la</strong> Esclerosis<br />
múltiple<br />
Arcos Sánchez C. 1 , Salinas V<strong>el</strong>a FT. 2 , Olmedil<strong>la</strong> González MN. 3<br />
Sanid. mil. 2011; 67 (2): 108-114; ISSN: 1887-8571<br />
RESUMEN<br />
El conocimi<strong>en</strong>to <strong>de</strong> <strong>la</strong> etiopatog<strong>en</strong>ia y <strong>el</strong> pronóstico <strong>de</strong> <strong>la</strong> Esclerosis Múltiple (EM) ha permitido <strong>de</strong>sarrol<strong>la</strong>r tratami<strong>en</strong>tos nuevos y más<br />
eficaces. Las terapias actuales pued<strong>en</strong> dividirse <strong>en</strong> tres gran<strong>de</strong>s grupos: los tratami<strong>en</strong>tos d<strong>el</strong> brote agudo, los modificadores d<strong>el</strong> curso <strong>de</strong> <strong>la</strong><br />
<strong>en</strong>fermedad y <strong>el</strong> tratami<strong>en</strong>to sintomático. Actualm<strong>en</strong>te hay seis fármacos aprobados para <strong>el</strong> tratami<strong>en</strong>to <strong>de</strong> <strong>la</strong> EM <strong>en</strong> <strong>España</strong>, dos nuevos<br />
fármacos orales (C<strong>la</strong>dribina y Fingolimod) y otros <strong>de</strong>stinados a mejorar <strong>la</strong> calidad <strong>de</strong> vida <strong>de</strong> los paci<strong>en</strong>tes (Fampridina y Sativex) están<br />
p<strong>en</strong>di<strong>en</strong>tes <strong>de</strong> aprobación y varios <strong>en</strong> distintas fases <strong>de</strong> estudios clínicos que ofrec<strong>en</strong> <strong>perspectivas</strong> muy esperanzadoras.<br />
PALABRAS CLAVE: Esclerosis múltiple, tratami<strong>en</strong>to, terapia farmacológica.<br />
New perspectives in the treatm<strong>en</strong>t of Multiple Sclerosis<br />
SUMMARY<br />
A best knowledge of etiopathog<strong>en</strong>y and prognosis of Multiple Sclerosis is allowing the <strong>de</strong>v<strong>el</strong>opm<strong>en</strong>t of new and more effective therapies.<br />
Curr<strong>en</strong>t therapies are divi<strong>de</strong>d into three groups: treatm<strong>en</strong>ts for the acute r<strong>el</strong>apses, disease-modifying therapy and symptomatic treatm<strong>en</strong>t.<br />
There are six approved drugs avai<strong>la</strong>ble in Spain, also there are two oral new drugs (C<strong>la</strong>dribina and Fingolimod) and others <strong>de</strong>signed for<br />
improving the quality of life of these pati<strong>en</strong>ts (Frampidina and Sativex) waiting to be approved and some others in differ<strong>en</strong>t stages of clinical<br />
trials that will offer <strong>en</strong>couraging perspectives in a near future.<br />
KEY WORDS: Multiple sclerosis, Treatm<strong>en</strong>t, Drug therapy.<br />
INTRODUCCIÓN<br />
La Esclerosis Múltiple 1 es un trastorno crónico, autoinmunitario<br />
y neuro<strong>de</strong>g<strong>en</strong>erativo d<strong>el</strong> sistema nervioso c<strong>en</strong>tral (SNC) caracterizado<br />
por inf<strong>la</strong>mación, <strong>de</strong>smi<strong>el</strong>inización, pérdida <strong>de</strong> oligod<strong>en</strong>drocitos y<br />
neuronas, que da lugar a una acumu<strong>la</strong>ción <strong>de</strong> discapacidad neurológica.<br />
Continúa si<strong>en</strong>do una <strong>de</strong> <strong>la</strong>s principales causas <strong>de</strong> incapacidad<br />
perman<strong>en</strong>te <strong>en</strong> <strong>la</strong>s personas jóv<strong>en</strong>es.<br />
La EM es una <strong>en</strong>fermedad heterogénea <strong>en</strong> su pres<strong>en</strong>tación y<br />
evolución. Normalm<strong>en</strong>te <strong>la</strong> <strong>en</strong>fermedad se pres<strong>en</strong>ta <strong>en</strong> forma <strong>de</strong><br />
episodios <strong>de</strong> déficit neurológico agudo, dando lugar a una forma<br />
remit<strong>en</strong>te-recurr<strong>en</strong>te (EMRR) que se caracteriza por brotes (recidivas)<br />
seguidos <strong>de</strong> recuperación completa o incompleta. Con <strong>el</strong><br />
tiempo, <strong>en</strong> <strong>la</strong> mayoría <strong>de</strong> los paci<strong>en</strong>tes se produce <strong>la</strong> evolución a un<br />
curso secundariam<strong>en</strong>te progresivo (EMSP), que se caracteriza por<br />
una progresión continua.<br />
Aproximadam<strong>en</strong>te un 10-15% <strong>de</strong> los paci<strong>en</strong>tes con EM pres<strong>en</strong>ta<br />
un curso primario progresivo (EMPP), <strong>de</strong>finido por un <strong>de</strong>terioro <strong>de</strong><br />
<strong>la</strong>s funciones neurológicas <strong>de</strong>s<strong>de</strong> <strong>el</strong> inicio <strong>de</strong> los síntomas sin exacerbaciones<br />
o remisiones superpuestas. En un 1-3% <strong>de</strong> los casos<br />
los paci<strong>en</strong>tes evolucionan <strong>de</strong> manera rápida <strong>en</strong> pocos meses tras <strong>el</strong><br />
inicio <strong>de</strong> <strong>la</strong> <strong>en</strong>fermedad (EM maligna o fulminante).<br />
1 Cap. Médico. Servicio <strong>de</strong> Neurología.<br />
2 Cap. Médico. Servicio <strong>de</strong> Radiodiagnóstico.<br />
3 Cte. Médico. Servicio <strong>de</strong> Neurología.<br />
Hospital C<strong>en</strong>tral <strong>de</strong> <strong>la</strong> Def<strong>en</strong>sa Gómez Ul<strong>la</strong>. Madrid. <strong>España</strong>.<br />
Dirección para correspond<strong>en</strong>cia: Dra. Carolina Arcos Sánchez. Hospital C<strong>en</strong>tral <strong>de</strong> <strong>la</strong> Def<strong>en</strong>sa.<br />
Servicio <strong>de</strong> Neurología. Glorieta d<strong>el</strong> Ejército s/n. 28047 Madrid. E-mail: carcsan@<br />
fn.m<strong>de</strong>.es<br />
Recibido: 3<strong>de</strong> mayo <strong>de</strong> 2010<br />
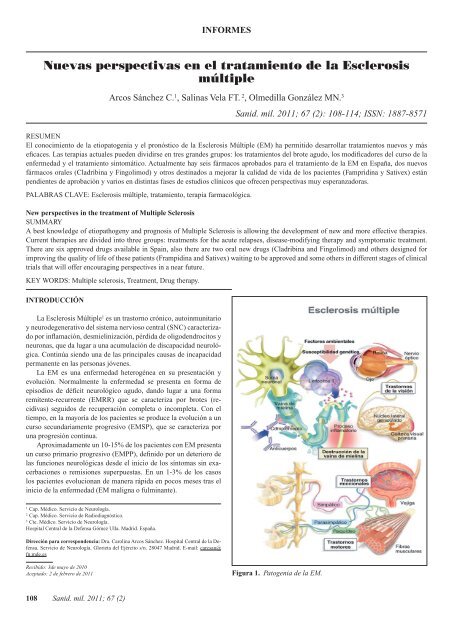
Aceptado: 2 <strong>de</strong> febrero <strong>de</strong> 2011 Figura 1. Patog<strong>en</strong>ia <strong>de</strong> <strong>la</strong> EM.
<strong>Nuevas</strong> <strong>perspectivas</strong> <strong>en</strong> <strong>el</strong> tratami<strong>en</strong>to <strong>de</strong> <strong>la</strong> esclerosis múltiple<br />
Se d<strong>en</strong>omina Síndrome Clínico Ais<strong>la</strong>do (CIS, por sus sig<strong>la</strong>s <strong>en</strong><br />
inglés) al primer brote sugestivo <strong>de</strong> EM, actualm<strong>en</strong>te se inicia <strong>el</strong><br />
tratami<strong>en</strong>to tras este primer episodio, ya que <strong>el</strong> riesgo <strong>de</strong> progresión<br />
a EM Cínicam<strong>en</strong>te Definida (EMCD) es d<strong>el</strong> 82% <strong>en</strong> 20 años.<br />
La EM es una <strong>en</strong>fermedad autoinmunitaria <strong>de</strong>smi<strong>el</strong>inizante crónica<br />
d<strong>el</strong> sistema nervioso c<strong>en</strong>tral (SNC) mediada por linfocitos T<br />
h<strong>el</strong>per 1 CD4+ dirigidos contra antíg<strong>en</strong>os d<strong>el</strong> complejo oligod<strong>en</strong>drocito-mi<strong>el</strong>ina,<br />
si bi<strong>en</strong> <strong>la</strong> participación <strong>de</strong> otros subtipos c<strong>el</strong>u<strong>la</strong>res,<br />
como linfocitos B, monocitos-macrófagos y microglía activada,<br />
conduce a <strong>la</strong> amplificación <strong>de</strong> <strong>la</strong> respuesta inf<strong>la</strong>matoria.<br />
La lesión activa se caracteriza por <strong>la</strong> infiltración multifocal periv<strong>en</strong>u<strong>la</strong>r<br />
<strong>de</strong> <strong>la</strong> sustancia b<strong>la</strong>nca d<strong>el</strong> SNC por linfocitos y monocitos-macrófagos,<br />
<strong>la</strong> pres<strong>en</strong>cia <strong>de</strong> microglia activada y <strong>la</strong> <strong>de</strong>strucción <strong>de</strong> <strong>la</strong> mi<strong>el</strong>ina<br />
y <strong>de</strong> los oligod<strong>en</strong>drocitos formadores <strong>de</strong> mi<strong>el</strong>ina, con pres<strong>en</strong>cia<br />
<strong>de</strong> axones parcialm<strong>en</strong>te mi<strong>el</strong>inizados. A este concepto se ha añadido,<br />
<strong>en</strong> base a los estudios neuropatológicos, <strong>la</strong> pres<strong>en</strong>cia, <strong>de</strong>s<strong>de</strong> <strong>la</strong>s fases<br />
iniciales <strong>de</strong> <strong>la</strong> <strong>en</strong>fermedad, <strong>de</strong> fragm<strong>en</strong>tación <strong>de</strong> axones y <strong>de</strong>pósito <strong>de</strong><br />
proteína precursora <strong>de</strong> amiloi<strong>de</strong> y los estudios <strong>de</strong> neuroimag<strong>en</strong> muestran<br />
conc<strong>en</strong>traciones reducidas <strong>de</strong> N-aceti<strong>la</strong>spartato (marcador <strong>de</strong> integridad<br />
axonal) y atrofia cerebral, esto ha llevado a consi<strong>de</strong>rar a <strong>la</strong> EM<br />
como una <strong>en</strong>fermedad inf<strong>la</strong>matoria pero también neuro<strong>de</strong>g<strong>en</strong>erativa.<br />
Este mayor conocimi<strong>en</strong>to <strong>de</strong> <strong>la</strong> <strong>en</strong>fermedad p<strong>la</strong>ntea nuevas <strong>perspectivas</strong><br />
<strong>en</strong> <strong>el</strong> diagnóstico y <strong>en</strong> <strong>el</strong> tratami<strong>en</strong>to.<br />
TRATAMIENTO DE LA EM<br />
La heterog<strong>en</strong>eidad <strong>en</strong> <strong>la</strong> evolución <strong>de</strong> <strong>la</strong> <strong>en</strong>fermedad es reflejo<br />
<strong>de</strong> los difer<strong>en</strong>tes mecanismos inmunopatológicos subyac<strong>en</strong>tes,<br />
los cuales van a condicionar <strong>la</strong> <strong>el</strong>ección <strong>de</strong> <strong>la</strong> estrategia terapéutica<br />
apropiada.<br />
Cuando hab<strong>la</strong>mos <strong>de</strong> tratami<strong>en</strong>to <strong>de</strong> <strong>la</strong> EM 2 éste incluye: <strong>el</strong> tratami<strong>en</strong>to<br />
d<strong>el</strong> brote agudo, los fármacos modificadores d<strong>el</strong> curso <strong>de</strong> <strong>la</strong><br />
<strong>en</strong>fermedad 3 y los fármacos <strong>de</strong>stinados a <strong>la</strong> mejoría <strong>de</strong> los síntomas<br />
asociados a <strong>la</strong> <strong>en</strong>fermedad. El reto sigue si<strong>en</strong>do <strong>en</strong>contrar fármacos<br />
curativos, con efecto profiláctico o bi<strong>en</strong> fármacos capaces <strong>de</strong> reparar<br />
<strong>la</strong>s alteraciones neurológicas producidas.<br />
No todas <strong>la</strong>s formas <strong>de</strong> EM cu<strong>en</strong>tan con un tratami<strong>en</strong>to <strong>de</strong> eficacia<br />
probada, sino únicam<strong>en</strong>te <strong>la</strong> forma recurr<strong>en</strong>te-remit<strong>en</strong>te y <strong>la</strong> secundariam<strong>en</strong>te<br />
progresiva con brotes. Lo que se persigue con <strong>el</strong> tra-<br />
Figura 2. Imag<strong>en</strong> típica <strong>de</strong> EM <strong>en</strong> RMN <strong>en</strong>cefálica.<br />
tami<strong>en</strong>to es reducir <strong>el</strong> número y <strong>la</strong> severidad <strong>de</strong> los brotes y limitar<br />
<strong>la</strong> acumu<strong>la</strong>ción <strong>de</strong> secu<strong>el</strong>as, sin ocasionar con <strong>el</strong>lo efectos adversos.<br />
En <strong>la</strong> actualidad se dispone <strong>de</strong> seis fármacos modificadores d<strong>el</strong><br />
curso <strong>de</strong> <strong>la</strong> <strong>en</strong>fermedad con indicación para EM son tres interferones<br />
beta, acetato <strong>de</strong> g<strong>la</strong>tiramero, natalizumab y mitoxantrona, también<br />
está aprobado <strong>el</strong> uso <strong>de</strong> azatioprina y <strong>de</strong> inmunoglobulinas humanas.<br />
Estos fármacos pued<strong>en</strong> dividirse <strong>en</strong> dos líneas <strong>de</strong> tratami<strong>en</strong>to,<br />
<strong>en</strong> <strong>la</strong> primera línea se <strong>en</strong>contrarían los interferones y <strong>el</strong> acetato <strong>de</strong><br />
g<strong>la</strong>tiramero y <strong>en</strong> <strong>la</strong> segunda <strong>la</strong> mitoxantrona y <strong>el</strong> natalizumab, probablem<strong>en</strong>te<br />
más eficaces pero con mayor índice <strong>de</strong> efectos adversos<br />
pot<strong>en</strong>cialm<strong>en</strong>te graves que los primeros que cu<strong>en</strong>tan un razonable<br />
perfil <strong>de</strong> seguridad y tolerancia.<br />
La eficacia <strong>de</strong> un tratami<strong>en</strong>to se mi<strong>de</strong> <strong>en</strong> términos <strong>de</strong> reducción<br />
<strong>de</strong> <strong>la</strong> tasa <strong>de</strong> brotes, <strong>de</strong> progresión <strong>de</strong> <strong>la</strong> <strong>en</strong>fermedad y <strong>en</strong> <strong>la</strong> actividad<br />
<strong>en</strong> Resonancia Magnética Nuclear (RMN) 4 . De estos tres parámetros,<br />
<strong>la</strong> pres<strong>en</strong>cia <strong>de</strong> cambios inf<strong>la</strong>matorios <strong>en</strong> RMN es <strong>el</strong> indicador<br />
más s<strong>en</strong>sible <strong>de</strong> monitorización <strong>de</strong> <strong>la</strong> respuesta al tratami<strong>en</strong>to. Se<br />
ha establecido <strong>la</strong> no eficacia <strong>de</strong> un tratami<strong>en</strong>to si a los 6-12 meses<br />
existe actividad <strong>en</strong> RMN. Sin embargo, <strong>en</strong> los d<strong>en</strong>ominados bu<strong>en</strong>os<br />
respon<strong>de</strong>dores se evid<strong>en</strong>cia una disminución d<strong>el</strong> volum<strong>en</strong> lesional<br />
<strong>en</strong> T1 y T2.<br />
Asimismo <strong>en</strong> <strong>el</strong> mom<strong>en</strong>to actual se abre una nueva perspectiva<br />
<strong>en</strong> <strong>el</strong> tratami<strong>en</strong>to, se están realizando múltiples <strong>en</strong>sayos clínicos y<br />
ya hay fármacos, tanto modificadores d<strong>el</strong> curso <strong>de</strong> <strong>la</strong> <strong>en</strong>fermedad<br />
como tratami<strong>en</strong>tos sintomáticos, p<strong>en</strong>di<strong>en</strong>tes <strong>de</strong> aprobación y cuya<br />
comercialización está prevista para <strong>el</strong> próximo año, que cu<strong>en</strong>tan con<br />
una v<strong>en</strong>taja fundam<strong>en</strong>tal: su administración por vía oral. A los que<br />
progresivam<strong>en</strong>te se añadirán aqu<strong>el</strong>los que se <strong>en</strong>cu<strong>en</strong>tran <strong>en</strong> distintas<br />
fases <strong>de</strong> <strong>en</strong>sayos clínicos.<br />
TRATAMIENTO DEL BROTE AGUDO<br />
El tratami<strong>en</strong>to d<strong>el</strong> brote agudo 5 se basa fundam<strong>en</strong>talm<strong>en</strong>te <strong>en</strong> <strong>el</strong><br />
empleo <strong>de</strong> megadosis <strong>de</strong> corticosteroi<strong>de</strong>s por vía <strong>en</strong>dov<strong>en</strong>osa, habitualm<strong>en</strong>te<br />
se administra 1g al día <strong>de</strong> 6-metilprednisolona durante 3<br />
o 5 días, que pue<strong>de</strong> estar seguido <strong>de</strong> una pauta oral <strong>de</strong>sc<strong>en</strong>d<strong>en</strong>te. Los<br />
glucocorticoi<strong>de</strong>s disminuy<strong>en</strong> <strong>la</strong> transcripción <strong>de</strong> citocinas proinf<strong>la</strong>matorias,<br />
regu<strong>la</strong>n <strong>la</strong> expresión <strong>de</strong> molécu<strong>la</strong>s <strong>de</strong> adhesión a <strong>la</strong> barrera<br />
hemato<strong>en</strong>cefálica, reduc<strong>en</strong> <strong>el</strong> e<strong>de</strong>ma tisu<strong>la</strong>r y <strong>el</strong> reclutami<strong>en</strong>to <strong>de</strong><br />
célu<strong>la</strong>s inf<strong>la</strong>matorias. Lo que se consigue con este tratami<strong>en</strong>to es<br />
acortar <strong>la</strong> duración <strong>de</strong> un brote y ac<strong>el</strong>erar <strong>la</strong> recuperación <strong>en</strong> paci<strong>en</strong>tes<br />
con un primer brote sugestivo <strong>de</strong> EM o CIS, <strong>en</strong> EMRR y <strong>en</strong> <strong>la</strong><br />
EMSP con brotes.<br />
También se ha utilizado <strong>la</strong> p<strong>la</strong>smaféresis, como segunda línea<br />
<strong>de</strong> tratami<strong>en</strong>to. En un estudio aleatorizado <strong>el</strong> 42% <strong>de</strong> los paci<strong>en</strong>tes<br />
que recibieron tratami<strong>en</strong>to activo pres<strong>en</strong>taron una mejoría funcional<br />
importante, fr<strong>en</strong>te al 5,9% <strong>de</strong> los que recibieron p<strong>la</strong>cebo. Solo<br />
se usa <strong>en</strong> casos excepcionales y serían necesarios nuevos estudios<br />
contro<strong>la</strong>dos y a más <strong>la</strong>rgo p<strong>la</strong>zo para comprobar <strong>la</strong> eficacia real <strong>de</strong><br />
este tratami<strong>en</strong>to.<br />
FÁRMACOS MODIFICADORES DEL CURSO DE LA<br />
ENFERMEDAD<br />
Estas terapias son aqu<strong>el</strong><strong>la</strong>s que han <strong>de</strong>mostrado eficacia para<br />
modificar <strong>la</strong> actividad <strong>de</strong> <strong>la</strong> <strong>en</strong>fermedad, a través <strong>de</strong> <strong>la</strong> disminución<br />
Sanid. mil. 2011; 67 (2) 109
C. Arcos Sánchez, et al.<br />
d<strong>el</strong> número y <strong>la</strong> gravedad <strong>de</strong> los brotes, y previni<strong>en</strong>do o retrasando<br />
<strong>la</strong> progresión <strong>de</strong> <strong>la</strong> discapacidad neurológica.<br />
Los fármacos incluidos <strong>en</strong> este grupo, actualm<strong>en</strong>te aprobados<br />
son los Interferones, <strong>el</strong> Acetato <strong>de</strong> G<strong>la</strong>tiramero, <strong>el</strong> Natalizumab, <strong>la</strong><br />
Mitoxantrona, <strong>la</strong> Azatioprina y otros inmunosupresores. Estos han<br />
<strong>de</strong>mostrado una tasa <strong>de</strong> disminución <strong>de</strong> brotes que osci<strong>la</strong> <strong>en</strong>tre <strong>el</strong> 18<br />
y <strong>el</strong> 68% y una m<strong>en</strong>or progresión <strong>de</strong> <strong>la</strong> <strong>en</strong>fermedad <strong>de</strong> <strong>en</strong>tre <strong>el</strong> 12<br />
y <strong>el</strong> 75%. También <strong>en</strong>contramos difer<strong>en</strong>cias <strong>en</strong> cuanto a un <strong>en</strong>l<strong>en</strong>tecimi<strong>en</strong>to<br />
<strong>de</strong> <strong>la</strong> evolución radiológica <strong>de</strong>mostrada por resonancia<br />
magnética (RM), dato muy importante <strong>en</strong> cuanto <strong>el</strong> pronóstico <strong>de</strong><br />
<strong>la</strong> <strong>en</strong>fermedad.<br />
INTERFERONES<br />
Los interferones 6 son un grupo <strong>de</strong> glucoproteínas producidas por<br />
numerosas célu<strong>la</strong>s d<strong>el</strong> organismo a raíz <strong>de</strong> infecciones virales o <strong>de</strong><br />
<strong>la</strong> interacción con superantíg<strong>en</strong>os o mitóg<strong>en</strong>os. Ti<strong>en</strong><strong>en</strong> un amplio espectro<br />
<strong>de</strong> efectos antivirales, antiproliferativos e inmunomodu<strong>la</strong>dores,<br />
los mecanismos <strong>de</strong> acción no están bi<strong>en</strong> establecidos; disminuy<strong>en</strong> <strong>la</strong><br />
síntesis <strong>de</strong> citocinas y <strong>la</strong> expresión <strong>de</strong> sus receptores, reduc<strong>en</strong> <strong>el</strong> acceso<br />
<strong>de</strong> célu<strong>la</strong>s inf<strong>la</strong>matorias al SNC mediante <strong>la</strong> inhibición <strong>de</strong> metaloproteinasas<br />
<strong>de</strong> matriz, efectos sobre <strong>la</strong> proliferación <strong>de</strong> célu<strong>la</strong>s T y <strong>la</strong><br />
liberación <strong>de</strong> IFN-gamma, <strong>la</strong> migración <strong>de</strong> célu<strong>la</strong>s T, <strong>la</strong> expresión <strong>de</strong><br />
molécu<strong>la</strong>s d<strong>el</strong> complejo mayor <strong>de</strong> histocompatibilidad (CMH-II) por<br />
parte d<strong>el</strong> IFN-gamma, <strong>la</strong> expresión <strong>de</strong> óxido nítrico sintetasa inducible<br />
y <strong>la</strong> expresión d<strong>el</strong> factor neural <strong>de</strong> crecimi<strong>en</strong>to, <strong>en</strong>tre otros.<br />
Supon<strong>en</strong> un tratami<strong>en</strong>to inmunomodu<strong>la</strong>dor <strong>de</strong> primera línea, <strong>en</strong><br />
EMRR, EMSP y CIS. La eficacia <strong>de</strong> los IFN-beta ha quedado establecida<br />
<strong>en</strong> varios <strong>en</strong>sayos clínicos multicéntricos, aleatorizados y<br />
contro<strong>la</strong>dos con p<strong>la</strong>cebo, con una evid<strong>en</strong>cia <strong>de</strong> c<strong>la</strong>se I.<br />
Los IFN-beta han <strong>de</strong>mostrado ser capaces <strong>de</strong> reducir <strong>la</strong> actividad<br />
<strong>de</strong> <strong>la</strong> <strong>en</strong>fermedad, tanto clínica, <strong>en</strong> cuanto a reducción <strong>de</strong> <strong>la</strong> tasa <strong>de</strong><br />
brotes (33%), como subclínica, <strong>en</strong> cuanto a carga lesional y actividad<br />
<strong>en</strong> RMN.<br />
Aún es controvertido si una mayor dosis y/o una mayor frecu<strong>en</strong>cia<br />
<strong>de</strong> administración supon<strong>en</strong> un mayor b<strong>en</strong>eficio terapéutico, los<br />
estudios realizados aportan resultados dispares.<br />
El tratami<strong>en</strong>to con IFN-beta se asocia a <strong>la</strong> producción <strong>de</strong> anticuerpos<br />
neutralizantes (NAb, por sus sig<strong>la</strong>s <strong>en</strong> inglés) anti-IFN. La<br />
producción <strong>de</strong> anticuerpos es m<strong>en</strong>or para <strong>el</strong> IFN-beta 1a intramuscu<strong>la</strong>r.<br />
Si bi<strong>en</strong> <strong>el</strong> niv<strong>el</strong> <strong>de</strong> evid<strong>en</strong>cia es <strong>de</strong> c<strong>la</strong>se II, parece que su pres<strong>en</strong>cia<br />
persist<strong>en</strong>te <strong>en</strong> suero <strong>de</strong>termina una reducción <strong>de</strong> <strong>la</strong> eficacia<br />
<strong>de</strong> los IFN-beta.<br />
Los efectos secundarios son simi<strong>la</strong>res, produc<strong>en</strong> fundam<strong>en</strong>talm<strong>en</strong>te<br />
un cuadro pseudogripal caracterizado por fatiga, fiebre y<br />
mialgias, <strong>el</strong> día <strong>de</strong> <strong>la</strong> inyección y que va disminuy<strong>en</strong>do progresivam<strong>en</strong>te<br />
durante <strong>el</strong> tratami<strong>en</strong>to. Otros efectos secundarios son un<br />
aum<strong>en</strong>to leve <strong>de</strong> <strong>la</strong>s <strong>en</strong>zimas hepáticas y <strong>la</strong> linfocitop<strong>en</strong>ia mo<strong>de</strong>rada,<br />
que rara vez obligan a susp<strong>en</strong><strong>de</strong>r <strong>el</strong> tratami<strong>en</strong>to.<br />
ACETATO DE GLATIRAMERO<br />
El acetato <strong>de</strong> g<strong>la</strong>tiramero (AG) 7 es <strong>el</strong> otro inmunomodu<strong>la</strong>dor <strong>de</strong><br />
primera línea aprobado para <strong>el</strong> tratami<strong>en</strong>to <strong>de</strong> <strong>la</strong> EM. Ha <strong>de</strong>mostrado<br />
reducir <strong>la</strong> actividad <strong>de</strong> <strong>la</strong> <strong>en</strong>fermedad tanto clínica como radiológica,<br />
así como retrasar <strong>la</strong> acumu<strong>la</strong>ción <strong>de</strong> discapacidad.<br />
110 Sanid. mil. 2011; 67 (2)<br />
Tab<strong>la</strong> 1. Parámetros <strong>de</strong> RMN que indican pres<strong>en</strong>cia <strong>de</strong> actividad<br />
inf<strong>la</strong>matoria.<br />
Análogo sintético <strong>de</strong> <strong>la</strong> proteína básica <strong>de</strong> <strong>la</strong> mi<strong>el</strong>ina, se <strong>de</strong>sarrolló<br />
para estudiar <strong>la</strong> biología <strong>de</strong> <strong>la</strong> <strong>en</strong>cefalomi<strong>el</strong>itis autoinmune<br />
experim<strong>en</strong>tal.<br />
No atraviesa <strong>la</strong> barrera hemato<strong>en</strong>cefálica, se une a molécu<strong>la</strong>s<br />
<strong>de</strong> CMH-I situadas <strong>en</strong> <strong>la</strong> superficie <strong>de</strong> <strong>la</strong>s célu<strong>la</strong>s pres<strong>en</strong>tadoras <strong>de</strong><br />
antíg<strong>en</strong>o (CPA) que reconoc<strong>en</strong> antíg<strong>en</strong>os <strong>de</strong> <strong>la</strong> proteína básica <strong>de</strong> <strong>la</strong><br />
mi<strong>el</strong>ina (PBM), previni<strong>en</strong>do <strong>la</strong> expansión linfocitaria.<br />
Estimu<strong>la</strong> <strong>la</strong> producción <strong>de</strong> citocinas antiinf<strong>la</strong>matorias. También<br />
se estudia <strong>el</strong> posible efecto neuroprotector a niv<strong>el</strong> <strong>de</strong> SNC.<br />
Según <strong>la</strong> literatura no exist<strong>en</strong> difer<strong>en</strong>cias significativas si se<br />
compara con <strong>el</strong> tratami<strong>en</strong>to con IFN. Se estima que <strong>la</strong> disminución<br />
<strong>de</strong> tasa <strong>de</strong> brotes, con ambos tipos <strong>de</strong> inmunomodu<strong>la</strong>dores, ronda<br />
<strong>el</strong> 29%.<br />
NATALIZUMAB<br />
– Lesiones activas.<br />
– Lesiones nuevas <strong>en</strong> T2.<br />
– Lesiones que capt<strong>en</strong> contraste.<br />
El natalizumab 8,9 es <strong>el</strong> primer anticuerpo monoclonal aprobado<br />
para <strong>la</strong> EMRR. Se trata <strong>de</strong> un anticuerpo monoclonal IgG4k humanizado,<br />
evita <strong>la</strong> unión linfocito-<strong>en</strong>dot<strong>el</strong>io e impi<strong>de</strong> <strong>la</strong> migración<br />
c<strong>el</strong>u<strong>la</strong>r a través <strong>de</strong> <strong>la</strong> barrera hemato<strong>en</strong>cefálica. Su efecto es inmunosupresor<br />
y antiinf<strong>la</strong>matorio.<br />
Eficacia <strong>de</strong>mostrada <strong>en</strong> <strong>el</strong> control <strong>de</strong> <strong>la</strong> actividad inf<strong>la</strong>matoria,<br />
<strong>el</strong> 37% <strong>de</strong> los paci<strong>en</strong>tes se <strong>en</strong>cu<strong>en</strong>tran libres <strong>de</strong> actividad <strong>de</strong> <strong>la</strong> <strong>en</strong>fermedad.<br />
La tasa <strong>de</strong> reducción <strong>de</strong> brotes es d<strong>el</strong> 68% y <strong>en</strong>l<strong>en</strong>tece <strong>el</strong><br />
empeorami<strong>en</strong>to <strong>de</strong> <strong>la</strong> discapacidad (42%).<br />
Indicado para formas EMRR que no respond<strong>en</strong> a<strong>de</strong>cuadam<strong>en</strong>te<br />
o no toleran otros tratami<strong>en</strong>tos, o <strong>en</strong> formas agresivas <strong>de</strong>s<strong>de</strong> <strong>el</strong> inicio.<br />
Se usa <strong>en</strong> monoterapia. Se administra a dosis <strong>de</strong> 300mg cada 28<br />
días por vía <strong>en</strong>dov<strong>en</strong>osa.<br />
Hasta un 6% <strong>de</strong> los paci<strong>en</strong>tes pued<strong>en</strong> <strong>de</strong>sarrol<strong>la</strong>r anticuerpos<br />
persist<strong>en</strong>tes contra <strong>el</strong> natalizumab, lo que se ha asociado a una disminución<br />
<strong>de</strong> <strong>la</strong> eficacia y a un increm<strong>en</strong>to <strong>de</strong> los efectos secundarios.<br />
Los efectos secundarios más frecu<strong>en</strong>tes son cefalea, fatiga y<br />
congestión nasal. Tras un breve periodo <strong>de</strong> comercialización <strong>en</strong> Estados<br />
Unidos, <strong>el</strong> natalizumab se retiró d<strong>el</strong> mercado al conocerse <strong>la</strong><br />
aparición <strong>de</strong> tres casos <strong>de</strong> leuco<strong>en</strong>cefalopatía multifocal progresiva<br />
(LMP), se volvió a aprobar <strong>en</strong> junio <strong>de</strong> 2006. A fecha 31 <strong>de</strong> diciem-<br />
Tab<strong>la</strong> 2. Fármacos aprobados <strong>en</strong> <strong>España</strong> para <strong>el</strong> tratami<strong>en</strong>to <strong>de</strong><br />
<strong>la</strong> EM.<br />
Fármaco Especialidad Dosis recom<strong>en</strong>dada<br />
Acetato <strong>de</strong> g<strong>la</strong>tiramero Copaxone ® 20 mg s.c. 1 vez al día.<br />
Interferón beta-1 a Rebif ® 22/44 µg s.c. 3 veces por semana.<br />
Avonex ® 20 µg i.m. 1 vez por semana.<br />
Interferón beta-1b Betaferon ® 8MU s.c. <strong>en</strong> días alternos.<br />
Extavia ® 0,25 mg s.c. 1 vez al día<br />
Mitoxantrona Novantrone ® 12 mg/m 2 1 vez cada 3 meses.<br />
Natalizumab Tysabri ® 300 mg i.v. cada 28 días.<br />
Azatioprina Imur<strong>el</strong> ® 0,3 mg/kg/día v.o.
<strong>Nuevas</strong> <strong>perspectivas</strong> <strong>en</strong> <strong>el</strong> tratami<strong>en</strong>to <strong>de</strong> <strong>la</strong> esclerosis múltiple<br />
Tab<strong>la</strong> 3. Fármacos p<strong>en</strong>di<strong>en</strong>tes <strong>de</strong> aprobación <strong>en</strong> <strong>España</strong> para <strong>el</strong> tratami<strong>en</strong>to <strong>de</strong> <strong>la</strong> EM.<br />
Uso previsto Fármaco Especialidad Dosis recom<strong>en</strong>dada<br />
Tratami<strong>en</strong>to sintomático Nabiximol Sativex ® Pulverización sublingual 4-24 al día.<br />
Modificadores C<strong>la</strong>dribina Leustatin ®<br />
bre <strong>de</strong> 2009 había 64.600 paci<strong>en</strong>tes tratados con natalizumab, hasta<br />
<strong>el</strong> 9 <strong>de</strong> febrero <strong>de</strong> 2010 se han pres<strong>en</strong>tado 35 casos confirmados <strong>de</strong><br />
LMP, lo que supone un riesgo <strong>de</strong> 0,52 por 1000 paci<strong>en</strong>tes. De los 35<br />
casos han fallecido 8 paci<strong>en</strong>tes. La experi<strong>en</strong>cia indica que <strong>el</strong> riesgo<br />
<strong>de</strong> LMP aum<strong>en</strong>ta a mayor duración d<strong>el</strong> tratami<strong>en</strong>to y es bajo <strong>en</strong> <strong>el</strong><br />
primer año <strong>de</strong> infusión.<br />
MITOXANTRONA<br />
La mitoxantrona 10 es un fármaco inmunosupresor e inmunomodu<strong>la</strong>dor.<br />
Es un <strong>de</strong>rivado sintético <strong>de</strong> <strong>la</strong> antraciclina que actúa intercalándose<br />
<strong>en</strong> <strong>el</strong> ADN y rompi<strong>en</strong>do sus cad<strong>en</strong>as y <strong>la</strong>s posteriores<br />
uniones cruzadas <strong>en</strong>tre <strong>el</strong><strong>la</strong>s.<br />
Ha <strong>de</strong>mostrado reducción <strong>en</strong> <strong>la</strong> tasa anual <strong>de</strong> brotes, una l<strong>en</strong>tificación<br />
<strong>en</strong> <strong>la</strong> progresión <strong>de</strong> <strong>la</strong> <strong>en</strong>fermedad y una mejoría <strong>en</strong> los<br />
parámetros <strong>de</strong> RMN. Indicada <strong>en</strong> EMRR, EMSP y EMPR.<br />
Cu<strong>en</strong>ta con dos pot<strong>en</strong>ciales efectos adversos severos: cardiotoxicidad,<br />
que pue<strong>de</strong> alcanzar <strong>el</strong> 5% cuando se supera una dosis<br />
acumu<strong>la</strong>da <strong>de</strong> 100 mg/m² y que hace preciso monitorizar <strong>la</strong><br />
función cardiaca, y leucemia mi<strong>el</strong>oi<strong>de</strong> aguda, in<strong>de</strong>p<strong>en</strong>di<strong>en</strong>te <strong>de</strong><br />
<strong>la</strong> dosis, con una frecu<strong>en</strong>cia alre<strong>de</strong>dor d<strong>el</strong> 0,25% y que se pue<strong>de</strong><br />
pres<strong>en</strong>tar <strong>de</strong> forma tardía hasta cinco años <strong>de</strong>spués <strong>de</strong> finalizar <strong>el</strong><br />
tratami<strong>en</strong>to.<br />
AZATIOPRINA<br />
Fampridina No comerc. 1 comp. 10 mg/12 h v.o.<br />
Litak ®<br />
Fingolimod Gil<strong>en</strong>ya ® 1 comp. 0,5 mg/24 h v.o.<br />
La azatioprina 11 es un fármaco con efectos inmunosupresores<br />
inespecíficos que afecta a <strong>la</strong> replicación d<strong>el</strong> ADN, por su actividad<br />
contra los metabolitos <strong>de</strong> <strong>la</strong> purina. Su efecto b<strong>en</strong>eficioso aparece <strong>de</strong><br />
forma diferida, pasados <strong>en</strong>tres tres y seis meses <strong>de</strong>s<strong>de</strong> <strong>el</strong> inicio d<strong>el</strong><br />
tratami<strong>en</strong>to.<br />
Hasta <strong>el</strong> año 1995 era <strong>el</strong> único tratami<strong>en</strong>to disponible para <strong>la</strong> EM.<br />
Alternativa <strong>en</strong> EMRR <strong>en</strong> paci<strong>en</strong>tes que no toleran o rechazan<br />
los fármacos <strong>de</strong> primera línea, si bi<strong>en</strong> no se dispone <strong>de</strong> estudios<br />
c<strong>la</strong>se I que aval<strong>en</strong> su eficacia. Es posible que reduzca <strong>la</strong> tasa <strong>de</strong><br />
brotes pero no se ha mostrado eficaz para evitar <strong>la</strong> progresión <strong>de</strong><br />
<strong>la</strong> discapacidad.<br />
Tab<strong>la</strong> 4. Fármacos <strong>en</strong> distintas fases <strong>de</strong> <strong>en</strong>sayos clínicos para <strong>el</strong><br />
tratami<strong>en</strong>to <strong>de</strong> <strong>la</strong> EM.<br />
Uso previsto Fármaco Dosis recom<strong>en</strong>dada<br />
Inmunomodu<strong>la</strong>dor Laquinimod 1comp. 0,6 mg/24 h v.o.<br />
Teriflunamida Dosis óptima no establecida.<br />
BG12 Dosis óptima no establecida.<br />
Inmunosupresor Alemtuzumab Administración anual i.v.<br />
Rituximab-Ocr<strong>el</strong>izumab 2 ciclos <strong>de</strong> 1 gr/15 días i.v.<br />
1-2 comp./24 h <strong>en</strong> cursos <strong>de</strong> 4-5 días consecutivos cada 28 días. 2-4 series v.o.<br />
Sus efectos secundarios más frecu<strong>en</strong>tes son leucop<strong>en</strong>ia reversible,<br />
efectos sistémicos y hepatotoxicidad. Pue<strong>de</strong> ser conv<strong>en</strong>i<strong>en</strong>te<br />
administrar ácido fólico durante <strong>el</strong> tratami<strong>en</strong>to.<br />
OTROS INMUNOSUPRESORES<br />
Entre los fármacos inmunosupresores 12 que se utilizan <strong>en</strong> <strong>la</strong> actualidad,<br />
<strong>de</strong>stacan:<br />
– CICLOFOSFAMIDA: Con propieda<strong>de</strong>s antimitóticas e inmunosupresoras.<br />
Ha <strong>de</strong>mostrado un <strong>en</strong>l<strong>en</strong>tecimi<strong>en</strong>to <strong>de</strong> <strong>la</strong> progresión<br />
<strong>de</strong> <strong>la</strong> <strong>en</strong>fermedad.<br />
– METOTREXATO: Inmunosupresor que interfiere <strong>en</strong> <strong>la</strong> síntesis<br />
<strong>de</strong> ADN con efectos inhibidores sobre <strong>la</strong> g<strong>en</strong>eración <strong>de</strong> mediadores<br />
inf<strong>la</strong>matorios. Se ha establecido una recom<strong>en</strong>dación <strong>de</strong> tipo C<br />
<strong>en</strong> EM progresiva.<br />
– CICLOSPORINA: Inmunosupresor que provoca una <strong>de</strong>pleción<br />
s<strong>el</strong>ectiva <strong>de</strong> linfocitos T h<strong>el</strong>per. Pue<strong>de</strong> t<strong>en</strong>er algún efecto b<strong>en</strong>eficioso<br />
<strong>en</strong> EM progresiva.<br />
ESTEROIDES<br />
Se está estudiando su utilización como tratami<strong>en</strong>to patogénico<br />
<strong>de</strong> <strong>la</strong> <strong>en</strong>fermedad, <strong>en</strong> forma <strong>de</strong> pulsos periódicos que podrían disminuir<br />
<strong>la</strong> progresión, <strong>el</strong> volum<strong>en</strong> lesional y <strong>la</strong> atrofia cerebral. Ya se<br />
está administrando <strong>en</strong> algunos c<strong>en</strong>tros durante <strong>el</strong> puerperio, por <strong>el</strong><br />
mayor riesgo <strong>de</strong> brotes <strong>en</strong> este periodo.<br />
INMUNOGLOBULINAS<br />
Se han estudiado <strong>en</strong> paci<strong>en</strong>tes con CIS, <strong>en</strong> los que se observó<br />
una reducción significativa <strong>de</strong> <strong>la</strong> probabilidad <strong>de</strong> pres<strong>en</strong>tar EM clínicam<strong>en</strong>te<br />
<strong>de</strong>finida (EMCD).<br />
En EMRR parece que pued<strong>en</strong> disminuir <strong>la</strong> tasa <strong>de</strong> brotes, sin que<br />
modifiqu<strong>en</strong> <strong>la</strong> progresión <strong>de</strong> <strong>la</strong> <strong>en</strong>fermedad.<br />
PLASMAFÉRESIS<br />
Este tratami<strong>en</strong>to no está indicado excepto <strong>en</strong> los brotes refractarios<br />
a esteroi<strong>de</strong>s.<br />
El inicio precoz <strong>de</strong> <strong>la</strong> p<strong>la</strong>smaféresis ha <strong>de</strong>mostrado mejoría clínica<br />
d<strong>el</strong> brote tras <strong>la</strong> sesión.<br />
Se ha utilizado para <strong>la</strong> reconstitución inmunológica <strong>en</strong> casos <strong>de</strong><br />
LMP <strong>en</strong> paci<strong>en</strong>tes tratados con natalizumab (aunque pue<strong>de</strong> existir<br />
riesgo <strong>de</strong> aparición <strong>de</strong> Sd. Inf<strong>la</strong>matorio <strong>de</strong> reconstitución inmunológica).<br />
Sanid. mil. 2011; 67 (2) 111
C. Arcos Sánchez, et al.<br />
HACIA UN NUEVO ALGORITMO TERAPEÚTICO<br />
Actualm<strong>en</strong>te exist<strong>en</strong> múltiples tratami<strong>en</strong>tos <strong>en</strong> distintas fases <strong>de</strong><br />
<strong>en</strong>sayos clínicos, son fármacos <strong>de</strong> características muy difer<strong>en</strong>tes,<br />
con indicaciones aún por <strong>de</strong>terminar, que próximam<strong>en</strong>te modificarán<br />
<strong>el</strong> tratami<strong>en</strong>to y previsiblem<strong>en</strong>te <strong>el</strong> curso <strong>de</strong> <strong>la</strong> <strong>en</strong>fermedad.<br />
CLADRIBINA<br />
La c<strong>la</strong>dribina 13 o 2 Cloro-2’<strong>de</strong>oxiad<strong>en</strong>osina (2-CdA), es un conocido<br />
ag<strong>en</strong>te antileucémico con administración vía oral, se trata <strong>de</strong> un<br />
análogo clorado <strong>de</strong> <strong>la</strong>s purinas resist<strong>en</strong>te a <strong>la</strong> ad<strong>en</strong>osina <strong>de</strong>saminasa<br />
que produce una <strong>de</strong>pleción linfocitaria s<strong>el</strong>ectiva, precoz y prolongada<br />
(con efecto reducido sobre neutrófilos), con lo que se consigue un efecto<br />
muy precoz <strong>en</strong> disminuir <strong>la</strong> actividad inf<strong>la</strong>matoria <strong>de</strong> <strong>la</strong> <strong>en</strong>fermedad.<br />
Es un inmunosupresor que atraviesa <strong>la</strong> barrera hemato<strong>en</strong>cefálica,<br />
inicialm<strong>en</strong>te estaría indicado <strong>en</strong> EMRR.<br />
Ha <strong>de</strong>mostrado una reducción <strong>de</strong> <strong>la</strong> tasa <strong>de</strong> brotes <strong>en</strong> un 58%,<br />
una disminución <strong>de</strong> <strong>la</strong> progresión <strong>de</strong> <strong>la</strong> discapacidad <strong>de</strong> forma mant<strong>en</strong>ida<br />
y una caída d<strong>el</strong> 75% <strong>de</strong> <strong>la</strong> actividad inf<strong>la</strong>matoria <strong>de</strong> <strong>la</strong> <strong>en</strong>fermedad<br />
<strong>en</strong> base a criterios <strong>de</strong> RMN.<br />
Como efectos adversos cabe <strong>de</strong>stacar: linfop<strong>en</strong>ia (que pue<strong>de</strong> dar<br />
lugar a infecciones y tumores) cefalea, nasofaringitis y nauseas.<br />
FINGOLIMOD (FTY720)<br />
El fingolimod 14 es un <strong>de</strong>rivado químico d<strong>el</strong> myriocin, un metabolito<br />
d<strong>el</strong> hongo Isaria sinc<strong>la</strong>irii, que había sido utilizado <strong>en</strong> <strong>la</strong> medicina<br />
tradicional china y d<strong>el</strong> que eran conocidos sus efectos agresivos<br />
sobre los linfocitos. Fue estudiado inicialm<strong>en</strong>te <strong>en</strong> <strong>la</strong> prev<strong>en</strong>ción<br />
d<strong>el</strong> rechazo <strong>en</strong> los trasp<strong>la</strong>ntes <strong>de</strong> órganos sólidos. Su administración<br />
es por vía oral.<br />
Se trata <strong>de</strong> un agonista <strong>de</strong> los receptores <strong>de</strong> <strong>la</strong> esfingosina 1-fosfato<br />
que, tras unirse a éstos, induce su internalización, <strong>de</strong> forma que<br />
tanto los linfocitos T CD4+ y CD8+ como los linfocitos B quedan<br />
«secuestrados» <strong>en</strong> los órganos linfoi<strong>de</strong>s secundarios.<br />
Atraviesa <strong>la</strong> BHE y acce<strong>de</strong> al SNC con efecto sobre pob<strong>la</strong>ciones<br />
neuronales. Bloquea célu<strong>la</strong>s <strong>en</strong>dot<strong>el</strong>iales <strong>de</strong> <strong>la</strong> barrera hemato<strong>en</strong>cefálica<br />
disminuy<strong>en</strong>do su permeabilidad.<br />
Produce una marcada linfocitop<strong>en</strong>ia periférica pero sin efecto<br />
inmunosupresor g<strong>en</strong>eralizado.<br />
Disminuye <strong>el</strong> porc<strong>en</strong>taje <strong>de</strong> lesiones captantes <strong>de</strong> gadolinio <strong>en</strong><br />
RMN y <strong>la</strong> tasa anual <strong>de</strong> brotes <strong>en</strong> un 60% respecto al p<strong>la</strong>cebo 15 .<br />
Actualm<strong>en</strong>te hay <strong>en</strong>sayos <strong>en</strong> formas RR (fase III) y PP.<br />
Entre los efectos adversos <strong>de</strong>stacan: bradicardia (<strong>en</strong> <strong>la</strong> primera<br />
dosis), e<strong>de</strong>ma <strong>de</strong> mácu<strong>la</strong>, nauseas, aum<strong>en</strong>to <strong>de</strong> <strong>la</strong>s transaminasas e<br />
infecciones.<br />
LAQUINIMOD<br />
El <strong>la</strong>quinimod 16 es un fármaco inmunomodu<strong>la</strong>dor <strong>en</strong> <strong>de</strong>sarrollo<br />
para EM. Es una quinolona-3-carboxamida con una biodisponibilidad<br />
oral exc<strong>el</strong><strong>en</strong>te. Su mecanismo <strong>de</strong> acción se basa <strong>en</strong> <strong>la</strong> inhibición<br />
<strong>de</strong> citoquinas proinf<strong>la</strong>matorias y <strong>en</strong> <strong>la</strong> activación <strong>de</strong> citoquinas antiinf<strong>la</strong>matorias.<br />
112 Sanid. mil. 2011; 67 (2)<br />
Ha <strong>de</strong>mostrado su eficacia con una disminución <strong>en</strong> un 40% <strong>de</strong><br />
<strong>la</strong>s lesiones captantes <strong>de</strong> gadolinio <strong>en</strong> RMN. Actualm<strong>en</strong>te están <strong>en</strong><br />
curso dos estudios <strong>en</strong> fase III (Allegro y Bravo).<br />
Como efecto secundario más frecu<strong>en</strong>te <strong>de</strong>staca <strong>el</strong> aum<strong>en</strong>to <strong>de</strong><br />
transaminasas.<br />
TERIFLUNAMIDA<br />
La teriflunamida 17 es un fármaco inmunomodu<strong>la</strong>dor, bloquea<br />
<strong>la</strong> <strong>en</strong>zima mitocondrial dihidro-oratato <strong>de</strong>shidrog<strong>en</strong>asa e inhibe <strong>la</strong><br />
proliferación <strong>de</strong> linfocitos T y B, su metabolito activo es <strong>la</strong> Laflunamida,<br />
usado <strong>en</strong> <strong>el</strong> tratami<strong>en</strong>to <strong>de</strong> <strong>la</strong> artritis reumatoi<strong>de</strong>, produce inhibición<br />
parcial <strong>de</strong> <strong>la</strong> síntesis <strong>de</strong> primidina y activación <strong>de</strong> citocinas<br />
antiinf<strong>la</strong>matorias <strong>de</strong>p<strong>en</strong>di<strong>en</strong>tes <strong>de</strong> IL-1.<br />
Ha <strong>de</strong>mostrado un <strong>de</strong>sc<strong>en</strong>so d<strong>el</strong> 61% <strong>de</strong> <strong>la</strong>s lesiones captantes<br />
<strong>de</strong> gadolinio <strong>en</strong> RMN.<br />
Bu<strong>en</strong> perfil <strong>de</strong> seguridad, incluso <strong>en</strong> combinación con IFN. Sus<br />
efectos secundarios más frecu<strong>en</strong>tes son: alopecia, nasofaringitis, artralgias<br />
e intolerancia digestiva.<br />
BG12<br />
Se trata <strong>de</strong> <strong>la</strong> formu<strong>la</strong>ción oral d<strong>el</strong> dimetil-fumarato, un inmunomodu<strong>la</strong>dor<br />
utilizado <strong>en</strong> <strong>el</strong> tratami<strong>en</strong>to <strong>de</strong> <strong>la</strong> psoriasis que actúa <strong>de</strong><br />
intermediario <strong>en</strong> <strong>el</strong> ciclo <strong>de</strong> Krebs, con efectos antiinf<strong>la</strong>matorios y<br />
citoprotectivos: disminuye <strong>el</strong> número <strong>de</strong> linfocitos T, produce una<br />
<strong>de</strong>sviación <strong>de</strong> citocinas <strong>de</strong> Th1 a Th2, disminuye infiltración <strong>de</strong> macrófagos,<br />
<strong>de</strong> microglia, <strong>de</strong> citocinas proinf<strong>la</strong>matorias y <strong>de</strong> TNF-1<br />
alfa.<br />
Actualm<strong>en</strong>te exist<strong>en</strong> dos <strong>en</strong>sayos clínicos <strong>en</strong> marcha que se <strong>en</strong>cu<strong>en</strong>tran<br />
<strong>en</strong> fase IIB (Confirm, Define).<br />
Ha <strong>de</strong>mostrado una reducción d<strong>el</strong> número total <strong>de</strong> nuevas lesiones<br />
<strong>en</strong> RMN (70% fr<strong>en</strong>te a p<strong>la</strong>cebo), y una t<strong>en</strong>d<strong>en</strong>cia a <strong>la</strong> reducción<br />
<strong>de</strong> brotes.<br />
No se han pres<strong>en</strong>tado reacciones adversas graves.<br />
ALEMTUZUMAB<br />
Es un anticuerpo monoclonal humanizado tipo IgG1k que se fija<br />
s<strong>el</strong>ectivam<strong>en</strong>te sobre <strong>la</strong> glucoproteína CD52 produci<strong>en</strong>do una <strong>de</strong>pleción<br />
linfocitaria <strong>de</strong> <strong>la</strong>rga duración. Fármaco aprobado por <strong>la</strong> FDA<br />
para <strong>el</strong> tratami<strong>en</strong>to <strong>de</strong> <strong>la</strong> leucemia linfocítica crónica <strong>de</strong> célu<strong>la</strong>s B.<br />
Ti<strong>en</strong>e como v<strong>en</strong>taja <strong>la</strong> administración anual <strong>en</strong>dov<strong>en</strong>osa.<br />
En formas RR ha <strong>de</strong>mostrado disminución <strong>de</strong> lesiones captantes<br />
<strong>de</strong> gadolino <strong>en</strong> RMN y <strong>de</strong> <strong>la</strong> tasa <strong>de</strong> brotes. Suprime <strong>la</strong> actividad<br />
inf<strong>la</strong>matoria pero no previ<strong>en</strong>e <strong>la</strong> progresión <strong>de</strong> discapacidad. Actualm<strong>en</strong>te<br />
están <strong>en</strong> curso dos <strong>en</strong>sayos <strong>en</strong> fase II.<br />
Sus efectos adversos principales son <strong>la</strong>s reacciones infusionales.<br />
RITUXIMAB-OCRELIZUMAB<br />
El rituximab 18 es otro anticuerpo monoclonal, este actúa s<strong>el</strong>ectivam<strong>en</strong>te<br />
sobre los Linfocitos B que expresan CD20. Existe una<br />
amplia experi<strong>en</strong>cia por su uso <strong>en</strong> otras <strong>en</strong>fermeda<strong>de</strong>s (neoplásicas y
<strong>Nuevas</strong> <strong>perspectivas</strong> <strong>en</strong> <strong>el</strong> tratami<strong>en</strong>to <strong>de</strong> <strong>la</strong> esclerosis múltiple<br />
disinmunes). El ocr<strong>el</strong>izumab 19 es rituximab humanizado, más seguro<br />
por su m<strong>en</strong>or inmunog<strong>en</strong>icidad y mejor perfil <strong>de</strong> efectos secundarios.<br />
Existe un estudio clínico <strong>en</strong> fase II.<br />
Su eficacia fundam<strong>en</strong>tal se basa <strong>en</strong> <strong>el</strong> tratami<strong>en</strong>to <strong>de</strong> <strong>la</strong> inf<strong>la</strong>mación.<br />
Ha <strong>de</strong>mostrado una disminución precoz d<strong>el</strong> 91% <strong>de</strong> <strong>la</strong>s<br />
lesiones captantes <strong>de</strong> gadolinio <strong>en</strong> RMN y <strong>de</strong> <strong>la</strong> tasa <strong>de</strong> brotes,<br />
con un efecto prolongado. En EMPP se han obt<strong>en</strong>ido resultados<br />
negativos.<br />
Entre sus efectos adversos cabe <strong>de</strong>stacar: <strong>la</strong>s reacciones infusionales<br />
y <strong>la</strong>s <strong>de</strong> reactivación viral.<br />
NUEVOS TRATAMIENTOS SINTOMÁTICOS<br />
En un futuro próximo <strong>el</strong> ars<strong>en</strong>al terapéutico <strong>de</strong> <strong>la</strong> <strong>en</strong>fermedad va<br />
a ser ampliado con <strong>la</strong> aparición <strong>de</strong> dos nuevos fármacos, p<strong>en</strong>di<strong>en</strong>tes<br />
<strong>de</strong> su aprobación, <strong>de</strong>stinados al tratami<strong>en</strong>to sintomático y a conseguir<br />
una mejora <strong>de</strong> <strong>la</strong> calidad <strong>de</strong> vida <strong>de</strong> los paci<strong>en</strong>tes con EM, son<br />
Sativex y Fampridina.<br />
SATIVEX ®<br />
El principio activo <strong>de</strong> este nuevo fármaco es <strong>el</strong> Nabiximol, una<br />
combinación <strong>de</strong> 2,7 mg <strong>de</strong> tetrahidrocannabinol, con efecto analgésico,<br />
r<strong>el</strong>ajante muscu<strong>la</strong>r, antiemético y estimu<strong>la</strong>nte d<strong>el</strong> apetito, junto<br />
con 2,5 mg <strong>de</strong> cannabidiol, que pot<strong>en</strong>cia <strong>el</strong> efecto analgésico, es ansiolítico<br />
y anticonvulsivante. Se fija <strong>en</strong> los receptores cannabinoi<strong>de</strong>s<br />
CB1 provocando una regu<strong>la</strong>ción <strong>de</strong> neurotransmisores (glutamato<br />
y GABA) y CB2 <strong>de</strong> <strong>la</strong>s célu<strong>la</strong>s inmunes, produci<strong>en</strong>do <strong>la</strong> liberación<br />
<strong>de</strong> citocinas.<br />
Ya cu<strong>en</strong>ta con indicación para dolor neuropático <strong>en</strong> EM y oncológico<br />
<strong>en</strong> Canadá, solicitada para espasticidad <strong>en</strong> EM. Se ha utilizado<br />
como uso compasivo <strong>en</strong> 61 países, actualm<strong>en</strong>te hay 68 paci<strong>en</strong>tes<br />
con EM tratados <strong>en</strong> <strong>España</strong> con este fármaco. Ha <strong>de</strong>mostrado una<br />
mejoría significativa d<strong>el</strong> dolor d<strong>el</strong> 41% y una mejoría <strong>de</strong> <strong>la</strong> espasticidad<br />
d<strong>el</strong> 40% con reducción <strong>de</strong> <strong>la</strong> frecu<strong>en</strong>cia <strong>de</strong> los espasmos d<strong>el</strong><br />
25%.<br />
Se administra <strong>en</strong> forma <strong>de</strong> pulverización <strong>en</strong> <strong>la</strong> mucosa oral sublingual,<br />
<strong>de</strong> dosificación flexible. Entre sus efectos secundarios <strong>de</strong>stacan:<br />
mareo y vértigo, cefalea, fatiga y somnol<strong>en</strong>cia, patología oral<br />
(aftas, leucop<strong>la</strong>sia), trastornos psiquiátricos, taquicardia e hipot<strong>en</strong>sión<br />
arterial. Y está contraindicado <strong>en</strong> esquizofr<strong>en</strong>ia, trastornos psicóticos,<br />
trastorno <strong>de</strong> personalidad, historia <strong>de</strong> abuso <strong>de</strong> psicótropos,<br />
embarazo, <strong>la</strong>ctancia, m<strong>en</strong>ores <strong>de</strong> 18 años.<br />
FAMPRIDINA<br />
La 4-aminopiridina 20 , es un alquitrán <strong>de</strong>rivado d<strong>el</strong> carbón mineral,<br />
actúa bloqueando los canales <strong>de</strong> potasio <strong>en</strong> <strong>el</strong> SNC aum<strong>en</strong>tando<br />
<strong>la</strong> conducción <strong>en</strong> los axones <strong>de</strong>smi<strong>el</strong>inizados produci<strong>en</strong>do una mejora<br />
d<strong>el</strong> impulso nervioso. Se han realizado estudios <strong>en</strong> otras <strong>en</strong>fermeda<strong>de</strong>s<br />
neurológicas como <strong>en</strong> <strong>la</strong> miast<strong>en</strong>ia, <strong>en</strong> <strong>la</strong> esclerosis <strong>la</strong>teral<br />
amiotrófica (ELA) y <strong>en</strong> lesiones medu<strong>la</strong>res.<br />
Está solicitada <strong>la</strong> indicación para trastorno <strong>de</strong> <strong>la</strong> marcha <strong>en</strong> EM,<br />
con lo que se convertiría <strong>en</strong> <strong>el</strong> primer tratami<strong>en</strong>to que pue<strong>de</strong> ayudar<br />
<strong>en</strong> <strong>la</strong> movilidad <strong>de</strong> los paci<strong>en</strong>tes con EM.<br />
Se estima que <strong>la</strong> dosis eficaz es <strong>de</strong> 10 mg dos veces al día vía oral.<br />
Para valorar <strong>la</strong> eficacia <strong>de</strong> este nuevo tratami<strong>en</strong>to sintomático<br />
se ha medido <strong>el</strong> tiempo y <strong>la</strong> v<strong>el</strong>ocidad d<strong>el</strong> paci<strong>en</strong>te para recorrer <strong>la</strong><br />
distancia <strong>de</strong> 7,5 metros. Hay aproximadam<strong>en</strong>te un 35% <strong>de</strong> respon<strong>de</strong>dores<br />
que pres<strong>en</strong>tan una mejora <strong>de</strong> <strong>la</strong> v<strong>el</strong>ocidad <strong>de</strong> <strong>la</strong> marcha, <strong>la</strong><br />
fatiga, <strong>la</strong> funcionalidad <strong>de</strong> los miembros inferiores, <strong>la</strong> espasticidad<br />
(medida según <strong>la</strong> esca<strong>la</strong> <strong>de</strong> Ashworth) y <strong>el</strong> ba<strong>la</strong>nce muscu<strong>la</strong>r. Por lo<br />
que ha <strong>de</strong>mostrado una mejora <strong>de</strong> <strong>la</strong> función motora <strong>en</strong> EM <strong>en</strong> los<br />
paci<strong>en</strong>tes respon<strong>de</strong>dores, in<strong>de</strong>p<strong>en</strong>di<strong>en</strong>tem<strong>en</strong>te d<strong>el</strong> tipo <strong>de</strong> EM y d<strong>el</strong><br />
tratami<strong>en</strong>to concomitante.<br />
Como efectos secundarios <strong>de</strong>stacan los mareos y <strong>la</strong> posibilidad<br />
<strong>de</strong> <strong>de</strong>s<strong>en</strong>cad<strong>en</strong>ar crisis epilépticas.<br />
CONCLUSIÓN<br />
En los próximos años los fármacos disponibles para <strong>el</strong> tratami<strong>en</strong>to<br />
<strong>de</strong> <strong>la</strong> EM van a dar lugar a un nuevo algoritmo terapéutico<br />
<strong>en</strong> <strong>la</strong> <strong>en</strong>fermedad, los nuevos fármacos están <strong>de</strong>stinados a mejorar <strong>el</strong><br />
curso <strong>de</strong> <strong>la</strong> <strong>en</strong>fermedad y <strong>la</strong> calidad <strong>de</strong> vida <strong>de</strong> los paci<strong>en</strong>tes.<br />
Ya contamos con nuevos fármacos que han <strong>de</strong>mostrado su eficacia,<br />
tanto modificadores d<strong>el</strong> curso <strong>de</strong> <strong>la</strong> <strong>en</strong>fermedad y como tratami<strong>en</strong>tos<br />
sintomáticos, algunos únicam<strong>en</strong>te p<strong>en</strong>di<strong>en</strong>tes <strong>de</strong> aprobación<br />
y que estarán disponibles probablem<strong>en</strong>te a lo <strong>la</strong>rgo <strong>de</strong> 2011,<br />
que cu<strong>en</strong>tan con <strong>la</strong> v<strong>en</strong>taja añadida <strong>de</strong> su administración vía oral,<br />
pero cuya indicación <strong>de</strong>berá ser individualizada.<br />
Pero lo más esperanzador es <strong>la</strong> multitud <strong>de</strong> estudios clínicos que<br />
están <strong>de</strong>sarrol<strong>la</strong>ndo nuevos fármacos que actúan sobre fases cada<br />
vez más específicas <strong>de</strong> <strong>la</strong> respuesta inmunitaria, para un mejor conocimi<strong>en</strong>to<br />
y control <strong>de</strong> <strong>la</strong> <strong>en</strong>fermedad.<br />
BIBLIOGRAFÍA<br />
1. Cook, S.D. Handbook of multiple sclerosis. Bas<strong>el</strong>: Marc<strong>el</strong> Dekker, INC., New<br />
York 2001.<br />
2. Sociedad Españo<strong>la</strong> <strong>de</strong> Neurología. Guía oficial para <strong>el</strong> diagnóstico y tratami<strong>en</strong>to<br />
<strong>de</strong> <strong>la</strong> esclerosis múltiple. Prous Sci<strong>en</strong>ce. Barc<strong>el</strong>ona 2007.<br />
3. Gooding, D.S. et al. Disease-modifying therapy in MS: a critical review of the<br />
literature. Part I: Analysis of clinical trial errors. Journal of Neurology 2004; 251<br />
Supl 5: 3-11.<br />
4. Barkhof, F. et al. Comparison of MRI criteria at first pres<strong>en</strong>tation to predict conversion<br />
to clinically <strong>de</strong>finite multiple sclerosis. Brain 1997; 120: 2059-2069.<br />
5. Hernán<strong>de</strong>z, M.A. et al. Tratami<strong>en</strong>to sintomático <strong>de</strong> <strong>la</strong> esclerosis múltiple. Revista<br />
Españo<strong>la</strong> <strong>de</strong> Esclerosis Múltiple 2007; 4: 5-14.<br />
6. Goodin, D.S. et al. Treatm<strong>en</strong>t of multiple sclerosis with human interferon beta.<br />
The international MS Journal 2005; 12: 96-108.<br />
7. Johnson, K.P. et al. Copolymer 1 reduces r<strong>el</strong>apse rate and improves disability<br />
in r<strong>el</strong>apsing-remitting multiple sclerosis: results of a phase multic<strong>en</strong>ter, doubleblind<br />
p<strong>la</strong>cebo controlled trial. The Copolymer 1 Multiple Sclerosis Group. Neurology<br />
1995; 45: 1268-1276.<br />
8. Coyle, P.K. y Jeffery, D.R. Clinical efficacy and b<strong>en</strong>efit of natalizumab. Multiple<br />
Sclerosis 2009; 15(S4): S7-S15.<br />
9. Coyle, P.K. et al. Best practice recomm<strong>en</strong>dations for the s<strong>el</strong>ection and managemanagem<strong>en</strong>t of pati<strong>en</strong>ts with multiple sclerosis receiving natalizumab therapy. Multiple<br />
Sclerosis 2009; 15(S4): S26-S36.<br />
10. Hartung, H.P. et al. Mitoxantrone in multiple sclerosis: a p<strong>la</strong>cebo-controlled, double<br />
blind, randomised, multic<strong>en</strong>tre trial. Lancet 2002; 360: 2018-2025.<br />
11. Pa<strong>la</strong>ce, J., Rothw<strong>el</strong>l, P. New treatm<strong>en</strong>ts and azathioprine in multiple sclerosis.<br />
Lancet 1997; 350:261.<br />
12. Gonsette, R.E. Inmunosuppressants in multiple sclerosis: the past, the pres<strong>en</strong>t and<br />
the future. Revista Españo<strong>la</strong> <strong>de</strong> Esclerosis Múltiple 2008; 6: 11-21.<br />
Sanid. mil. 2011; 67 (2) 113
C. Arcos Sánchez, et al.<br />
13. Giovannoni, G. et al. A p<strong>la</strong>cebo-controlled trial of oral c<strong>la</strong>dribine for r<strong>el</strong>apsing<br />
multiple sclerosis. New Eng<strong>la</strong>nd Journal of Medicine 2010; DOI: 10.1056/NE-<br />
JMoa0902533.<br />
14. Kappos, L. et al. Oral fingolimod (FTY720) for r<strong>el</strong>apsing multiple sclerosis. New<br />
Eng<strong>la</strong>nd Journal of Medicine 2006; 355: 1124-1140.<br />
15. Coh<strong>en</strong>, J.A. et al. Oral fingolimod fi ngolimod or intramuscu<strong>la</strong>r interferon for r<strong>el</strong>apsing mulmultiple sclerosis. New Eng<strong>la</strong>nd Journal of Medicine 2010; 362: 402-415.<br />
16. Polman, C. et al. Treatm<strong>en</strong>t with <strong>la</strong>quinimod reduces <strong>de</strong>v<strong>el</strong>opm<strong>en</strong>t of active MRI<br />
lesions in r<strong>el</strong>apsing sclerosis multiple. Neurology 2005; 64: 987-991.<br />
17. O’Connor, P.W. et al. Teriflunomi<strong>de</strong> Multiple Sclerosis Trial Group; University<br />
of British Columbia MS/MRI Research Group. A phase II study of the safety<br />
and efficacy of teriflunomi<strong>de</strong> in multiple sclerosis with r<strong>el</strong>apses. Neurology 2006;<br />
66:894-900.<br />
18. Hauser, S.L. et al. A phase II randomized, p<strong>la</strong>cebo-controlled, multic<strong>en</strong>ter trial of<br />
rituximab in adults with r<strong>el</strong>apsing remitting multiple sclerosis. Neurology 2007;<br />
68 Supl 1: A99.<br />
19. Hauser, S. et al. B-c<strong>el</strong>l <strong>de</strong>pletion with an anti-CD20 monoclonal antibody (rituximab)<br />
in r<strong>el</strong>apsing remitting multiple sclerosis. New Eng<strong>la</strong>nd Journal of Medicine<br />
2008; 358: 676-688.<br />
114 Sanid. mil. 2011; 67 (2)<br />
20. Goodman, A.D. et al. Sustained-r<strong>el</strong>ease oral fampridine in multiple sclerosis: a<br />
randomized, double-blind, controlled trial. Lancet 2009; 373: 732-738.<br />
21. Hirst, C.L. et al. 1-H treatm<strong>en</strong>t in pati<strong>en</strong>ts with aggressive r<strong>el</strong>apsing remitting<br />
multiple sclerosis. Journal of Neurology 2008; 255: 231-238.<br />
22. Rieckman, P. et al. Corr<strong>el</strong>ation of soluble adhesion molecules in blood and cerebrospinal<br />
fluid with magnetic resonance imaging activity in pati<strong>en</strong>ts with multiple<br />
sclerosis. Ann Neurology 1998; 43: 384-387.<br />
23. Jim<strong>en</strong>ez, M.D. Esclerosis Múltiple. Continua Neurológica. Sociedad Españo<strong>la</strong> <strong>de</strong><br />
Neurología. Ars Medica, Barc<strong>el</strong>ona 2007.<br />
24. O’Connor, R.P. et al. Efficacy of intramuscu<strong>la</strong>r interferon beta-1a in pati<strong>en</strong>ts with<br />
clinically iso<strong>la</strong>ted syndrome: analysis of subgroups based on new risk criteria.<br />
Multiple Sclerosis 2009; 15: 728-734.<br />
25. Vollmer, T. et al. Acetato <strong>de</strong> g<strong>la</strong>tiramero tras <strong>el</strong> tratami<strong>en</strong>to <strong>de</strong> inducción con mitoxantrona<br />
<strong>en</strong> <strong>la</strong> esclerosis múltiple recidivante. Multiple Sclerosis 2008; 14: 663-<br />
670.<br />
26. Arroyo, R. y De <strong>la</strong>s Heras, V. Esclerosis múltiple: actualización d<strong>el</strong> tratami<strong>en</strong>to.<br />
Mayo ediciones. Barc<strong>el</strong>ona 2009.<br />
27. Ruiz-Peña, J.L. y Izquierdo-Ayuso, G. Inmunosupresores y esclerosis múltiple.<br />
Revista Españo<strong>la</strong> <strong>de</strong> Neurología 2002; 35: 373-380.