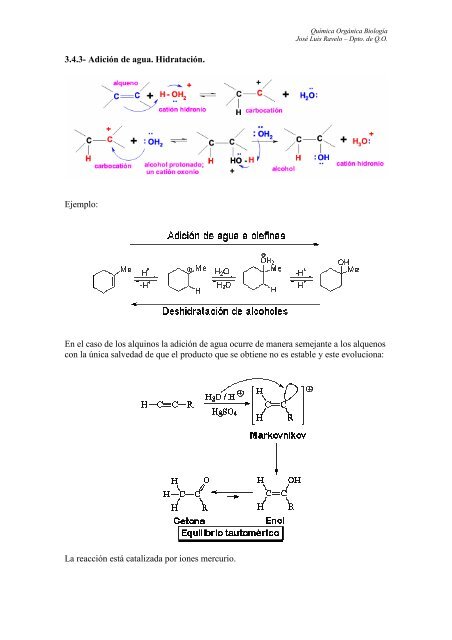
3.4.3- Adición de agua. Hidratación. Ejemplo: En el ... - Webgarden
3.4.3- Adición de agua. Hidratación. Ejemplo: En el ... - Webgarden
3.4.3- Adición de agua. Hidratación. Ejemplo: En el ... - Webgarden
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
<strong>3.4.3</strong>- <strong>Adición</strong> <strong>de</strong> <strong>agua</strong>. <strong>Hidratación</strong>.<br />
<strong>Ejemplo</strong>:<br />
Química Orgánica Biología<br />
José Luis Rav<strong>el</strong>o – Dpto. <strong>de</strong> Q.O.<br />
<strong>En</strong> <strong>el</strong> caso <strong>de</strong> los alquinos la adición <strong>de</strong> <strong>agua</strong> ocurre <strong>de</strong> manera semejante a los alquenos<br />
con la única salvedad <strong>de</strong> que <strong>el</strong> producto que se obtiene no es estable y este evoluciona:<br />
La reacción está catalizada por iones mercurio.
3.4.4- <strong>Adición</strong> <strong>de</strong> halógenos.<br />
Química Orgánica Biología<br />
José Luis Rav<strong>el</strong>o – Dpto. <strong>de</strong> Q.O.<br />
La reacción va bien con cloro y bromo, con <strong>el</strong> flúor es violentamente (explosiva), y con<br />
<strong>el</strong> yodo no va por razones termodinámicas.<br />
Las reacciones se realizan a temperatura ambiente o, con refrigeración, en disolventes<br />
halogenados inertes como los halometanos.<br />
La reacción es estereoespecífica. El resultado global es una adición anti al doble enlace:<br />
H<br />
H 3C CH 3<br />
H<br />
H<br />
(Z)-2-buteno<br />
H 3C H<br />
(E)-2-buteno<br />
CH 3<br />
+ Br Br<br />
+ Br Br<br />
H<br />
Br +<br />
H<br />
H 3C CH 3<br />
H<br />
(a)<br />
Ión bromonio<br />
(a)<br />
(a)<br />
Br +<br />
H 3C H<br />
(a)<br />
(b)<br />
CH 3<br />
Ión bromonio<br />
+ Br -<br />
+ Br -<br />
(a)<br />
(b) (b)<br />
(b)<br />
(b)<br />
(a)<br />
(b)<br />
H Br<br />
H3C H<br />
Br CH3 Br<br />
H<br />
H<br />
CH3 H3C Br<br />
(d,l)-2,3-dibromobutano<br />
H Br<br />
H3C CH3 Br H<br />
Br CH3 H<br />
H<br />
H3C Br<br />
(meso)-2,3-dibromobutano
Química Orgánica Biología<br />
José Luis Rav<strong>el</strong>o – Dpto. <strong>de</strong> Q.O.<br />
La presencia <strong>de</strong> otros nucleófilos, podría producir competición por la captura <strong>de</strong>l<br />
intermedio:<br />
H 3C-HC CH 2<br />
+ Cl 2<br />
+ Br 2<br />
H 2O<br />
NaOH<br />
La adición <strong>el</strong>ectrófila <strong>de</strong> halógenos a los alquinos:<br />
3.4.5- Oximercuración-<strong>de</strong>smercuración.<br />
Cl<br />
OH<br />
(73%)<br />
H2O NaOH H OH<br />
3C-HC CH2Br (mayoritario)<br />
Consiste en la adición <strong>el</strong>ectrofílica <strong>de</strong> una sal <strong>de</strong> mercurio (II) a un alqueno. .<br />
La disolución <strong>de</strong>l acetato <strong>de</strong> mercurio provoca su disociación parcial generándose un<br />
ión mercurio.
Química Orgánica Biología<br />
José Luis Rav<strong>el</strong>o – Dpto. <strong>de</strong> Q.O.<br />
<strong>En</strong> la siguiente etapa (<strong>de</strong>smercuración), <strong>el</strong> sustituyente que contiene mercurio es<br />
reemplazado por hidrógeno por tratamiento con borohidruro sódico en presencia <strong>de</strong><br />
base. El resultado global es la hidratación (Markovnikov) <strong>de</strong>l doble enlace para dar un<br />
alcohol.<br />
3.4.6- Hidroboración-oxidación.<br />
El borano, BH3, se adiciona al doble enlace sin activación catalítica. El borano (que en<br />
realidad existe en forma <strong>de</strong> dímero, B2H6) es asequible comercialmente en disoluciones<br />
<strong>de</strong> éter o tetrahidrofurano.
Química Orgánica Biología<br />
José Luis Rav<strong>el</strong>o – Dpto. <strong>de</strong> Q.O.<br />
Como <strong>el</strong> enlace π es rico y <strong>el</strong> borano pobre en <strong>el</strong>ectrones, se produce la adición<br />
<strong>el</strong>ectrofílica. El boro se une al carbono menos impedido (menos sustituido).<br />
R<br />
R´<br />
C C<br />
<strong>Ejemplo</strong>:<br />
H<br />
H B<br />
+ B H<br />
H<br />
R<br />
R´<br />
C C<br />
H<br />
H<br />
CH 3<br />
C6H5 C CH2 α-metilestireno<br />
1) (BH 3) 2/THF<br />
2) NaOH/H 2O/H 2O 2<br />
R<br />
R´<br />
δ +<br />
H<br />
δ -<br />
B<br />
C C H<br />
H<br />
CH 3<br />
=<br />
R<br />
C6H5 CH CH2OH (95%)<br />
2-fenil-1-propanol<br />
H B<br />
C C H<br />
R´ H<br />
adición cis<br />
Por otro lado los alquinos terminales se hidroboran regios<strong>el</strong>ectivamente, <strong>de</strong> forma anti-<br />
Markovnikov, con ataque <strong>de</strong>l boro al carbono menos sustituido.<br />
3.4.7- <strong>Adición</strong> <strong>de</strong> radicales.<br />
Las reacciones radicalarias requieren únicamente un <strong>el</strong>ectrón, con lo que se forma un<br />
radical alquilo.<br />
Las consecuencias <strong>de</strong> este diferente comportamiento son productos anti-Markovnikov.
Química Orgánica Biología<br />
José Luis Rav<strong>el</strong>o – Dpto. <strong>de</strong> Q.O.<br />
El HBr es <strong>el</strong> único haluro <strong>de</strong> hidrógeno que se adiciona a un alqueno en condiciones<br />
radicalarias. Las adiciones <strong>de</strong> HCl y HI transcurren a través <strong>de</strong> mecanismos iónicos.<br />
Esta inversión en la orientación, causada por los peróxidos, se conoce como <strong>el</strong> efecto<br />
peróxido.<br />
<strong>Ejemplo</strong>:<br />
El bromuro <strong>de</strong> hidrógeno se adiciona también a los triples enlaces mediante un<br />
mecanismo radicalario, siguiendo un comportamiento anti-Markovnikov.
3.4.8- Epoxidación.<br />
Química Orgánica Biología<br />
José Luis Rav<strong>el</strong>o – Dpto. <strong>de</strong> Q.O.<br />
La reacción se lleva a cabo a temperatura ambiente en un disolvente inerte como<br />
cloroformo, diclorometano o benceno.<br />
H 3C<br />
C 6H 5<br />
O<br />
O O H<br />
H<br />
H C 6H 5<br />
CH 2Cl 2<br />
O<br />
C6H5 H + CH3CO2H H C6H5 La reacción es estereoespecífica “syn”, con retención <strong>de</strong> la estereoquímica <strong>de</strong>l alqueno<br />
<strong>de</strong> partida.<br />
La reactividad <strong>de</strong> los alquenos hacia los ácidos peroxicarboxílicos aumenta con la<br />
sustitución alquílica, permitiendo <strong>de</strong> esta forma oxidaciones s<strong>el</strong>ectivas.<br />
3.4.9- Hidroxilación. Formación <strong>de</strong> dioles.<br />
Tanto <strong>el</strong> permanganato potásico como <strong>el</strong> tetróxido <strong>de</strong> osmio reaccionan con los<br />
alquenos, para dar los correspondientes dioles vecinales syn.
Química Orgánica Biología<br />
José Luis Rav<strong>el</strong>o – Dpto. <strong>de</strong> Q.O.<br />
HO2C-(H2C) 7<br />
C<br />
H<br />
(CH2) 7-CO2H C<br />
H<br />
OsO4 HO2C-(H2C) 7<br />
H<br />
C<br />
HO<br />
(CH2) 7-CO2H C<br />
H<br />
OH<br />
ácido oléico ácido eritro-9,10-dihidroxiesteárico<br />
Mecanismo:<br />
C C<br />
OsO 4<br />
KMnO 4<br />
O O<br />
Os<br />
O O<br />
C C<br />
O O<br />
Mn<br />
O O -<br />
K +<br />
C C<br />
H 2O<br />
H 2O<br />
HO OH<br />
C C<br />
cis-diol<br />
HO OH<br />
C C<br />
+ [ OsO 3 ]<br />
+ [ MnO3 ] K + -<br />
Los alquinos, también sufren reacciones <strong>de</strong> oxidación, generando alquenoles, que<br />
nuevamente mediante equilibrio ceto-enólico da lugar a compuestos carbonílicos.<br />
3.4.10- Ozonólisis. Ruptura oxidativa.<br />
El método más suave empleado para la ruptura oxidativa <strong>de</strong> alquenos con formación <strong>de</strong><br />
compuestos carbonílicos es la reacción con ozono, u ozonólisis.
R R´<br />
C C<br />
H<br />
+<br />
R´´<br />
O O O:<br />
: :<br />
:<br />
: :<br />
O O O:<br />
: :<br />
: :<br />
: :<br />
ozono<br />
<strong>Ejemplo</strong>:<br />
+ O 3<br />
C<br />
C<br />
O O<br />
O<br />
C O<br />
O O<br />
molozónido ozónido<br />
CH 2Cl 2<br />
0º -78º<br />
O<br />
O<br />
O<br />
3.5- REACCIONES DE POLIMERIZACIÓN.<br />
C<br />
H 2/Pd<br />
Zn/AcOH<br />
H 2O 2<br />
<strong>Ejemplo</strong> <strong>de</strong> dimerización en condiciones ácidas (catiónicas):<br />
2 (H 3C) 2C CH 2 H +<br />
isobutileno<br />
Mecanismo:<br />
H 2/Pd<br />
Zn ó Ar 3P<br />
H 2O 2<br />
Química Orgánica Biología<br />
José Luis Rav<strong>el</strong>o – Dpto. <strong>de</strong> Q.O.<br />
R<br />
H<br />
R<br />
HO<br />
CHO<br />
CHO<br />
C O<br />
C O<br />
adipal<strong>de</strong>hído<br />
CO2H ácido adípico<br />
CO2H R´<br />
+ O C<br />
R´´<br />
R´<br />
+ O C<br />
R´´<br />
(H 3C) 3C-HC C(CH 3) 2 (H 3C) 2C CH 2 (H 3C) 3C-H 2C-(H 3C) 2C-HC C(CH 3) 2<br />
2,4,4-trimetil-2-penteno<br />
(dímero)<br />
-H +<br />
2,4,4,6,6-pentametil-2-hepteno<br />
(trímero)<br />
(H3C) 2C CH2 + H + + (H<br />
(H3C) 2C CH 3C) 2C CH +<br />
2<br />
3<br />
(H3C) 3C-H2C C(CH3) 2<br />
(H 3C) 3C-H 2C-(H 3C) 2C-HC C(CH 3) 2<br />
2,4,4,6,6-pentametil-2-hepteno<br />
(trímero)<br />
(H 3C) 2C CH 2<br />
H<br />
+<br />
(H3C) 3C-H2C-(H3C) 2C-HC C(CH3) 2
<strong>Ejemplo</strong> <strong>de</strong> polimerización en condiciones radicalarias:<br />
Química Orgánica Biología<br />
José Luis Rav<strong>el</strong>o – Dpto. <strong>de</strong> Q.O.