Susana Castillo-Rojas - Instituto de Ciencias Nucleares ...
Susana Castillo-Rojas - Instituto de Ciencias Nucleares ...
Susana Castillo-Rojas - Instituto de Ciencias Nucleares ...
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
Weight (%)<br />
Weight (%)<br />
INFORME TÉCNICO 01, 1-11, (2007) <strong>Castillo</strong>-<strong>Rojas</strong>, S.<br />
Departamento <strong>de</strong> Química <strong>de</strong> Radiaciones y<br />
Radioquímica. ICN-UNAM<br />
8<br />
Apéndice I<br />
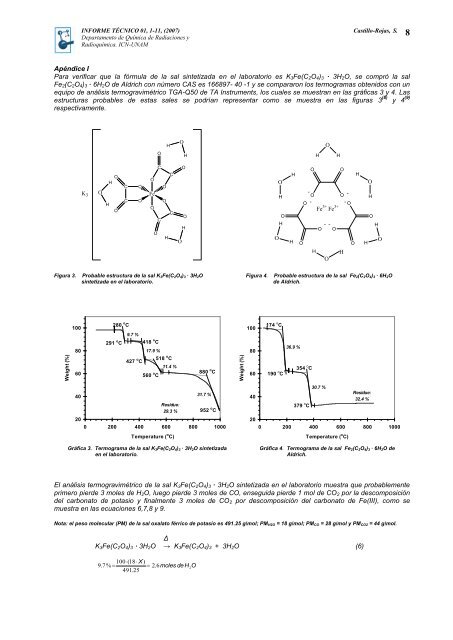
Para verificar que la fórmula <strong>de</strong> la sal sintetizada en el laboratorio es K 3Fe(C 2O 4) 3 · 3H 2O, se compró la sal<br />
Fe 2(C 2O 4) 3 · 6H 2O <strong>de</strong> Aldrich con número CAS es 166897- 40 -1 y se compararon los termogramas obtenidos con un<br />
equipo <strong>de</strong> análisis termogravimétrico TGA-Q50 <strong>de</strong> TA Instruments, los cuales se muestran en las gráficas 3 y 4. Las<br />
estructuras probables <strong>de</strong> estas sales se podrían representar como se muestra en las figuras 3 (8) y 4 (9)<br />
respectivamente.<br />
H<br />
O<br />
O<br />
O<br />
H<br />
H<br />
H<br />
K 3<br />
O<br />
O<br />
H<br />
H<br />
O<br />
C<br />
C<br />
O<br />
O<br />
C<br />
C<br />
O<br />
O<br />
Fe<br />
O<br />
O<br />
C<br />
C<br />
O<br />
H<br />
O<br />
O<br />
H<br />
O<br />
O<br />
H<br />
O<br />
H<br />
O<br />
H<br />
H<br />
O<br />
O<br />
H<br />
-<br />
O<br />
O -<br />
O -<br />
- O<br />
Fe 3+ Fe 3+<br />
- -<br />
O O<br />
O<br />
O<br />
H H<br />
O<br />
O<br />
H<br />
O<br />
H<br />
O<br />
H<br />
Figura 3. Probable estructura <strong>de</strong> la sal K 3Fe(C 2O 4) 3 ∙ 3H 2O Figura 4. Probable estructura <strong>de</strong> la sal Fe 2(C 2O 4) 3 ∙ 6H 2O<br />
sintetizada en el laboratorio.<br />
<strong>de</strong> Aldrich.<br />
100<br />
80<br />
60<br />
280 o C<br />
9.7 %<br />
291 o C 418 o C<br />
17.9 %<br />
427 o 518 o C<br />
C<br />
11.4 %<br />
560 o C<br />
880 o C<br />
100<br />
80<br />
60<br />
174 o C<br />
36.9 %<br />
354 o C<br />
190 o C<br />
40<br />
Residue:<br />
29.3 %<br />
20<br />
0 200 400 600 800 1000<br />
Temperature ( o C)<br />
31.7 %<br />
952 o C<br />
Gráfica 3. Termograma <strong>de</strong> la sal K 3Fe(C 2O 4) 3 ∙ 3H 2O sintetizada<br />
en el laboratorio.<br />
40<br />
379 o C<br />
30.7 %<br />
20<br />
0 200 400 600 800 1000<br />
Temperature ( o C)<br />
Residue:<br />
32.4 %<br />
Gráfica 4. Termograma <strong>de</strong> la sal Fe 2(C 2O 4) 3 ∙ 6H 2O <strong>de</strong><br />
Aldrich.<br />
El análisis termogravimétrico <strong>de</strong> la sal K 3Fe(C 2O 4) 3 · 3H 2O sintetizada en el laboratorio muestra que probablemente<br />
primero pier<strong>de</strong> 3 moles <strong>de</strong> H 2O, luego pier<strong>de</strong> 3 moles <strong>de</strong> CO, enseguida pier<strong>de</strong> 1 mol <strong>de</strong> CO 2 por la <strong>de</strong>scomposición<br />
<strong>de</strong>l carbonato <strong>de</strong> potasio y finalmente 3 moles <strong>de</strong> CO 2 por <strong>de</strong>scomposición <strong>de</strong>l carbonato <strong>de</strong> Fe(III), como se<br />
muestra en las ecuaciones 6,7,8 y 9.<br />
Nota: el peso molecular (PM) <strong>de</strong> la sal oxalato férrico <strong>de</strong> potasio es 491.25 g/mol; PM H2O = 18 g/mol; PM CO = 28 g/mol y PM CO2 = 44 g/mol.<br />
Δ<br />
K 3Fe(C 2O 4) 3 · 3H 2O → K 3Fe(C 2O 4) 3 + 3H 2O (6)<br />
9.7%<br />
100 (18 X)<br />
491.25<br />
2.6moles <strong>de</strong> H O<br />
2