HYDROMÉTALLURGIE DU ZINC
HYDROMÉTALLURGIE DU ZINC
HYDROMÉTALLURGIE DU ZINC
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
Page 4 sur 5<br />
<strong>HYDROMÉTALLURGIE</strong> <strong>DU</strong> <strong>ZINC</strong>.<br />
Rappel :<br />
On définit le « rendement en courant » ou rendement faradique F d’un électrolyseur, comme le rapport<br />
de la masse de métal effectivement obtenue sur la masse de métal calculée selon la loi de Faraday :<br />
mexpérimentale Iutile<br />
F .<br />
m I<br />
calculée appliquée<br />
Les pertes d’énergie sont principalement dues :<br />
au rendement en courant, voisin de 90 %, dû à la concurrence de la réaction de réduction du<br />
<br />
proton : 2Haq2eH2( g)<br />
;<br />
à la diminution de la concentration en ions Zn 2+ dans le bain. On ne mène pas<br />
l’électrolyse à terme en laissant de 10 à 20 g de Zn 2+ par litre.<br />
à la présence d’impuretés dans la solution (Mn 2+ , Mg 2+ , Ca 2+ ).<br />
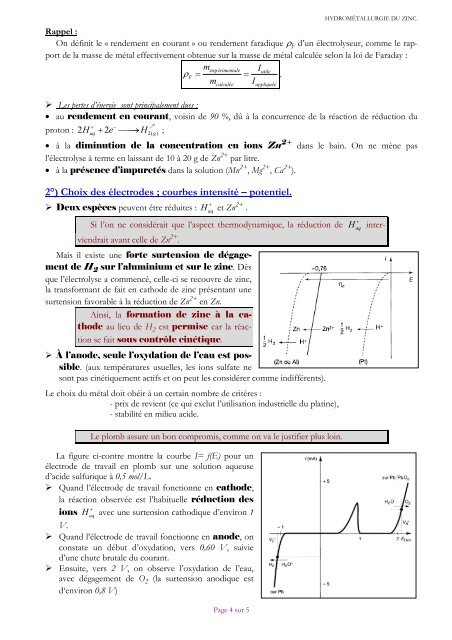
2°) Choix des électrodes ; courbes intensité – potentiel.<br />
Deux espèces peuvent être réduites : aq H et Zn 2+ .<br />
Si l’on ne considérait que l’aspect thermodynamique, la réduction de aq H inter-<br />
viendrait avant celle de Zn 2+ .<br />
Mais il existe une forte surtension de dégagement<br />
de H 2 sur l’aluminium et sur le zinc. Dès<br />
que l’électrolyse a commencé, celle-ci se recouvre de zinc,<br />
la transformant de fait en cathode de zinc présentant une<br />
surtension favorable à la réduction de Zn 2+ en Zn.<br />
Ainsi, la formation de zinc à la cathode<br />
au lieu de H 2 est permise car la réaction<br />
se fait sous contrôle cinétique.<br />
À l’anode, seule l’oxydation de l’eau est possible.<br />
(aux températures usuelles, les ions sulfate ne<br />
sont pas cinétiquement actifs et on peut les considérer comme indifférents).<br />
Le choix du métal doit obéir à un certain nombre de critères :<br />
- prix de revient (ce qui exclut l’utilisation industrielle du platine),<br />
- stabilité en milieu acide.<br />
Le plomb assure un bon compromis, comme on va le justifier plus loin.<br />
La figure ci-contre montre la courbe I= f(E) pour un<br />
électrode de travail en plomb sur une solution aqueuse<br />
d’acide sulfurique à 0,5 mol/L.<br />
Quand l’électrode de travail fonctionne en cathode,<br />
la réaction observée est l’habituelle réduction des<br />
ions aq H avec une surtension cathodique d’environ 1<br />
V.<br />
Quand l’électrode de travail fonctionne en anode, on<br />
constate un début d’oxydation, vers 0,60 V, suivie<br />
d’une chute brutale du courant.<br />
Ensuite, vers 2 V, on observe l’oxydation de l’eau,<br />
avec dégagement de O2 (la surtension anodique est<br />
d‘environ 0,8 V)