HYDROMÉTALLURGIE DU ZINC
HYDROMÉTALLURGIE DU ZINC
HYDROMÉTALLURGIE DU ZINC
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
<strong>HYDROMÉTALLURGIE</strong> <strong>DU</strong> <strong>ZINC</strong>.<br />
Page 1 sur 5<br />
<strong>HYDROMÉTALLURGIE</strong> <strong>DU</strong> <strong>ZINC</strong>.<br />
Introduction :<br />
La métallurgie est l’art d’extraire les métaux de leurs minerais. Compte tenu du caractère oxydant de<br />
l’atmosphère terrestre, les minerais contiennent généralement les éléments métalliques à l’état oxydé. : la<br />
plupart d’entre eux sont des sulfures, des oxydes, des chlorures ou des carbonates.<br />
Quelques rares métaux peuvent être trouvés à l’état natif (or, argent, cuivre, platine, …).<br />
Chimiquement, la préparation des métaux est donc une réduction.<br />
Les minerais étant généralement des composés complexes, l’obtention du métal nécessite de nombreuses<br />
étapes. On peut opérer :<br />
par voie chimique, en présence d'un réducteur solide ou gazeux à haute température: c'est le domaine<br />
de la pyrométallurgie.<br />
Cf le chapitre « Notions de pyrométallurgie ; élaboration du zinc »<br />
par voie électrochimique, par électrolyse des solutions aqueuses concentrées contenant le cation<br />
hydraté: c'est le domaine de l'hydrométallurgie.<br />
Les principes de l'hydrométallurgie reposent sur<br />
l'utilisation des diagrammes potentiel-pH (la plupart<br />
d'entre eux ont été publiés par POURBAIX et ses collaborateurs<br />
en 1969), et des courbes intensité – potentiel<br />
pour interpréter l’étape d’électrolyse d'une solution<br />
aqueuse de l'un des sels du métal.<br />
Nous choisirons d’illustrer les différentes étapes de<br />
l’hydrométallurgie dans le cas du zinc, pour<br />
lequel cette méthode de préparation assure 90 % de<br />
la production mondiale de métal de première fusion.<br />
Elle se déroule en 4 étapes successives (à partir de<br />
l’obtention de la calcine, oxyde de zinc ZnO impur)<br />
:<br />
une dissolution acide : la lixiviation,<br />
une précipitation des ions Fer (II) ou Fer (III)<br />
une purification par cémentation,<br />
une électrolyse qui donne un métal Zn très pur<br />
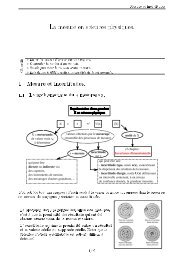
ZnS + impuretés<br />
grillage<br />
I. Lixiviation et élimination des ions fer (III).<br />
Le produit de départ est toujours l'oxyde (obtenu directement ou indirectement après grillage du sulfure<br />
ZnS), composé solide et souvent insoluble, dont il convient de faire passer le cation métallique<br />
Zn 2+ en solution ! Cette opération porte le nom de lixiviation.<br />
Par définition, la lixiviation est une opération qui consiste à faire passer lentement<br />
un solvant à travers un produit convenablement pulvérisé, et déposé en couche épaisse,<br />
pour en extraire un ou plusieurs constituants solubles.<br />
SO 2<br />
PbSO 4 ,<br />
Fe(OH) 3<br />
Cu, Co,<br />
Cd<br />
ZnO (calcine) +<br />
oxydes métalliques<br />
lixiviation<br />
Zn 2+<br />
Cu 2+ ; Co 2+ ; Cd 2+<br />
Mn 2+<br />
cémentation<br />
Zn 2+ + Mn 2+<br />
électrolyse<br />
Zn pur à 99,995 %<br />
(- de 50 ppm d’impuretés)<br />
air<br />
H 2 SO 4<br />
+ air<br />
poudre<br />
de zinc<br />
Sulfate de zinc et H 2SO 4
Page 2 sur 5<br />
<strong>HYDROMÉTALLURGIE</strong> <strong>DU</strong> <strong>ZINC</strong>.<br />
En pratique, la lixiviation est une attaque acido-basique d'un minerai et suivant le domaine de<br />
pH dans lequel on opère, on parlera de lixiviation acide, neutre ou basique. Parfois, plusieurs lixiviations sont<br />
nécessaires pour éliminer des produits non voulus (impuretés, autres cations métalliques).<br />
La mise en solution effectuée industriellement n’est pas aussi simple car, dans la<br />
calcine, il y d’autres éléments métalliques qu’on veut éliminer au mieux, et quelquefois,<br />
des métaux importants qu’on veut récupérer ! Dans la chimie du zinc, on réalise deux<br />
lixiviations :<br />
1. Lixiviation neutre.<br />
On traite d’abord la calcine provenant du grillage (ZnO impur) par une solution d’acide sulfurique à 2<br />
mol.L -1 , en présence d’air (parfois même de dioxygène)<br />
Le zinc passe en solution (pendant plusieurs heures) sous la forme d’ions Zn 2+ selon la réaction :<br />
2<br />
ZnO 2H<br />
Zn H O<br />
( s) aq ( aq)<br />
2<br />
Cette réaction acide-base exothermique élève la température vers 60 °C et augmente le pH.<br />
Ainsi, à ce stade :<br />
La solution aqueuse, vers pH = 5, contient les ions<br />
Zn 2+ , mais aussi des ions Cd 2+ , Ni 2+ , Cu 2+ , Co 2+<br />
chimiquement proches des ions zinc, ainsi que des<br />
ions Fe 2+ qui proviennent du grillage de la pyrite<br />
? Ces ions ferreux sont en faible quantité, du<br />
fait de leur oxydation par le dioxygène de l’air et<br />
de la précipitation de l’hydroxyde de fer III qui en<br />
résulte.<br />
Le solide, lui, contient le complément de zinc (> 10<br />
%) sous la forme d’un oxyde associé à l’oxyde de<br />
fer Fe 2 O 3 dans une structure stable et complexe,<br />
une ferrite de zinc de formule (ZnO, Fe 2 O 3 ).<br />
2. Lixiviation acide.<br />
Pour récupérer au maximum le zinc, le résidu solide est attaqué à chaud (vers 90 °C) par la solution<br />
aqueuse provenant de l’électrolyse : celle-ci contient en effet de l’acide sulfurique formé par l’électrolyse<br />
et encore quelques ions Zn 2+ qui n’ont pas été réduits. La ferrite est dissoute et la solution contient maintenant<br />
des ions Zn 2+ et des ions Fe 3+ . Elle contient aussi les ions métalliques qui avaient initialement précipités<br />
sous formes d’hydroxydes.<br />
De la partie solide, on peut récupérer du plomb, de l’argent et de l’or (en quantités<br />
faibles mais non négligeables).<br />
À ce stade, la solution acide contient des ions Zn 2+ et des ions Fe 3+ , dont<br />
l’élimination est difficile !<br />
Pour résoudre cette difficulté, plusieurs procédés sont utilisés qui permettent tous d’obtenir des précipités<br />
plus complexes, mais facilement filtrables, ce qui n’était pas le cas de l’hydroxyde de fer III.<br />
Après les lixiviations, la solution (acide) contient, outre les ions Zn 2+ , un certain<br />
nombre de cations métalliques : Cd 2+ , Ni 2+ , Cu 2+ , Co 2+ , Mn 2+<br />
II. Cémentation de la solution.<br />
L’élimination des impuretés est nécessaire, d’abord pour obtenir du zinc très pur, et aussi parce que<br />
les aspects cinétiques des réactions d’électrolyse pourraient se trouver modifiés du fait de leur présence<br />
!<br />
L’élimination de la plupart d’entre eux est effectuée par cémentation, c’est à dire par réduction des<br />
cations métalliques par un autre métal. Comme on ne veut pas introduire d’autres ions métalliques en<br />
solution, il faut utiliser du zinc, lui même comme réducteur.<br />
Le terme cémentation définit (du moins dans ce contexte d'hydrométallurgie) une<br />
opération qui consiste à faire précipiter un métal en solution à l'aide d'un autre<br />
métal.
D’un point de vue thermodynamique, l’analyse des potentiels rédox standard,<br />
comme celle des diagrammes potentiel-pH, montre que tous les ions, à<br />
l’exception de Mn 2+ et Zn 2+ seront réduits par la poudre de zinc (cela est<br />
plus difficile pour Ni 2+ et Co 2+ qui demandent la présence d’activateurs et une<br />
température de l’ordre de 90 °C …).<br />
Les courbes intensité – potentiel montrent que<br />
tous les phénomènes observés sont conformes<br />
aux prévisions thermodynamiques : elles permettent,<br />
de plus, d’interpréter les différentes vitesses<br />
de réaction observées<br />
La présence des ions Mn 2+ n’est pas gênante,<br />
car lors de l’électrolyse, ils ne seront pas<br />
réduits compte tenu de la valeur nettement négative<br />
de leur potentiel standard rédox.<br />
Page 3 sur 5<br />
<strong>HYDROMÉTALLURGIE</strong> <strong>DU</strong> <strong>ZINC</strong>.<br />
La solution obtenue après cémentation contient environ 2,5 mol.L -1 de zinc, sous<br />
forme d’ions Zn 2+ et 2 mol.L -1 d’acide sulfurique H 2 SO 4 . Il s’agit d’une solution fortement<br />
acide.<br />
La concentration des cations Cd 2+ , Ni 2+ , Cu 2+ et Co 2+ dans la solution est en général<br />
inférieure à 10 -5 mol.L -1<br />
III. Électrolyse de la solution de sulfate de zinc et d’acide sulfurique.<br />
1°) Caractéristiques de l’électrolyse industrielle du zinc.<br />
L’électrolyse se fait dans des cuves en ciment, recouvertes de polychlorure de<br />
vinyle., vers 30 à 40 °C, entre une anode en plomb (qui se recouvre de<br />
PbO 2(s) ) et une cathode en aluminium.<br />
Le métal aluminium est protégé, à des pH voisins de 5, par un film d’alumine A 2 O 3 : il n’y a pas de<br />
risque ainsi, à voir le zinc et l’aluminium s’allier.<br />
On récupère le métal très pur sur la cathode (électrode à laquelle se produit la<br />
réaction de réduction), par une opération dite de pelage (en anglais stripping).<br />
Le zinc est ensuite conduit fondu dans des fours puis coulé en lingots de 25 kg.<br />
Le bilan de l’électrolyse s’écrit :<br />
1<br />
.<br />
2<br />
2<br />
<br />
Zn H2 O Zn( s) 2Haq<br />
O2(<br />
g)<br />
L’électrolyse a lieu dans les conditions suivantes :<br />
Surface des électrodes (planes, 2 faces) 3,2 m 2<br />
Distance entre électrodes 20 mm<br />
Durée du dépôt 48 h<br />
Nombre de cathodes par cellule 86<br />
Intensité par cellule 115 000 A<br />
Production par cellule 3 000 kg de Zn/jour<br />
Pour chaque électrode :<br />
tension 3,2 à 3,7 V<br />
densité de courant 400 à 700 A/m 2<br />
rendement en courant 88 à 92 %<br />
E (V)<br />
Cu2+ 0,34 Cu<br />
Cd2+<br />
Zn2+<br />
Mn2+<br />
- 0,40<br />
- 0,76<br />
- 1,17<br />
Cd<br />
Zn<br />
Mn
Page 4 sur 5<br />
<strong>HYDROMÉTALLURGIE</strong> <strong>DU</strong> <strong>ZINC</strong>.<br />
Rappel :<br />
On définit le « rendement en courant » ou rendement faradique F d’un électrolyseur, comme le rapport<br />
de la masse de métal effectivement obtenue sur la masse de métal calculée selon la loi de Faraday :<br />
mexpérimentale Iutile<br />
F .<br />
m I<br />
calculée appliquée<br />
Les pertes d’énergie sont principalement dues :<br />
au rendement en courant, voisin de 90 %, dû à la concurrence de la réaction de réduction du<br />
<br />
proton : 2Haq2eH2( g)<br />
;<br />
à la diminution de la concentration en ions Zn 2+ dans le bain. On ne mène pas<br />
l’électrolyse à terme en laissant de 10 à 20 g de Zn 2+ par litre.<br />
à la présence d’impuretés dans la solution (Mn 2+ , Mg 2+ , Ca 2+ ).<br />
2°) Choix des électrodes ; courbes intensité – potentiel.<br />
Deux espèces peuvent être réduites : aq H et Zn 2+ .<br />
Si l’on ne considérait que l’aspect thermodynamique, la réduction de aq H inter-<br />
viendrait avant celle de Zn 2+ .<br />
Mais il existe une forte surtension de dégagement<br />
de H 2 sur l’aluminium et sur le zinc. Dès<br />
que l’électrolyse a commencé, celle-ci se recouvre de zinc,<br />
la transformant de fait en cathode de zinc présentant une<br />
surtension favorable à la réduction de Zn 2+ en Zn.<br />
Ainsi, la formation de zinc à la cathode<br />
au lieu de H 2 est permise car la réaction<br />
se fait sous contrôle cinétique.<br />
À l’anode, seule l’oxydation de l’eau est possible.<br />
(aux températures usuelles, les ions sulfate ne<br />
sont pas cinétiquement actifs et on peut les considérer comme indifférents).<br />
Le choix du métal doit obéir à un certain nombre de critères :<br />
- prix de revient (ce qui exclut l’utilisation industrielle du platine),<br />
- stabilité en milieu acide.<br />
Le plomb assure un bon compromis, comme on va le justifier plus loin.<br />
La figure ci-contre montre la courbe I= f(E) pour un<br />
électrode de travail en plomb sur une solution aqueuse<br />
d’acide sulfurique à 0,5 mol/L.<br />
Quand l’électrode de travail fonctionne en cathode,<br />
la réaction observée est l’habituelle réduction des<br />
ions aq H avec une surtension cathodique d’environ 1<br />
V.<br />
Quand l’électrode de travail fonctionne en anode, on<br />
constate un début d’oxydation, vers 0,60 V, suivie<br />
d’une chute brutale du courant.<br />
Ensuite, vers 2 V, on observe l’oxydation de l’eau,<br />
avec dégagement de O2 (la surtension anodique est<br />
d‘environ 0,8 V)
2<br />
On donne : couple Pb 2<br />
<br />
: Pb 2e<br />
Pb<br />
Pb<br />
E 0,13V<br />
,<br />
PbO<br />
couple 2<br />
Pb : <br />
PbO22e4Haq Pb 2H2OE<br />
0,63 V .<br />
Page 5 sur 5<br />
<strong>HYDROMÉTALLURGIE</strong> <strong>DU</strong> <strong>ZINC</strong>.<br />
N’observant aucun courant aux environs de -0,13 V, on en déduit que le couple<br />
Pb 2+ /Pb est lent.<br />
En revanche, l’augmentation du courant aux environs de 0,70 V s’explique par l’oxydation du plomb<br />
métallique en oxyde PbO 2 .<br />
La chute brutale du courant que l’on observe plus loin s’explique par un<br />
phénomène de passivation.<br />
Lorsque l’oxyde PbO 2 , isolant électrique, recouvre toute l’électrode de plomb, les échanges électriques<br />
entre le métal et la solution sont impossibles : l’électrode est devenue quasi inattaquable.<br />
On aboutit en conclusion à un énoncé qui pourrait paraître a priori surprenant :<br />
Une électrode d’un métal réducteur, convenablement passivée, est totalement<br />
inerte en oxydation et supporte des potentiels au moins aussi élevés que<br />
ceux atteints avec l’électrode de platine.<br />
Le schéma ci-contre fait apparaître les différentes<br />
données électrochimiques et permet<br />
de comprendre les choix industriels retenus<br />
pour l’électrolyse de la solution acide de sulfate<br />
de zinc.<br />
La tension entre les électrodes ne doit pas<br />
trop augmenter afin de ne pas atteindre le<br />
courant de diffusion de Zn 2+ , qui risquerait<br />
de conduire à un dégagement de H 2 .<br />
La tension appliquée se décompose en :<br />
U E E rI ,<br />
AC A C A C chute ohmique<br />
thermodynamique cinétique<br />
soit : U 1,23 ( 0,76) 0,7 ( 0,10) 0,7 ; U 3,50 V<br />
AC<br />
chute ohmique<br />
Pour l’électrolyse industrielle de ZnSO 4 , la consommation d’énergie est de 3,2<br />
MWh par tonne de zinc produite.<br />
AC