Test du 15 décembre 2012
Test du 15 décembre 2012
Test du 15 décembre 2012
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
<strong>Test</strong> TS – Décembre <strong>2012</strong> - Corrigé<br />
Partie I – Repro<strong>du</strong>ction des Angiospermes (10 points) Barème<br />
* Utilisation de connecteurs logiques<br />
* 1 idée par paragraphe (plan avec titres)<br />
* Orthographe et grammaire correctes<br />
Intro<strong>du</strong>ction<br />
Les Angiospermes ou plantes à fleurs vivent fixées. Leurs organes repro<strong>du</strong>cteurs se trouvent dans leurs fleurs,<br />
hermaphrodites pour la plupart (leurs fleurs contiennent des organes ♂ et des organes ♀).<br />
Quelles stratégies utilisent les plantes pour favoriser la rencontre de leurs gamètes et pour coloniser leur<br />
environnement tout en restant fixées ?<br />
I- La fécondation croisée<br />
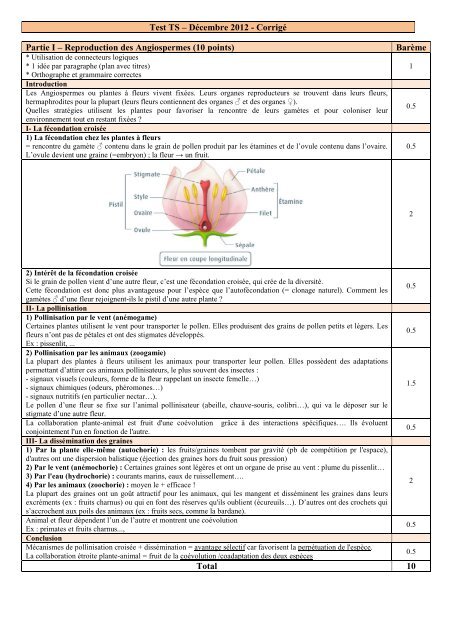
1) La fécondation chez les plantes à fleurs<br />
= rencontre <strong>du</strong> gamète ♂ contenu dans le grain de pollen pro<strong>du</strong>it par les étamines et de l’ovule contenu dans l’ovaire.<br />
L’ovule devient une graine (=embryon) ; la fleur → un fruit.<br />
2) Intérêt de la fécondation croisée<br />
Si le grain de pollen vient d’une autre fleur, c’est une fécondation croisée, qui crée de la diversité.<br />
Cette fécondation est donc plus avantageuse pour l’espèce que l’autofécondation (= clonage naturel). Comment les<br />
gamètes ♂ d’une fleur rejoignent-ils le pistil d’une autre plante ?<br />
II- La pollinisation<br />
1) Pollinisation par le vent (anémogame)<br />
Certaines plantes utilisent le vent pour transporter le pollen. Elles pro<strong>du</strong>isent des grains de pollen petits et légers. Les<br />
fleurs n’ont pas de pétales et ont des stigmates développés.<br />
Ex : pissenlit, ...<br />
2) Pollinisation par les animaux (zoogamie)<br />
La plupart des plantes à fleurs utilisent les animaux pour transporter leur pollen. Elles possèdent des adaptations<br />
permettant d’attirer ces animaux pollinisateurs, le plus souvent des insectes :<br />
- signaux visuels (couleurs, forme de la fleur rappelant un insecte femelle…)<br />
- signaux chimiques (odeurs, phéromones…)<br />
- signaux nutritifs (en particulier nectar…).<br />
Le pollen d’une fleur se fixe sur l’animal pollinisateur (abeille, chauve-souris, colibri…), qui va le déposer sur le<br />
stigmate d’une autre fleur.<br />
La collaboration plante-animal est fruit d'une coévolution grâce à des interactions spécifiques…. Ils évoluent<br />
conjointement l'un en fonction de l'autre.<br />
III- La dissémination des graines<br />
1) Par la plante elle-même (autochorie) : les fruits/graines tombent par gravité (pb de compétition pr l'espace),<br />
d'autres ont une dispersion balistique (éjection des graines hors <strong>du</strong> fruit sous pression)<br />
2) Par le vent (anémochorie) : Certaines graines sont légères et ont un organe de prise au vent : plume <strong>du</strong> pissenlit…<br />
3) Par l'eau (hydrochorie) : courants marins, eaux de ruissellement….<br />
4) Par les animaux (zoochorie) : moyen le + efficace !<br />
La plupart des graines ont un goût attractif pour les animaux, qui les mangent et disséminent les graines dans leurs<br />
excréments (ex : fruits charnus) ou qui en font des réserves qu'ils oublient (écureuils…). D’autres ont des crochets qui<br />
s’accrochent aux poils des animaux (ex : fruits secs, comme la bardane).<br />
Animal et fleur dépendent l’un de l’autre et montrent une coévolution<br />
Ex : primates et fruits charnus...,<br />
Conclusion<br />
Mécanismes de pollinisation croisée + dissémination = avantage sélectif car favorisent la perpétuation de l'espèce.<br />
La collaboration étroite plante-animal = fruit de la coévolution /coadaptation des deux espèces<br />
Total 10<br />
1<br />
0.5<br />
0.5<br />
2<br />
0.5<br />
0.5<br />
1.5<br />
0.5<br />
2<br />
0.5<br />
0.5
Partie II – Exercice 2 - NON SPE – Evolution de la biodiversité - (7 points)<br />
Intro avec problèmes posés (il y en a deux) :<br />
Certains organismes nuisibles deviennent résistants aux traitements jadis efficaces. L’étude des docts fournis,<br />
qui concernent 2 exemples, va nous permettre d’expliquer l’apparition d’organismes résistants ainsi que<br />
l’augmentation de leur nb dans les populations.<br />
I. ORIGINE DE LA RESISTANCE (COMMENT EXPLIQUER L’APPARITION D’ORGANISMES RESISTANTS ?)<br />
A. Résistance de la bactérie Haemophilus influenzae aux antibiotiques.<br />
Le doc 1 nous explique que cette bactérie, responsable de la méningite chez l’enfant, est combattue à l’aide de<br />
la pénicilline, antibiotique qui normalement élimine ces bactéries, et nous indique que la protéine PBP3 est<br />
soupçonnée d’intervenir dans les mécanismes de résistance à la pénicilline.<br />
On considère 4 souches d’ H. influenzae : 2 sensibles à la pénicilline, Rd et T196, et 2 résistantes, H2 et KK01.<br />
La comparaison de la séquence des AA 311 à 540 de la PBP3 de ces 4 souches nous permet d’établir les<br />
tableaux suivants (la souche Rd étant prise comme réf.).<br />
On observe qu’il n’y a aucune différence entre les souches sensibles Rd et T196 pour cette portion de séquence.<br />
N° AA<br />
Souches<br />
350 357 437 502 517 526<br />
Rd = T196 D S A M R N<br />
H2 N N S M H N<br />
KK01 N S A V R K<br />
Position et nature des AA différents entre les séquences partielles de la PBP3 des 4 souches d’H. influenzae<br />
Rd = T196 H2<br />
KK01 3 5<br />
H2 4<br />
Matrice des distances : nb d’AA ≠ entre les séquences<br />
partielles de la PBP3 des 4 souches<br />
Les séquences d’AA st très proches (- de 2,5% de ≠) mais pas identiques. Nous avons à faire à des souches<br />
différentes d’une même espèce de bactéries, la résistance à la pénicilline suggère des propriétés ≠ de la PBP3.<br />
Les différences observées dans la séquence primaire (I) peuvent expliquer ces différences de propriétés par<br />
modification de la conformation spatiale de la PBP3.<br />
Or, la séquence I est déterminée par la séquence de nucléotides <strong>du</strong> gène qui la code. Toute modification ds la<br />
séquence I a pour origine une mutation dans la séquence nucléotidique.<br />
Ces mutations st dans ce cas ponctuelles et ne sont ni silencieuses ni neutres (puisqu’il y a modif de la séq d’AA<br />
ET des propriétés de la protéine), ce sont probablement des substitutions faux-sens.<br />
Conclusion :<br />
La résistance de la bactérie H. influenzae à la pénicilline est liée à l’existence de différents allèles <strong>du</strong> gène<br />
codant la PBP3. Les innovations génétiques à l’origine de ces allèles sont des mutations par substitution non<br />
neutres.<br />
B. Résistance <strong>du</strong> moustique Culex pipiens aux insecticides organophosphorés (IOP).<br />
Le doc 2 nous explique que le génome de C. pipiens contient 2 gènes A et B codant des estérases, enzymes<br />
catalysant la dégradation des IOP, et que la quantité d’estérases est 500 fois + importante chez les résistants.<br />
La comparaison <strong>du</strong> génome d’un moustique sensible et d’un moustique résistant révèle que celui <strong>du</strong> moustique<br />
résistant possède 3 fois le groupe des deux gènes, tandis que celui <strong>du</strong> moustique sensible n’en a qu’un ex.<br />
Cette amplification <strong>du</strong> nb de gènes ne peut résulter que de <strong>du</strong>plications transpositions successives.<br />
En outre, le doc ne signale aucune ≠ entre les <strong>du</strong>plicata <strong>du</strong> gène A ni entre les <strong>du</strong>plicata <strong>du</strong> gène B. On peut en<br />
dé<strong>du</strong>ire qu’aucune mutation pouvant con<strong>du</strong>ire à des estérases aux propriétés ≠ n’est survenue.<br />
(On peut émettre l’hypothèse de <strong>du</strong>plications transpositions récentes).<br />
Conclusion : L’origine de la résistance des moustiques aux IOP est donc un mécanisme de <strong>du</strong>plications<br />
transpositions des gènes codant les estérases ; cette innovation génétique a pour conséquence une plus gde<br />
pro<strong>du</strong>ction d’estérases, et comme aucune mutation n’est survenue, les enzymes ont conservé leur propriété de<br />
catalyser la dégradation des IOP.<br />
0,5<br />
1,5<br />
1,5<br />
1<br />
0,5
II. L’AUGMENTATION DU NB D’ORGANISMES RESISTANTS DANS LA POPULATION<br />
Le doc 3 illustre l’évolution de la fréquence des moustiques résistants aux IOP dans la région de Montpellier<br />
pour 2 années : 1968 et 2002, en fonction de la distance à la mer. La zone traitée correspond aux 20 1 er km.<br />
Pour 1968, on remarque que la fréquence des résistants est très faible (< 10%) et constante quelle que soit la<br />
distance à la mer (donc quelle que soit la zone, traitée ou pas).<br />
Pour 2002, on observe que la fréquence des résistants est ≥ 80% dans la zone traitée, et qu’elle diminue ensuite<br />
rapidement quand on s’en éloigne, sans jamais toutefois être < à 20%.<br />
Dans tout le secteur analysé on constate donc la présence de résistants aux IOP, capables de survivre à des<br />
concentrations qui à la fin des années 60 les éliminaient.<br />
Dans la zone traitée, les résistants ont une + grande probabilité de survie que les sensibles, donc contribuent + à<br />
la repro<strong>du</strong>ction de l’espèce, donc au fil des générations la fréquence des moustiques résistants porteurs de<br />
l’amplification génique augmente. La pression de sélection négative de l’environnement (ici les IOP) ne<br />
s’exerce que sur les sensibles.<br />
Dans la zone non traitée, la présence de moustiques résistants s’explique par des migrations de moustiques<br />
résistants, qui, n’ayant pas d’avantage sélectif, restent minoritaires.<br />
CONCLUSION<br />
La résistance des nuisibles aux traitements jadis efficaces peut s’expliquer par des innovations génétiques :<br />
• des mutations (non neutres) à l’origine d’allèles codant des protéines aux séquences polypeptidiques<br />
proches, mais aux propriétés différentes : modification <strong>du</strong> phénotype moléculaire modification <strong>du</strong><br />
phénotype macroscopique (résistance).<br />
• des <strong>du</strong>plications- transpositions entraînant une amplification génique permettant une augmentation de la<br />
quantité de protéines pro<strong>du</strong>ites. Si ces protéines ont un rôle dans la dégradation des pro<strong>du</strong>its de traitement<br />
(comme nous l’avons vu pour C. pipiens), l’augmentation de leur quantité résistance des organismes.<br />
Enfin, l’augmentation <strong>du</strong> nb d’organismes résistants dans les populations est le fait de la sélection naturelle :<br />
dans les zones de traitement les phénotypes résistants ont un avantage sélectif sur les sensibles, leur conférant<br />
une plus grande probabilité de survie donc une plus grande probabilité de transmettre aux générations futures le<br />
génotype à l’origine de cette résistance.<br />
Partie II – Exercice 1 – 3 points<br />
Histoire évolutive de l'Homme<br />
La bonne réponse est la c) : plusieurs rameaux c.à.d. plusieurs espèces, ont coexisté jusqu'à -30 000 ans.<br />
a) fausse : une espèce fossile ne peut jamais être considérée comme un ancêtre commun.<br />
b) fausse : A. sediba a coexisté avec 3 espèces <strong>du</strong> genre Homo il y a env. 2 Ma.<br />
d) fausse : H. sapiens et H. neanderthalensis ont cohabité entre -200 000 ans et -50 000 ans.<br />
0,5<br />
1<br />
0,5