Les voies de signalisation cellulaire des facteurs angiogènes
Les voies de signalisation cellulaire des facteurs angiogènes
Les voies de signalisation cellulaire des facteurs angiogènes
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
<strong>Les</strong> <strong>voies</strong> <strong>de</strong> <strong>signalisation</strong><br />
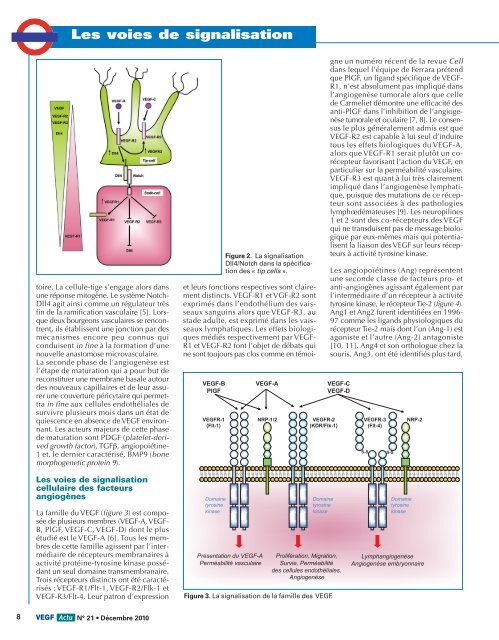
toire. La cellule-tige s’engage alors dans<br />
une réponse mitogène. Le système Notch-<br />
Dll4 agit ainsi comme un régulateur très<br />
fin <strong>de</strong> la ramification vasculaire [5]. Lorsque<br />
<strong>de</strong>ux bourgeons vasculaires se rencontrent,<br />
ils établissent une jonction par <strong>de</strong>s<br />
mécanismes encore peu connus qui<br />
conduisent in fine à la formation d’une<br />
nouvelle anastomose microvasculaire.<br />
La secon<strong>de</strong> phase <strong>de</strong> l’angiogenèse est<br />
l’étape <strong>de</strong> maturation qui a pour but <strong>de</strong><br />
reconstituer une membrane basale autour<br />
<strong>de</strong>s nouveaux capillaires et <strong>de</strong> leur assurer<br />
une couverture péricytaire qui permettra<br />
in fine aux cellules endothéliales <strong>de</strong><br />
survivre plusieurs mois dans un état <strong>de</strong><br />
quiescence en absence <strong>de</strong> VEGF environnant.<br />
<strong>Les</strong> acteurs majeurs <strong>de</strong> cette phase<br />
<strong>de</strong> maturation sont PDGF (platelet-<strong>de</strong>rived<br />
growth factor), TGFβ, angiopoiétine-<br />
1 et, le <strong>de</strong>rnier caractérisé, BMP9 (bone<br />
morphogenetic protein 9).<br />
VEGF-B<br />
PlGF<br />
VEGFR-1<br />
(Flt-1)<br />
Figure 2. La <strong>signalisation</strong><br />
Dll4/Notch dans la spécification<br />
<strong>de</strong>s « tip cells ».<br />
VEGF-A<br />
NRP-1/2<br />
VEGFR-2<br />
(KDR/Flk-1)<br />
et leurs fonctions respectives sont clairement<br />
distincts. VEGF-R1 et VGF-R2 sont<br />
exprimés dans l’endothélium <strong>de</strong>s vaisseaux<br />
sanguins alors que VEGF-R3, au<br />
sta<strong>de</strong> adulte, est exprimé dans les vaisseaux<br />
lymphatiques. <strong>Les</strong> effets biologiques<br />
médiés respectivement par VEGF-<br />
R1 et VEGF-R2 font l’objet <strong>de</strong> débats qui<br />
ne sont toujours pas clos comme en témoigne<br />
un numéro récent <strong>de</strong> la revue Cell<br />
dans lequel l’équipe <strong>de</strong> Ferrara prétend<br />
que PlGF, un ligand spécifique <strong>de</strong> VEGF-<br />
R1, n’est absolument pas impliqué dans<br />
l’angiogenèse tumorale alors que celle<br />
<strong>de</strong> Carmeliet démontre une efficacité <strong>de</strong>s<br />
anti-PlGF dans l’inhibition <strong>de</strong> l’angiogenèse<br />
tumorale et oculaire [7, 8]. Le consensus<br />
le plus généralement admis est que<br />
VEGF-R2 est capable à lui seul d’induire<br />
tous les effets biologiques du VEGF-A,<br />
alors que VEGF-R1 serait plutôt un corécepteur<br />
favorisant l’action du VEGF, en<br />
particulier sur la perméabilité vasculaire.<br />
VEGF-R3 est quant à lui très clairement<br />
impliqué dans l’angiogenèse lymphatique,<br />
puisque <strong>de</strong>s mutations <strong>de</strong> ce récepteur<br />
sont associées à <strong>de</strong>s pathologies<br />
lymphœdémateuses [9]. <strong>Les</strong> neuropilines<br />
1 et 2 sont <strong>de</strong>s co-récepteurs <strong>de</strong>s VEGF<br />
qui ne transduisent pas <strong>de</strong> message biologique<br />
par eux-mêmes mais qui potentialisent<br />
la liaison <strong>de</strong>s VEGF sur leurs récepteurs<br />
à activité tyrosine kinase.<br />
<strong>Les</strong> angiopoïétines (Ang) représentent<br />
une secon<strong>de</strong> classe <strong>de</strong> <strong>facteurs</strong> pro- et<br />
anti-angiogènes agissant également par<br />
l’intermédiaire d’un récepteur à activité<br />
tyrosine kinase, le récepteur Tie-2 (figure 4).<br />
Ang1 et Ang2 furent i<strong>de</strong>ntifiées en 1996-<br />
97 comme les ligands physiologiques du<br />
récepteur Tie-2 mais dont l’un (Ang-1) est<br />
agoniste et l’autre (Ang-2) antagoniste<br />
[10, 11]. Ang4 et son orthologue chez la<br />
souris, Ang3, ont été i<strong>de</strong>ntifiés plus tard,<br />
VEGF-C<br />
VEGF-D<br />
VEGFR-3<br />
(Flt-4)<br />
S-S<br />
S-S<br />
NRP-2<br />
<strong>Les</strong> <strong>voies</strong> <strong>de</strong> <strong>signalisation</strong><br />
<strong>cellulaire</strong> <strong>de</strong>s <strong>facteurs</strong><br />
angiogènes<br />
La famille du VEGF (figure 3) est composée<br />
<strong>de</strong> plusieurs membres (VEGF-A, VEGF-<br />
B, PlGF, VEGF-C, VEGF-D) dont le plus<br />
étudié est le VEGF-A [6]. Tous les mem -<br />
bres <strong>de</strong> cette famille agissent par l’intermédiaire<br />
<strong>de</strong> récepteurs membranaires à<br />
activité protéine-tyrosine kinase possédant<br />
un seul domaine transmembranaire.<br />
Trois récepteurs distincts ont été caractérisés<br />
: VEGF-R1/Flt-1, VEGF-R2/Flk-1 et<br />
VEGF-R3/Flt-4. Leur patron d’expression<br />
Domaine<br />
tyrosine<br />
kinase<br />
Présentation du VEGF-A<br />
Perméabilité vasculaire<br />
Domaine<br />
tyrosine<br />
kinase<br />
Prolifération, Migration,<br />
Survie, Perméabilité<br />
<strong>de</strong>s cellules endothéliales.<br />
Angiogenèse<br />
Figure 3. La <strong>signalisation</strong> <strong>de</strong> la famille <strong>de</strong>s VEGF.<br />
Domaine<br />
tyrosine<br />
kinase<br />
Lymphangiogenèse<br />
Angiogenèse embryonnaire<br />
8 VEGF Actu N° 21 • Décembre 2010