Ch. 12. Exercices corrigés. Transformations en chimie organique ...
Ch. 12. Exercices corrigés. Transformations en chimie organique ...
Ch. 12. Exercices corrigés. Transformations en chimie organique ...
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
Thème 2 : COMPRENDRE– Lois et modèles p : 1 <strong>Ch</strong>.12 <strong>Transformations</strong> <strong>en</strong> <strong>chimie</strong> <strong>organique</strong>. Aspects microscopiques<br />
<strong>Ch</strong>. <strong>12.</strong> <strong>Exercices</strong> corrigés.<br />
<strong>Transformations</strong> <strong>en</strong> <strong>chimie</strong> <strong>organique</strong>. Aspects microscopiques.<br />
EXERCICE corrigé : <strong>Ch</strong><strong>12.</strong> <strong>Transformations</strong> <strong>en</strong> <strong>chimie</strong> <strong>organique</strong> : aspect microscopique p : 315-316<br />
Pour aller plus loin. Les électronégativités sont données dans la classification périodique (rabat VI).<br />
p : 315 n°18. Bac. Hydratation de l'hex-1-ène Compét<strong>en</strong>ces:Extraire des informations; raisonner; calculer; modéliser<br />
On chauffe à reflux un mélange obt<strong>en</strong>u <strong>en</strong> ajoutant un volume V = 20 mL d'hex-1 -ène à une solution aqueuse d'acide sulfurique.<br />
Après lavage, séchage et distillation, une masse m = 8,22 g d'hexan-2-ol est obt<strong>en</strong>ue.<br />
1. a. Écrire l'équation de la réaction <strong>en</strong>tre l'eau et l'hex-l-ène.<br />
b. À quelle catégorie de réactions apparti<strong>en</strong>t-elle réaction d’addition<br />
c. Quelle modification de structure s'est produite au cours de cette réaction<br />
Au cours de cette réaction, un changem<strong>en</strong>t de groupe caractéristique se produit.<br />
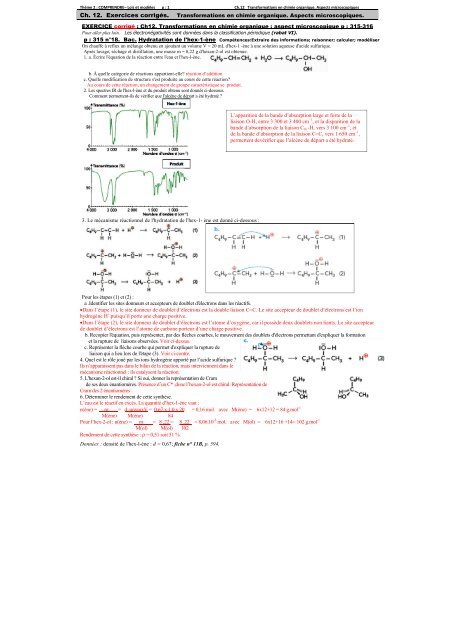
2. Les spectres IR de l'hex-l-ène et du produit obt<strong>en</strong>u sont donnés ci-dessous.<br />
Comm<strong>en</strong>t permett<strong>en</strong>t-ils de vérifier que l'alcène de départ a été hydraté <br />
L’apparition de la bande d’absorption large et forte de la<br />
liaison O-H, <strong>en</strong>tre 3 300 et 3 400 cm –1 , et la disparition de la<br />
bande d’absorption de la liaison C tri -H, vers 3 100 cm –1 , et<br />
de la bande d’absorption de la liaison C=C, vers 1 650 cm –1 ,<br />
permett<strong>en</strong>t devérifier que l’alcène de départ a été hydraté.<br />
3. Le mécanisme réactionnel de l'hydratation de l'hex-1- ène est donné ci-dessous :<br />
Pour les étapes (1) et (2) :<br />
a .Id<strong>en</strong>tifier les sites donneurs et accepteurs de doublet d'électrons dans les réactifs.<br />
•Dans l’étape (1), le site donneur de doublet d’électrons est la double liaison C=C. Le site accepteur de doublet d’électrons est l’ion<br />
hydrogène H + puisqu’il porte une charge positive.<br />
•Dans l’étape (2), le site donneur de doublet d’électrons est l’atome d’oxygène, car il possède deux doublets non liants. Le site accepteur<br />
de doublet d’électrons est l’atome de carbone porteur d’une charge positive.<br />
b. Recopier l'équation, puis représ<strong>en</strong>ter, par des flèches courbes, le mouvem<strong>en</strong>t des doublets d'électrons permettant d'expliquer la formation<br />
et la rupture de liaisons observées. Voir ci-dessus.<br />
c. Représ<strong>en</strong>ter la flèche courbe qui permet d'expliquer la rupture de<br />
liaison qui a lieu lors de l'étape (3). Voir ci-contre.<br />
4. Quel est le rôle joué par les ions hydrogène apporté par l’acide sulfurique <br />
Ils n’apparaiss<strong>en</strong>t pas dans le bilan de la réaction, mais intervi<strong>en</strong>n<strong>en</strong>t dans le<br />
mécanisme réactionnel : ils catalys<strong>en</strong>t la réaction.<br />
5. L'hexan-2-ol est-il chiral Si oui, donner la représ<strong>en</strong>tation de Cram<br />
de ses deux énantiomères. Prés<strong>en</strong>ce d’un C* ,donc l’hexan-2-ol est chiral. Représ<strong>en</strong>tation de<br />
Cram des 2 énantiomères :<br />
6. Déterminer le r<strong>en</strong>dem<strong>en</strong>t de cette synthèse.<br />
L’eau est le réactif <strong>en</strong> excès. La quantité d’hex-1-ène vaut :<br />
n(ène) = m = d .µ(eau).V = 0,67 x 1,0 x 20 = 0,16 mol. avec M(ène) = 6x12+12 = 84 g.mol -1<br />
M(ène) M(ène) 84<br />
Pour l’hex-2-ol : n(ène) = m = 8 ,22 = 8 ,22 = 8,06.10 -2 mol. avec M(ol) = 6x12+16 +14= 102 g.mol -1<br />
M(ol) M(ol) 102<br />
R<strong>en</strong>dem<strong>en</strong>t de cette synthèse : ρ = 0,51 soit 51 %.<br />
Données : d<strong>en</strong>sité de l'hex-l-ène : d = 0,67; fiche n° 11B, p. 594.
Thème 2 : COMPRENDRE– Lois et modèles p : 2 <strong>Ch</strong>.12 <strong>Transformations</strong> <strong>en</strong> <strong>chimie</strong> <strong>organique</strong>. Aspects microscopiques<br />
EXERCICE résolu : <strong>Ch</strong><strong>12.</strong> <strong>Transformations</strong> <strong>en</strong> <strong>chimie</strong> <strong>organique</strong> : aspect microscopique p : 316<br />
Pour aller plus loin. Les électronégativités sont données dans la classification périodique (rabat VI).<br />
p : 315 n°19. Hydratation du chloral Compét<strong>en</strong>ces : Extraire des informations; raisonner; modéliser; rédiger.<br />
L'hydrate de chloral est <strong>en</strong>core utilisé comme sédatif dans certains pays. 11 est obt<strong>en</strong>u par hydratation <strong>en</strong> milieu acide du chloral selon la réaction d'équation :<br />
1.a. À quelle catégorie de réactions apparti<strong>en</strong>t-elle<br />
Cette réaction est une réaction d’addition.<br />
b. Quelle modification de structure s'est produite au cours de<br />
cette réaction<br />
Une modification de groupe caractéristique s’est<br />
produite au cours de cette réaction.<br />
2. Le spectre IR du produit obt<strong>en</strong>u est donné ci-contre :<br />
a. Montrer qu'il permet de vérifier que le chloral a été hydraté.<br />
L’apparition de la bande d’absorption large et forte de la liaison O-H,<br />
vers 3 300 et 3 400 cm –1 , et la disparition de la bande d’absorption de la<br />
liaison C=O, vers 1 700 cm –1 , permett<strong>en</strong>t de vérifier que le<br />
chloral a bi<strong>en</strong> été hydraté.<br />
b. Combi<strong>en</strong> observera-t-on de signaux dans le spectre de RMN<br />
de l'hydrate de chloral. Quelle sera leur multiplicité<br />
On observera deux signaux dans le spectre de RMN de l’hydrate de chloral de multiplicité 1.<br />
Le mécanisme réactionnel correspondant à cette hydratation est donné ci-dessous :<br />
3. Pour l'étape (1) :<br />
a. Id<strong>en</strong>tifier les sites donneurs et accepteurs de doublet d'électrons dans les réactifs.<br />
. • Le chloral comporte trois atomes de chlore et un atome d’oxygène, tous porteurs de doublet non liants : ces atomes sont des sites donneurs de<br />
doublet d’électrons.<br />
. • Les deux atomes de carbone du chloral sont liés à des atomes plus électronégatifs qu’eux ; ces atomes de carbone port<strong>en</strong>t donc des charges<br />
partielles positives et sont des sites accepteurs de doublet<br />
d’électrons.<br />
. • L’ion hydrogène porte une charge positive ; il est un site<br />
accepteur de doublet d’électrons.<br />
b .Recopier l'équation, puis représ<strong>en</strong>ter, par des flèches courbes, le<br />
mouvem<strong>en</strong>t des doublets d'électrons expliquant la formation et la rupture des<br />
liaisons observées.<br />
4. Rédiger un texte expliquant les flèches courbes tracées pour l'étape (2).<br />
Dans l’étape (2), la flèche courbe partant d’un des doublets d’électrons non liants de l’atome d’oxygène de la molécule d’eau et allant jusqu’à l’atome<br />
de carbone lié à l’atome d’oxygène traduit l’interaction qui a lieu <strong>en</strong>tre l’oxygène, site donneur de doublet d’électrons, et le carbone, site accepteur de<br />
doublet d’électrons (puisqu’il est lié à un atome d’oxygène plus électronégatif que lui). Elle explique la formation de la liaison <strong>en</strong>tre ces deux atomes.<br />
Comme l’atome de carbone ne peut pas être <strong>en</strong>touré de plus de quatre doublets pour respecter la règle de l’octet, une des liaisons qu’il <strong>en</strong>gageait<br />
se rompt lorsque la liaison <strong>en</strong>tre cet atome et l’atome d’oxygène de la molécule d’eau s’établit : un des deux doublets d’électrons de la double liaison<br />
C=O bascule ainsi sur l’atome d’oxygène (atome le plus électronégatif), ce que traduit la flèche courbe rouge.<br />
5. Quels sont les produits formés lors de l'étape (3) Recopier et compléter son équation.<br />
Les produits formés lors de l’étape (3) sont un ion hydrogène H+ et le chloral Cl 3 C-CH(OH) 2 .<br />
6. Quel est le rôle joué par les ions hydrogène prés<strong>en</strong>ts dans le milieu acide<br />
Donnée : fiche n° 11B, p. 594.<br />
Les ions hydrogène prés<strong>en</strong>ts dans le milieu acide n’apparaiss<strong>en</strong>t pas dans le bilan de la réaction, mais intervi<strong>en</strong>n<strong>en</strong>t dans le mécanisme réactionnel :<br />
ils catalys<strong>en</strong>t la réaction.