You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
Seconde – Sciences Physiques et Chimiques<br />
Activité n°5.3<br />
1 ère Partie : La santé – Chapitre 5 Correction<br />
Quelques molécules de la santé et leurs <strong>groupes</strong> caractéristiques (<strong>corr</strong>ection)<br />
Première partie<br />
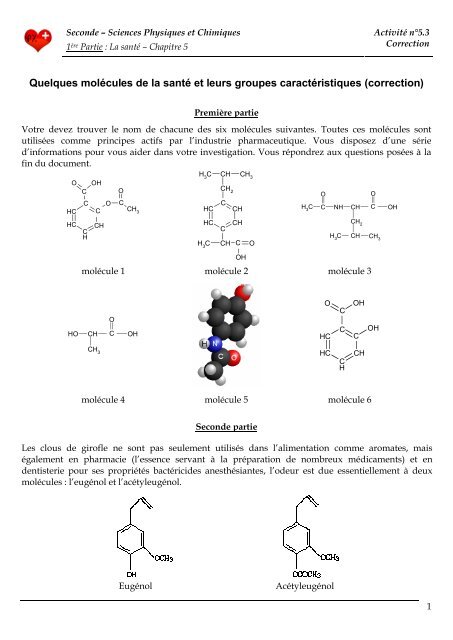
Votre devez trouver le nom de chacune des six molécules suivantes. Toutes ces molécules sont<br />
utilisées comme principes actifs par l’industrie pharmaceutique. Vous disposez d’une série<br />
d’informations pour vous aider dans votre investigation. Vous répondrez aux questions posées à la<br />
fin du document.<br />
O<br />
HC<br />
HC<br />
C<br />
C<br />
C<br />
H<br />
OH<br />
C<br />
CH<br />
O<br />
O<br />
C<br />
CH 3<br />
H 3<br />
C<br />
H 3<br />
C<br />
HC<br />
HC<br />
CH CH 3<br />
CH 2<br />
C<br />
C<br />
CH<br />
molécule 1 molécule 2 molécule 3<br />
CH<br />
CH<br />
C<br />
OH<br />
O<br />
H 3<br />
C<br />
O<br />
C<br />
NH<br />
C H 3<br />
CH<br />
CH 2<br />
CH<br />
O<br />
C<br />
CH 3<br />
OH<br />
HO<br />
CH<br />
O<br />
C<br />
OH<br />
O<br />
HC<br />
C<br />
C<br />
OH<br />
C<br />
OH<br />
CH 3<br />
HC<br />
C<br />
H<br />
CH<br />
molécule 4 molécule 5 molécule 6<br />
Seconde partie<br />
Les clous de girofle ne sont pas seulement utilisés dans l’alimentation comme aromates, mais<br />
également en pharmacie (l’essence servant à la préparation de nombreux médicaments) et en<br />
dentisterie pour ses propriétés bactéricides anesthésiantes, l’odeur est due essentiellement à deux<br />
molécules : l’eugénol et l’acétyleugénol.<br />
Eugénol<br />
Acétyleugénol<br />
1
Seconde – Sciences Physiques et Chimiques<br />
Activité n°5.3<br />
1 ère Partie : La santé – Chapitre 5 Correction<br />
Informations<br />
Information 1. Les molécules utilisées pour leurs vertus thérapeutiques comportent des <strong>groupes</strong><br />
d’atomes leur conférant des propriétés chimiques spécifiques ; ces <strong>groupes</strong> d’atomes sont appelés<br />
<strong>groupes</strong> caractéristiques.<br />
Exemples de <strong>groupes</strong> caractéristiques<br />
─ O ─ OH C<br />
O<br />
OH<br />
éther oxyde hydroxyle carboxyle ester amine amide<br />
C<br />
O<br />
O<br />
NH 2<br />
C<br />
O<br />
NH<br />
Information 2. L’acétyl-leucine, dont l'action sur le vertige de la souris<br />
a été découverte en 1957, est utilisée depuis avec succès en clinique<br />
humaine comme médicament symptomatique des états vertigineux.<br />
Cette molécule comporte un groupe carboxyle et un groupe amide.<br />
Information 3. La kératose pilaire est une maladie de peau se caractérisant par une sécheresse<br />
importante et la présence de squames (écailles de peau) très fines, ressemblant à des écailles de<br />
poisson, ce qui donne à la peau un aspect rêche. Certains traitements thérapeutiques préconisent<br />
l’utilisation de modificateur de la kératinisation, tels que l’acide salicylique et l’acide lactique. Ces<br />
deux molécules possèdent les mêmes <strong>groupes</strong> caractéristiques : un groupe carboxyle et un groupe<br />
hydroxyle, mais la molécule d’acide salicylique est cyclique, contrairement à celle d’acide lactique.<br />
Information 4. Le paracétamol, l’aspirine et l’ibuprofène sont des espèces chimiques utilisées en<br />
médecine pour leurs propriétés antalgique (ou analgésique) et antipyrétique (ou fébrifuge). Elles<br />
constituent le principe actif de nombreux médicaments commercialisés sous des noms variés. La<br />
molécule d’ibuprofène ne comporte qu’un groupe caractéristique : le groupe carboxyle. Les<br />
molécules d’aspirine et de paracétamol ont chacune deux <strong>groupes</strong> caractéristiques différents :<br />
carboxyle et ester pour l’aspirine, amide et hydroxyle pour le paracétamol.<br />
Information 5. L’aspirine est le nom usuel de l’acide acétylsalicylique. Cette molécule est synthétisée<br />
par transformation chimique de l’acide salicylique. Au cours de cette synthèse, le groupe hydroxyle<br />
de l’acide salicylique est transformé en groupe ester, tandis que le reste de la molécule ne change pas.<br />
Information 6. Contrairement à l’aspirine, le paracétamol peut généralement<br />
être utilisé par les personnes qui suivent un traitement anticoagulant. La<br />
synthèse du paracétamol est effectuée par transformation chimique du paraaminophénol.<br />
Au cours de cette synthèse, le groupe amine du paraaminophénol<br />
est transformé en groupe amide, tandis que le reste de la<br />
molécule est inchangé.<br />
HC<br />
HC<br />
OH<br />
C<br />
C<br />
NH 2<br />
CH<br />
CH<br />
Para-aminophénol<br />
2
Seconde – Sciences Physiques et Chimiques<br />
Activité n°5.3<br />
1 ère Partie : La santé – Chapitre 5 Correction<br />
Première partie<br />
Questions<br />
1. Définir les termes : thérapeutique, antalgique, antipyrétique, anticoagulant, synthèse chimique.<br />
Thérapeutique : relatif au traitement des maladies (curatif).<br />
Antalgique : se dit d’un médicament destiné à réduire la douleur (analgésique).<br />
Antipyrétique : se dit d’un médicament destiné à combattre la fièvre (fébrifuge).<br />
Anticoagulant : se dit d’un médicament destiné à éviter la coagulation naturelle du sang et la<br />
formation de caillots sanguins.<br />
Synthèse chimique : enchaînement de réactions chimiques mis en œuvre pour l'obtention d'un ou de<br />
plusieurs produits finaux<br />
2. Nommer les six molécules qui sont citées pour leurs vertus thérapeutiques.<br />
acétyl-leucine<br />
acide salicylique<br />
acide lactique<br />
acide acétylsalicylique<br />
paracétamol<br />
ibuprofène<br />
3. Définir un modèle éclaté, un modèle compact, une formule développée, une formule semi<br />
développée, une formule brute et une formule topologique (donner un exemple parmi les<br />
molécules de la 1 ère partie si possible).<br />
Modèle éclaté : représentation d’une molécule faisant apparaître le centre des atomes (boules) et les<br />
liaisons entre eux (bâtons). Exemple : voir activité 5.1.<br />
Modèle compact : représentation d’une molécule faisant apparaître les atomes et leur<br />
interpénétration. Exemple : voir activité 5.1.<br />
Formule développée : écriture schématique d’une molécule où les atomes sont indiqués par leur<br />
symbole élémentaire et reliés par des traits représentant les liaisons covalentes. Exemple : voir<br />
activité 5.2.<br />
Formule semi-développée : formule développée où les liaisons des atomes d’hydrogène<br />
n’apparaissent pas. Exemples : molécules 1, 2, 3, 4 et 6 de la 1 ère partie.<br />
Formule topologique : formule semi-développée où seuls les hétéroatomes et les liaisons covalentes<br />
sont indiqués. Exemple : molécules d’eugénol et d’acétyleugénol<br />
4. A partir de ces molécules, indiquer le nombre de liaisons réalisé par chaque atome. Quelles sont<br />
les possibilités pour faire ces liaisons <br />
Hydrogène H : 1 liaison (simple)<br />
Carbone C : 4 liaisons (4 simples – 2 simples et 1 double – 1 simples et 1 triple - 2 doubles)<br />
Oxygène O : 2 liaisons (2 simples – 1 double)<br />
Azote N : 3 liaisons (3 simples – 1 simple et 1 double – 1 triple)<br />
5. Ces molécules appartiennent à la chimie organique. Justifier.<br />
La chimie organique est une branche de la chimie concernant l'étude scientifique de molécules<br />
contenant du carbone et de l'hydrogène, en particulier leur structure, leurs propriétés, leur<br />
composition, leurs réactions et leur préparation. Toutes les molécules présentées ont un « squelette<br />
carboné » et des atomes d’hydrogène : ce sont des molécules organiques.<br />
6. Donner la formule semi développée de la molécule 5.<br />
3
Seconde – Sciences Physiques et Chimiques<br />
Activité n°5.3<br />
1 ère Partie : La santé – Chapitre 5 Correction<br />
HO<br />
HC<br />
HC<br />
H 3 C<br />
C<br />
O<br />
C<br />
C<br />
N<br />
CH<br />
CH<br />
H<br />
7. Identifier les six molécules en rédigeant votre argumentation. Donner leur formule brute.<br />
Molécule n°1 : cycle C6, carboxyle, ester<br />
O<br />
HC<br />
HC<br />
C<br />
C<br />
C<br />
H<br />
OH<br />
C<br />
CH<br />
O<br />
O<br />
C<br />
CH 3<br />
Il s’agit de la molécule d’acide acétylsalicylique (ou aspirine, d’après les infos 4 et 5), C9H8O4.<br />
Molécule n°2 : cycle C6, carboxyle<br />
C<br />
CH CH 3<br />
CH 2<br />
HC<br />
C<br />
CH<br />
H 3<br />
C<br />
HC<br />
C<br />
CH<br />
H 3<br />
CH<br />
C<br />
O<br />
Il s’agit de la molécule d’ibuprofène (info ), C13H18O2.<br />
OH<br />
Molécule n°3 : amide, carboxyle<br />
O<br />
O<br />
H 3<br />
C<br />
C<br />
NH<br />
CH<br />
C<br />
OH<br />
CH 2<br />
C H 3<br />
Il s’agit de la molécule d’acétyl-leucine (info ), C8H15NO3.<br />
CH<br />
CH 3<br />
Molécule n°4 : hydroxyle, carboxyle<br />
O<br />
HO<br />
CH<br />
C<br />
OH<br />
Il s’agit de l’acide lactique (info 3) C3H6O3 car elle n’est pas cyclique.<br />
CH 3<br />
4
Seconde – Sciences Physiques et Chimiques<br />
Activité n°5.3<br />
1 ère Partie : La santé – Chapitre 5 Correction<br />
Molécule n°5 : cycle C6, amide<br />
HC<br />
HC<br />
H 3 C<br />
C<br />
O<br />
HO<br />
C<br />
CH<br />
CH<br />
C<br />
N<br />
H<br />
Il s’agit de la molécule de paracétamol (info 4 et 6), C8H9NO2.<br />
Molécule n°6 : cycle C6, hydroxyle, carboxyle<br />
O<br />
C<br />
OH<br />
HC<br />
C<br />
C<br />
OH<br />
Il s’agit de la molécule d’acide salicylique (infos 3 et 5), C7H6O3.<br />
Seconde partie<br />
HC<br />
C<br />
H<br />
1. Les molécules d’eugénol et d’acétyleugénol sont assez semblables. Préciser la partie qui diffère.<br />
Dans la molécule d’acétyleugénol, le groupe hydroxyle de la molécule d’eugénol est remplacée par<br />
un groupe ester.<br />
2. Pour chaque molécule, identifier les <strong>groupes</strong> caractéristiques et les nommer.<br />
Molécule d’eugénol : étheroxyde, hydroxyle<br />
Molécule d’acétyleugénol : étheroxyde, ester<br />
3. Donner la formule brute et semi développée de chaque molécule.<br />
eugénol C10H12O2<br />
HC<br />
H 2 C<br />
C<br />
CH<br />
CH<br />
CH<br />
CH 2<br />
HC<br />
C<br />
C<br />
O<br />
OH<br />
CH 3<br />
acétyleugénol C12H14O3<br />
HC<br />
H 2 C<br />
C<br />
CH<br />
CH<br />
CH 2<br />
HC<br />
C<br />
C<br />
O<br />
O<br />
C<br />
O<br />
CH 3<br />
CH 3<br />
5