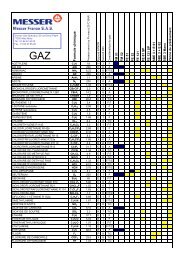
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
<strong>Gases</strong> <strong>for</strong> <strong>Life</strong>Oxygène, azote et bien plus encoreLes gaz industriels sont aussi essentiels que l'eau et l'électricité.Même dans la vie quotidienne.
Qu'est-ce que les gaz industriels ?On désigne par Gaz Industriels les gaz présents dans l'airoxygène, azote, argon, xénon, néon, krypton, dioxyde decarbone CO 2 , hélium ainsi que l'acétylène et l'hydrogènesans oublier les mélanges de tous ces gaz. Chez <strong>Messer</strong>,nous avons choisi de nommer nos gaz industriels « <strong>Gases</strong><strong>for</strong> <strong>Life</strong> » (gaz pour la vie). Ces derniers sont produits àgrande échelle et deviennent aussi essentiels que l'eau etl'électricité dans beaucoup de procédés de fabrication deproduits de la vie quotidienne.Qu'est-ce que l'air ?Ce que nous appelons communément« air » est un mélange de différentsgaz <strong>for</strong>mé par l'atmosphèrede notre planète. L'air est composéessentiellement d'azote (78%) etd'oxygène (21%), d'une petite partied'argon (1%) et d'autres gaz dits « rares» en très petites quantités .Dioxyde de carbone CO 2, néon Ne, hélium He, méthaneCH 4, krypton Kr, hydrogène H 2, protoxyde d'azote N 2 O,monoxyde de carbone CO, xénon Xe (0,1 % au total)Ar(0,9 %)O 2(21 %)N 2(78 %)D'où viennent-ils ?L'oxygène, l'azote, l'argon, le xénon, le néon et le kryptonsont fabriqués à partir de l'air ambiant. Le dioxyde de carboneou gaz carbonique CO 2 est quant à lui capté sur les rejetsgazeux émis par les industries chimiques et biologiques.Il est ensuite liquéfié et purifié. Il peut aussi être issu desources naturelles. L'hydrogène et l'acétylène sont produitschimiquement. L'hélium est extrait de sources naturellesdans le sous-sol.ProductionchimiqueH 2C 2 H 2GazindustrielsSéparation d'airKrArO 2N 2NeComment récupérer les gaz contenus dans l'air ?Afin de récupérer ces gaz, nous utilisons des unités de séparation d'airqui peuvent dépasser 60 mètres de hauteur. Dans ces unités, nousmettons en oeuvre un procédé physique pour séparer les différentscomposants de l'air. Voici de manière simplifiée comment se déroule ceprocédé, appelé également rectification à basse température :L'air ambiant que nous respirons est successivement :• filtré (dépoussiéré) etcomprimé à environ 6 bar• pré-refroidi avec de l'eau derefroidissement• séché dans un tamis moléculaireet débarassé du CO 2• refroidi à -175 °C dans unéchangeur thermique, puisliquéfié• décomposé en oxygène etazote liquides et gazeux dansune colonne de séparation• décomposé également enargon liquideLes gaz de l’air azote, oxygèneet argon ainsi produits sontensuite stockés sous <strong>for</strong>meliquide dans des réservoirscryogéniques.Rejets industrielsSources naturelles
De quelle manière nos gaz industriels « <strong>Gases</strong> <strong>for</strong> <strong>Life</strong> » parviennent-ils chez nos clients ?Pour répondre aux besoins en petites quantités, les gaz sontstockés dans des bouteilles sous pression. Lorsque nos clientsont besoin de gaz industriels en grandes quantités, nous installonssur leurs sites des réservoirs fixes permettant de stockerdes gaz tels que l'oxygène, l'azote, l'argon ou le CO 2 sous <strong>for</strong>meliquide. Les gaz liquéfiés sont transportés depuis nos sites deproduction jusque chez nos clients dans des camions citernes.Plus un utilisateur a des besoins en gaz industriels élevés, plus ilse doit d'être proche du lieu de production des gaz qu'il utilise.En règle générale, les gaz sont produits là où se trouvent les besoins,à savoir à proximité des zones industrielles importantes.Les grands sites industriels tels que les aciéries ou les industrieschimiques, ont des besoins en gaz industriels si importantsqu'une unité de séparation d'air est parfois exploitée à demeuresur leur site. Une ou plusieurs grandes entreprises peuvent êtreaussi alimentées en gaz industriels par des réseaux de pipelines,notamment dans des zones industrielles où nous sommesimplantées.Qui utlise nos « <strong>Gases</strong> <strong>for</strong> <strong>Life</strong> » ?Qui est le groupe <strong>Messer</strong> ?Les gaz industriels sont utilisés à différents degrés depureté et à différentes fins. Selon leur utilisation, ils sedéclinent en gaz alimentaires, gaz pharmaceutiques, gazmédicaux, gaz spéciaux ou gaz de soudage par exemple.Les gaz industriels permettent de rendre les procédés deproduction plus sûrs et plus économiques et d'améliorer laqualité des produits. Souvent, ils contribuent à la protectionde l'environnement. Certains procédés et applicationsseraient même impossibles sans les caractéristiqueschimiques des gaz. Les secteurs d'activité typiques qui utilisentdes gaz sont les suivants : l'automobile, la sidérurgie,les technologies de l'environnement, l'agroalimentaire etles boissons, le bâtiment et travaux publics, la métallurgie,le verre et la céramique, la médecine et l'industrie pharmaceutique,l'industrie chimique ainsi que la recherche etle développement.Gazindustriels<strong>Messer</strong> est le plus grand spécialiste de gaz industriels dirigépar son propriétaire. Adolf <strong>Messer</strong> a fondé la société en1898 et c'est son petit-fils Stefan <strong>Messer</strong> (photo) qui dirigel'entreprise aujourd'hui. Lui et ses plus de 5 000 collaborateursen Europe et en Asie travaillent selon des valeurs biendéfinies : Ce sont entre autres l'orientation vers les clients etles collaborateurs, la responsabilité sociale, la responsabilitéd'entrepreneur, l'excellence ainsi que la confiance et lerespect. Le siège social de ce groupe familial <strong>Messer</strong> se trouveà Bad Soden près de Franc<strong>for</strong>t.
OOxygèneUne tendance à vouloirse lierSymbole chimique : ORessources :20,9 pour cent dans l'air ;50,5 pour cent dans l'ensemblede l'atmosphère, l'hydrosphère, labiosphère et la lithosphèrePoint d'ébullition : - 183 °CL'oxygène liquide sous pressionatmosphérique n'occupe que1/854ème de son volume gazeux.Point de congélation : - 219 °CCaractéristiques chimiques :Très réactif, il se lie avec presquetous les autres éléments. Il intervientdans la plupart des procédés decombustion et de corrosion.Extraction : Séparation d'airApplicationsAccélération des réactions d'oxydationdans différents secteurs etprocédés ; augmentation destempératures de process dansla métallurgie, l'industrie descéramiques et du verre ; accélérationde procédés biologiques et biochimiques,par exemple dans lecadre du traitement d'eau usées(stations d'épuration biologique) ;aide respiratoire dans le domainemédical, ainsi que beaucoup d'autresapplications encore.L'oxygène permet parexemple de faciliter lethermo<strong>for</strong>mage et leraffinage du verre.Plus de la moitié, à savoir précisément 50,5 pour cent des parties de notreplanète accessibles à l'homme, sont composés d'oxygène. C'est le pourcentagede cet élément dans l'atmosphère, l'hydrosphère (les eaux) et la lithosphèrejusqu'à une profondeur de 16 kilomètres. Rien que par sa masse, l'oxygène estainsi l'élément de base le plus important de notre mondeL'oxygène tient son nom d'une erreur de la science naturelle ancienne. Au18 ème siècle, les pionniers de la chimie pensaient que ce gaz incolore et inodoreétait responsable de la <strong>for</strong>mation des acides. C'est pourquoi, ils l'ont appeléOxygenium (<strong>for</strong>mateur d'acide), dérivé du mot grec oxys qui veut dire acide.D'ailleurs, dans l'espace, l'oxygène est le troisième élément après l'hydrogène etl'hélium, mais avec une fraction massique beaucoup moins importante que surterre. Dans le système solaire, il représente environ 0,8 pour cent. Le caractèreréactif de l'oxygène est exploité par des entreprises industrielles qui cherchentà rendre leurs productions plus efficaces à moindres coûts : l'oxygène intervientdans la plupart des procédés industriels dans lesquels des combustions ouréactions chimiques jouent un rôle, depuis le recuit d'acier jusqu'au traitementd'eau.L'oxygène médicaljoue un rôleimportant en tantque gaz respirable.
Le froid de l'azote liquidestabilise les sols sur leschantiers de terrassement.NSymboleL'azote est un composant essentiel des aminoacides et, en tant que tel, unélément de base de toute <strong>for</strong>me de vie. Sans cet élément dont le symbole chimiqueest N, il n'y aurait pas de métabolisme, pas de protéines et pas d'ADN, nipour les plantes ni pour les animaux ou les hommes. L'azote représente presque2 kg du poids d'un adulte de 70 kg.Son nom allemand (Stickstoff = matière étouffante) vient du fait qu'il estcapable d'étouffer aussi bien des flammes que tout être vivant. Le nomscientifique Nitrogenium est dérivé du mot grec « nitros » qui veut dire nitratede potassium, molécule à partir de laquelle l'azote était extrait avant l'inventionde la séparation d'air.99 pour cent de l'azote de la terre se trouvent dans l'air. La plupart des plantesconsomment de l’azote à partir de composés présents dans les terresarables. C'est pourquoi, plus de 80 pour cent de la production d'azote mondiale(environ 40 millions tonnes par an) sont utilisés uniquement pour la fabricationd'engrais chimique.De l'azote pur est entre autres utilisé pour gonfler les pneus des avions de sorteque les roues ne prennent pas feu lors du décollage et de l'atterrissage suite au<strong>for</strong>t développement de chaleur. L'azote fait aussi fonction de gaz propulseur,par exemple pour la crème chantilly, ou de gaz de protection pour l'emballagede produits alimentaires.L'azote liquide est utilisé en cryogénie comme moyen de refroidissement, parexemple pour stocker des produits alimentaires ou pour la surgélation rapide.D'autres domaines d'application de l'azote liquide sont le refroidissement dubéton, la congélation des sols en génie civil ainsi que la cryochirurgie dans ledomaine médical. L'exemple le plus connu pour cette dernière est la « cryoablation» de verrues (brûlure par un froid extrême).AzoteA la base de la viechimique : NRessources :Présent à environ 78 pour cent envolume, l'azote est le composant leplus important de l'air, sa fractionmassique par rapport à la lithosphèreest de 0,03 pour centPoint d'ébullition : -196 °CPoint de congélation : - 210 °CCaractéristiques chimiques :En condensant, l'azote moléculaireneutre à l'odeur et au goût devient unliquide incolore. Il est extrêmementpeu réactif , ne se dissout pratiquementpas dans l'eau et estininflammable.Extraction : Séparation d'airApplicationsGaz de protection pour laproduction et le transport dematières inflammables ; gazpropulseur ; gaz pour gonflerlespneus d'avion ; recyclage deréfrigérateurs ; auxiliaire pourla production de substancesactives ; cryobroyage de matièresplastiques ; production d'engraischimiques ; congélation des solssur les chantiers souterrains ;refroidissement de béton prêtà l'emploi ; cryochirurgie, parexemple la « cryoablation » desverrues ; gaz de protection pourla fabrication de composantsmicroélectroniquesLors de la fabrication decomposants électroniques,par ex. pour les lecteurs MP3,l'azote est utilisé comme gaz deprotection.
Gaz raresNoblement discretsL'argon (Ar), le krypton (Kr),le néon (Ne) et le xénon (Xe)font partie du groupe des gazrares ou gaz nobles que l'onpeut extraire de l'air. Leur pointcommun est le fait de n'existerque dans de petites quantitéset de ne réagir que très peuavec d'autres matières : ils sontinertes.ApplicationsArgon : Gaz de protection pour lesoudage d'alliages d'aluminiumou d'aciers spéciaux ; gaz de remplissagepour les ampoules ; gazd'éclairage pour tubes lumineuxà gaz ; agent de protection contrel'oxydation dans l'industrie agroalimentaire; agent d'extinctionincendie gazeuxHélium : Agent réfrigérant dans lesappareils IRM ; gaz de remplissagepour les ballons-sondesXénon : Gaz d'éclairage pour tubeslumineux à gaz ; composants desgaz de remplissage utilisés pourles écrans plasma ; agent de propulsionpour les moteurs ioniquesL'argon sert de gaz deprotection pour denombreuses applicationsde soudage.Le groupe des gaz rares comprend l'hélium, le néon, l'argon, le krypton et le xénonainsi que le radon radioactif et l'ununoctium généré uniquement de manièreartificielle. Ces gaz sont également appelés gaz « nobles » du fait que, comme lesmétaux précieux tels que l'or, l'argent, le platine etc., dans des conditions normales,ils ne s'assemblent presque pas avec d'autres éléments. C'est pourquoi les métauxprécieux restent longtemps blancs et gardent leur « aspect noble ». Les gaz raressont encore moins réactifs que les métaux précieux et méritent donc leur nom.Le gaz rare le plus répandu sur la terre est l'argon (Ar). L'air ambiant contient environun pour cent d'argon. L'argon est notamment utilisé pour le soudage d'alliagesd'aluminium ou d'aciers spéciaux. On l'emploie alors comme gaz de protection,souvent sous <strong>for</strong>me de mélange avec d'autres gaz : l'argon à la fois inerte et lourd(densité supérieure à l’air) protège la zone de soudage contre l'oxygène permettantainsi d'augmenter la qualité et la durabilité des cordons de soudure.L'application la plus connue pour l'hélium, gaz à la fois inerte et très léger, estcertainement le ballon flottant dans l'air. Mais l'hélium est utilisé pour de nombreusesautres applications importantes. Par exemple, dans le domaine médical, onemploie de l'hélium cryogénique liquide comme agent réfrigérant pour les aimantssupra conducteurs des appareils IRM. Tout comme l'argon, il est utilisé comme gazde protection pour le soudage ; il est également le gaz de traçage le plus utilisépour la détection de fuites.Le krypton (Kr), le xénon (Xe) et le néon (Ne) sont avant tout utilisés comme gaz deremplissage ou gaz d'assistance dans des ampoules et des lasers. Les phares auxénon dans l'automobile illustrent ce type d'application très connue par exemple. Ilséclairent beaucoup mieux que les phares halogènes et ont en outre une durée devie plus longue. Le gaz xénon qui leur a donné leur nom est nécessaire au processusde décharge qui permet d'avoir cette lumière très claire. Cependant, les lampeshalogènes sont elles aussi remplies de mélanges de gaz rares. Le xénon et le néonsont également les composants principaux du gaz de remplissage utilisé pour lesécrans plasma.Le krypton sert en outre de gaz de remplissage pour les doubles vitrages : lorsquel'espace entre les vitres est rempli de krypton, les caractéristiques d'isolation sontbeaucoup plus per<strong>for</strong>mantes qu'avec des remplissages à l'air ou à l'argon.Des pharesmodernes auxénon trans<strong>for</strong>mentl'obscurité de la nuiten lumière du jour.
CODioxyde decarboneL'origine de la biomasseLe dioxyde decarbone ou gazcarbonique CO 2 estégalement utiliséLes plantes poussent grâce au CO 2 qu’elles trans<strong>for</strong>ment en oxygène et matièreorganique : le CO 2 est donc indispensable à toute <strong>for</strong>me de vie supérieure.En dehors de l'eau, les plantes contiennent essentiellement des composés carbonés.Elles récupèrent le carbone dont elles ont besoin pour développer leursracines, troncs, feuilles et fruits... à partir du CO 2 contenu dans l'air et libèrent del'oxygène. Les plantes constituent l’alimentation de base d’une grande partiedu monde animal et, de plus en plus, des hommes.Pendant des centaines de millions d'années, cette biomasse a généré des réservesgigantesques de charbon, de pétrole et de gaz naturel que l'homme retrans<strong>for</strong>mede plus en plus massivement en CO 2 par combustion. Cela expliquel’augmentation du taux de dioxyde de carbone dans l'atmosphère ces dernièresdécennies et, entre autres, la hausse globale de la température, le réchauffementclimatique, dû à un effet d'isolation thermique : l’effet de serre.Les progrès techniques permettent de récupérer une partie de ces émissionsde CO 2 et de les réutiliser dans d'autres procédés. L'application la plus connueest l'enrichissement des sodas en gaz carbonique qui leur permet de devenirpétillants (carbonatation des boissons gazeuses).Sous sa <strong>for</strong>me solide de neige ou glace carbonique, le CO 2 permet de refroidiret de surgeler. Dans le traitement de l'eau potable et la neutralisation des eauxusées, le CO 2 faiblement acide joue un rôle de plus en plus important et trèsécologique. Contrairement aux acides minéraux <strong>for</strong>ts agressifs, l'acide organiquefaible CO 2 ne laisse pas de résidus problématiques.Le CO 2 est aussi utilisé dans les serres d’horticulture pour accélérer la croissancedes végétaux. Il redevient alors une biomasse.Formule chimique : CO 2Ressources :L'essentiel du dioxyde de carbone setrouve dissous dans l'eau des merset des fleuves sous <strong>for</strong>me de CO 2 ,d'hydrocarbonate ou d'ions carbonate.Seuls 2 pour cent des ressourcesterrestres se trouvent dans l'atmosphèredont le taux de CO 2 est d'environ 0,04pour cent volumétrique.Point de sublimation : - 79 °CSous pression normale, il devientdirectement gazeuxrPoint triple : - 57 °C à 5,18 barCaractéristiques chimiques :Incolore et inodore, incombustible, peuréactif, se dissout pourtant bien dansl'eau. Il <strong>for</strong>me des carbonates ou deshydrocarbonates avec les oxydes ouhydroxydes métalliques basiques.Récupération :Le CO 2 est le plus souvent un coproduitissu de procédés biochimiques ouchimiques. Il se <strong>for</strong>me entre autreslors du « vapore<strong>for</strong>mage », un procédéclassique utilisé pour produire del'hydrogène, de l'ammoniac et d'autreséléments chimiques de base. C'estégalement un produit secondairerelativement pur et facile à récupérerlors de la production d'oxyde d'éthylèneet d'autres procédés industrielstels que la fermentation alcoolique(production de bioéthanol ou brasseries).Des sources naturelles de CO 2 setrouvent notamment dans les sous-solsdes régions d'origine volcanique.Le recyclagede papier avecdu CO 2 est unecontributionimportante à laprotection del'environnementApplicationsAdditif alimentaire dans les sodas ;traitement de l'eau potable ; neutralisationdes eaux usées ; fertilisationdans les serres ; agent réfrigérant ; agentde nettoyage (sous <strong>for</strong>me de glacecarbonique) ; agent de refroidissement,par exemple pour les traiteurs (glacecarbonique) ou le transport soustempérature dirigée ; lutte contrel'incendie ; recyclage du papier
Bonjour, les gaz pour la vie« <strong>Gases</strong> <strong>for</strong> life »Cette image cache quatre« <strong>Gases</strong> <strong>for</strong> <strong>Life</strong> ». Et un enfant.O 2CO 2CO 2CO 2O 3 N 2CO 2N2La campagne publicitaire actuelle du groupe<strong>Messer</strong> illustre l'utilisation des gaz industrielsdans notre quotidien. Le visuel publicitaire « Petitdéjeuner » montre que l'azote (N 2 ) est utiliséentre autres pour broyer les épices ou pouremballer le fromage sous atmosphère protectricede manière optimale. Le dioxyde de carbone(CO 2 ) intervient pour sa part dans la fertilisationdes légumes (tomates en particulier), le refroidissementde pâte en pâtisserie ou dans l'extractionde la caféine du café et, bien évidemment, ilentre dans la composition des boissons gazeusespour les faire pétiller. L'oxygène (O 2 ) est quant àlui utilisé pour la fabrication du verre tandis quel'ozone (O 3 ) aide à blanchir le papier de manièreécologique.Pour plus d'in<strong>for</strong>mations, rendez-vous surwww.messergroup.comwww.specialtygases.deDécouvrez aussi le site<strong>Gases</strong><strong>for</strong><strong>Life</strong>.deParticipez àGaseWikiSuivez l'actualité du groupe <strong>Messer</strong>sur FacebookSuivez l'actualité du groupe <strong>Messer</strong>sur TwitterProfil d'entreprisesur Xing<strong>Messer</strong> France S.A.S.Angélique Renier25, rue Auguste Blanche92816 Puteaux CedexTél. +33 1 40 80 33 00Fax +33 1 40 80 33 99www.messer.frhttp://blog-messer-france.cominfo@messer.fr