molécule de cyclohexane - Webnode
molécule de cyclohexane - Webnode
molécule de cyclohexane - Webnode
- No tags were found...
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
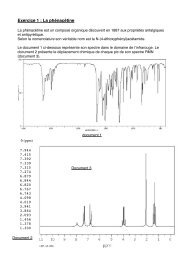
TPOn possè<strong>de</strong> une solution S résultant d’un mélanged’une solution <strong>de</strong> sulfate <strong>de</strong> cuivre (II) et d’une solution<strong>de</strong> rouge <strong>de</strong> méthyle.Comment séparer ces <strong>de</strong>ux solutions?
On va utiliser un solvant extracteur pour extraire lerouge <strong>de</strong> méthyle <strong>de</strong> la solution S.Comment choisir ce solvant?-Le rouge <strong>de</strong> méthyle doit être plus soluble dans cesolvant que dans la solution aqueuse S.-Ce solvant ne doit pas être miscible avec l’eau <strong>de</strong> lasolution S.
Le solvant extracteur choisi pour extraire lerouge <strong>de</strong> méthyle est le <strong>cyclohexane</strong>.Le sulfate <strong>de</strong> cuivre, insoluble dans le<strong>cyclohexane</strong>, restera dans la solution S.Le rouge <strong>de</strong> méthyle est un indicateur coloré. Ilchange <strong>de</strong> couleur suivant le pH.pH: 4,2 6,2
ExpérienceOn agite,on dégazeet on laissedécanter.Phase organiquecontenant le<strong>cyclohexane</strong> et lerouge <strong>de</strong> méthylePhase aqueusecontenant le sulfate<strong>de</strong> cuivreLe <strong>cyclohexane</strong> moins <strong>de</strong>nse que l’eau est situéau <strong>de</strong>ssus.
On recueille la phase aqueuse inférieure dans un bécher A etla phase organique supérieure dans un bécher B.
Pour obtenir le sulfate <strong>de</strong> cuivre (II) et le rouge <strong>de</strong>méthyle à l’état soli<strong>de</strong>, il faut évaporer les <strong>de</strong>uxsolvants eau et <strong>cyclohexane</strong>.
L’oxygène O étant + électronégatif que l’hydrogène, il attirevers lui les électrons <strong>de</strong> la liaison OH, qui <strong>de</strong>vient polarisée.(δ+)(2δ-)pMolécule d’eau: polaire(δ+)
Molécule d’éthanol: les liaisons O-H et C-O sontpolarisées. La molécule est polaire.
molécule <strong>de</strong> <strong>cyclohexane</strong>, les liaisons C-C sontapolaires. Les liaisons C-H sont faiblement polaires.La molécule est apolaire.
567L’eau et l’éthanol sont toutes les <strong>de</strong>ux <strong>de</strong>s moléculespolaires. Des liaisons <strong>de</strong> Van <strong>de</strong>r Waals et <strong>de</strong>s liaisonshydrogène s’établissent entre les <strong>de</strong>ux molécules. Celaexplique que l’eau et l’éthanol soient totalementmiscibles.On peut supposer qu’une molécule peu polaire ouapolaire est soluble dans un solvant apolaire.Des interactions électriques s’établissent entre lesions du soli<strong>de</strong> ionique et l’eau, solvant polaire. Celaexplique la gran<strong>de</strong> solubilité du sulfate <strong>de</strong> cuivredans l’eau.
8Voir au début du TP9Une espèce polaire se dissout dans un solvant polaire.Une espèce apolaire -------------------------------apolaire.Une espèce ionique --------------------------------polaire.