39 A Bohr-féle atommodell Az előbbiek szerint az atomok ...
39 A Bohr-féle atommodell Az előbbiek szerint az atomok ...
39 A Bohr-féle atommodell Az előbbiek szerint az atomok ...
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
Atomfizika 41 A hidrogénatom <strong>Bohr</strong>-<strong>féle</strong> elmélete<br />
összes egy elektront tartalm<strong>az</strong>ó hidrogénszerű ionra, a Z=2 rendszámú<br />
He + ionra, a Z=3 rendszámú Li – ionra,…stb is alkalm<strong>az</strong>hatók.<br />
A klasszikus mechanika <strong>szerint</strong> <strong>az</strong> r sugarú körpálya mechanikai stabilitásának<br />
feltétele, hogy <strong>az</strong> elektronra a mag által kifejtett Coulomb erő<br />
éppen egyenlő legyen a centripetális erővel:<br />
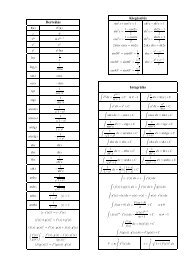
2<br />
m v<br />
r<br />
Ze e<br />
k k<br />
r<br />
Ze ⋅<br />
= = 2<br />
2<br />
r<br />
Ez a feltétel tetszőleges r sugár esetén fennáll. <strong>Az</strong> első <strong>Bohr</strong>-<strong>féle</strong> posztulátum<br />
<strong>szerint</strong> <strong>az</strong>onban <strong>az</strong> elektron nem keringhet tetszőleges sugarú<br />
körpályán, hanem csak stacionárius pályákon. Ezek kiválasztásához<br />
használjuk most fel a <strong>Bohr</strong>-<strong>féle</strong> kvantumfeltételt:<br />
mvr n h<br />
= , ahol n = 1, 2, 3,<br />
...<br />
2π<br />
Ebben a két egyenletben ismeretlenek <strong>az</strong> n kvantumszámhoz tartozó<br />
elektronpálya rn sugara, és ezen a pályán <strong>az</strong> elektron vn sebessége. A<br />
fenti két egyenletből álló egyenletrendszer könnyen megoldható erre a<br />
két ismeretlenre, a megoldás:<br />
r<br />
2<br />
h 2 2πe kZ 1<br />
= ⋅ n ; v = ⋅<br />
2 2<br />
4π<br />
me kZ h n<br />
n n<br />
Speciálisan Z = 1 és n = 1 esetén megkapjuk a hidrogénatom legbelső,<br />
alapállapotbeli elektronpályájának sugarát:<br />
r<br />
1<br />
2<br />
h<br />
= = 0, 53 ⋅10<br />
2 2<br />
4π<br />
me k<br />
valamint ezen a pályán <strong>az</strong> elektron sebességét:<br />
v<br />
1<br />
2<br />
2<br />
−8<br />
2<br />
cm<br />
2πe<br />
k<br />
8 cm c<br />
= = 2, 2⋅ 10 =<br />
h<br />
s 137<br />
ahol c a vákuumbeli fénysebesség. <strong>Az</strong> n kvantumszámú pályán <strong>az</strong> elektronpálya<br />
sugarát és <strong>az</strong>on <strong>az</strong> elektron sebességét a fenti általános formulák<br />
alapján nagyon egyszerűen kapjuk: