Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
Come procedere per preparare una soluzione <strong>tampone</strong>?<br />
Cos’è una soluzione <strong>tampone</strong>?<br />
Si definisce una soluzione <strong>tampone</strong> una soluzione che si oppone alla<br />
variazione del pH per aggiunte moderate di acidi o basi.<br />
Gli acidi, rispettivamente le basi aggiunte alla soluzione vengono neutralizzati<br />
dalla base rispettivamente dall’acido.<br />
Perché tale comportamento sia possibile, per preparare una soluzione<br />
<strong>tampone</strong> devo utilizzare un acido (o una base) debole.<br />
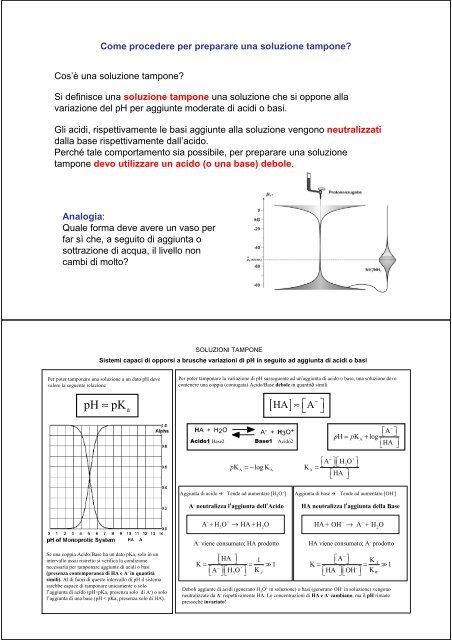
Analogia:<br />
Quale forma deve avere un vaso per<br />
far sì che, a seguito di aggiunta o<br />
sottrazione di acqua, il livello non<br />
cambi di molto?<br />
SOLUZIONI TAMPONE<br />
Sistemi capaci di opporsi a brusche variazioni di pH in seguito ad aggiunta di acidi o basi<br />
Per poter tamponare una soluzione a un dato pH deve<br />
valere la seguente relazione<br />
pH ≈ pKa<br />
Se una coppia Acido/Base ha un dato pKa, solo in un<br />
intervallo assai ristretto si verifica la condizione<br />
necessaria per tamponare aggiunte di acidi o basi<br />
(presenza contemporanea di HA e A - in quantità<br />
simili). Al di fuori di questo intervallo di pH il sistema<br />
sarebbe capace di tamponare unicamente o solo<br />
l’aggiunta di acido (pH>pKa, presenza solo di A - ) o solo<br />
l’aggiunta di una base (pH < pKa, presenza solo di HA).<br />
Per poter tamponare la variazione di pH susseguente ad un’aggiunta di acido o base, una soluzione deve<br />
contenere una coppia (coniugata) Acido/Base debole in quantità simili<br />
HA + H2O A- + H3O+<br />
Acido1 Base2 Base1 Acido2<br />
p KA = −log<br />
KA<br />
[ ]<br />
Aggiunta di acido Tende ad aumentare [H 3 O + ]<br />
A - neutralizza l’aggiunta dell’Acido<br />
A + H O → HA + H O<br />
- +<br />
3 2<br />
A - viene consumato; HA prodotto<br />
⎡HA ⎤ 1<br />
K =<br />
⎣ ⎦<br />
= ≫1<br />
−<br />
+<br />
⎡<br />
⎣A ⎤<br />
⎦<br />
⎡<br />
⎣H K<br />
3O<br />
⎤<br />
⎦ A<br />
HA A −<br />
≈ ⎡<br />
⎣<br />
⎤<br />
⎦<br />
K<br />
A<br />
⎡<br />
⎣A ⎤<br />
⎦<br />
⎡<br />
⎣<br />
⎤<br />
⎦<br />
−<br />
H = KA + log<br />
HA<br />
p p<br />
−<br />
+<br />
⎡A ⎤ ⎡H3O ⎤<br />
=<br />
⎣ ⎦ ⎣ ⎦<br />
⎡<br />
⎣HA ⎤<br />
⎦<br />
Aggiunta di base Tende ad aumentare [OH - ]<br />
HA neutralizza l’aggiunta della Base<br />
− −<br />
HA + OH → A + H O<br />
HA viene consumato; A - prodotto<br />
−<br />
⎡A ⎤ K A<br />
K =<br />
⎣ ⎦<br />
= ≫1<br />
-<br />
⎡<br />
⎣HA ⎤<br />
⎦<br />
⎡<br />
⎣OH ⎤<br />
⎦<br />
KW<br />
Deboli aggiunte di acidi (generano H 3 O + in soluzione) o basi (generano OH - in soluzione) vengono<br />
neutralizzate da A - rispettivamente HA. <strong>Le</strong> concentrazioni di HA e A - cambiano, ma il pH rimane<br />
pressoché invariato!<br />
2
Due domande a cui dare una risposta per preparare una soluzione <strong>tampone</strong><br />
1 Quale pH deve poter mantenere la soluzione?<br />
2 Quale quantità di acido rispettivamente di base deve essere in grado di<br />
neutralizzare la soluzione?<br />
Nella nostra analogia:<br />
A quale livello si situa il rigonfiamento<br />
massimo del vaso?<br />
Quanto grande deve essere il<br />
rigonfiamento? Quanto “largo” deve cioè<br />
essere il vaso?<br />
La scelta del sistema <strong>tampone</strong>: fissiamo il livello<br />
pH ≈ pKa<br />
Si prende un acido debole il cui pK a sia il più prossimo possibile al pH che deve<br />
garantire la soluzione <strong>tampone</strong>.<br />
La scelta della quantità di acido e base<br />
−<br />
⎡<br />
⎣HA ⎤<br />
⎦ + ⎡<br />
⎣A ⎤<br />
⎦<br />
= ctot<br />
Si deve valutare la quantità di acido e di base che il nostro <strong>tampone</strong> dovrebbe<br />
essere in grado di neutralizzare.
<strong>Le</strong> due condizioni permettono di definire in maniera univoca la modalità per<br />
preparare la soluzione <strong>tampone</strong> dalle proprietà desiderate<br />
(due equazioni per due incognite)<br />
-<br />
⎡ ⎤<br />
⎣A ⎦<br />
= 10<br />
[ HA]<br />
(pH-pKa)<br />
⎡<br />
⎣<br />
⎤<br />
⎦<br />
⎡<br />
⎣<br />
⎤<br />
⎦<br />
-<br />
A + HA = ctot<br />
Come procedo per preparare la soluzione <strong>tampone</strong><br />
Per via diretta<br />
m = ⎡<br />
⎣HA ⎤<br />
⎦iVsoluzione iM<br />
HA HA<br />
M =<br />
massa molare di HA<br />
HA<br />
−<br />
m = ⎡<br />
⎣A ⎤<br />
⎦iVsoluzione iM<br />
− −<br />
A A<br />
A M −<br />
= massa molare di A<br />
Metto nel bicchiere le rispettive masse di acido e base e poi aggiungo acqua fino ad<br />
ottenere il volume desiderato di soluzione.<br />
−
Come procedo per preparare la soluzione <strong>tampone</strong><br />
Per via indiretta<br />
A volte capita di non disporre dell’acido o della base debole. Per ovviare a questa<br />
situazione, la base coniugata (rispettivamente l’acido) può essere prodotta in<br />
soluzione tramite reazione chimica tra l’acido e una base forte (ad esempio<br />
NaOH).<br />
Aggiunta di acido Tende ad aumentare [H 3 O + ]<br />
A - neutralizza l’aggiunta dell’Acido<br />
A + H O → HA + H O<br />
- +<br />
3 2<br />
A - viene consumato; HA prodotto<br />
⎡HA ⎤ 1<br />
K =<br />
⎣ ⎦<br />
= ≫1<br />
−<br />
+<br />
⎡<br />
⎣A ⎤<br />
⎦<br />
⎡<br />
⎣H K<br />
3O<br />
⎤<br />
⎦ A<br />
Come si procede praticamente …<br />
Utilizzo del pH-metro<br />
Nel bicchiere si mette la quantità<br />
totale di acido o base debole<br />
desiderata e poi si aggiunge una<br />
base o un acido forte in modo da<br />
produrre la quantità desiderata di<br />
base, rispettivamente acido<br />
coniugato. Ciò fino a quando il pHmetro<br />
indica il pH desiderato.<br />
Aggiunta di base Tende ad aumentare [OH - ]<br />
HA neutralizza l’aggiunta della Base<br />
− −<br />
HA + OH → A + H O<br />
HA viene consumato; A - prodotto<br />
−<br />
⎡A ⎤ K A<br />
K =<br />
⎣ ⎦<br />
= ≫1<br />
-<br />
⎡<br />
⎣HA ⎤<br />
⎦<br />
⎡<br />
⎣OH ⎤<br />
⎦<br />
KW<br />
2
Come si procede praticamente …<br />
Utilizzo di ricette riportate su appositi manuali<br />
(Handbook of Chemistry and Physics, 2007)<br />
Esercizio<br />
Preparare 500 dm 3 soluzione <strong>tampone</strong> 10 mM a pH 4,65
Algebra 1 …<br />
All’equilibrio:<br />
−<br />
HA ←⎯→ ⎯ A + H<br />
μ = μ + μ<br />
HA −<br />
A H<br />
Considerando condizioni di p e T standard, consideriamo solo la dipendenza<br />
del potenziale chimico dalla concentrazione<br />
−<br />
[ ] −<br />
+<br />
μ + μ log HA = μ + μ log ⎡A ⎤ + μ + μ log ⎡H ⎤<br />
0 0 0 +<br />
HA d eq A d ⎣ ⎦eq H d ⎣ ⎦eq<br />
μ μ μ μ ⎡<br />
⎣<br />
⎤<br />
⎦ μ ⎡<br />
⎣<br />
⎤<br />
⎦ μ<br />
K<br />
+<br />
+<br />
[ ]<br />
0 0 0 −<br />
+<br />
HA − − − + = log A + log H − log HA<br />
A H<br />
A<br />
d<br />
eq<br />
d<br />
eq<br />
d eq<br />
0 0 0 0<br />
μ μ − μ + μ<br />
HA A H<br />
[ HA]<br />
− +<br />
⎡A ⎤ ⎡H ⎤<br />
eq eq<br />
− − −Δ ⎣ ⎦ ⎣ ⎦<br />
= = log<br />
μ μ<br />
⎡<br />
⎣A ⎤<br />
⎦<br />
⎡<br />
⎣H ⎤<br />
⎦<br />
= = 10<br />
[ HA]<br />
d d eq<br />
− +<br />
0<br />
−Δμ<br />
eq eq μ<br />
eq<br />
Algebra 2 … − +<br />
d<br />
HA ←⎯→ ⎯ A + H<br />
K A<br />
Numero di equilibrio<br />
(impropriamente costante di equilibrio)<br />
− +<br />
⎡<br />
⎣A ⎤<br />
⎦<br />
⎡<br />
⎣H ⎤<br />
=<br />
⎦<br />
[ HA]<br />
− + −<br />
⎡A ⎤ ⎡H ⎤ ⎡A ⎤<br />
+<br />
log K A = log<br />
⎣ ⎦ ⎣ ⎦<br />
= log<br />
⎣ ⎦<br />
+ log ⎡<br />
⎣H ⎤<br />
⎦<br />
−<br />
⎡<br />
⎣A ⎤<br />
⎦<br />
[ HA] [ HA]<br />
⎡ ⎤<br />
−<br />
⎡A ⎤<br />
pK = − log<br />
⎣ ⎦<br />
+ pH<br />
+<br />
− log K A = −log − log H<br />
[ HA]<br />
⎣ ⎦ A<br />
[ HA]<br />
−<br />
⎡A ⎤<br />
pH = pK A + log<br />
⎣ ⎦ Equazione di Henderson- Hasselbach<br />
HA<br />
[ ]