Chimere e coltura in vitro - gruppove.net
Chimere e coltura in vitro - gruppove.net
Chimere e coltura in vitro - gruppove.net
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
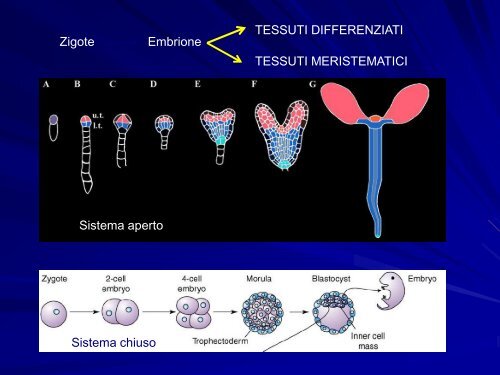
Zigote Embrione<br />
Sistema aperto<br />
Sistema chiuso<br />
TESSUTI DIFFERENZIATI<br />
TESSUTI MERISTEMATICI
L’ulteriore sviluppo dell’embrione <strong>in</strong> pianta adulta<br />
è assicurato dalla proliferazione dei tessuti<br />
meristematici<br />
NON SI REALIZZA IN PRATICA LA SEPARAZIONE<br />
FRA LINEA SOMATICA E LINEA GERMINALE<br />
Fase vegetativa Cambiamento di fase Fase riproduttiva
Lo sviluppo è una cont<strong>in</strong>ua ripetizione di identici processi ciclici<br />
Organismi ad ontogenesi ricorrente<br />
Totipotenza cellulare<br />
In teoria, la serie di divisioni equazionali cui lo<br />
zigote va <strong>in</strong>contro nel formare la pianta adulta<br />
produce cellule con identico patrimonio<br />
nucleare… TUTTAVIA ……<br />
DISTURBI DEL CICLO MITOTICO<br />
MODIFICAZIONI DEL<br />
NUMERO E STRUTTURA<br />
DEI CROMOSOMI O<br />
STRUTTURA DEI GENI<br />
TESSUTI E/O ORGANI<br />
MESCOLANZA DI<br />
CELLULE A DIVERSO<br />
PATRIMONIO<br />
NUCLEARE (CHIMERE)
CHIMERE<br />
CHIMERE NUCLEARI<br />
citologiche<br />
ge<strong>net</strong>iche<br />
CHIMERE CITOPLASMATICHE<br />
TOTIPOTENZA Ruolo fondamentale delle mutazioni somatiche<br />
negli organismi vegetali<br />
COSTITUZIONE CHIMERICA DEI TESSUTI DIFFERENZIATI<br />
<strong>Chimere</strong> da <strong>in</strong>nesto<br />
Endoreduplicazione (G 1 – G 2) Politenia<br />
Aneuploidia Aneusomatia<br />
Mutazioni cromosomiche<br />
Mutazioni geniche nucleari e citoplasmatiche<br />
arancio Bizzarria (1640) arancio amaro/cedro<br />
Cytisus adami (1825) Cytisus purpureus/C. laburnum<br />
Sono la conseguenza dello sviluppo di apici chimerici (cellule delle due specie)
CHIMERE GENETICHE E CITOLOGICHE PERICLINALI<br />
Utili <strong>in</strong> studi ontoge<strong>net</strong>ici per tracciare la distribuzione dei vari tessuti nella<br />
pianta adulta a partire dagli apici<br />
CHIMERA PERICLINALE:<br />
DIVERSA COSTITUZIONE<br />
GENETICA DEGLI STRATI<br />
TUNICA: divisioni anticl<strong>in</strong>e (pareti perpendicolari)<br />
CORPUS: divisioni con pareti a varia <strong>in</strong>cl<strong>in</strong>azione<br />
Le analisi di molte chimere pericl<strong>in</strong>ali hanno<br />
fornito <strong>in</strong>formazioni sull’ontogenesi dei tessuti<br />
Strato L 1 (epidermidi)<br />
Strato L 2 (tessuto<br />
sporigeno)<br />
DA UNA CHIMERA PERICLINALE SI POSSONO INOLTRE OTTENERE<br />
SPONTANEAMENTE O CON AZIONI SPERIMENTALI (Radiazioni)<br />
RIMANEGGIAMENTI DEGLI STRATI A PRODURRE NUOVE CHIMERE
RISTRUTTURAZIONE DELLE CHIMERE (riarrangiamento degli strati)<br />
Po<strong>in</strong>settia (a partire dalla varietà rosa Ecke’s p<strong>in</strong>k nuovi apici)<br />
<strong>Chimere</strong> <strong>in</strong> patata e <strong>in</strong> piante a propagazione vegetativa<br />
Ristrutturazione delle chimere con radiazioni ionizzanti<br />
Garofano “white sim” (BRR)<br />
seme<br />
Raggi x<br />
Fiori bianchi screziati<br />
di rosso<br />
Garofani William sim (rossi)<br />
Nelle specie a propagazione vegetativa la presenza di cellule<br />
chimeriche è la norma e non un eccezione. Questa costituzione<br />
ge<strong>net</strong>ica va considerata quando si parla di cloni di materiale<br />
propagato vegetativamente
Le ristrutturazioni sono la conseguenza:<br />
Reduplicazioni<br />
Perforazioni<br />
Traslocazioni
Le traslocazioni prevedono una<br />
perforazione ed una<br />
reduplicazione seguite da una<br />
estensione degli strati della tunica<br />
<strong>in</strong> seguito a divisioni anticl<strong>in</strong>e<br />
Passaggio da una chimera BBR<br />
ad una chimera BRB<br />
CITOCHIMERE<br />
<strong>Chimere</strong> <strong>in</strong> cui le differenze ge<strong>net</strong>iche fra le<br />
cellule e/o strati riguardano il numero<br />
cromosomico<br />
Per studi ontoge<strong>net</strong>ici sono risultate importanti anche le chimere citologiche<br />
(numeri cromosomici diversi nei diversi strati: es: diplo-tetra-diploidi L1 (2n) –<br />
L2 (4n) – L3 (2n) Analisi microscopica della costituzione citologica dei<br />
tessuti
Materiali vegetali da trattare con mutageni<br />
Generazione M 0: i) semi<br />
ii) organi a propagazione vegetativa<br />
iii) gameti<br />
Generazione M 1<br />
Trattamento mutageno<br />
Mutazioni generalmente<br />
recessive<br />
SEMI E ORGANI A PROPAGAZIONE<br />
VEGETATIVA – MERISTEMI (MULTICELLULARI)<br />
MUTAZIONE EVENTO<br />
CELLULARE<br />
Dopo trattamento mutageno<br />
Chimera a mosaico
E’ nella generazione M 2<br />
che noi possiamo<br />
evidenziare la chimera<br />
CHIMERA A MOSAICO<br />
CHIMERA SETTORIALE<br />
Per mettere <strong>in</strong> evidenza le mutazioni<br />
recessive <strong>in</strong>dispensabile<br />
l’autofecondazione della<br />
generazione M 1 ed ottenere la<br />
generazione M 2<br />
Cont<strong>in</strong>uo sviluppo dell’apice<br />
Le s<strong>in</strong>gole cellule mutate<br />
divengono progenitrici di l<strong>in</strong>ee<br />
cellulari che vanno ad occupare<br />
un settore<br />
i) L’ampiezza del settore mutato dipenderà dal<br />
numero di <strong>in</strong>iziali<br />
ii) La trasmissibilità della mutazione alla<br />
generazione successiva dipenderà dalla posizione<br />
nell’apice delle cellule mutate
Generazione M 0: genotipo AA (materiale trattato)<br />
Generazione M 1: genotipo Aa<br />
Generazione M 2: AA + 2Aa + aa (fenotipo mutante)<br />
Se gli organi riproduttivi derivano da una sola cellula <strong>in</strong>iziale<br />
La segregazione <strong>in</strong> M 2 = 3:1<br />
Se le cellule <strong>in</strong>iziali degli organi riproduttivi sono DUE:<br />
Una mutata una normale<br />
Generazione M 2<br />
Cellula normale segregazione 4:0<br />
Cellula mutata segregazione 3:1<br />
Se le cellule <strong>in</strong>iziali degli organi riproduttivi sono TRE<br />
di cui solo una mutata:<br />
Generazione M 2: segregazione 11:1<br />
Se le cellule <strong>in</strong>iziali degli organi riproduttivi sono QUATTRO<br />
di cui solo una mutata:<br />
Generazione M 2: segregazione 15:1<br />
7:1
L’analisi delle chimere a mosaico e settoriali consente studi sui processi di sviluppo<br />
i) Determ<strong>in</strong>azione del numero di <strong>in</strong>iziali di un organo<br />
ii) quali cellule dell’apice partecipano alla formazione di un organo<br />
Il numero di <strong>in</strong>iziali<br />
dipende dall’ord<strong>in</strong>e<br />
ontoge<strong>net</strong>ico (grado<br />
di differenziazione)<br />
del primordio<br />
Metodo Topografico<br />
Consiste nel sem<strong>in</strong>are la<br />
spiga non sgranata, <strong>in</strong><br />
modo da localizzare le<br />
plantule mutate nella loro<br />
posizione spaziale nella<br />
spiga e conseguentemente<br />
nell’apice che ha orig<strong>in</strong>ato<br />
la spiga
Studi ontoge<strong>net</strong>ici si possono basare anche sull’<strong>in</strong>duzione di<br />
condizioni ge<strong>net</strong>iche a effetto visibile <strong>in</strong> M 1<br />
In questo caso il materiale M 0 sarà eterozigote (Aa) per geni che<br />
controllano la pigmentazione, la forma delle foglie, fusto, fiori o frutti<br />
(marcatori istoge<strong>net</strong>ici)<br />
L’ampiezza del settore <strong>in</strong>dicherà il numero di cellule <strong>in</strong>iziali<br />
Specie a propagazione vegetativa si prestano per questi studi essendo presenti<br />
varietà eterozigoti per geni controllanti il colore del fiore dei frutti e delle foglie
Meccanismi modificano l’ampiezza del settore mutato<br />
Selezione diplontica e aplontica<br />
- Le cellule mutate possono avere una vitalità più bassa delle<br />
cellule normali<br />
Deficit di recessivi<br />
Ristrutturazione degli apici per morte cellulare<br />
- Le cellule degli altri strati possono sostituire cellule troppo<br />
danneggiate<br />
COME SI PUO’ OVVIARE AL PROBLEMA DEL CHIMERISMO NEL<br />
TRATTAMENTO MUTAGENO<br />
i)Trattamento degli zigoti (difficile conoscere il preciso momento della fecondazione)<br />
ii)Trattamento dei gametofiti maschili<br />
- spettro diverso delle mutazioni rispetto al trattamento di cellule somatiche<br />
- solo gameti con mutazioni non troppo deleterie sono <strong>in</strong> grado di fecondare<br />
l’ovocellula (filtro aplontico)
SPECIE AUTOGAME (omozigoti)<br />
SPECIE ALLOGAME (eterozigoti) (l<strong>in</strong>ee <strong>in</strong>bred)<br />
SPECIE A PROPAGAZIONE VEGETATIVA<br />
mutazioni spontanee gemmarie<br />
le mutazioni <strong>in</strong>dotte <strong>in</strong> queste specie ha trovato larga utilizzazione <strong>in</strong><br />
quanto l’ibridazione <strong>in</strong>tra- e <strong>in</strong>ter-specifica richiede un lavoro molto<br />
lungo<br />
Materiale utilizzato nella mutagenesi <strong>in</strong> specie a propagazione vegetativa:<br />
tuberi, stoloni, rizomi, bulbi, talee, apici meristematici<br />
TRATTAMENTO MUTAGENO<br />
SPECIE A PROPAGAZIONE VEGETATIVA<br />
PERCHE’?<br />
i) GEMME ETEROZIGOTI<br />
MUTAZIONI (GEMMARIE)<br />
GIA’ VISIBILI <strong>in</strong> M 1<br />
ii) RISTRUTTURAZIONI DELL’APICE CHIMERICO, un tessuto<br />
profondo mutato partecipa alla formazione di un germoglio
chimere<br />
settoriali<br />
omoistonte<br />
normale<br />
(selvatico)<br />
Omoistonte<br />
mutante<br />
Mutazioni gemmarie: Malvasia<br />
rosa su un ceppo di Malvasia di<br />
Candia Aromatica (ac<strong>in</strong>o bianco)<br />
chimera<br />
mericl<strong>in</strong>ale<br />
chimera<br />
pericl<strong>in</strong>ale
Eterozigosità e chimerismo sono due aspetti ge<strong>net</strong>ici comuni nella<br />
piante a propagazione vegetativa<br />
Nelle specie a propagazione<br />
vegetativa come la vite sarà<br />
<strong>in</strong>dispensabile con<br />
opportune operazioni di<br />
potatura, selezione e<br />
moltiplicazione (anche <strong>in</strong><br />
<strong>vitro</strong>) ottenere gemme, e di<br />
conseguenza cloni,<br />
omoistonti per la mutazione<br />
(completamente mutati)
Considerazioni generali<br />
1) Tenere presente il sistema riproduttivo<br />
2) In generale la mutagenesi andrebbe utilizzata quando si vuole migliorare una<br />
varietà per qualche determ<strong>in</strong>ata caratteristica senza alterare<br />
profondamente il genotipo.<br />
3) Avere <strong>in</strong> mente un ideotipo.<br />
4) I materiali ottenuti a seguito del trattamento mutageno possono essere<br />
selezionati direttamente per costituire nuove varietà.<br />
5) I materiali ottenuti possono essere <strong>in</strong>crociati con l<strong>in</strong>ee già esistenti allo<br />
scopo di <strong>in</strong>trodurre <strong>in</strong> queste caratteri <strong>in</strong>sorti con il trattamento mutageno.<br />
6) Necessario non usare dosi o concentrazioni troppo alte del mutageno per non<br />
<strong>in</strong>durre più mutazioni nella stessa cellula e <strong>in</strong>durre soprattutto mutazioni<br />
geniche.<br />
7) Legge delle serie omologhe -ideotipo (Vavilov, 1922)
Totipotenza<br />
L’accrescimento illimitato nelle piante è determ<strong>in</strong>ato dall’attività<br />
mitotica di cellule localizzate agli apici: caul<strong>in</strong>are e radicale<br />
Alla base del<br />
meccanismo di<br />
omeostasi, che<br />
assicura il giusto<br />
bilanciamento tra<br />
cellule meristematiche<br />
<strong>in</strong> via di<br />
differenziazione e<br />
cellule che devono<br />
rimanere pluripotenti,<br />
esiste l'<strong>in</strong>terazione<br />
molecolare dei prodotti<br />
del gene WUSCHEL<br />
(WUS) e di quelli dei<br />
geni CLAVATA (CLV).
Altri geni, quali SHOOTMERISTEMLESS (STM) e CUP-SHAPED<br />
COTYLEDON (CUC) sono co<strong>in</strong>volti nella formazione dell’apice meristematico<br />
caul<strong>in</strong>are (SAM) <strong>in</strong> maniera <strong>in</strong>dipendente dal sistema WUS-CLV<br />
L'attività del gene ASYMMETRIC LEAVES1 (AS1)<br />
(arancio <strong>in</strong> B), che codifica per un fattore di<br />
trascrizione di tipo MYB-ARP reprime l'espressione di<br />
geni KNOX di classe 1 (KNAT1, KNAT2 e KNAT6) (<strong>in</strong><br />
violetto <strong>in</strong> B) e ciò consente alle cellule di differenziare<br />
L’<strong>in</strong>izio della formazione<br />
dei primordi fogliari si<br />
accompagna a segnali<br />
ormonali (aux<strong>in</strong>a) e ad<br />
una dim<strong>in</strong>uzione<br />
dell’espressione dei geni<br />
"KNOTTED-like<br />
homeobox" (KNOX),<br />
mentre l’espressione dei<br />
geni regolatori di tipo<br />
MYB, omologhi a<br />
PHANTASTICA, marcano<br />
i primi stadi dello sviluppo<br />
delle fogliare.<br />
(stati di determ<strong>in</strong>azione) Ma le cellule vegetali differenziate possono modificare il<br />
loro dest<strong>in</strong>o Riacquisire La TOTIPOTENZA
Planaria<br />
I processi di sviluppo delle piante<br />
sono molto flessibili se comparati a<br />
quelli attivi <strong>in</strong> animali<br />
neoblasti<br />
Transdifferenziazione<br />
Tuttavia, negli animali la sola<br />
cellula <strong>in</strong> grado di produrre un<br />
organismo completo è lo zigote<br />
Axolotl<br />
Al contrario nelle piante lo zigote non è la sola cellula<br />
capace di sviluppare un embrione
…. Così come cellule differenziate possono <strong>in</strong>iziare lo sviluppo<br />
di meristemi avventizi e/o embrioni avventizi ….<br />
COMPETENZA ALL’ORGANOGENESI AVVENTIZIA<br />
Lo stato di competenza organoge<strong>net</strong>ica sembra essere associato<br />
all’espressione di geni che codificano per prote<strong>in</strong>e co<strong>in</strong>volte nella<br />
trasduzione del segnale legato alle citoch<strong>in</strong><strong>in</strong>e (CKI1 e CRE1) e<br />
nella ripresa del ciclo cellulare (CDC2a e CycD-3) ad esempio cicl<strong>in</strong>e<br />
Successivamente l’ attivazione ectopica di specifici geni regolatori dei<br />
meristemi caul<strong>in</strong>ari quali, WUS, STM (KNOX di classe I) e CLV1 è un<br />
evento molecolare chiave per lo stato di determ<strong>in</strong>azione allo sviluppo di<br />
meristemi avventizi.<br />
Il processo sembra attivato da ormoni: citoch<strong>in</strong><strong>in</strong>e<br />
Tali risultati sono avvalorati dal fenotipo delle piante sovraesprimenti<br />
geni KNOX di classe I e/o il gene IPT di Agrabacterium tumefaciens.
COMPETENZA ALL’EMBRIOGENESI SOMATICA<br />
Embriogenesi zigotica<br />
Apomittica<br />
Somatica (<strong>in</strong> <strong>vitro</strong>, <strong>in</strong> vivo)<br />
E’ probabile che il controllo ge<strong>net</strong>ico dei primi stadi di embriogenesi<br />
zigotica, apomittica, o <strong>in</strong>dotta <strong>in</strong> <strong>vitro</strong>, sia fondamentalmente analogo.<br />
Ciò risulta evidente se si considera che l’attività dei geni PICKLE<br />
(PKL), LEAFY COTYLEDON1 (LEC1), LEC1-LIKE (L1L), LEC2 e<br />
FUSCA3 (FUS3) è richiesta durante le fasi di morfogenesi e<br />
maturazione dell’embrione zigotico ma al contempo, la loro sovraespressione<br />
<strong>in</strong> cellule differenziate può essere sufficiente per <strong>in</strong>durre<br />
la formazione di embrioni somatici.<br />
Analogamente la trascrizione di SOMATIC EMBRYOGENESIS<br />
RECEPTOR-LIKE KINASE 1 (SERK1), un gene marcatore delle<br />
cellule embriogeniche che codifica per un recettore ch<strong>in</strong>asico si attiva<br />
non soltanto nell’embriogenesi zigotica ed <strong>in</strong> quella somatica, ma<br />
anche nella nucella della specie apomittica Poa pratensis.
I diversi processi di embriogenesi<br />
nelle piante condividono un controllo<br />
ormonale basato su tre classi<br />
pr<strong>in</strong>cipali: aux<strong>in</strong>a, acido abscissico<br />
(ABA) e gibberell<strong>in</strong>e (GAs).<br />
aux<strong>in</strong>e<br />
I geni della famiglia PIN-FORMED<br />
(PIN), che codificano per prote<strong>in</strong>e<br />
di trasporto <strong>in</strong> uscita dell’aux<strong>in</strong>a,<br />
svolgono un ruolo chiave<br />
determ<strong>in</strong>ando la polarità del flusso<br />
ormonale nelle cellule<br />
dell’embrione <strong>in</strong> formazione<br />
La realizzazione di dom<strong>in</strong>i cellulari<br />
con distribuzione asimmetrica<br />
dell’aux<strong>in</strong>a è importante durante<br />
l’<strong>in</strong>iziazione <strong>in</strong> vivo di primordi e <strong>in</strong><br />
<strong>vitro</strong> nei processi di <strong>in</strong>iziazione dell’<br />
embriogenesi somatica
acido abscissico (ABA) e gibberell<strong>in</strong>e (GA)<br />
Intervengono nel controllo fisiologico dell’embriogenesi soprattutto nella fase<br />
di maturazione dell’embrione e di germ<strong>in</strong>azione del seme.<br />
Nell’embriogenesi zigotica è attiva una regolazione a feed-back positivo:<br />
l’ABA ha un effetto positivo sulla s<strong>in</strong>tesi delle sostanze di riserva attraverso<br />
l’attivazione di LEC1 e FUS3 mentre la trascrizione di FUS3 stimola la s<strong>in</strong>tesi<br />
di ABA.<br />
E’ stato ipotizzato che i rapporti reciproci di ABA e GA siano importanti anche<br />
nella fase di morfogenesi dell’embrione e, addirittura, nell’<strong>in</strong>duzione di un<br />
nuovo dest<strong>in</strong>o cellulare (competenza embriogenica) grazie ad un<br />
meccanismo di regolazione che <strong>in</strong>clude i geni LEC.
ABA
Molti studi hanno chiarito aspetti fondamentali della regolazione delle ultime fasi<br />
dell’embriogenesi somatica, ma il quadro complessivo dei meccanismi<br />
molecolari, cellulari e biochimici che sono alla base dell’omeostasi delle cellule<br />
pluripotenti e del cambiamento del dest<strong>in</strong>o cellulare è tuttora <strong>in</strong>completo.<br />
La semplice espressione ectopica di alcuni fattori di trascrizione [ad es. LEC1,<br />
LEC2, BABY BOOM (BBM), WUSCHEL (WUS) e AGOMOUS-LIKE15 (AGL15)]<br />
può determ<strong>in</strong>are l’<strong>in</strong>duzione di embrioni somatici <strong>in</strong> tessuti differenziati<br />
La sovraespressione di WUS appare reprimere l’attività di LEC1, mentre<br />
AGL15, che è attivato dall’espressione ectopica di LEC2, è <strong>in</strong> grado a sua volta<br />
di regolare SERK1.<br />
Tuttavia, l’espressione dei geni LEC1, LEC2, BBM, WUS e AGL15 nella cellula<br />
uovo o nello zigote non è ancora stata dimostrata e rimane tuttora da valutare<br />
se l’espressione ectopica di questi geni possa causare qualche tipo di stress<br />
ed attivare una risposta tale da <strong>in</strong>durre <strong>in</strong>direttamente un cambiamento del<br />
dest<strong>in</strong>o cellulare
MECCANISMI EPIGENETICI E TOTIPOTENZA<br />
La capacità di una cellula vegetale di riacquisire totipotenza è<br />
espressione del fatto che il differenziamento cellulare non implica la<br />
perdita dell'<strong>in</strong>formazione contenuta nell'<strong>in</strong>tero patrimonio ge<strong>net</strong>ico.<br />
CELLULA<br />
DIFFERENZIATA<br />
generale revisione del profilo di espressione<br />
cambiamento della struttura cromat<strong>in</strong>ica<br />
1) Variazioni nei rapporti eucromat<strong>in</strong>a/eterocromat<strong>in</strong>a<br />
2) Metilazione del DNA<br />
CELLULA<br />
EMBRIOGENICA<br />
Il ruolo fondamentale della struttura cromat<strong>in</strong>ica nell’acquisizione della<br />
totipotenza è avvalorata dalla caratterizzazione del mutante pickle<br />
PICKLE codifica per la subunità di un complesso “Chromodoma<strong>in</strong><br />
Helicase DNA-b<strong>in</strong>d<strong>in</strong>g prote<strong>in</strong> 3" (CHD3) che <strong>in</strong>duce la repressione di geni<br />
<strong>in</strong>ducibili mediante deacetilazione istonica
Alcuni risultati suggeriscono un ruolo chiave delle prote<strong>in</strong>e polycomb<br />
(PcG) nella riprogrammazione dell’espressione genica che sottende al<br />
cambiamento del dest<strong>in</strong>o cellulare<br />
PcG Silenziamento genico<br />
Mutazioni a carico di PcG:<br />
Struttura cromat<strong>in</strong>a<br />
Metilazione istonica<br />
- mutanti che esprimono ectopicamente geni KNOX<br />
- mutanti caratterizzati dallo sviluppo di endospermi (fie) e<br />
del seme (fis) <strong>in</strong> assenza di fertilizzazione<br />
Ciò dimostra che <strong>in</strong> condizioni normali, un meccanismo di controllo<br />
basato sulla struttura della cromat<strong>in</strong>a reprime il programma<br />
embrionale f<strong>in</strong>o al compimento della fertilizzazione<br />
La natura molecolare della totipotenza rimane un mistero. Un<br />
obbiettivo affasc<strong>in</strong>ante è comprendere la natura dei segnali che<br />
rimuovono il controllo epige<strong>net</strong>ico della differenziazione cellulare
Colture <strong>in</strong> <strong>vitro</strong>: Variabilità ge<strong>net</strong>ica<br />
1939 White, Gutheret, Nobencourt CRESCITA ILLIMITATA IN VITRO<br />
APICI CAULINARI CLONAZIONE DI PIANTE IN VITRO<br />
Tessuti differenziati<br />
somatici ed aploidi<br />
Organogenesi<br />
avventizia<br />
Uniformità ge<strong>net</strong>ica<br />
i) conservazione, materiali di alto valore<br />
ii) micropropagazione virus esente<br />
Coltivati <strong>in</strong> <strong>vitro</strong> <strong>in</strong> presenza di ormoni<br />
Callo<br />
Rigenerazione<br />
Embriogenesi<br />
avventizia (somatica,<br />
andro- g<strong>in</strong>o-ge<strong>net</strong>ica)
Applicazioni tecniche di <strong>coltura</strong> <strong>in</strong> <strong>vitro</strong><br />
1) Micropropagazione<br />
2) Ottenimento di ibridi somatici mediante fusione di protoplasti<br />
3) Recupero di embrioni di ibridi <strong>in</strong>terspecifici o <strong>in</strong>tergenerici<br />
4) Ottenimento di l<strong>in</strong>ee aploidi via androgenesi e g<strong>in</strong>ogenesi<br />
5) Selezione di l<strong>in</strong>ee cellulari resistenti a stress biotici ed abiotici<br />
6) Selezione di l<strong>in</strong>ee cellulari per la produzione di metaboliti<br />
secondari<br />
7) Sfruttamento della variabilità ge<strong>net</strong>ica <strong>in</strong>dotta dalla <strong>coltura</strong> <strong>in</strong> <strong>vitro</strong><br />
per l’ottenimento di mutanti<br />
8) Trasformazione ge<strong>net</strong>ica
Variabilità ge<strong>net</strong>ica<br />
1) CONDIZIONI GENETICHE IN VIVO (variabilità <strong>in</strong> vivo)<br />
2) VARIABILITA’ GENETICA INDOTTA DURANTE LA FORMAZIONE E<br />
SVILUPPO DEL CALLO<br />
3) VARIABILITA’ GENETICA NELLE PIANTE RIGENERATE<br />
1) CONDIZIONI GENETICHE IN VIVO<br />
GIMNOSPERME e 20% ANGIOSPERME (APIACEAE , ASTERACEAE)<br />
Le cellule differenziano nello stato diploide con la quantità nucleare di DNA 2C<br />
(Fase G1) G2 (2C)<br />
G1 S<br />
(2C-4C)<br />
(4C)<br />
M<br />
(2C)<br />
(2C)<br />
STRETTO CONTROLLO DELLA SEQUENZA SINTESI DNA MITOSI<br />
MA 80% ANGIOSPERME ENDOREDUPLICAZIONI DURANTE IL<br />
PROCESSO DI DIFFERENZIAZIONE (8C, 16C, 32C, 64C)
TESSUTI: CELLULE DIPLOIDI<br />
CELLULE ENDOREDUPLICATE<br />
CELLULE ENDOREDUPLICATE<br />
2C 4C 8C<br />
8C 2n diplocromosomi<br />
POLISOMATIA<br />
16C 2n quadruplocromosomi<br />
Se entrano <strong>in</strong> mitosi POLIPLOIDIA<br />
ALCUNE CELLULE DIFFERENZIATE ANEUPLOIDI<br />
TESSUTI: CELLULE DIPLOIDI<br />
CELLULE ANEUPLOIDI<br />
ANEUSOMATIA<br />
NEI TESSUTI DIFFERENZIATI SONO PRESENTI ANCHE CELLULE CON:<br />
Mutazioni cromosomiche<br />
Mutazioni geniche (nucleari e citoplasmatiche)<br />
IN CONCLUSIONE: UN TESSUTO, UN ORGANO, UNA PIANTA SONO<br />
MOSAICI GENETICI CHIMERE
PROCESSI NUCLEARI DURANTE LA CALLOGENESI<br />
Variabiltà <strong>in</strong>dotta<br />
TESSUTI IN VITRO STIMOLI ORMONALI<br />
1) MITOSI<br />
2) ENDOREDUPLICAZIONE SEGUITA DA MITOSI<br />
3) FRAMMENTAZIONE NUCLEARE SEGUITA DA MITOSI<br />
1a) Mitosi da cellule diploidi calli diploidi<br />
1b) Mitosi da cellule endoreduplicate (ER) calli poliploidi<br />
1c) Mitosi da cellule ER e diploidi calli mixoploidi<br />
1d) Mitosi da cellule diploidi e aneuplodi calli aneusomatici<br />
2) ER SEGUITA DA MITOSI<br />
stimolata soprattutto da trattamenti ormonali<br />
<strong>in</strong> specie prone all’ER (Nicotiana, Datura)
3) FRAMMENTAZIONE NUCLEARE (AMITOSI) SEGUITA DA MITOSI<br />
MITOSI<br />
INFLUENZATA<br />
NOTEVOLMENTE DAI<br />
RAPPORTI ORMONALI:<br />
ALTI RAPPORTI<br />
AUXINE/ CITOCHININE<br />
CALLI CON CELLULE A NUMERI<br />
CROMOSOMICI MOLTI SQUILIBRATI<br />
(anche aploidi)<br />
PROGRESSIVA SELEZIONE<br />
MITOTICA NEL CALLO A<br />
Tuttavia: le cellule con frammenti<br />
FAVORIRE LE CELLULE<br />
nucleari entrano <strong>in</strong> mitosi con difficoltà<br />
DIPLOIDI<br />
DURANTE LE FASI DI CALLOGENESI, SPECIALMENTE SE MOLTO<br />
PROTRATTA LE CELLULE IN DIVISIONE VANNO INCONTRO AD UN<br />
ULTERIORE VARIAZIONE GENETICA CHE DIPENDE:<br />
Caratteristiche del materiale di partenza<br />
Condizioni di <strong>coltura</strong> (ormoni)
ULTERIORI MECCANISMI CHE INDUCONO VARIABILITA’ GENETICA<br />
1) ABORTI DI FUSO MITOTICO POLI- E ANEUSOMATIA<br />
2) FUSIONE DI NUCLEI POLIPLOIDIA<br />
3) CROMOSOMI RITARDATARI ANEUPLOIDIA<br />
4) FUSI MULTIPOLARI ANEUPLOIDIA<br />
5) MUTAZIONI CROMOSOMICHE (dicentrici, anelli)<br />
6) REPLICAZIONE TARDIVA DI REGIONI ETEROCROMATICHE<br />
7) MUTAZIONI GENICHE<br />
8) CROSSING OVER MITOTICI<br />
9) ATTIVAZIONE DI ELEMENTI MOBILI TRASPONIBILI<br />
VARIABILITA’ GENETICA NELLE PIANTE RIGENERATE<br />
a) Organogenesi avventizia<br />
b) Embriogenesi avventizia<br />
Orig<strong>in</strong>e multicellulare (chimerismo)<br />
Orig<strong>in</strong>e unicellulare (mutanti solidi)
NON TUTTA LA VARIABILITA’ GENERATA DALLA COLTURA IN VITRO E’<br />
RECUPERABILE<br />
Variabilità<br />
T0 Espianto<br />
Fasi della rigenerazione<br />
Da cellule meno<br />
danneggiate<br />
Le piante rigenerate (R 1) Autofecondazione Generazione R 2<br />
Nella generazione R 2 si evidenzia il<br />
controllo ge<strong>net</strong>ico di eventuali<br />
mutazioni <strong>in</strong>dotte e/o recuperate<br />
Variabilità ge<strong>net</strong>ica<br />
recuperata<br />
Considerando l’orig<strong>in</strong>e pluricellulare<br />
dei germogli avventizi (chimerismo)<br />
DEFICIT di RECESSIVI <strong>in</strong> R 2
IBRIDAZIONE SESSUALE<br />
<strong>in</strong>terspecifica<br />
<strong>in</strong>tergenerica<br />
IBRIDAZIONE SOMATICA<br />
Incompatibilità pre-zigotica<br />
Incompatibilità post-zigotica<br />
FUSIONE DI PROTOPLASTI, CELLULE<br />
PRIVATE DI PARETE ISOLATE DA DUE<br />
SPECIE DISTINTE<br />
1) Isolamento soluzioni enzimatiche<br />
2) Fusione (eterocarionte)<br />
3) Isolamento eterocarionti<br />
4) Riformazione della parete mitosi<br />
5) Callogenesi e rigenerazione delle piante ibride<br />
embryo rescue<br />
Dicarion<br />
S<strong>in</strong>carion<br />
6) Caratterizzazione ge<strong>net</strong>ico molecolare delle piante ibride
FUSIONE DEI PROTOPLASTI<br />
1) METODI CHIMICI PEG, Ca 2+ , elevato pH<br />
2) METODI FISICI ELETTROPORAZIONE<br />
METODI CHIMICI<br />
Il PEG è altamente idrosolubile con carica leggermente negativa, che gli<br />
consente di unirsi con i gruppi carichi positivamente delle membrane cellulari<br />
Il PEG agisce come ponte molecolare fra due protoplasti<br />
La fusione avviene durante il lavaggio<br />
Ridistribuzione delle cariche elettriche<br />
Sulla superficie delle membrane<br />
FUSIONE
I PROTOPLASTI SONO IMMERSI IN UNA<br />
SOLUZIONE CON DUE ELETTRODI CHE<br />
GENERANO UN CAMPO ELETTRICO A<br />
CORRENTE ALTERNATA<br />
IMPULSI DI CORRENTE CONTINUA AD<br />
ALTO VOLTAGGIO<br />
METODI FISICI<br />
All<strong>in</strong>eamento dei protoplasti<br />
(dielettroforesi)<br />
Rottura nella membrana nei<br />
punti di contatto<br />
Ponti citoplasmatici<br />
FUSIONE<br />
Dopo 24-48 ore RICOSTRUZIONE<br />
PARETE<br />
DIVISIONI MITOTICHE CALLO RIGENERAZIONE ANFIDIPLOIDE<br />
Riconoscimento protoplasti ibridi<br />
-Separazione meccanica (sedimentazione, micromanipolatori)<br />
-Caratteristiche morfologiche<br />
-Complementazione genica
1) IBRIDI SOMATICI SIMMETRICI (co<strong>in</strong>volge i due nuclei e citoplasmi parentali)<br />
<strong>in</strong>dividui poliploidi <strong>in</strong>stabili a livello genomico<br />
Incompatibilità somatica<br />
2) IBRIDI SOMATICI ASIMMETRICI<br />
quando una delle due specie, considerata ricevente, viene arricchita<br />
soltanto di una parte del genoma dell’altra specie (donatrice)<br />
RAGGI X<br />
SPECIE DONATRICE (citoplasti) + SPECIE RICEVENTE (m<strong>in</strong>iprotoplasti)<br />
IBRIDI CITOPLASMATICI (CI-IBRIDI)<br />
Trasferimento di geni localizzati nel genoma plastidiale e/o mitocondriale<br />
- Resistenza ad erbicidi<br />
- Maschiosterilità<br />
I protoplasti sono utilizzati <strong>in</strong> esperimenti di trasformazione ge<strong>net</strong>ica
APLOIDI IN VIVO PARTENOGENOSI DA OVOCELLULE APLOIDI NON<br />
FECONDATE o DA SINERGIDI (aploide-diploide)<br />
APLOIDI IN VITRO antere<br />
poll<strong>in</strong>e<br />
ovuli<br />
1964 Guha e Maheshwari <strong>in</strong> Datura <strong>in</strong>oxia<br />
ANDROGENESI<br />
DIRETTA<br />
INDIRETTA<br />
ANDROGENESI<br />
GINOGENESI<br />
Fattori fondamentali ai f<strong>in</strong>i dell’androgenesi:<br />
-genotipo<br />
-stadio di sviluppo delle antere<br />
Embrioni aploidi<br />
Germogli o embrioni aploidi<br />
Il processo di differenziazione gametofitica può essere deviato<br />
verso quello sporofitico esclusivamente <strong>in</strong> corrispondenza di un<br />
preciso stadio di sviluppo del granello poll<strong>in</strong>ico (tetrade o<br />
un<strong>in</strong>ucleato)
In molte specie è stata<br />
osservata la presenza<br />
di forme atipiche di<br />
granuli poll<strong>in</strong>ici non <strong>in</strong><br />
grado di germ<strong>in</strong>are<br />
Mitosi del nucleo<br />
vegetativo<br />
Sviluppo di tipo<br />
sporofitico<br />
Aploidi <strong>in</strong> <strong>vitro</strong>
L’androgenesi puo essere<br />
diretta o <strong>in</strong>diretta<br />
Nel caso di rigenerazione<br />
<strong>in</strong>diretta il callo va spesso<br />
<strong>in</strong>contro a fenomeni di<br />
diploidizzazione
IMPORTANZA DEGLI APLOIDI IN GENETICA<br />
1) studi di dosaggio genico<br />
2) riconoscimento immediato delle mutazioni<br />
3) omozigosi (trattamento con colchic<strong>in</strong>a) – l<strong>in</strong>ee <strong>in</strong>bred<br />
4) produzione di l<strong>in</strong>ee pure <strong>in</strong> specie auto<strong>in</strong>compatibili<br />
5) studi filoge<strong>net</strong>ici<br />
L’androgenesi è stata ampiamente utilizzata anche <strong>in</strong> specie arboree dove<br />
l’ottenimento di l<strong>in</strong>ee omozigoti è difficilmente perseguibile<br />
Costituzione di piante aploidi<br />
e diaploidi<br />
-Studio del controllo ge<strong>net</strong>ico<br />
di alcuni caratteri<br />
-Ottenimento di porta<strong>in</strong>nesti<br />
uniformi da seme ibrido<br />
-Sfruttamento del materiale <strong>in</strong><br />
esperimenti di mutagenesi