Aldeidi e Chetoni.pdf - PianetaChimica.it
Aldeidi e Chetoni.pdf - PianetaChimica.it
Aldeidi e Chetoni.pdf - PianetaChimica.it
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
ALDEIDI E CHETONI<br />
Introduzione<br />
Il gruppo funzionale di aldeidi e chetoni è il carbonile:<br />
O<br />
C<br />
Nelle aldeidi il carbonile si trova in posizione terminale, nei chetoni si trova all’interno della catena.<br />
O<br />
O<br />
CH 3<br />
CH 2<br />
CH 2<br />
CH 2<br />
C<br />
CH 3<br />
CH 2<br />
CH 2<br />
C CH 3<br />
pentanale<br />
aldeide<br />
H<br />
2-pentanone<br />
chetone<br />
Il carbonile ha una struttura planare perchè ha al centro un carbonio con ibridazione sp 2 .<br />
C<br />
O<br />
Nel carbonile il carbonio è parzialmente pos<strong>it</strong>ivo sia per effetto induttivo, a causa dell’elettronegativ<strong>it</strong>à<br />
dell’ossigeno, sia per risonanza come è illustrato nella seguente figura.<br />
O<br />
C<br />
O − C +<br />
Misure del momento dipolare della formaldeide hanno permesso di concludere che sul carbonio del carbonile<br />
è presente circa mezza carica pos<strong>it</strong>iva quindi le due forme lim<strong>it</strong>e hanno circa la stessa importanza.<br />
Disegneremo il carbonile utilizzando la prima delle due strutture dove non c’è separazione di carica e tutti gli<br />
atomi hanno l’ottetto.<br />
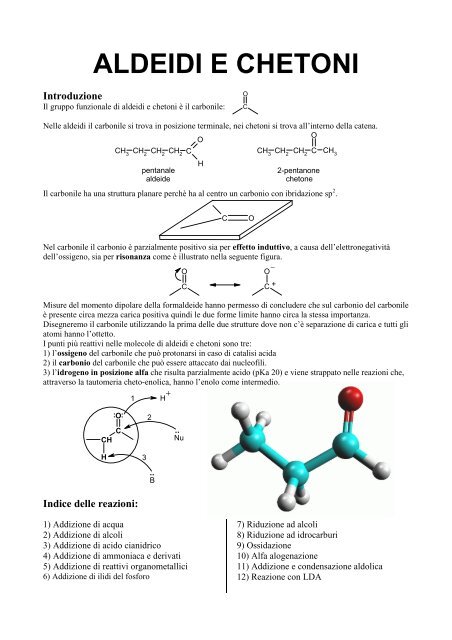
I punti più reattivi nelle molecole di aldeidi e chetoni sono tre:<br />
1) l’ossigeno del carbonile che può protonarsi in caso di catalisi acida<br />
2) il carbonio del carbonile che può essere attaccato dai nucleofili.<br />
3) l’idrogeno in posizione alfa che risulta parzialmente acido (pKa 20) e viene strappato nelle reazioni che,<br />
attraverso la tautomeria cheto-enolica, hanno l’enolo come intermedio.<br />
1<br />
: O:<br />
C<br />
CH<br />
H<br />
Indice delle reazioni:<br />
3<br />
2<br />
..<br />
B<br />
H + ..<br />
Nu<br />
1) Addizione di acqua<br />
2) Addizione di alcoli<br />
3) Addizione di acido cianidrico<br />
4) Addizione di ammoniaca e derivati<br />
5) Addizione di reattivi organometallici<br />
6) Addizione di ilidi del fosforo<br />
7) Riduzione ad alcoli<br />
8) Riduzione ad idrocarburi<br />
9) Ossidazione<br />
10) Alfa alogenazione<br />
11) Addizione e condensazione aldolica<br />
12) Reazione con LDA
www.pianetachimica.<strong>it</strong><br />
Addizione di acqua<br />
La reazione tipica di aldeidi e chetoni è l’addizione nucleofila al carbonile. Questa può essere meglio<br />
compresa esaminando con attenzione il caso più elementare, l’addizione di acqua.<br />
L’addizione nucleofila al carbonile è influenzata sia da fattori elettronici che sterici.<br />
I fattori elettronici (donazioni di elettroni) influenzano la stabil<strong>it</strong>à del doppio legame carbonio-ossigeno e la<br />
quant<strong>it</strong>à di carica pos<strong>it</strong>iva presente sul carbonio del carbonile.<br />
I fattori sterici (ingombro sterico) condizionano soprattutto la stabil<strong>it</strong>à del prodotto finale nel quale i<br />
sost<strong>it</strong>uenti sono più vicini tra loro visto che il carbonio del carbonile da sp 2 (120°) diventa sp 3 (109°).<br />
Per comprendere come agiscono questi fattori consideriamo le seguenti tre molecole:<br />
H<br />
O<br />
C<br />
H<br />
formaldeide<br />
C H 3<br />
O<br />
C<br />
H<br />
. − +<br />
O OH 2<br />
HO<br />
OH<br />
H 2<br />
Ȯ :<br />
C<br />
C<br />
H H<br />
H H<br />
formaldeide<br />
idratata<br />
. − +<br />
O OH 2<br />
HO<br />
OH<br />
H 2<br />
Ȯ :<br />
C<br />
C<br />
H 3<br />
C H<br />
C H<br />
H 3<br />
99,9 %<br />
C H 3<br />
acetaldeide<br />
O<br />
C<br />
CH 3<br />
acetaldeide<br />
idratata<br />
. − +<br />
O OH 2<br />
HO<br />
OH<br />
H 2<br />
Ȯ :<br />
C<br />
C<br />
H 3<br />
C CH 3<br />
H 3<br />
C CH 3<br />
50 %<br />
acetone<br />
acetone<br />
0,1 %<br />
idratato<br />
Consideriamo dapprima i fattori elettronici. Confrontiamo l’effetto dei sost<strong>it</strong>uenti sul carbonile. I gruppi<br />
metilici CH 3 sono leggermente elettron donatori rispetto ai semplici atomi di idrogeno e stabilizzano il<br />
doppio legame C=O in modo simile a quanto già visto per gli alcheni. Quindi il carbonile è più stabile se è<br />
più sost<strong>it</strong>u<strong>it</strong>o. L’ordine di stabil<strong>it</strong>à è allora:<br />
formaldeide < acetaldeide < acetone<br />
Come si può vedere nel grafico qui sotto a sinistra, i fattori che stabilizzano i reagenti rendono meno<br />
favorevole il ∆G° (come è indicato dalla freccia a sinistra) e quindi abbassano la K di equilibrio. Questo è in<br />
accordo con il fatto che la molecola più stabile, acetone, è quella che si idrata meno (0,1 %).<br />
E<br />
formaldeide<br />
acetaldeide<br />
acetone<br />
l'effetto elettron donatore<br />
stabilizza il carbonile<br />
c.r.<br />
acetone idratato<br />
acetaldeide idratata<br />
formaldeide idratata<br />
l'ingombro sterico<br />
destabilizza il composto idratato<br />
Consideriamo ora i fattori sterici. Nelle molecole idratate i sost<strong>it</strong>uenti sono più vicini tra loro rispetto alla<br />
molecola di partenza, infatti, durante la reazione, l’angolo di legame passa da 120° (sp 2 ) a 109° (sp 3 ).<br />
La presenza di gruppi metilici CH 3 , più ingombranti degli atomi di idrogeno, destabilizza le molecole<br />
idratate che quindi sono meno stabili se sono più sost<strong>it</strong>u<strong>it</strong>e.<br />
L’ordine di stabil<strong>it</strong>à è allora:<br />
acetone idratato < acetaldeide idratata < formaldeide idratata<br />
Prof. Mauro Tonellato – ITIS Marconi – Padova <strong>Aldeidi</strong> e chetoni 2
www.pianetachimica.<strong>it</strong><br />
Nel grafico precedente, sulla destra, si vede che l’ingombro sterico destabilizza i prodotti idratati e rende<br />
meno favorevole il ∆G° (come è indicato dalla freccia a destra) e quindi abbassa la K di equilibrio. Questo è<br />
in accordo con il fatto che la molecola meno stabile, l’acetone idratato, si forma meno (0,1 %).<br />
Concludendo, la reazione di idratazione della formaldeide è la più favorevole e procede con ∆G° < 0.<br />
La stessa reazione per l’acetaldeide ha circa ∆G° = 0 infatti l’acetaldeide è idratata circa al 50% in acqua.<br />
Per l’acetone, invece, la reazione è svantaggiosa e ha ∆G° > 0, infatti l’acetone è idratato allo 0,1 % in acqua.<br />
Con ragionamenti simili si può capire perchè le aldeidi aromatiche, come la benzaldeide, sono meno<br />
reattive delle aldeidi alifatiche. L’anello aromatico stabilizza il carbonile donando elettroni per risonanza.<br />
−<br />
O H<br />
O H<br />
C<br />
C<br />
benzaldeide<br />
La benzaldeide, come l’acetone, è idratata solo allo 0,1 % in acqua.<br />
La reazione di idratazione avviene molto più velocemente se viene condotta in ambiente leggermente acido<br />
o basico cioè con catalisi acida o basica, cerchiamo di capirne il motivo studiando il meccanismo di reazione.<br />
Esaminiamo per prima la catalisi acida.<br />
C H 3<br />
: O:<br />
C<br />
H<br />
acetaldeide<br />
H<br />
O . HO<br />
OH 2<br />
HO<br />
OH<br />
H + + +<br />
H 2<br />
Ȯ :<br />
C<br />
C<br />
C<br />
H 3<br />
C H H 3<br />
C H<br />
H 3<br />
C H<br />
+<br />
acetaldeide<br />
idratata<br />
Nel primo passaggio, il carbonile si protona sull’ossigeno e questo lo rende molto più reattivo verso<br />
l’acqua, un nucleofilo debole. La molecola, durante la reazione, è neutra o pos<strong>it</strong>iva, non compaiono mai<br />
cariche negative.<br />
Nella catalisi basica, invece, mostrata qui sotto, il carbonile non viene modificato, la reazione accelera<br />
perchè in ambiente basico il nucleofilo diventa più reattivo infatti al posto dell’acqua reagisce OH − .<br />
C H 3<br />
O<br />
C<br />
H<br />
acetaldeide<br />
.. − −.. : O:<br />
OH<br />
: OH<br />
C<br />
C H 3<br />
H<br />
H<br />
OH<br />
HO<br />
C H 3<br />
C<br />
OH<br />
H<br />
acetaldeide<br />
idratata<br />
50 %<br />
La molecola, durante la reazione, è neutra o negativa, non compaiono mai cariche pos<strong>it</strong>ive.<br />
Notate che in tutti e due i casi si ottiene la stessa percentuale di acetaldeide idratata, 50 %, cioè non viene<br />
modificata la K di equilibrio. La catalisi, infatti, influenza solo la veloc<strong>it</strong>à di reazione perchè offre un<br />
diverso meccanismo alla reazione con una diversa energia di attivazione, ma l’equilibrio non viene<br />
modificato.<br />
+<br />
OH<br />
−<br />
50 %<br />
Prof. Mauro Tonellato – ITIS Marconi – Padova <strong>Aldeidi</strong> e chetoni 3
www.pianetachimica.<strong>it</strong><br />
Addizione di alcoli, sintesi di acetali<br />
Le aldeidi e i chetoni reagiscono con due molecole di alcol in catalisi acida per dare gli acetali. Il semiacetale<br />
che si forma inizialmente per addizione di una molecola di alcol è instabile e in genere non è isolabile, ma<br />
reagisce con una seconda molecola di alcol e si trasforma velocemente in acetale, un dietere geminale.<br />
OH<br />
CH<br />
O<br />
OH<br />
OH<br />
O 2<br />
CH 3<br />
H + CH 3<br />
CH 2<br />
CH 3<br />
C + CH 3<br />
CH 2<br />
CH 3<br />
C O CH 2<br />
CH 3<br />
CH 3<br />
C O CH 2<br />
CH 3<br />
H<br />
H +<br />
+<br />
H<br />
H<br />
acetaldeide<br />
etanolo<br />
1-etossietanolo<br />
(semiacetale)<br />
1,1-dietossietano<br />
(acetale)<br />
In questa reazione le aldeidi reagiscono più facilmente dei chetoni come avviene nell’addizione di acqua.<br />
Il meccanismo della formazione del semiacetale è identico a quello di idratazione delle aldeidi con catalisi<br />
acida.<br />
: .. OH<br />
..<br />
O:<br />
O H<br />
OH<br />
OH<br />
H + +<br />
CH2 CH 3 +<br />
CH 3<br />
C<br />
CH 3<br />
C<br />
CH3 C O CH 2<br />
CH 3<br />
CH 3<br />
C O CH 2<br />
CH 3<br />
H<br />
H<br />
H H<br />
H<br />
La reazione però non si ferma qui: in ambiente acido il semiacetale si disidrata attraverso la formazione di un<br />
carbocatione stabilizzato per risonanza. La reazione avviene a freddo in ambiente leggermente acido.<br />
Ci si può chiedere perchè questa disidratazione sia così facile, mentre quella dei normali alcoli, che si<br />
disidratano per formare alcheni, richiede 140 °C e H 2 SO 4 concentrato. La differenza è dovuta al fatto che nei<br />
semiacetali è presente un secondo ossigeno che aiuta l’espulsione di acqua formando un carbocatione<br />
stabilizzato per risonanza, come è illustrato qui sotto:<br />
..<br />
: OH<br />
OH<br />
H + +<br />
2<br />
..<br />
CH 3<br />
C O CH 2<br />
CH 3<br />
CH 3<br />
C O CH 2<br />
CH 3<br />
H<br />
H<br />
..<br />
+<br />
CH 3<br />
C O CH 2<br />
CH 3<br />
H<br />
: ..<br />
OH<br />
CH 2<br />
CH 3<br />
H 2<br />
O<br />
H<br />
CH 3<br />
+<br />
O<br />
C<br />
CH 2<br />
CH 3<br />
O CH 2<br />
CH 3<br />
CH 3<br />
O<br />
C<br />
CH 2<br />
CH 3<br />
O CH 2<br />
CH 3<br />
+<br />
CH 3<br />
C O CH 2<br />
CH 3<br />
H<br />
..<br />
..<br />
carbocatione stabilizzato<br />
per risonanza<br />
H<br />
H<br />
La reazione, in ambiente acido, è reversibile e quindi l’aldeide viene trasformata nell’acetale se c’è un<br />
eccesso di alcol, mentre l’acetale viene idrolizzato liberando l’aldeide se c’è un eccesso di acqua.<br />
I chetoni sono meno reattivi delle aldeidi e producono acetali con difficoltà. La reazione però può essere<br />
condotta con successo allontanando l’acqua per distillazione azeotropica con benzene (7% acqua, 74%<br />
benzene, 19% etanolo). La reazione può anche essere favor<strong>it</strong>a riducendo lo svantaggio entropico dovuto alla<br />
diminuzione del disordine molecolare (tre molecole ne producono due). Questo accade negli zuccheri<br />
quando l’alcol e l’aldeide (o il chetone) appartengono alla stessa molecola e si ottiene un semiacetale ciclico.<br />
Questo accade anche utilizzando un diolo al posto delle due molecole di alcol. Usando 1,2-etandiolo o<br />
1,3-propandiolo si ottiene un acetale ciclico come quello illustrato qui sotto.<br />
O<br />
OH<br />
C<br />
CH 3<br />
CH 2<br />
CH<br />
+<br />
3<br />
CH 2<br />
OH<br />
CH 2<br />
H +<br />
O<br />
O<br />
CH 3<br />
CH 2<br />
CH<br />
+ H 2<br />
O<br />
3<br />
2-butanone<br />
1,2-etandiolo<br />
2-etil-2-metil-1,3-dioxolano<br />
80 %<br />
Prof. Mauro Tonellato – ITIS Marconi – Padova <strong>Aldeidi</strong> e chetoni 4
www.pianetachimica.<strong>it</strong><br />
Gli acetali sono stabili alle basi, in questo assomigliano agli eteri. Il gruppo alcossido, infatti, è un pessimo<br />
gruppo uscente. Questo consente di usare l’acetale come gruppo protettore di una aldeide per eseguire<br />
reazioni in ambiente basico, nel quale le aldeidi sono instabili (perchè possono reagire con i nucleofili o dare<br />
condensazione aldolica).<br />
Consideriamo, per esempio, la seguente reazione.<br />
O<br />
O<br />
CH 3<br />
C CH 2<br />
C CH<br />
CH 3<br />
C CH 2<br />
C C<br />
CH 3<br />
4-pentin-2-one 4-esin-2-one<br />
Per allungare la catena è necessario trattare l’alchino con sodioamide per ottenere l’acetiluro che poi, per<br />
reazione con ioduro di metile, permette di allungare la catena. Questi passaggi in ambiente basico non sono<br />
possibili se è presente il chetone, in particolare l’anione acetiluro darebbe condensazione con il chetone<br />
formando un alcol superiore. Se però si protegge il chetone trasformandolo in acetale, allora la reazione<br />
diventa realizzabile.<br />
O<br />
CH 3<br />
C CH 2<br />
C CH<br />
OH<br />
OH<br />
CH 2<br />
CH 2<br />
H +<br />
O<br />
CH 3<br />
C<br />
O<br />
CH 2<br />
C CH<br />
−<br />
NH O O<br />
2<br />
CH 3<br />
I<br />
C<br />
CH 3<br />
CH 2<br />
C C: −<br />
O<br />
CH 3<br />
C<br />
O<br />
CH 2<br />
C C<br />
O<br />
H 2<br />
O<br />
CH 3<br />
C CH 2<br />
C C<br />
CH<br />
H +<br />
3<br />
CH 3<br />
Un altro esempio è la seguente reazione di riduzione:<br />
O<br />
O<br />
CH 3<br />
C CH 2<br />
CH 2<br />
C<br />
OH<br />
acido 4-oxopentanoico<br />
CH 3<br />
C CH 2<br />
CH 2<br />
CH 2<br />
Prof. Mauro Tonellato – ITIS Marconi – Padova <strong>Aldeidi</strong> e chetoni 5<br />
O<br />
OH<br />
5-idrossipentan-2-one<br />
Con LiAlH 4 , i chetoni si riducono più facilmente degli acidi carbossilici, quindi per ridurre ad alcol solo il<br />
carbossile è indispensabile proteggere il gruppo chetonico trasformandolo in acetale.<br />
O<br />
CH 3<br />
C CH 2<br />
CH 2<br />
C<br />
O<br />
CH 3<br />
C<br />
O<br />
OH<br />
OH<br />
OH<br />
CH 2<br />
CH<br />
O O<br />
2<br />
LiAlH 4<br />
C<br />
O<br />
H + CH 3<br />
CH 2<br />
CH 2<br />
C<br />
OH<br />
O<br />
O<br />
OH<br />
− H 2<br />
O<br />
O CH 3<br />
C CH 2<br />
CH 2<br />
CH 2<br />
H +<br />
CH 2<br />
CH 2<br />
CH 2<br />
O<br />
CH 3<br />
C<br />
O<br />
O −<br />
CH 2<br />
CH 2<br />
CH 2<br />
Gli acetali non possono essere preparati in ambiente basico. La reazione procede fino alla formazione del<br />
semiacetale, ma a questo punto l’ossigeno etereo non può trasformarsi in un nucleofilo migliore (non ha un<br />
H + da perdere) e quindi non è in grado di spingere OH − fuori dalla molecola. L’alcossido può strappare un H +<br />
solo dal gruppo OH e questo spinge la reazione indietro.<br />
.. −<br />
: O:<br />
− ..<br />
O<br />
: O:<br />
O CH 2<br />
CH 3<br />
O<br />
.. −<br />
CH 2<br />
CH 3<br />
H O Et<br />
: O:<br />
CH 3<br />
C CH 3<br />
C<br />
C<br />
C H 3<br />
CH 3<br />
C H 3<br />
H O CH 2<br />
CH 3<br />
CH 2<br />
CH 3<br />
CH 3<br />
semiacetale<br />
l'alcossido può strappare<br />
un H + solo dal gruppo OH
Addizione di acido cianidrico<br />
<strong>Aldeidi</strong> e chetoni possono reagire con acido cianidrico per formare cianidrine.<br />
O<br />
CH 3<br />
C<br />
H<br />
acetaldeide<br />
+<br />
OH<br />
pH 10<br />
HCN CH 3<br />
CH<br />
C<br />
N<br />
2-idrossipropanon<strong>it</strong>rile<br />
(cianidrina)<br />
www.pianetachimica.<strong>it</strong><br />
La reazione viene condotta con catalisi moderatamente basica, a pH 10. Il pH deve essere abbastanza alto<br />
da generare una quant<strong>it</strong>à sufficiente di ione CN − , la specie che fa l’attacco nucleofilo al carbonile, (HCN ha<br />
pKa 10) ma non deve diventare troppo basico per consentire all’alcossido, che si forma durante la reazione,<br />
di protonarsi. La reazione si conduce quindi con NaCN a pH 10, al quale si ha 50% di CN − e 50 % di HCN, e<br />
si mantiene a pH 10 aggiungendo H 2 SO 4 goccia a goccia.<br />
CH 3<br />
C<br />
O<br />
H<br />
-<br />
O:<br />
-<br />
: C N CH 3<br />
CH<br />
C<br />
N<br />
H CN<br />
pH 10<br />
CH 3<br />
OH<br />
CH<br />
C<br />
N<br />
: .. H 2<br />
SO 4<br />
goccia goccia<br />
La reazione di sintesi delle cianidrine è facilmente reversibile.<br />
Trattando la cianidrina con metossido di sodio CH 3 ONa, in ambiente quindi decisamente basico, si può<br />
spingere a sinistra la reazione mostrata sopra.<br />
O<br />
CH 3<br />
CH<br />
H<br />
C<br />
N<br />
CH 3<br />
..<br />
O O .. : - .. -<br />
: :<br />
CH 3<br />
CH<br />
C N CH 3<br />
C<br />
O<br />
H<br />
+ - : C<br />
Dato che la reazione delle cianidrine è così facilmente reversibile, può essere usata sia per allungare sia per<br />
accorciare la catena di atomi di carbonio di uno zucchero.<br />
Viene anche utilizzata per la sintesi degli α idrossiacidi, qui vediamo la sintesi di acido lattico a partire da<br />
acetaldeide.<br />
O<br />
CH 3<br />
C<br />
H<br />
acetaldeide<br />
+<br />
OH<br />
pH 10<br />
HCN CH 3<br />
CH<br />
OH<br />
H 2<br />
O<br />
C N CH 3<br />
CH<br />
H +<br />
COOH<br />
2-idrossipropanon<strong>it</strong>rile<br />
acido lattico<br />
(cianidrina)<br />
Una variante di questa reazione che parte da un cloruro acilico produce invece un α ossiacido, qui<br />
vediamo la sintesi di acido piruvico.<br />
O<br />
O<br />
O<br />
pH 10<br />
H 2<br />
O<br />
CH 3<br />
C + HCN CH 3<br />
C C N CH 3<br />
C COOH<br />
Cl<br />
H +<br />
cloruro di acetile 2-oxopropanon<strong>it</strong>rile acido piruvico<br />
N<br />
Prof. Mauro Tonellato – ITIS Marconi – Padova <strong>Aldeidi</strong> e chetoni 6
www.pianetachimica.<strong>it</strong><br />
Addizione di ammoniaca e derivati<br />
L’ammoniaca e i suoi derivati (ammine primarie e secondarie, idrossilammina, fenilidrazina, ecc.) sono<br />
molecole nucleofile e quindi reagiscono regolarmente con aldeidi e chetoni con una reazione di sost<strong>it</strong>uzione<br />
nucleofila nella quale l’azoto si lega con doppio legame al carbonio e viene espulsa acqua. Si formano gli<br />
analoghi azotati di aldeidi e chetoni.<br />
<strong>Aldeidi</strong> e chetoni, reagendo con ammoniaca e ammine primarie, formano immine. Il pH della reazione<br />
deve essere intorno a 5, cioè abbastanza acido da permettere di ottenere una sufficiente quant<strong>it</strong>à di aldeide o<br />
chetone con il carbonile protonato, ma non troppo acido perché l’ammina verrebbe trasformata in ione<br />
ammonio che non è più nucleofilo.<br />
O<br />
pH 5<br />
NH<br />
CH 3<br />
C + NH 3<br />
CH 3<br />
C + H 2<br />
O<br />
H<br />
H<br />
acetaldeide etanimmina<br />
O<br />
CH 3<br />
C<br />
H<br />
acetaldeide<br />
NH 2 pH 5<br />
N CH 2<br />
CH 3<br />
+ CH 2<br />
CH 3<br />
CH 3<br />
C<br />
+ H 2<br />
O<br />
H<br />
etanammina<br />
N-etilideneetanammina<br />
Le immine ottenute dall’ammoniaca sono reattive e possono polimerizzare per attacco dell’azoto (che resta<br />
parzialmente nucleofilo) sul carbonile. Queste immine, quindi, vengono fatte reagire immediatamente nello<br />
stesso ambiente di reazione. Con NaBH 4 , per esempio, le immine si riducono ad ammine, oppure per<br />
reazione con lo ione cianuro le immine formano le corrispondenti cianammine che possono essere idrolizzate<br />
ad amminoacidi.<br />
O<br />
CH 3<br />
C +<br />
H<br />
acetaldeide<br />
NH 3<br />
NH<br />
CH 3<br />
C<br />
H<br />
etanimmina<br />
CN −<br />
NH 2<br />
CH 3<br />
CH CN<br />
2-amminopropanon<strong>it</strong>rile<br />
(cianammina)<br />
H 2<br />
O<br />
H +<br />
NH 2<br />
CH 3<br />
CH COOH<br />
alanina<br />
(amminoacido)<br />
La sintesi delle immine avviene in due tempi. Prima si ha l’addizione nucleofila dell’ammina all’aldeide (o al<br />
chetone) con formazione di una molecola simile ai semiacetali chiamata carbinolammina, poi questa perde<br />
una molecola d’acqua per formare l’immina finale.<br />
CH 3<br />
C<br />
..<br />
O:<br />
H<br />
H + +<br />
O<br />
CH 3<br />
C<br />
H<br />
H<br />
: NH 2<br />
OH<br />
CH2 CH 3 +<br />
CH3 C NH CH 2<br />
CH 3<br />
H<br />
H<br />
CH 3<br />
C<br />
OH<br />
H<br />
NH CH 2<br />
CH 3<br />
carbinolammina<br />
: ..<br />
OH<br />
CH 3<br />
C NH CH 2<br />
CH 3<br />
OH<br />
H + +<br />
2<br />
CH 3<br />
C NH .. CH 2<br />
CH 3<br />
CH 3<br />
C<br />
+<br />
NH<br />
CH 2<br />
CH 3<br />
CH 3<br />
C<br />
N<br />
CH 2<br />
CH 3<br />
H<br />
H<br />
H<br />
H<br />
carbinolammina<br />
N-etilideneetanammina<br />
Prof. Mauro Tonellato – ITIS Marconi – Padova <strong>Aldeidi</strong> e chetoni 7
<strong>Aldeidi</strong> e chetoni reagendo con ammine secondarie formano le enammine.<br />
H CH CH 3<br />
3<br />
O<br />
N<br />
pH 5<br />
N CH 2<br />
CH 3<br />
CH 3<br />
C + CH 2<br />
CH 3<br />
CH 2<br />
C<br />
+ H 2<br />
O<br />
H<br />
H<br />
acetaldeide<br />
N-metiletanammina<br />
N-etil-N-metiletenammina<br />
www.pianetachimica.<strong>it</strong><br />
L’azoto dell’ammina secondaria non ha due idrogeni da perdere per formare i due nuovi legami con il carbonio,<br />
quindi non si può formare un’immina neutra. Quando la carbinolammina, che si forma inizialmente,<br />
perde una molecola d’acqua, si forma uno ione immonio, questo perde la carica pos<strong>it</strong>iva attraverso una<br />
tautomeria che produce l’enammina.<br />
CH 3<br />
C<br />
..<br />
O:<br />
H<br />
: .. OH<br />
CH 3<br />
C N..<br />
H<br />
CH 3<br />
carbinolammina<br />
H + +<br />
O H<br />
CH 3<br />
C<br />
H<br />
CH 2<br />
CH 3<br />
: NH<br />
CH2 CH 3<br />
CH 3<br />
OH<br />
C<br />
+<br />
N<br />
CH 3<br />
OH<br />
C N<br />
H H<br />
CH 2<br />
CH 3<br />
H<br />
CH 2<br />
CH 3<br />
CH 3<br />
carbinolammina<br />
+<br />
CH 3<br />
CH 3<br />
OH<br />
H + 2<br />
CH N CH<br />
3<br />
2<br />
CH 3<br />
N CH 2<br />
CH<br />
+<br />
3<br />
CH 3<br />
C N..<br />
CH 2<br />
C<br />
CH 2<br />
C<br />
CH 2<br />
CH H 3<br />
tautomeria<br />
H<br />
H<br />
H<br />
ione immonio N-etil-N-metiletenammina<br />
<strong>Aldeidi</strong> e chetoni reagendo con idrossilammina formano le ossime.<br />
Mentre con fenilidrazina formano i fenilidrazoni.<br />
Queste reazioni sono molto simili a quelle che formano le immine con le ammine primarie.<br />
O<br />
pH 5<br />
N OH<br />
CH 3<br />
C + NH 2<br />
OH<br />
CH 3<br />
C + H 2<br />
O<br />
H<br />
acetaldeide<br />
idrossilammina<br />
H<br />
etanal ossima<br />
CH 3<br />
C<br />
O<br />
pH 5<br />
N NH<br />
+ NH 2<br />
NH<br />
CH 3<br />
C<br />
+ H 2<br />
O<br />
acetone<br />
CH 3<br />
fenilidrazina<br />
CH 3<br />
acetone fenilidrazone<br />
O 2<br />
N<br />
CH 3<br />
C<br />
O<br />
O 2<br />
N<br />
pH 5<br />
N NH<br />
NO 2<br />
+ NH 2<br />
NH<br />
NO 2<br />
CH 3<br />
C<br />
+ H 2<br />
O<br />
CH 3<br />
acetone<br />
2,4-din<strong>it</strong>rofenilidrazina<br />
CH 3<br />
acetone 2,4-din<strong>it</strong>rofenilidrazone<br />
I derivati 2,4-din<strong>it</strong>rofenilidrazoni sono poco solubili e formano un precip<strong>it</strong>ato cristallino che presenta un<br />
punto di fusione caratteristico e diverso per ogni aldeide e chetone.<br />
Per questo motivo un tempo questa sintesi veniva utilizzata per identificare un’aldeide o un chetone in base<br />
al punto di fusione del suo derivato 2,4-din<strong>it</strong>rofenilidrazone.<br />
Oggi si preferisce identificare le molecole organiche per via strumentale con la spettroscopia IR, NMR o di<br />
massa.<br />
Prof. Mauro Tonellato – ITIS Marconi – Padova <strong>Aldeidi</strong> e chetoni 8
www.pianetachimica.<strong>it</strong><br />
Addizione di reattivi organometallici<br />
I reattivi organometallici come i reattivi di Grignard (magnesio organici), i l<strong>it</strong>io organici e gli acetiluri di<br />
sodio reagiscono con aldeidi e chetoni con una addizione nucleofila che forma alcoli superiori. Queste sono<br />
quindi reazioni importanti dal punto di vista sintetico.<br />
Con la formaldeide si ottengono alcoli primari, con le aldeidi si ottengono alcoli secondari, con i chetoni si<br />
formano alcoli terziari.<br />
O<br />
C +<br />
H H<br />
formaldeide<br />
MgBr<br />
O MgBr OH<br />
etere<br />
H 2<br />
O<br />
CH 2<br />
CH 2<br />
CH 3<br />
CH 2<br />
CH 2<br />
CH 2<br />
CH 3<br />
CH 2<br />
CH 2<br />
CH 2<br />
CH 3<br />
1-propilmagnesio<br />
bromuro<br />
1-butanolato<br />
magnesio bromuro<br />
1-butanolo<br />
O<br />
CH 3<br />
C +<br />
H<br />
acetaldeide<br />
MgBr<br />
O<br />
MgBr<br />
OH<br />
etere<br />
H 2<br />
O<br />
CH 2<br />
CH 2<br />
CH 3<br />
CH 3<br />
CH CH 2<br />
CH 2<br />
CH 3<br />
CH 3<br />
CH CH 2<br />
CH 2<br />
CH 3<br />
1-propilmagnesio<br />
bromuro<br />
2-pentanolato<br />
magnesio bromuro<br />
2-pentanolo<br />
C H 3<br />
O<br />
C<br />
acetone<br />
CH 3<br />
+<br />
MgBr<br />
O<br />
MgBr<br />
OH<br />
CH 2<br />
CH 2<br />
CH 3<br />
etere<br />
H 2<br />
O<br />
CH 3<br />
C CH 2<br />
CH 2<br />
CH 3<br />
CH 3<br />
CH 3<br />
C CH 2<br />
CH 2<br />
CH 3<br />
CH 3<br />
1-propilmagnesio<br />
2-metil-2-pentanolato<br />
2-metil-2-pentanolo<br />
bromuro<br />
magnesio bromuro<br />
I reattivi l<strong>it</strong>io organici si comportano in modo analogo ai magnesio organici. Qui vediamo la sintesi di un<br />
alcol β-γ insaturo.<br />
C<br />
O<br />
+<br />
Li<br />
CH<br />
CH 2<br />
etere<br />
Li<br />
O<br />
OH<br />
H 2<br />
O<br />
CH CH CH 2<br />
CH<br />
CH CH 2<br />
H<br />
benzaldeide vinill<strong>it</strong>io 1-fenil-2-propen-1-olato<br />
1-fenil-2-propen-1-olo<br />
l<strong>it</strong>io<br />
Gli acetiluri si sommano ad aldeidi e chetoni producendo alcoli acetilenici. La reazione è del tutto analoga a<br />
quella dei reattivi di Grignard e l<strong>it</strong>io organici.<br />
O<br />
C +<br />
H H<br />
formaldeide<br />
Na<br />
C C CH 3<br />
1-propinilsodio<br />
etere<br />
O MgBr OH<br />
H 2<br />
O<br />
CH 2<br />
C C CH 3<br />
CH 2<br />
C C CH 3<br />
2-butin-1-olato<br />
magnesio bromuro<br />
2-butin-1-olo<br />
Il meccanismo di reazione consiste in un attacco concertato dell’ossigeno del carbonile sul magnesio<br />
pos<strong>it</strong>ivo e del carbonio del reattivo organometallico (che ha carattere carbanionico) sul carbonio del<br />
carbonile. Si forma quindi un sale alcossido nel quale il legame ossigeno-magnesio è in buona parte ionico. Il<br />
trattamento con acqua ci dà l’alcol per reazione acido base con l’alcossido.<br />
H<br />
.. MgBr<br />
O : MgBr<br />
O<br />
etere<br />
H 2<br />
O<br />
C + CH 2<br />
CH 2<br />
CH 3<br />
CH 2<br />
CH 2<br />
CH 2<br />
CH 3<br />
H<br />
OH<br />
CH 2<br />
CH 2<br />
CH 2<br />
CH 3<br />
Prof. Mauro Tonellato – ITIS Marconi – Padova <strong>Aldeidi</strong> e chetoni 9
www.pianetachimica.<strong>it</strong><br />
Addizione di ilidi del fosforo (reazione di W<strong>it</strong>tig)<br />
Le ilidi del fosforo sono composti nei quali il fosforo è legato ad un carbonio con carattere<br />
carbanionico e condensano facilmente con aldeidi e chetoni per produrre alcheni nei quali la<br />
posizione del doppio legame è determinata senza incertezze.<br />
La sintesi comincia con la preparazione della ilide che si ottiene in due passaggi. Nel primo si tratta<br />
un alogenuro alchilico con trifenilfosfina per ottenere un sale di alchil-trifenilfosfonio.<br />
+ −<br />
(C 6<br />
H 5<br />
) 3<br />
P:<br />
+ CH 3<br />
Br (C 6<br />
H 5<br />
) 3<br />
P CH 3<br />
Br<br />
trifenilfosfina bromometano metiltrifenilfosfonio<br />
Questo, per trattamento con una base forte, come sodiometil metil solfossido (in dimetilsolfossido),<br />
produce la ilide, un alchilidene-trifenilfosforano.<br />
O<br />
H Na O<br />
O<br />
+<br />
CH 3<br />
S CH 3<br />
+ .. −<br />
(C 6<br />
H 5<br />
) 3<br />
P CH 2<br />
+ CH 2<br />
S CH 3<br />
(C 6<br />
H 5<br />
) 3<br />
P CH 2<br />
(C 6<br />
H 5<br />
) 3<br />
P CH 2<br />
+ CH 3<br />
S<br />
metiltrifenil<br />
fosfonio<br />
sodiometil metil<br />
solfossido<br />
metilenetrifenilfosforano<br />
(ilide)<br />
CH 3<br />
dimetilsolfossido<br />
Come base, in alternativa, si può anche usare butill<strong>it</strong>io (in tetraidrofurano).<br />
La ilide non viene isolata e viene sub<strong>it</strong>o fatta reagire aggiungendo l’aldeide o il chetone nel pallone<br />
di reazione.<br />
CH 3<br />
SOCH 3<br />
+<br />
(C 6<br />
H 5<br />
) 3<br />
P CH 2<br />
+ O<br />
CH 2<br />
(C 6<br />
H 5<br />
) 3<br />
P O<br />
metilenetrifenilfosforano<br />
(ilide)<br />
cicloesanone metilenecicloesano ossido di<br />
trifenilfosfina<br />
Il meccanismo di reazione prevede un attacco concertato dell’ossigeno del carbonile sul fosforo<br />
pos<strong>it</strong>ivo e del carbonio con parziale carattere carbanionico della ilide al carbonile del chetone.<br />
L’intermedio di reazione è un anello a quattro atomi che si rompe per formare da una parte<br />
l’alchene finale e dall’altra l’ossido di trifenilfosfina che possiede un doppio legame fosforoossigeno<br />
particolarmente stabile (130 kcal/mol).<br />
: O:<br />
Ph<br />
Ph<br />
Ph<br />
P<br />
+<br />
−<br />
: CH 2<br />
O<br />
Ph<br />
P<br />
CH 2<br />
Ph<br />
Ph<br />
CH 2<br />
+<br />
Ph<br />
Ph<br />
P<br />
O<br />
Ph<br />
Se il gruppo alchilico della ilide è asimmetrico, e anche il composto carbonilico è asimmetrico,<br />
allora si possono formare miscele di alcheni cis e trans. L’alchene più stabile si forma in quant<strong>it</strong>à<br />
maggiore.<br />
(C 6<br />
H 5<br />
) 3<br />
P C<br />
CH 3<br />
+ CH 3<br />
C<br />
H<br />
etilidenetrifenilfosforano<br />
ilide<br />
O<br />
CH 2<br />
CH 3<br />
H 3<br />
C CH<br />
CH 3<br />
3<br />
SOCH 3<br />
C C +<br />
CH 3<br />
CH 2<br />
Prof. Mauro Tonellato – ITIS Marconi – Padova <strong>Aldeidi</strong> e chetoni 10<br />
H<br />
CH 3<br />
CH 2<br />
C<br />
H 3<br />
C<br />
2-butanone 90 % (E) 10 % (Z)<br />
Per identificare il gruppo carbonilico e la ilide che servono per preparare un certo alchene, bisogna<br />
immaginare di tagliare l’alchene in corrispondenza del doppio legame. I due frammenti ottenuti<br />
vanno preparati uno come composto carbonilico e l’altro come ilide o viceversa.<br />
H 3<br />
C CH 3<br />
Spesso le sintesi W<strong>it</strong>tig possono essere progettate in due modi diversi, la scelta<br />
C C del frammento da preparare come composto carbonilico oppure come ilide è<br />
legata anche alla loro disponibil<strong>it</strong>à.<br />
CH 3<br />
CH 2<br />
H<br />
C<br />
CH 3<br />
H
www.pianetachimica.<strong>it</strong><br />
Riduzione ad alcoli<br />
La riduzione su grande scala di aldeidi e chetoni per ottenere alcoli viene esegu<strong>it</strong>a con idrogeno e<br />
catalizzatore, Ni, Pt, Pd o Ru. In queste condizioni, però, il doppio legame degli alcheni si riduce molto più<br />
velocemente del carbonile, quindi per questa via non è possibile ridurre aldeidi e chetoni ad alcoli senza<br />
ridurre anche un eventuale doppio legame carbonio-carbonio presente nella molecola.<br />
O<br />
OH<br />
Pt<br />
CH 3<br />
CH 2<br />
C + H 2 CH 3<br />
CH 2<br />
CH 2<br />
propanale<br />
H<br />
1-propanolo<br />
O<br />
Pt<br />
OH<br />
CH 3<br />
CH CH C CH 3<br />
+ H 2 CH 3<br />
CH 2<br />
CH 2<br />
CH CH 3<br />
pent-3-en-2-one<br />
2-pentanolo<br />
In laboratorio, aldeidi e chetoni vengono di sol<strong>it</strong>o ridotti ad alcoli utilizzando sodio boroidruro NaBH 4 o<br />
l<strong>it</strong>io alluminio idruro LiAlH 4 . Questi idruri metallici complessi sono inerti nei confronti dei doppi legami<br />
carbonio-carbonio e quindi permettono una riduzione più selettiva rispetto all’idrogenazione catal<strong>it</strong>ica.<br />
Na +<br />
H<br />
H<br />
−<br />
B<br />
H<br />
Li +<br />
H<br />
H<br />
−<br />
Al<br />
H<br />
H<br />
H<br />
sodio boroidruro<br />
l<strong>it</strong>io alluminio idruro<br />
NaBH 4 è un riducente piuttosto blando che viene usato in solvente alcolico o acquoso. Può ridurre solo<br />
aldeidi, chetoni e cloruri acilici (i derivati più reattivi degli acidi), mentre non riduce gli acidi carbossilici e<br />
gli altri derivati né i doppi legami di alcheni e alchini. Permette quindi di ridurre in modo selettivo il gruppo<br />
carbonilico di aldeidi e chetoni in molecole che possiedono anche altri gruppi funzionali.<br />
Tutti e quattro gli ioni idruro di NaBH 4 sono reattivi. L’estere borico, che si ottiene dopo la riduzione, viene<br />
idrolizzato per leggero riscaldamento per liberare l’alcol finale.<br />
4<br />
CH 3<br />
CH 2<br />
C<br />
propanale<br />
O<br />
H<br />
+<br />
O<br />
OH<br />
1) metanolo<br />
4 CH 3<br />
CH CH C CH 3<br />
+ NaBH 4<br />
CH 3<br />
CH CH CH CH 3<br />
2) H 2<br />
O / OH − 4<br />
pent-3-en-2-one<br />
NaBH 4<br />
metanolo<br />
CH 3<br />
CH 2<br />
CH 2<br />
pent-3-en-2-olo<br />
O O<br />
OH O<br />
1) metanolo<br />
4 CH 3<br />
C CH 2<br />
C + NaBH 4<br />
CH 3<br />
CH CH 2<br />
C<br />
2) H<br />
O CH 2<br />
O / OH − 4<br />
3<br />
O CH 3<br />
metil 3-oxobutanoato<br />
metil 3-idrossibutanoato<br />
RO<br />
O<br />
estere borico<br />
−<br />
B<br />
OR<br />
OR<br />
H 2<br />
O / OH −<br />
calore<br />
OH<br />
−<br />
4 CH 3<br />
CH 2<br />
CH 2<br />
+ B(OH) 4<br />
1-propanolo<br />
Prof. Mauro Tonellato – ITIS Marconi – Padova <strong>Aldeidi</strong> e chetoni 11
www.pianetachimica.<strong>it</strong><br />
LiAlH 4 è un riducente molto più reattivo e viene distrutto anche da tracce di acqua, per questo viene<br />
utilizzato in etere e va trattato con le stesse precauzioni necessarie per i reattivi di Grignard.<br />
Oltre ad aldeidi e chetoni, LiAlH 4 può ridurre anche altre molecole più difficili da ridurre come gli acidi<br />
carbossilici e i loro derivati, esteri, ammidi, n<strong>it</strong>rili, ecc. ma è inattivo verso alcheni e alchini. Anche qui dalla<br />
riduzione si ottiene un estere che viene idrolizzato per riscaldamento con acqua in ambiente basico per<br />
liberare l’alcol finale.<br />
4<br />
O<br />
CH 3<br />
CH 2<br />
C<br />
H<br />
propanale<br />
+<br />
LiAlH 4<br />
etere<br />
RO<br />
−<br />
Al<br />
O<br />
CH 3<br />
CH 2<br />
CH 2<br />
estere<br />
OR<br />
OR<br />
OH<br />
H 2<br />
O / OH −<br />
4 CH 3<br />
CH 2<br />
CH 2<br />
calore<br />
+<br />
−<br />
Al(OH) 4<br />
1-propanolo<br />
4<br />
O<br />
CH 2<br />
CH C<br />
+<br />
LiAlH 4<br />
1) etere<br />
OH<br />
4 CH 2<br />
CH CH 2<br />
+<br />
−<br />
Al(OH) 4<br />
propanale<br />
H<br />
2) H 2<br />
O / OH − prop-2-en-1-olo<br />
Meccanismo di reazione:<br />
Gli idruri complessi riducono il carbonile per trasferimento di uno ione idruro dal boro (o dall’alluminio)<br />
al carbonio del carbonile e il contemporaneo attacco dell’ossigeno del carbonile al boro o all’alluminio.<br />
Questa riduzione non può essere realizzata usando un normale idruro metallico, come NaH, perché questo<br />
libera H − , lo ione idruro, che da solo non è abbastanza nucleofilo perchè i suoi elettroni si trovano in un<br />
orb<strong>it</strong>ale 1s troppo piccolo per dare una buona sovrapposizione con l’orb<strong>it</strong>ale LUMO del carbonile (che ha le<br />
dimensioni di un orb<strong>it</strong>ale 2p del carbonio). Gli idruri complessi, invece, hanno orb<strong>it</strong>ali di dimensioni adatte e<br />
la reazione avviene con un trasferimento di idruro, non con un attacco dello ione idruro libero.<br />
Vediamo il meccanismo nella reazione dell’acetaldeide con sodio boroidruro che produce etanolo.<br />
CH 3<br />
: O:<br />
C<br />
H<br />
H<br />
H<br />
−<br />
B H<br />
L’attacco iniziale del sodio boroidruro all’aldeide è un attacco concertato che può essere meglio<br />
cap<strong>it</strong>o vedendolo in due tempi:<br />
CH 3<br />
O<br />
C<br />
H<br />
.. −<br />
H<br />
: O:<br />
−<br />
H B H CH 3<br />
C H<br />
H<br />
H<br />
H<br />
B<br />
H<br />
H<br />
H<br />
CH 3<br />
H<br />
O<br />
C<br />
H<br />
−<br />
B<br />
H<br />
H<br />
H<br />
3<br />
O<br />
CH 3<br />
C<br />
H<br />
tutti e 4 gli<br />
ioni idruro<br />
sono riducenti<br />
RO<br />
O<br />
CH 3<br />
C<br />
H<br />
−<br />
B<br />
H<br />
OR<br />
OR<br />
O<br />
: OH .. −<br />
: .. −<br />
:<br />
calore<br />
(4 volte)<br />
4 CH 3<br />
C H +<br />
−<br />
B(OH) 4<br />
H<br />
H<br />
OH<br />
4<br />
CH 3<br />
OH<br />
C H<br />
H<br />
La meccanismo di reazione del LiAlH 4 è del tutto identico a questo.<br />
Prof. Mauro Tonellato – ITIS Marconi – Padova <strong>Aldeidi</strong> e chetoni 12
www.pianetachimica.<strong>it</strong><br />
Riduzione ad idrocarburi<br />
Le aldeidi e i chetoni possono essere ridotti direttamente ad idrocarburi con tre diverse reazioni: la riduzione<br />
di Clemmensen, la riduzione di Wolff-Kishner, la desolforazione dei tioacetali.<br />
Esistono comunque altre vie di riduzione “creative” che possono essere realizzate in più passaggi, ad<br />
esempio si possono fare le seguenti trasformazioni:<br />
1) chetone => alcol => bromuro alchilico => alcano<br />
CH 3<br />
O<br />
1) NaBH 4<br />
OH<br />
Br<br />
CH 3<br />
PBr 3 Zn / HCl<br />
C CH 3<br />
CH 3<br />
CH CH 3<br />
CH 3<br />
CH CH 3<br />
2) H 2 O / OH − CH 2<br />
CH 3<br />
acetone<br />
2-propanolo<br />
2-bromopropano<br />
propano<br />
MgBr<br />
Mg<br />
HCl<br />
CH 3<br />
CH CH 3<br />
CH 3<br />
CH 2<br />
CH 3<br />
Oppure:<br />
2) chetone => alcol => alchene => alcano<br />
bromuro di<br />
isopropilmagnesio<br />
O<br />
OH<br />
1) NaBH 4<br />
H 2<br />
SO 4 H 2<br />
/ Pt<br />
CH 3<br />
C CH 3<br />
CH 3<br />
CH CH 3<br />
CH 3<br />
CH CH 2<br />
CH 3<br />
CH 2<br />
CH 3<br />
2) H 2<br />
O / OH −<br />
acetone<br />
2-propanolo propene propano<br />
Le tre reazioni classiche operano la riduzione in modo più veloce e conveniente.<br />
La riduzione di Clemmensen riduce aldeidi e chetoni con zinco in amalgama di mercurio in HCl<br />
concentrato.<br />
O<br />
CH 3<br />
C CH 3<br />
Zn / Hg<br />
HCl conc<br />
CH 3<br />
CH 2<br />
CH 3<br />
propano<br />
acetone<br />
propano<br />
Questa reazione non segue lo schema [chetone => alcol => cloruro alchilico => alcano], infatti un alcol non<br />
si riduce in queste condizioni. Piuttosto, durante la reazione il chetone si lega sulla superficie del metallo<br />
formando intermedi zinco organici.<br />
Le molecole sensibili agli acidi non possono essere ridotte con la reazione di Clemmensen dato che è<br />
condotta in HCl concentrato.<br />
I chetoni che sopportano l’ambiente basico possono essere ridotti ad idrocarburi con la riduzione di Wolff-<br />
Kishner, con idrazina, trietilenglicole , KOH a 175 °C, oppure, in una variante più moderna, con idrazina e<br />
poi con dimetilsolfossido e terzbutossido a 30 °C. Le aldeidi, invece, non sopportano l’ambiente basico e non<br />
possono essere ridotte con questa reazione.<br />
NH 2<br />
O<br />
N<br />
NH 2<br />
NH 2<br />
DMSO<br />
CH 3<br />
C CH 3<br />
CH 3<br />
C CH 3<br />
CH 3<br />
CH 2<br />
CH 3<br />
tBuO − + N 2<br />
acetone<br />
2-propanone idrazone<br />
propano<br />
Nella prima parte della reazione si prepara l’idrazone, questo viene isolato e poi viene fatto reagire in un<br />
solvente polare aprotico, dimetilsolfossido DMSO, nel quale una base come terzbutossido è molto più<br />
reattiva perché non deve fare legami idrogeno col solvente. Questo permette di eseguire la reazione a<br />
temperatura ambiente.<br />
H<br />
CH 3<br />
C CH 3<br />
N N H<br />
idrazone<br />
− ..<br />
: O ..<br />
H<br />
O<br />
tautomeria<br />
H<br />
N N tBu<br />
CH 3<br />
CH CH 3<br />
tBu<br />
− ..<br />
: O ..<br />
Prof. Mauro Tonellato – ITIS Marconi – Padova <strong>Aldeidi</strong> e chetoni 13<br />
tBu<br />
CH 3<br />
−..<br />
CH CH 3<br />
N N<br />
H<br />
O<br />
tBu<br />
CH 3<br />
CH 2<br />
CH 3<br />
propano
www.pianetachimica.<strong>it</strong><br />
Se l’aldeide o il chetone non sopportano nè l’ambiente acido nè quello basico, si può eseguire la riduzione<br />
operando in assenza di acidi e basi. Si trasforma il carbonile in un tioacetale e si esegue una idrogenazione<br />
catal<strong>it</strong>ica con nichel Raney, polvere di nichel saturata con idrogeno. Lo zolfo viene estratto dalla molecola e<br />
incorporato nel catalizzatore che viene così “avvelenato”. Per questo si usa nichel e non platino!<br />
O<br />
SH<br />
SH<br />
CH 2<br />
CH 2<br />
S<br />
S<br />
Ni Raney<br />
CH 3<br />
C CH 3<br />
CH 3<br />
C CH 3<br />
CH 3<br />
CH 2<br />
CH 3<br />
acetone<br />
2,2-dimetil-1,3-d<strong>it</strong>iolano<br />
(tioacetale)<br />
propano<br />
Ossidazione<br />
Le aldeidi vengono ossidate facilmente ad acidi carbossilici da una varietà di reattivi. Il più utilizzato è forse<br />
il Cr(VI) sotto forma di bicromato in ambiente acquoso acido nel quale si forma acido cromico H 2 CrO 4 . Le<br />
aldeidi reagiscono nella forma idratata come si è visto nel cap<strong>it</strong>olo sugli alcoli. Solo se possiedono dei gruppi<br />
OH, infatti, le aldeidi possono formare esteri dell’acido cromico che sono l’intermedio chiave della reazione<br />
di ossidazione.<br />
O H 2<br />
O / H + OH<br />
H 2<br />
CrO 4<br />
O<br />
CH 3<br />
C<br />
CH 3<br />
C OH CH 3<br />
C<br />
H<br />
H<br />
H<br />
2<br />
SO 4<br />
OH<br />
acetaldeide<br />
acetaldeide<br />
idratata<br />
acido acetico<br />
Ricordiamo brevemente il meccanismo:<br />
O<br />
+<br />
O<br />
OH<br />
+<br />
HO<br />
Cr OH 2<br />
O H<br />
OH<br />
OH Cr<br />
.. O<br />
+ O<br />
CH 3<br />
C<br />
CH 3<br />
C OH<br />
CH 3<br />
C O<br />
H H 2<br />
Ȯ .<br />
.. : H +<br />
..<br />
:<br />
H<br />
H H H 2<br />
Ȯ . :<br />
O OH<br />
OH Cr<br />
+<br />
O<br />
O<br />
O H<br />
E2<br />
CH 3<br />
C O<br />
CH 3<br />
C + Cr<br />
H 2<br />
Ọ .<br />
:<br />
H<br />
OH HO OH<br />
estere dell'acido cromico<br />
L’intermedio è un estere dell’acido cromico che subisce una reazione di eliminazione E2 per produrre il<br />
doppio legame C=O dell’acido carbossilico.<br />
I reattivi di Fehling, Benedict e Tollens ossidano le aldeidi ad acidi carbossilici, vengono usati solo a scopo<br />
anal<strong>it</strong>ico e non preparativo soprattutto coi carboidrati.<br />
Nei saggi di Fehling e Benedict il reattivo ossidante è il Cu 2+ che in ambiente basico ossida le aldeidi ad<br />
acidi carbossilici. Si forma un precip<strong>it</strong>ato rosso mattone di ossido rameoso Cu 2 O che permette di confermare<br />
la presenza di aldeidi.<br />
O<br />
O<br />
CH 3<br />
C<br />
H<br />
+ 2 Cu 2+ + 5 OH − CH 3<br />
C<br />
O −<br />
+ Cu 2<br />
O +<br />
precip<strong>it</strong>ato<br />
rosso mattone<br />
3 H 2<br />
O<br />
Il reattivo di Fehling è composto di due soluzioni da mescolare al momento dell’uso: soluzione A: NaOH e<br />
tartrato di sodio (un complessante del Cu 2+ ); soluzione B: CuSO 4 . Il tartrato impedisce per qualche tempo al<br />
rame di precip<strong>it</strong>are come idrossido e questo consente di eseguire la reazione.<br />
Prof. Mauro Tonellato – ITIS Marconi – Padova <strong>Aldeidi</strong> e chetoni 14
www.pianetachimica.<strong>it</strong><br />
Il reattivo di Benedict, invece, consiste in un’unica soluzione: NaOH, c<strong>it</strong>rato di sodio e CuSO 4 . Si può conservare<br />
senza che il rame precip<strong>it</strong>i come idrossido perchè il c<strong>it</strong>rato è un complessante più forte del tartrato.<br />
Nel saggio di Tollens il reattivo è cost<strong>it</strong>u<strong>it</strong>o da una soluzione ammoniacale di AgNO 3 . Il reagente ossidante è<br />
Ag + che ossida le aldeidi ad acidi carbossilici. Precip<strong>it</strong>a argento metallico che forma uno specchio sulle<br />
pareti di vetro.<br />
O<br />
O<br />
CH 3<br />
C<br />
H<br />
+ 2 Ag + + 3 NH 3 + H 2<br />
O<br />
CH 3<br />
C<br />
O −<br />
+ 2 Ag + 3 NH<br />
+<br />
4<br />
precip<strong>it</strong>ato<br />
a specchio<br />
I chetoni si ossidano solo se viene rotto uno dei legami C−C a ridosso del carbonile, ma per questo servono<br />
condizioni forti di ossidazione. Per esempio il permanganato a caldo attacca il doppio legame degli enoli che<br />
si trovano in equilibrio con i chetoni per tautomeria cheto-enolica. Dato che il chetone può formare l’enolo a<br />
sinistra o a destra del carbonile, si ottengono miscele di prodotti e la reazione è di scarso interesse.<br />
Più interessante è la reazione di Baeyer Villiger cioè l’ossidazione con perossiacidi che trasforma i chetoni<br />
in esteri. Qui vediamo l’ossidazione con acido perossiacetico dell’acetofenone che dà fenil acetato.<br />
O<br />
O<br />
C<br />
CH 3<br />
CH 3<br />
C<br />
O<br />
+ +<br />
O O H<br />
O<br />
C<br />
CH 3<br />
CH 3<br />
C<br />
O<br />
In questa reazione l’ossigeno perossidico del perossiacido (in grassetto e indicato da una freccia) si inserisce<br />
nel legame C−C a fianco del carbonile che così diventa un estere.<br />
La reazione avviene con catalisi acida. Il meccanismo è il seguente:<br />
+<br />
OH<br />
OH<br />
OH<br />
O<br />
C CH 3<br />
C CH<br />
C<br />
3<br />
C CH CH3<br />
H +<br />
3<br />
..<br />
..<br />
+<br />
H O O<br />
O O<br />
O<br />
..<br />
:<br />
OH<br />
O C<br />
O C<br />
CH 3<br />
CH 3<br />
+<br />
OH<br />
: OH<br />
.. OH<br />
C CH 3<br />
O<br />
− H +<br />
C CH 3 O C<br />
O<br />
O C CH 3<br />
trasposizione<br />
O+<br />
CH 3<br />
del fenile<br />
Per chiarezza i due passaggi centrali del meccanismo sono stati mostrati distinti anche se in realtà<br />
l’espulsione dell’acido e la trasposizione avvengono contemporaneamente. Il gruppo che traspone mantiene<br />
la configurazione. Se nel chetone ci sono due gruppi diversi (come nell’esempio) quello che traspone è<br />
prevedibile in base alla seguente gerarchia:<br />
terz-alchile > sec-alchile > > fenile > n-alchile > metile<br />
Nell’esempio qui sopra, quindi, migra il gruppo fenile piuttosto del metile.<br />
OH<br />
Prof. Mauro Tonellato – ITIS Marconi – Padova <strong>Aldeidi</strong> e chetoni 15
www.pianetachimica.<strong>it</strong><br />
Alfa alogenazione<br />
Le aldeidi, trattate con Cl 2 o Br 2 , si ossidano formando acidi carbossilici.<br />
I chetoni enolizzabili, invece, trattati con Cl 2 o Br 2 vengono alogenati in posizione alfa. La reazione procede<br />
in modo molto diverso a seconda che sia condotta in catalisi acida o basica.<br />
O<br />
O<br />
+<br />
C<br />
H 2<br />
O / H<br />
C<br />
H 3<br />
C CH 2<br />
CH 3<br />
+ Cl 2<br />
H 3<br />
C CH CH 3<br />
+ HCl<br />
2-butanone<br />
catalisi<br />
acida<br />
Cl<br />
3-cloro-2-butanone<br />
O<br />
O<br />
−<br />
C<br />
H 2<br />
O / OH C<br />
H 3<br />
C CH 2<br />
CH −<br />
3<br />
+ 3 Cl 2<br />
O CH 2<br />
CH 3<br />
+ CHCl 3<br />
+ 3 Cl −<br />
2-butanone<br />
catalisi<br />
basica propanoato<br />
La veloc<strong>it</strong>à di questa reazione è v = k [chetone] cioè dipende solo dalla concentrazione del chetone, e non<br />
dipende da quella dell’alogeno, questo suggerisce che nello stadio lento si formi l’intermedio enolo e che<br />
questo poi reagisca velocemente con l’alogeno.<br />
Con la catalisi acida si ha la monoalogenazione del chetone dalla parte più sost<strong>it</strong>u<strong>it</strong>a, quindi nella prima<br />
reazione qui sopra si forma 3-cloro-2-butanone e non 1-cloro-2-butanone. Il cloroderivato, inoltre, è meno<br />
reattivo del chetone di partenza (il doppio legame dell’enolo è destabilizzato dal cloro elettronegativo) e<br />
quindi, se si usa una sola mole di Cl 2 , si ha la monoalogenazione. Inoltre, poichè lo stato di transizione è<br />
simile all’enolo, la reazione procede attraverso l’enolo più stabile, cioè quello col doppio legame più<br />
sost<strong>it</strong>u<strong>it</strong>o.<br />
: O:<br />
OH +<br />
OH<br />
H<br />
H<br />
C<br />
+<br />
C<br />
tautomeria C<br />
H 3<br />
C CH CH 3<br />
H O<br />
H 3<br />
C CH CH 3<br />
: O:<br />
H 3<br />
C CH CH 3<br />
H<br />
H<br />
2-butanone<br />
..<br />
: OH<br />
Cl Cl<br />
C<br />
H 3<br />
C CH CH 3<br />
veloce<br />
+<br />
O<br />
H<br />
C<br />
H 3<br />
C CH CH 3<br />
..<br />
: Cl<br />
..<br />
: −<br />
C<br />
H 3<br />
C CH CH 3<br />
Cl<br />
Cl<br />
enolo<br />
meno reattivo del chetone iniziale<br />
Con la catalisi basica si ha la polialogenazione del chetone dalla parte meno sost<strong>it</strong>u<strong>it</strong>a. Lo stato di<br />
transizione non assomiglia ad un enolo, ma ad un anione e dato che gli anioni meno sost<strong>it</strong>u<strong>it</strong>i sono più<br />
stabili, lo strappo dell’H + avviene dal lato meno sost<strong>it</strong>u<strong>it</strong>o. L’intermedio simile ad un anione ha poi un’altra<br />
conseguenza, risulta più stabile se è alogenato (il cloro elettronegativo stabilizza la carica negativa). Quindi il<br />
chetone monoalogenato è più acido (pKa 14) del chetone iniziale e la seconda alogenazione è più veloce<br />
della prima e l’eventuale terza alogenazione (nel caso di metilchetoni) è ancora più veloce.<br />
O<br />
C<br />
H 2<br />
C CH 2<br />
CH 3<br />
H<br />
2-butanone (pKa 20)<br />
Cl<br />
O<br />
− ..<br />
: OH ..<br />
C<br />
HC<br />
CH 2<br />
CH 3<br />
H<br />
chetone monoalogenato (pKa 14)<br />
più acido del chetone iniziale<br />
1^<br />
tautomeria<br />
lenta<br />
−..<br />
: OH ..<br />
O<br />
C<br />
C<br />
H 2<br />
C<br />
.. − CH 2<br />
CH 3<br />
H 2<br />
C CH 2<br />
CH 3<br />
2^<br />
tautomeria<br />
più veloce<br />
Cl<br />
H<br />
enolato<br />
meno sost<strong>it</strong>u<strong>it</strong>o<br />
: O<br />
.. : −<br />
C<br />
HC<br />
CH 2<br />
CH 3<br />
enolato<br />
Prof. Mauro Tonellato – ITIS Marconi – Padova <strong>Aldeidi</strong> e chetoni 16<br />
H<br />
O<br />
..<br />
: O: −<br />
Cl<br />
Cl<br />
enolo<br />
più stabile<br />
Cl<br />
Cl
www.pianetachimica.<strong>it</strong><br />
O<br />
C<br />
Cl C CH 2<br />
CH 3<br />
Cl H<br />
chetone dialogenato<br />
ancora più acido<br />
− ..<br />
: OH ..<br />
3^<br />
tautomeria<br />
ancora<br />
più veloce<br />
Cl<br />
Cl<br />
: O<br />
: −<br />
C<br />
C CH 2<br />
CH 3<br />
enolato<br />
Cl<br />
Cl<br />
O<br />
C<br />
Cl C CH 2<br />
CH 3<br />
Cl Cl<br />
chetone trialogenato<br />
O<br />
CH 3<br />
CH 2<br />
C<br />
O−<br />
ione propanoato<br />
−<br />
− O OH<br />
: OH<br />
.. : .. :<br />
O<br />
..<br />
− C<br />
: OH<br />
..<br />
..<br />
Cl C CH 2<br />
CH 3 CH 3<br />
CH 2<br />
C<br />
Cl Cl<br />
O H<br />
Cl<br />
Cl C: − H OH<br />
Cl<br />
Cl<br />
Cl C H<br />
Cl<br />
cloroformio<br />
Il chetone trialogenato che si forma può perdere un carbonio per idrolisi basica. Infatti il metile trialogenato è<br />
diventato CCl 3 e si è trasformato in un buon gruppo uscente dato che la carica negativa sul carbonio è<br />
stabilizzata per effetto induttivo dai tre atomi di cloro. Si ottiene quindi CCl 3 − e acido propanoico. CCl 3 − si<br />
protona e diventa cloroformio CHCl 3 mentre l’acido, in ambiente basico, forma lo ione carbossilato. Dal<br />
metilchetone originale (2-butanone) abbiamo ottenuto il sale dell’acido propanoico, un acido carbossilico<br />
con un carbonio in meno rispetto al chetone di partenza.<br />
Questa reazione è tipica dei metilchetoni ed è nota come reazione aloformio, il gruppo metilico del chetone<br />
viene perso come cloroformio e il metilchetone diventa un acido carbossilico con un carbonio in meno.<br />
Un tempo la reazione iodoformio veniva usata per il riconoscimento qual<strong>it</strong>ativo dei metilchetoni.<br />
Se, trattando la sostanza incogn<strong>it</strong>a con KI, Cl 2 , NaOH, si osservava la formazione di un precip<strong>it</strong>ato giallo,<br />
iodoformio appunto, allora la sostanza incogn<strong>it</strong>a era un metilchetone. Ecco la reazione nel caso dell’acetone.<br />
O<br />
O<br />
−<br />
C + 4 OH + 6 KI + 3 Cl 2<br />
CH 3<br />
C + CHI 3 + 6 KCl + 3 H 2<br />
O + 3 I −<br />
H 3<br />
C CH 3<br />
O<br />
−<br />
acetone<br />
iodoformio<br />
Il Cl 2 ossida KI formando I 2 , questo viene attaccato dall’intermedio enolato che dopo tre alogenazioni con I 2<br />
perde iodoformio CHI 3 che forma un precip<strong>it</strong>ato giallo.<br />
Prof. Mauro Tonellato – ITIS Marconi – Padova <strong>Aldeidi</strong> e chetoni 17
www.pianetachimica.<strong>it</strong><br />
Addizione e condensazione aldolica<br />
Le aldeidi, se trattate in ambiente acquoso moderatamente basico, danno addizione aldolica, cioè due aldeidi<br />
si sommano tra loro per formare una beta idrossi aldeide chiamata aldolo.<br />
2<br />
CH 3<br />
CH 2<br />
C<br />
propanale<br />
O<br />
H<br />
−<br />
OH<br />
H 2<br />
O<br />
CH 3<br />
CH 2<br />
C<br />
OH<br />
H<br />
CH<br />
CH 3<br />
C<br />
O<br />
H<br />
3-idrossi-2-metilpentanale<br />
β-idrossialdeide<br />
Il carbonio in alfa di un’aldeide si lega al carbonile di una seconda aldeide per formare una molecola con una<br />
catena di carboni più lunga che è chiamata aldolo (aldeide e alcol). Anche questa reazione, come<br />
l’alogenazione, procede attraverso la formazione di enoli. Il primo passaggio della reazione è dunque la<br />
tautomeria cheto enolica catalizzata dalle basi che produce enolati. L’intermedio enolato dà poi una<br />
reazione di addizione nucleofila al carbonile di un’altra aldeide con formazione di un alcossido che<br />
nell’ultimo passaggio si protona formando l’aldolo. La pKa dell’idrogeno in alfa dei chetoni e delle aldeidi è<br />
circa 20, cioè si tratta di un idrogeno 10 25 volte più acido di un normale idrogeno di un alcano che ha pKa<br />
circa 45.<br />
H<br />
CH 3<br />
CH C<br />
O<br />
H<br />
O<br />
−<br />
: OH<br />
..<br />
..<br />
H 2<br />
O<br />
tautomeria<br />
O<br />
−..<br />
CH 3<br />
CH C<br />
H<br />
enolato<br />
.. −<br />
: O:<br />
CH 3<br />
CH C<br />
CH 3<br />
CH 2<br />
C<br />
O CH 3<br />
CH 2<br />
C CH C<br />
CH 3<br />
CH 2<br />
C CH C<br />
.. −<br />
H CH<br />
C<br />
H CH 3<br />
H<br />
H CH 3<br />
H<br />
CH 3<br />
H<br />
Mentre con le aldeidi l’addizione aldolica in ambiente basico è spostata a destra, con i chetoni è spostata a<br />
sinistra e quindi i chetoni formano solo tracce di aldolo (a freddo) perchè il carbonile dei chetoni è meno<br />
reattivo sia per l’effetto induttivo dei sost<strong>it</strong>uenti che per l’ingombro sterico che destabilizza i prodotti.<br />
Se la reazione, però, viene condotta in ambiente acido, anche i chetoni reagiscono e danno condensazione<br />
aldolica (cioè addizione ed eliminazione). Infatti il beta idrossi chetone che si forma in minima quant<strong>it</strong>à<br />
espelle una molecola d’acqua producendo un chetone alfa beta insaturo, che si sottrae all’equilibrio e trascina<br />
a destra la reazione.<br />
La condensazione in ambiente acido di aldeidi e chetoni produce composti carbonilici alfa beta insaturi e<br />
viene chiamata condensazione aldolica. La condensazione può avvenire anche in ambiente basico se si<br />
conduce la reazione a temperatura elevata, a 80 - 100 °C.<br />
O<br />
H<br />
O<br />
−<br />
H<br />
OH<br />
OH<br />
O<br />
2<br />
O<br />
OH O<br />
H + H +<br />
CH 3<br />
CH 2<br />
C<br />
CH 3<br />
CH 2<br />
C CH C<br />
CH 3<br />
CH 2<br />
C C<br />
H<br />
CH 2<br />
O<br />
− H<br />
3 CH CH 2<br />
O<br />
3<br />
CH 3 3<br />
CH 3<br />
CH 3<br />
C<br />
O<br />
CH 3<br />
2-butanone<br />
β-idrossichetone<br />
(tracce)<br />
chetone alfa-beta insaturo<br />
Il meccanismo di reazione inizia con la tautomeria cheto enolica catalizzata dagli acidi:<br />
..<br />
O:<br />
OH<br />
H + +<br />
tautomeria<br />
OH<br />
CH 3<br />
CH 2<br />
C<br />
CH 3<br />
CH C<br />
CH 3<br />
CH C<br />
H<br />
CH 2<br />
O<br />
H :<br />
3 H<br />
CH 2<br />
Ọ .<br />
3<br />
CH 3<br />
2-butanone<br />
enolo<br />
Prof. Mauro Tonellato – ITIS Marconi – Padova <strong>Aldeidi</strong> e chetoni 18
www.pianetachimica.<strong>it</strong><br />
L’enolo attacca il chetone protonato con una addizione nucleofila:<br />
CH 3<br />
CH 2<br />
C<br />
+<br />
OH<br />
CH<br />
CH 3 CH 3<br />
C<br />
: OH<br />
.. +<br />
OH OH<br />
CH 3<br />
CH 2<br />
C<br />
CH<br />
CH 3 CH 3<br />
CH 3<br />
C<br />
beta idrossi chetone<br />
(tracce)<br />
Il beta idrossi chetone perde il gruppo OH in modo estremamente facile. Bisogna quindi invocare un<br />
meccanismo diverso da quello della normale disidratazione degli alcoli che invece avviene con difficoltà e<br />
richiede 150 °C e H 2 SO 4 concentrato.<br />
L’H + in posizione alfa in questa molecola può essere strappato facilmente grazie alla tautomeria cheto<br />
enolica. Il beta idrossi enolo che si forma può espellere acqua invece di ricreare il chetone. La reazione è<br />
favor<strong>it</strong>a anche dal fatto che la molecola finale, il chetone alfa beta insaturo, ha il doppio legame coniugato<br />
col carbonile, quindi è stabilizzato per risonanza.<br />
CH 3<br />
CH 2<br />
C<br />
OH<br />
CH 3<br />
H<br />
C<br />
CH 3<br />
C<br />
+<br />
OH<br />
beta idrossi chetone<br />
(tracce)<br />
CH 3<br />
H 2<br />
Ȯ .<br />
:<br />
tautomeria<br />
OH<br />
CH 3<br />
CH 2<br />
C<br />
C<br />
CH 3<br />
CH 3<br />
beta idrossi enolo<br />
(tracce)<br />
+<br />
OH 2 : OH<br />
..<br />
+<br />
−<br />
OH<br />
H<br />
O<br />
2<br />
O<br />
CH 3<br />
CH 2<br />
C C C<br />
CH 3<br />
CH 2<br />
C C C<br />
CH 3<br />
CH 2<br />
C C C<br />
CH CH CH<br />
3 3<br />
3<br />
CH CH<br />
3<br />
CH 3 3<br />
CH CH<br />
3<br />
CH 3 3<br />
beta idrossi enolo<br />
(tracce)<br />
C<br />
OH<br />
CH 3<br />
H +<br />
CH 3<br />
chetone alfa-beta insaturo<br />
3,4-dimetiles-3-en-2-one<br />
Le aldeidi che non possiedono alfa idrogeni non sono enolizzabili e quindi non possono dare addizione<br />
aldolica. Questi sono tre esempi:<br />
H<br />
O<br />
C<br />
H<br />
O<br />
C<br />
H<br />
C H 3<br />
CH 3<br />
C<br />
O<br />
C<br />
CH 3<br />
formaldeide benzaldeide 2,2-dimetilpropanale<br />
Tuttavia se queste aldeidi vengono trattate in ambiente molto basico si rivelano instabili e vanno incontro ad<br />
una reazione di ossidoriduzione interna, una dismutazione conosciuta come reazione di Cannizzaro.<br />
O<br />
H<br />
O<br />
OH<br />
2<br />
C<br />
H<br />
−<br />
OH<br />
H 2<br />
O<br />
H 2<br />
O / H +<br />
C<br />
OH<br />
+<br />
CH 2<br />
benzaldeide acido benzoico alcol benzilico<br />
Prof. Mauro Tonellato – ITIS Marconi – Padova <strong>Aldeidi</strong> e chetoni 19
www.pianetachimica.<strong>it</strong><br />
La reazione procede per trasferimento di uno ione idruro dal dianione di un’aldeide idratata ad un’altra<br />
aldeide. Dopo neutralizzazione si ottiene un acido carbossilico ed un alcol.<br />
Il meccanismo è il seguente:<br />
O<br />
C : OH<br />
.. −<br />
−<br />
O : OH<br />
.. −<br />
O<br />
−<br />
H ..<br />
..<br />
−<br />
C OH<br />
C O<br />
benzaldeide<br />
: O<br />
.. : − −<br />
C O<br />
H<br />
O<br />
C<br />
H<br />
trasferimento<br />
di idruro<br />
C<br />
H<br />
dianione<br />
H<br />
O − H<br />
dianione<br />
L’addizione aldolica tra aldeidi diverse è chiamata addizione aldolica incrociata, questa reazione porta in<br />
generale a miscele di prodotti a causa del fatto che un’aldeide può addizionarsi sia con sè stessa che con<br />
l’altra aldeide. Quindi, da due aldeidi A e B, si possono ottenere i prodotti AA, BB, AB, BA.<br />
Se tuttavia la reazione avviene tra un’aldeide che può solo essere attaccata ma non è capace di attaccare<br />
(un’aldeide non enolizzabile) e un chetone che può solo attaccare, ma non può essere attaccato (i chetoni<br />
non si addizionano in ambiente basico perchè il loro carbonile è poco reattivo), allora la reazione procede<br />
con successo.<br />
O<br />
C<br />
benzaldeide<br />
H<br />
+<br />
O<br />
−<br />
C<br />
OH<br />
H 3<br />
C CH 3<br />
H 2<br />
O<br />
O<br />
+<br />
O<br />
H<br />
CH CH C CH 3<br />
acetone 4-fenil-but-3-en-2-one<br />
Notate che in questa reazione, nonostante l’ambiente basico, si è ottenuto un chetone alfa beta insaturo.<br />
Questo è dovuto al fatto che il doppio legame è particolarmente stabilizzato non solo dal carbonile, ma anche<br />
dalla coniugazione con l’anello benzenico. In questo caso è molto difficile impedire la disidratazione<br />
dell’aldolo.<br />
Si può avere addizione aldolica incrociata anche tra un chetone ed una aldeide qualsiasi, a patto di far<br />
reagire l’aldeide con un grande eccesso dell’enolato del chetone. Questo si realizza trattando il chetone con<br />
una base molto forte come LDA (l<strong>it</strong>io diisppropilammide, pKa 36) che lo trasforma tutto nel suo enolato e<br />
poi aggiungendo goccia a goccia l’aldeide. Questa non ha il tempo di trasformarsi in enolato, ma reagisce<br />
con l’eccesso di enolato del chetone che trova in soluzione.<br />
O<br />
CH 3<br />
CH 2<br />
C<br />
O<br />
LDA<br />
H<br />
H 2<br />
O<br />
C<br />
C<br />
H 3<br />
C CH 3 THF H 2<br />
C<br />
.. CH 3<br />
−<br />
O<br />
OH<br />
CH 3<br />
CH 2<br />
CH<br />
−<br />
O<br />
C<br />
O<br />
CH 2<br />
C<br />
CH 3<br />
acetone<br />
enolato dell'acetone<br />
4-idrossiesan-2-one<br />
Prof. Mauro Tonellato – ITIS Marconi – Padova <strong>Aldeidi</strong> e chetoni 20
www.pianetachimica.<strong>it</strong><br />
Reazione con LDA, l<strong>it</strong>io diisopropil ammide<br />
LDA, l<strong>it</strong>io diisopropil ammide, si prepara per trattamento di diisopropil ammina con butill<strong>it</strong>io o con l<strong>it</strong>io<br />
metallico:<br />
H<br />
N<br />
+<br />
Li<br />
THF .. − Li+<br />
N<br />
.. +<br />
diisopropil ammina butill<strong>it</strong>io<br />
LDA<br />
butano<br />
E una base molto forte (pKa 36) ma ingombrata a causa dei due sost<strong>it</strong>uenti isopropilici che le impediscono di<br />
agire da nucleofilo, per questo nelle reazioni si comporta solo da base senza attaccare il carbonile.<br />
Il trattamento di un chetone (pKa 20) con una base molto forte (pKa 36) ma ingombrata, come LDA, lo<br />
trasforma al 100% nel suo enolato. Questo è nucleofilo e può essere fatto reagire con una varietà di<br />
molecole. Nella pagina precedente abbiamo visto che può reagire con una aldeide, ma può reagire anche con<br />
alogenuri alchilici (metilici o primari) e con cloruri acilici.<br />
Nella reazione di un chetone con LDA e poi con un cloruro alchilico si ottiene un chetone con una catena<br />
di atomi di carbonio più lunga. Se il chetone è asimmetrico, la carica negativa si forma dalla parte meno<br />
sost<strong>it</strong>u<strong>it</strong>a se la reazione viene condotta a bassa temperatura -70 °C, cioè sotto controllo cinetico.<br />
Cl<br />
O<br />
O CH 3<br />
CH 2<br />
CH O<br />
LDA<br />
2<br />
C<br />
C<br />
CH 3<br />
CH 2<br />
CH 2<br />
CH 2<br />
C CH 3<br />
H 3<br />
C CH 3 THF H 2<br />
C CH 3<br />
.. −<br />
acetone<br />
enolato dell'acetone<br />
esan-2-one<br />
Trattando un chetone con LDA e poi con un cloruro acilico si ottiene un b dichetone:<br />
O<br />
O CH 3<br />
CH 2<br />
C<br />
O O<br />
LDA<br />
Cl<br />
C<br />
C<br />
CH 3<br />
CH 2<br />
C CH 2<br />
C<br />
H 3<br />
C CH 3 THF H 2<br />
C<br />
.. CH 3<br />
−<br />
esan-2,4-dione<br />
O<br />
CH 3<br />
acetone<br />
enolato dell'acetone<br />
Prof. Mauro Tonellato – ITIS Marconi – Padova <strong>Aldeidi</strong> e chetoni 21