impiego dell'alga verde chlamydomonas reinhardtii per la ... - CIRIAF
impiego dell'alga verde chlamydomonas reinhardtii per la ... - CIRIAF
impiego dell'alga verde chlamydomonas reinhardtii per la ... - CIRIAF
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
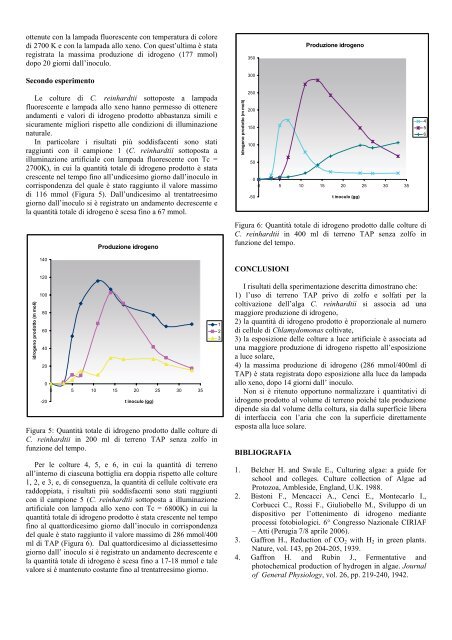
ottenute con <strong>la</strong> <strong>la</strong>mpada fluorescente con tem<strong>per</strong>atura di coloredi 2700 K e con <strong>la</strong> <strong>la</strong>mpada allo xeno. Con quest’ultima è stataregistrata <strong>la</strong> massima produzione di idrogeno (177 mmol)dopo 20 giorni dall’inoculo.Secondo es<strong>per</strong>imento350300Produzione idrogenoLe colture di C. <strong>reinhardtii</strong> sottoposte a <strong>la</strong>mpadafluorescente e <strong>la</strong>mpada allo xeno hanno <strong>per</strong>messo di ottenereandamenti e valori di idrogeno prodotto abbastanza simili esicuramente migliori rispetto alle condizioni di illuminazionenaturale.In partico<strong>la</strong>re i risultati più soddisfacenti sono statiraggiunti con il campione 1 (C. <strong>reinhardtii</strong> sottoposta ailluminazione artificiale con <strong>la</strong>mpada fluorescente con Tc =2700K), in cui <strong>la</strong> quantità totale di idrogeno prodotto è statacrescente nel tempo fino all’undicesimo giorno dall’inoculo incorrispondenza del quale è stato raggiunto il valore massimodi 116 mmol (Figura 5). Dall’undicesimo al trentatreesimogiorno dall’inoculo si è registrato un andamento decrescente e<strong>la</strong> quantità totale di idrogeno è scesa fino a 67 mmol.idrogeno prodotto (m moli)2502001501005000 5 10 15 20 25 30 35-50t inoculo (gg)456idrogeno prodotto (m moli)14012010080604020-20Produzione idrogeno00 5 10 15 20 25 30 35t inoculo (gg)Figura 5: Quantità totale di idrogeno prodotto dalle colture diC. <strong>reinhardtii</strong> in 200 ml di terreno TAP senza zolfo infunzione del tempo.Per le colture 4, 5, e 6, in cui <strong>la</strong> quantità di terrenoall’interno di ciascuna bottiglia era doppia rispetto alle colture1, 2, e 3, e, di conseguenza, <strong>la</strong> quantità di cellule coltivate eraraddoppiata, i risultati più soddisfacenti sono stati raggiunticon il campione 5 (C. <strong>reinhardtii</strong> sottoposta a illuminazioneartificiale con <strong>la</strong>mpada allo xeno con Tc = 6800K) in cui <strong>la</strong>quantità totale di idrogeno prodotto è stata crescente nel tempofino al quattordicesimo giorno dall’inoculo in corrispondenzadel quale è stato raggiunto il valore massimo di 286 mmol/400ml di TAP (Figura 6). Dal quattordicesimo al diciassettesimogiorno dall’ inoculo si è registrato un andamento decrescente e<strong>la</strong> quantità totale di idrogeno è scesa fino a 17-18 mmol e talevalore si è mantenuto costante fino al trentatreesimo giorno.123Figura 6: Quantità totale di idrogeno prodotto dalle colture diC. <strong>reinhardtii</strong> in 400 ml di terreno TAP senza zolfo infunzione del tempo.CONCLUSIONII risultati del<strong>la</strong> s<strong>per</strong>imentazione descritta dimostrano che:1) l’uso di terreno TAP privo di zolfo e solfati <strong>per</strong> <strong>la</strong>coltivazione dell’alga C. <strong>reinhardtii</strong> si associa ad unamaggiore produzione di idrogeno,2) <strong>la</strong> quantità di idrogeno prodotto è proporzionale al numerodi cellule di Ch<strong>la</strong>mydomonas coltivate,3) <strong>la</strong> esposizione delle colture a luce artificiale è associata aduna maggiore produzione di idrogeno rispetto all’esposizionea luce so<strong>la</strong>re,4) <strong>la</strong> massima produzione di idrogeno (286 mmol/400ml diTAP) è stata registrata dopo esposizione al<strong>la</strong> luce da <strong>la</strong>mpadaallo xeno, dopo 14 giorni dall’ inoculo.Non si è ritenuto opportuno normalizzare i quantitativi diidrogeno prodotto al volume di terreno poiché tale produzionedipende sia dal volume del<strong>la</strong> coltura, sia dal<strong>la</strong> su<strong>per</strong>ficie liberadi interfaccia con l’aria che con <strong>la</strong> su<strong>per</strong>ficie direttamenteesposta al<strong>la</strong> luce so<strong>la</strong>re.BIBLIOGRAFIA1. Belcher H. and Swale E., Culturing algae: a guide forschool and colleges. Culture collection of Algae adProtozoa, Ambleside, Eng<strong>la</strong>nd, U.K. 1988.2. Bistoni F., Mencacci A., Cenci E., Montecarlo I.,Corbucci C., Rossi F., Giuliobello M., Sviluppo di undispositivo <strong>per</strong> l’ottenimento di idrogeno medianteprocessi fotobiologici. 6° Congresso Nazionale <strong>CIRIAF</strong>– Atti (Perugia 7/8 aprile 2006).3. Gaffron H., Reduction of CO 2 with H 2 in green p<strong>la</strong>nts.Nature, vol. 143, pp 204-205, 1939.4. Gaffron H. and Rubin J., Fermentative andphotochemical production of hydrogen in algae. Journalof General Physiology, vol. 26, pp. 219-240, 1942.