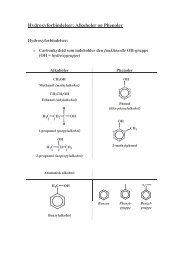
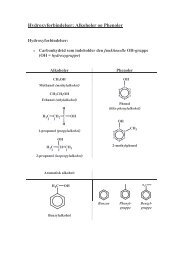
Atomer: Elektronkonfiguration og Orbitaler.
Atomer: Elektronkonfiguration og Orbitaler.
Atomer: Elektronkonfiguration og Orbitaler.
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
<strong>Atomer</strong>: <strong>Elektronkonfiguration</strong> <strong>og</strong> <strong>Orbitaler</strong>.<br />
I kemi C så du at atomernes elektroner befinder sig i skaller<br />
rundt om atomkernen <strong>og</strong> vi har tegnet skallerne som<br />
kugleformede elektronskyer - dvs. områder hvor der er en<br />
stor sandsynlighed for at elektronen befinder sig:<br />
I forbindelse med omtalen af oktetreglen <strong>og</strong> af ledige<br />
elektronpar, blev det <strong>og</strong>så nævnt at elektroner hører<br />
sammen to <strong>og</strong> to i elektronpar.<br />
F.eks. dannes en kovalent binding af to elektroner - én fra hvert atom:<br />
H<br />
CH4<br />
H<br />
C H<br />
H<br />
H<br />
H C x<br />
x<br />
x<br />
H<br />
x<br />
H<br />
H<br />
H<br />
NH3<br />
x<br />
H<br />
x<br />
N<br />
x<br />
H<br />
H<br />
N<br />
H<br />
Side 1 af 4<br />
H<br />
H2O<br />
O<br />
H<br />
x<br />
H O<br />
x<br />
H<br />
I det følgende skal vi se nærmere på opbygningen af elektronstrukturen omkring en<br />
atomkerne, <strong>og</strong> hvorfor elektronerne altid forsøger at danne elektronpar.<br />
Det er måske ikke så mærkeligt at elektronerne i den<br />
inderste skal gerne vil være et par - der er jo kun plads til 2<br />
elektroner.<br />
I den næste skal er der plads til 8 elektroner <strong>og</strong> der er ikke<br />
umiddelbart n<strong>og</strong>en grund til at de holder sammen parvis,<br />
men ....<br />
Skal nr. Betegnelse Antal e -<br />
1 K 2<br />
2 L 8<br />
3 M 18<br />
4 N 32<br />
5 O 50<br />
2n 2 elektroner i skal nr. n<br />
nærmere undersøgelser har vist at skallerne er opdelt i undergrupper som kaldes<br />
orbitaler.
I den inderste skal er der én orbital <strong>og</strong> elektronskyen er<br />
kugleformet med plads til 2 elektroner. Denne type orbital<br />
kaldes en "s" orbital <strong>og</strong> i dette tilfælde betegnes den 1s<br />
fordi den hører til skal nr. 1.<br />
I L-skallen er der plads til 8 elektroner som viser sig at<br />
være fordelt mellem to typer orbitaler: s <strong>og</strong> p.<br />
s orbitalen er ligesom før kugleformet <strong>og</strong> kaldes 2s fordi<br />
den hører til skal nr. 2, <strong>og</strong> der er kun plads til 2 elektroner.<br />
De sidste 6 elektroner hører til en p orbital som er opdelt i<br />
tre sløjfer, hver med plads til 2 elektroner - ialt 6. De tre<br />
sløjfer er vinkelret på hinanden som vist på figuren.<br />
Tilsammen er der i de to orbitaler altså plads til 8<br />
elektroner som skalmodellen forudsagde.<br />
I de næste skaller er der plads til flere orbitaler:<br />
d-orbitaler med plads til 10 elektroner <strong>og</strong> f-orbitaler med<br />
plads til 14 elektroner.<br />
Disse er ligesom p-orbitalerne opdelt i underorbitaler, hver<br />
med plads til 2 elektroner.<br />
Ialt er der derfor plads til det antal elektroner i M <strong>og</strong> N<br />
skallerne, som er angive i tabellen til højre.<br />
Symmetrien af d <strong>og</strong> f orbitalerne er ikke vist, men hvis du<br />
stadig ikke har fået nok af orbitaler, så prøv denne webside:<br />
Kemi A Noter<br />
<strong>og</strong> find linket til "Grand orbital table by manthey".<br />
eller prøv "Levende orbitaler" hvis du vil have lidt mere<br />
indflydelse på hvad du ser.<br />
Side 2 af 4<br />
Kskal <br />
Lskal<br />
M: 3s<br />
3p<br />
3d<br />
N: 4s<br />
4p<br />
4d<br />
4f<br />
Vi mangler stadig en forklaring på hvorfor elektroner gerne vil optræde parvis.<br />
y<br />
y<br />
y<br />
z<br />
z<br />
z<br />
2<br />
6<br />
10<br />
18<br />
2<br />
6<br />
10<br />
14<br />
32<br />
x<br />
x<br />
x<br />
1s<br />
orbital<br />
2s<br />
orbital<br />
2px<br />
orbital<br />
2py<br />
orbital<br />
2pz<br />
orbital<br />
Elektroner har en negativ elektrisk ladning <strong>og</strong> vil derfor opføre sig som en magnet når den<br />
roterer - jeres fysiklærere vil sikkert sætte stor pris på spørgsmål om hvorfor :)<br />
Orienteringen af magneten - altså i hvilken retning polerne peger, afhænger af<br />
omløbsretningen som illustreret på figuren øverst på næste side:
N<br />
N<br />
S<br />
De to tilstande elektronerne kan være i angives med pile i små<br />
kasser <strong>og</strong> betegnes "spin op" <strong>og</strong> "spin ned".<br />
Man kan sige at de to tilstande, "spin op" <strong>og</strong> "spin ned", passer<br />
sammen som to magneter som vist på figuren ved siden af, <strong>og</strong><br />
elektronerne vil derfor gerne hænge sammen to <strong>og</strong> to.<br />
I princippet kan man godt sætte flere elektroner sammen ifølge<br />
denne "magnetmodel", men det er ikke observeret i naturen.<br />
<strong>Elektronkonfiguration</strong> <strong>og</strong> det periodiske system.<br />
I det periodiske system stiger antallet af elektroner omkring kernen, med atomnummeret.<br />
Generelt anbringes elektronerne i skaller <strong>og</strong> orbitaler på en sådan måde at elektronens<br />
energi er lavest mulig. Det betyder at orbitalerne fyldes med elektroner i rækkefølgen s, p,<br />
d, f etc. - i det mindste så længe der er tale om de lettere grundstoffer. Ved store<br />
atomnumre er der afvigelser som vi skal se.<br />
Eksempler fra det udleverede periodiske system:<br />
Al har:<br />
2 e - i 1s orbitalen<br />
2 e - i 2s orbitalen<br />
6 e - i 2p orbitalen<br />
2 e - i 3s orbitalen<br />
1 e - i 3p orbitalen<br />
K<br />
L<br />
M<br />
N<br />
Side 3 af 4<br />
S<br />
S<br />
N<br />
S<br />
N<br />
N S<br />
Al 26,98 Si 28,09 P 30,97 S 32,06 Cl 35,45 Ar 39,95<br />
Aluminium Silicium Phosphor Svovl Chlor Argon<br />
13 1,61 14 1,90 15 2,19 16 2,58 17 3,16 18 -<br />
3 4 ±3,5,4 ±2,4,6 ±1,3,5,7 -<br />
s p d f s p d f s p d f s p d f s p d f s p d f<br />
2 2 2 2 2 2<br />
2 6 2 6 2 6 2 6 2 6 2 6<br />
2 1 2 2 2 3 2 4 2 5 2 6<br />
svarende til at Al i alt har 13 elektroner, heraf 3 i den yderste skal (hovedgruppe 3). Da<br />
den yderste skal er nummer 3, står Al i periode 3.
Da de to inderste skaller <strong>og</strong> s orbitalen i tredje skal, er fulde, fyldes der elektroner i p<br />
orbitalen i skal 3 efterhånden som atomnummeret stiger. Det er hovedsagelig elektronerne<br />
i p-orbitalerne i den yderste skal som bestemmer de kemiske egenskaber.<br />
Når det drejer sig om undergruppe<br />
metallerne, er forholdene<br />
lidt anderledes mht. påfyldning<br />
af elektroner.<br />
Her fyldes der elektroner i<br />
enten 4s eller 3d orbitalerne,<br />
afhængigt af hvilken mulig-<br />
Sc 44,95 Ti 47,90 V 50,94 Cr 52,00 Mn 54,94 Fe 55,85<br />
Scandium Titan Vanadium Chrom Mangan Jern<br />
21 1,36 22 1,54 23 1,63 24 1,66 25 1,55 26 1,83<br />
3 4,3 5,4,3,2 6,3,2 7,6,4,2,3 2,3<br />
s p d f s p d f s p d f s p d f s p d f s p d f<br />
2 2 2 2 2 2<br />
2 6 2 6 2 6 2 6 2 6 2 6<br />
2 6 1 2 6 2 2 6 3 2 6 5 2 6 5 2 6 6<br />
2 2 2 1 2 2<br />
hed der giver elektronen den laveste energi. Der fyldes altså elektroner i to forskellige<br />
skaller, <strong>og</strong> i dette tilfælde er det altså elektronerne i de to yderste skaller der bestemmer<br />
de kemiske egenskaber.<br />
<strong>Elektronkonfiguration</strong>en kan angives på flere forskellige måder. Hvis vi f.eks. bruger Fe<br />
som eksempel, kan man vælge at angive elektronkonfigurationen som en tabel, som vist i<br />
udsnittet fra det periodiske system. Kortere <strong>og</strong> mere almindelige måder er:<br />
1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2<br />
1s 2 2s 2 p 6 3s 2 p 6 d 6 4s 2<br />
[Ar]3d 6 4s 2<br />
hvor den sidste angivelse betyder at Fe har samme elektronkonfiguration som Ar (det<br />
foregående ædelgasatom) plus 6 elektroner i 3d-orbitalen, <strong>og</strong> 2 elektroner i 4s-orbitalen.<br />
Grunden til at der fyldes elektroner i én d-orbital ad gangen, indtil der er én elektron i hver,<br />
<strong>og</strong> først derefter nummer to i den d-orbitalen med den laveste energi, er Hunds Regel:<br />
<strong>Orbitaler</strong> med samme energi, fyldes op med elektroner, så der dannes flest mulige<br />
parallelle spin.<br />
Ar ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↑ ↑ ↑ ↑ ↓<br />
3s 3px 3py 3pz 3dxy 3dyz 3dzx 3dx 2 y 2 3dz 2<br />
Figuren nedenunder viser hvilke orbitaler der fyldes op svarende til at det periodiske<br />
system opdeles i blokke.<br />
I VIII<br />
1.Periode<br />
2.Periode<br />
II III IV V VI VII s-blok<br />
3.Periode IIIA IVA VA VIA VIIA VIIIA IB IIB<br />
4.Periode<br />
5.Periode<br />
6.Periode<br />
7.Periode<br />
s-blok<br />
d-blok<br />
p-blok<br />
6.Periode<br />
7.Periode<br />
f-blok<br />
Side 4 af 4<br />
4s 2