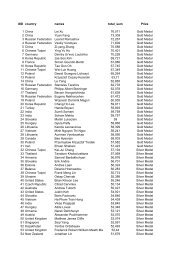
Kjemi OL Norsk finale
Kjemi OL Norsk finale
Kjemi OL Norsk finale
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
Tabellverdier og formlerKonstanter Faradays konstant : F = 96485 C mol -1Gasskonstanten : R = 8,315 J K -1 mol -1 alternativtR = 0,08206 L atm K -1 mol -1Plancks konstant : h = 6,626 • 10 -34 JsNernsts ligningBraggs lovRT 0 ln0 Q0,0592alternativt lg Q , 25CnFn2d sin = n (n=1)Termodynamiske sammenhengerH = U + (pV)G = H - T SG = -n F EG = - R T ln KAntall dobbeltbindingsekvivalenter:(NB! halogen teller som hydrogen)CaHbOcNd(2a 2) (b d)DBE 2Utvalgte omtrentlige 1 H-frekvensområder i NMR :Metylgrupper –R–CH 3 0,8 – 1,2 ppmMetylengrupper –R–CH 2 –R– 1,0 – 1,5 ppmMethingrupper –R–C(R)H–R– 1,2 – 1,8 ppmAllyl (nabo til dobbeltbinding) –C=C–CH– 1,5 – 2.0 ppm–R–CH 2 –CO–C/O (nabo til karbonyl)2 – 3 ppm–R–CXH 2 hvor X=halogen2 – 4 ppm–R–CH 2 –O– (nabo til eter)3 – 4 ppmVinyl (sitter på dobbeltbinding) –C=C–H 4 – 6 ppmAromatiske protoner6 – 9 ppmAldehyd (kan være svakt signal)9 – 10 ppmIntegrerte hastighetslover : 0. ordens reaksjon [A] (t) = -k t + [A] 01. ordens reaksjon ln [A] (t) = ln [A] 0 - k t2. ordens reaksjon 1 / [A] (t) = 1 / [A] 0 + k tHalveringstider :0. ordens reaksjon t ½ = [A] 0 / 2 k1. ordens reaksjon t ½ = ln 2 / k2. ordens reaksjon t ½ = 1 / (k [A] 0 )