termoquimica
termoquimica
termoquimica
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
Prof. Agamenon Roberto TERMOQUÍMICA www.agamenonquimica.com<br />
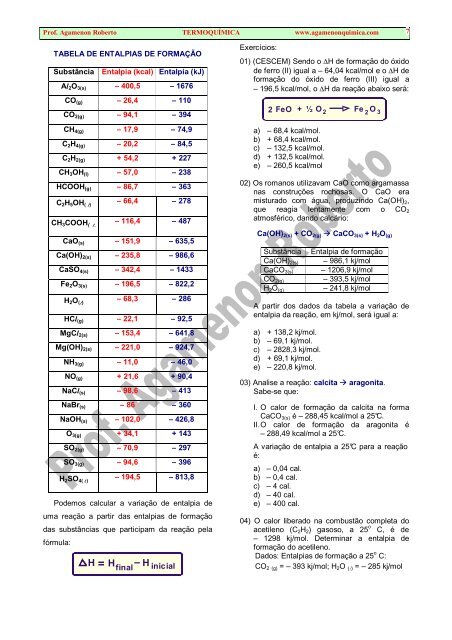
TABELA DE ENTALPIAS DE FORMAÇÃO<br />
Substância Entalpia (kcal) Entalpia (kJ)<br />
Al2O3(s) – 400,5 – 1676<br />
CO(g) – 26,4 – 110<br />
CO2(g) – 94,1 – 394<br />
CH4(g) – 17,9 – 74,9<br />
C2H4(g) – 20,2 – 84,5<br />
C2H2(g) + 54,2 + 227<br />
CH3OH(l) – 57,0 – 238<br />
HCOOH(g) – 86,7 – 363<br />
C2H5OH( ℓ) – 66,4 – 278<br />
CH3COOH( ℓ⌢ – 116,4 – 487<br />
CaO(s) – 151,9 – 635,5<br />
Ca(OH)2(s) – 235,8 – 986,6<br />
CaSO4(s) – 342,4 – 1433<br />
Fe2O3(s) – 196,5 – 822,2<br />
H2O(ℓ) – 68,3 – 286<br />
HCl(g) – 22,1 – 92,5<br />
MgCl2(s) – 153,4 – 641,8<br />
Mg(OH)2(s) – 221,0 – 924,7<br />
NH3(g) – 11,0 – 46,0<br />
NO(g) + 21,6 + 90,4<br />
NaCl(s) – 98,6 – 413<br />
NaBr(s) – 86 – 360<br />
NaOH(s) – 102,0 – 426,8<br />
O3(g) + 34,1 + 143<br />
SO2(g) – 70,9 – 297<br />
SO3(g) – 94,6 – 396<br />
H2SO4( ℓ) – 194,5 – 813,8<br />
Podemos calcular a variação de entalpia de<br />
uma reação a partir das entalpias de formação<br />
das substâncias que participam da reação pela<br />
fórmula:<br />
H = H - H<br />
final inicial<br />
Exercícios:<br />
01) (CESCEM) Sendo o ∆H de formação do óxido<br />
de ferro (II) igual a – 64,04 kcal/mol e o ∆H de<br />
formação do óxido de ferro (III) igual a<br />
– 196,5 kcal/mol, o ∆H da reação abaixo será:<br />
2 FeO + O Fe O<br />
a) – 68,4 kcal/mol.<br />
b) + 68,4 kcal/mol.<br />
c) – 132,5 kcal/mol.<br />
d) + 132,5 kcal/mol.<br />
e) – 260,5 kcal/mol<br />
½ 2<br />
2 3<br />
02) Os romanos utilizavam CaO como argamassa<br />
nas construções rochosas. O CaO era<br />
misturado com água, produzindo Ca(OH)2,<br />
que reagia lentamente com o CO2<br />
atmosférico, dando calcário:<br />
Ca(OH)2(s) + CO2(g) � CaCO3(s) + H2O(g)<br />
Substância Entalpia de formação<br />
Ca(OH)2(s) – 986,1 kj/mol<br />
CaCO3(s) – 1206,9 kj/mol<br />
CO2(g)<br />
– 393,5 kj/mol<br />
– 241,8 kj/mol<br />
H2O(g)<br />
A partir dos dados da tabela a variação de<br />
entalpia da reação, em kj/mol, será igual a:<br />
a) + 138,2 kj/mol.<br />
b) – 69,1 kj/mol.<br />
c) – 2828,3 kj/mol.<br />
d) + 69,1 kj/mol.<br />
e) – 220,8 kj/mol.<br />
03) Analise a reação: calcita � aragonita.<br />
Sabe-se que:<br />
I. O calor de formação da calcita na forma<br />
CaCO3(s) é – 288,45 kcal/mol a 25°C.<br />
II. O calor de formação da aragonita é<br />
– 288,49 kcal/mol a 25°C.<br />
A variação de entalpia a 25°C para a reação<br />
é:<br />
a) – 0,04 cal.<br />
b) – 0,4 cal.<br />
c) – 4 cal.<br />
d) – 40 cal.<br />
e) – 400 cal.<br />
04) O calor liberado na combustão completa do<br />
acetileno (C2H2) gasoso, a 25 o C, é de<br />
– 1298 kj/mol. Determinar a entalpia de<br />
formação do acetileno.<br />
Dados: Entalpias de formação a 25 o C:<br />
CO2 (g) = – 393 kj/mol; H2O (ℓ) = – 285 kj/mol<br />
7