Roberta Lyrio Santos Neves Avaliação da ... - NIMA - PUC-Rio
Roberta Lyrio Santos Neves Avaliação da ... - NIMA - PUC-Rio
Roberta Lyrio Santos Neves Avaliação da ... - NIMA - PUC-Rio
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
A-PDF Merger DEMO : Purchase from www.A-PDF.com to remove the watermark<br />
<strong>Roberta</strong> <strong>Lyrio</strong> <strong>Santos</strong> <strong>Neves</strong><br />
Avaliação <strong>da</strong> contaminação de óleo no ambiente<br />
estuarino <strong>da</strong> Baía de Guanabara (RJ) pela determinação<br />
fluorimétrica de Hidrocarbonetos Policíclicos<br />
Aromáticos (HPAs) na bílis de peixes Mugil liza<br />
Dissertação de Mestrado<br />
Dissertação apresenta<strong>da</strong> ao Programa de Pósgraduação<br />
em Química <strong>da</strong> <strong>PUC</strong>-<strong>Rio</strong> como requisito<br />
parcial para obtenção do grau de Mestre em<br />
Química Analítica.<br />
Orientadores: Prof. <strong>Roberta</strong> Lourenço Ziolli<br />
Prof. Terezinha Ferreira de Oliveira<br />
<strong>Rio</strong> de Janeiro<br />
fevereiro de 2006
<strong>Roberta</strong> <strong>Lyrio</strong> <strong>Santos</strong> <strong>Neves</strong><br />
Avaliação <strong>da</strong> contaminação de óleo no ambiente<br />
estuarino <strong>da</strong> Baía de Guanabara (RJ) pela<br />
determinação fluorimétrica de<br />
Hidrocarbonetos Policíclicos Aromáticos<br />
(HPAs) na bílis de peixes Mugil liza<br />
Dissertação apresenta<strong>da</strong> como requisito parcial para obtenção<br />
do grau de Mestre pelo Programa de Pós-Graduação em<br />
Química <strong>da</strong> <strong>PUC</strong>-<strong>Rio</strong>. Aprova<strong>da</strong> pela Comissão Examinadora<br />
abaixo assina<strong>da</strong>.<br />
Prof a. <strong>Roberta</strong> Lourenço Ziolli<br />
Orientadora<br />
Departamento de Química – <strong>PUC</strong>-<strong>Rio</strong><br />
Dra. Zuleica Carmem Castilhos<br />
Centro de Tecnologia Mineral – UFRJ<br />
Prof. Ricardo Queiroz Aucélio<br />
Departamento de Química – <strong>PUC</strong>-<strong>Rio</strong><br />
Prof. José Eugenio Leal<br />
Coordenador Setorial do<br />
Centro Técnico Científico – <strong>PUC</strong>-<strong>Rio</strong><br />
<strong>Rio</strong> de Janeiro, 22 de fevereiro de 2006
Todos os direitos reservados. É proibi<strong>da</strong> a reprodução total<br />
ou parcial do trabalho sem autorização <strong>da</strong> universi<strong>da</strong>de, <strong>da</strong><br />
autora e do orientador.<br />
<strong>Roberta</strong> <strong>Lyrio</strong> <strong>Santos</strong> <strong>Neves</strong><br />
Graduou-se em Engenharia Química na <strong>PUC</strong>-<strong>Rio</strong> em 1996.<br />
Trabalhou na L’Oréal de 1996 a 2003, na área de<br />
regulamentação de cosméticos. Participou de diversos<br />
congressos na área ambiental.<br />
Ficha Catalográfica<br />
<strong>Neves</strong>, <strong>Roberta</strong> <strong>Lyrio</strong> <strong>Santos</strong><br />
<strong>Neves</strong>, <strong>Roberta</strong> <strong>Lyrio</strong> <strong>Santos</strong><br />
Hidrocarbonetos Policíclicos Aromáticos (HPAs) na<br />
bílis do Avaliação peixe Mugil <strong>da</strong> contaminação liza como biomarcadores de óleo no ambiente para o<br />
monitoramento estatutário <strong>da</strong> Baía ambiental de Guanabara <strong>da</strong> contaminação (RJ) pela determinação<br />
óleo/<br />
<strong>Roberta</strong> <strong>Lyrio</strong> <strong>Santos</strong> <strong>Neves</strong>; orientadora: <strong>Roberta</strong><br />
Lourenço fluorimétrica Ziolli. de – hidrocabornetos <strong>Rio</strong> de Janeiro: <strong>PUC</strong>, policíclicos Departamento aromáticos de<br />
Química, (HPAs) na 2006. bílis de peixes Mugil Liza / <strong>Roberta</strong> <strong>Lyrio</strong><br />
<strong>Santos</strong> <strong>Neves</strong> ; orientadores: <strong>Roberta</strong> Lourenço Ziolli,<br />
Terezinha<br />
v., 101<br />
Ferreira<br />
f.: il.; 29,7<br />
de<br />
cm<br />
Oliveira. – <strong>Rio</strong> de Janeiro : <strong>PUC</strong>,<br />
Departamento de Química, 2006.<br />
1. Dissertação (mestrado) – Pontifícia Universi<strong>da</strong>de<br />
120 f. : il. ; 30 cm<br />
Católica do <strong>Rio</strong> de Janeiro, Departamento de Química.<br />
Dissertação (mestrado) – Pontifícia<br />
Universi<strong>da</strong>de<br />
Inclui referências<br />
Católica<br />
bibliográficas.<br />
do <strong>Rio</strong> de Janeiro, Departamento<br />
de Química.<br />
CDD: 540
Aos meus pais, Lúcia e José Eduardo,<br />
e a minha irmã, Renata,<br />
por serem uma família incrível.
Agradecimentos<br />
À minha orientadora, <strong>Roberta</strong> Lourenço Ziolli, pela confiança em mim deposita<strong>da</strong><br />
e pelo apoio neste trabalho.<br />
À minha orientadora, Terezinha Ferreira de Oliveira, pela amizade e pelo<br />
incentivo ao longo deste trabalho.<br />
Ao professor Ricardo Queiroz Aucélio pelo empréstimo do equipamento e pela<br />
ótima acolhi<strong>da</strong> no seu laboratório.<br />
Aos amigos, Pedro Cavalcanti e Nédio Araújo, por to<strong>da</strong> a amizade dentro e fora<br />
do laboratório.<br />
Aos amigos, Ana Paula, Bruno, Camila, Carol, Diego, José Victor e Letícia, por<br />
to<strong>da</strong> a aju<strong>da</strong> nas coletas e pela ótima convivência no laboratório.<br />
À Yaneth pela amizade e por to<strong>da</strong>s as noites insones, fun<strong>da</strong>mentais para esse<br />
trabalho.<br />
À Lívia e Bernardo, companheiros nesse desafio.<br />
Aos amigos do LEEA, Wagner, Carlos, Ilfran, Alessandra, Flávia e João, pela<br />
apoio e amizade ao longo deste trabalho.<br />
À professora Angela Rebelo Wagener por todo o material emprestado.<br />
À equipe do LABMAM, em especial ao Ricardo, Cláudia, Adriana e Francine por<br />
to<strong>da</strong> a aju<strong>da</strong> forneci<strong>da</strong>.
Ao CNPq e a <strong>PUC</strong> pelos auxílios concedidos, sem os quais este trabalho não<br />
poderia ter sido realizado.<br />
À prof. Isabel Moreira por todo material emprestado.<br />
Ao Anselmo pela aju<strong>da</strong> com o espectrofotômetro.<br />
Ao Jorge, Charles e Carlão pelo empréstimo de equipamentos.<br />
À todos <strong>da</strong> secretária do departamento pela aju<strong>da</strong>, em especial a Fátima.<br />
Ao Sr. Irani e ao Nico pelas coletas na Baía de Guanabara e em Itaipu.<br />
À Ana Paula Rodrigues pela aju<strong>da</strong> com os peixes e pela companhia sempre<br />
diverti<strong>da</strong>.<br />
Ao Alexandre Azevedo pelo apoio e carinho nestes últimos meses.<br />
e a todos os meus amigos e familiares que sempre me incentivaram e souberam<br />
entender minha ausência neste período.
Resumo<br />
<strong>Neves</strong>, <strong>Roberta</strong> <strong>Lyrio</strong> <strong>Santos</strong>. Avaliação <strong>da</strong> contaminação de óleo no<br />
ambiente estuarino <strong>da</strong> Baía de Guanabara (RJ) pela determinação<br />
fluorimétrica de Hidrocarbonetos Policíclicos Aromáticos (HPAs) na<br />
bílis de peixes Mugil liza. <strong>Rio</strong> de Janeiro, 2006. 120p. Dissertação de<br />
Mestrado – Departamento de Química, Pontifícia Universi<strong>da</strong>de Católica do<br />
<strong>Rio</strong> de Janeiro.<br />
Os Hidrocarbonetos Policíclicos Aromáticos (HPAs) são poluentes ubíquos<br />
na natureza sendo os derrames de óleo uma <strong>da</strong>s principais fontes destes compostos<br />
para os ambientes aquáticos costeiros. Este trabalho avalia a possibili<strong>da</strong>de de uso<br />
dos metabólitos de HPAs na bílis do peixe Mugil liza (tainha) como biomarcadores<br />
no monitoramento ambiental de ecossistemas aquáticos. Para esta avaliação<br />
realizou-se um monitoramento sazonal na Baía de Guanabara, RJ, área cronicamente<br />
contamina<strong>da</strong> por óleo, e em Itaipu, Niterói, RJ, como área controle. Nos locais<br />
de coleta foram medidos parâmetros físico-químicos tais como, pH, oxigênio<br />
dissolvido, entre outros e selecionados os peixes variando entre 35 e 51 cm para<br />
maior homogenei<strong>da</strong>de <strong>da</strong>s amostras. Em laboratório foram feitas medi<strong>da</strong>s morfométricas<br />
dos indivíduos e retirado o seu líquido biliar. O método analítico foi otimizado<br />
e seus parâmetros de desempenho analítico foram determinados. As amostras<br />
de líquido biliar foram diluí<strong>da</strong>s em etanol 48% (1:2000 v/v) e analisa<strong>da</strong>s por<br />
fluorescência nos comprimentos de on<strong>da</strong> de excitação e emissão, respectivamente,<br />
332 nm e 383 nm. A média <strong>da</strong>s concentrações de HPAs totais na bílis dos peixes<br />
coletados na Baía de Guanabara foi significativamente diferente <strong>da</strong> área controle,<br />
Itaipu. Na Baía de Guanabara, valores de 7,0 ± 3,4 (n=19) e 10,4 ± 6,4 (n=12) mg<br />
de equivalentes (eqv.) de pireno L -1 foram obtidos, respectivamente, no inverno e<br />
no verão. Em Itaipu, a concentração de HPAs foi de 1,8 ± 0,7 (n=11) mg de eqv.<br />
de pireno L -1 . Estes resultados indicam que o método é capaz de diferenciar áreas<br />
recentemente contamina<strong>da</strong>s por óleo de áreas não contamina<strong>da</strong>s, sendo o peixe<br />
Mugil liza um possível biomonitor para esta área. Este método analítico apresenta<br />
vantagens em relação a outros métodos, tais como tempo e custo de análise reduzidos,<br />
podendo ser usado em levantamento de <strong>da</strong>dos preliminares nos programas<br />
de monitoramento ambiental.<br />
Palavras-chave<br />
HPAs, biomarcador, Mugil liza, bílis, Baía de Guanabara
Abstract<br />
<strong>Neves</strong>, <strong>Roberta</strong> <strong>Lyrio</strong> <strong>Santos</strong>. Evaluation of the oil contamination of the<br />
estuarine environment of the Guanabara Bay (RJ) by the fluorometric<br />
determination of Polycyclic Aromatic Hydrocarbons (PAHs) in the<br />
Mugil liza fish bile. <strong>Rio</strong> de Janeiro, 2006. 120p. MSc. Dissertation –<br />
Departamento de Química, Pontifícia Universi<strong>da</strong>de Católica do <strong>Rio</strong> de<br />
Janeiro.<br />
Polycyclic aromatic hydrocarbons (PAHs) are ubiquitous in the<br />
environment. The main source of contamination is antropogenic, and oil spills are<br />
one of the main PAHs sources for the aquatic environment. This work evaluates<br />
the usage of PAH metabolites in fish bile (Mugil liza) as biomarkers in the aquatic<br />
environment. For this evaluation two distinct areas were monitores: Guanabara<br />
Bay, RJ, known for its chronic oil contamination, and Itaipu, Niterói, RJ, the<br />
control area. Physico-chemical measurements: pH, dissolved oxygen, conductivity<br />
and transparency were made in situ and fish varying from 35 to 50 cm were<br />
selected for sampling homogeneity and sexual maturity. In the laboratory,<br />
morphometric measures were taken and the fish bile was extracted. After<br />
optimizing the analytical method the samples were analysed by diluting each bile<br />
sample in ethanol 48% (1:2000 v/v) and fluorimetric measurements were made in<br />
excitation/emission wavelengths of 332 nm/383 nm. The mean total PAHs<br />
concentrations in the bile samples collected in the Guanabara Bay were<br />
significantly different from the control area, Itaipu. In the Guanabara Bay the<br />
means were 7,0 ± 3,4 (n=19) and 10,4 ± 6,4 (n=12) mg L -1 pyrene equivalents, in<br />
winter and summer, respectively. In Itaipu, the mean HPA concentration was 1,8<br />
± 0,7 (n=11) mg L -1 pyrene equivalents. These results indicate that this method<br />
can differentiate contaminated areas from non contaminated ones, making the fish<br />
Mugil liza one possible biomonitor in the Guanabara Bay, RJ. Additionally, this<br />
analytical method has advantages compared to other methods because it is less<br />
time consuming and is inexpensive and therefore could be used as a preliminary<br />
monitoring tool.<br />
Keywords<br />
PAHs, biomarker, Mugil liza, bile, Guanabara Bay
Sumário<br />
1. Introdução 17<br />
1.1. Objetivo geral 19<br />
1.2. Objetivos específicos 19<br />
2. Petróleo no meio ambiente aquático 21<br />
2.1. Fontes de contaminação por óleo 21<br />
2.2. Hidrocarbonetos Policíclicos Aromáticos 23<br />
2.2.1. Fontes de contaminação por HPAs 24<br />
2.2.2. Proprie<strong>da</strong>des físico-químicas dos HPAs 26<br />
2.3. Distribuição dos HPAs no ambiente aquático 27<br />
3. Toxici<strong>da</strong>de dos HPAs 32<br />
3.1. Considerações Gerais 32<br />
3.2. Metabolismo dos HPAs em peixes 33<br />
3.2.1. O metabolismo do pireno 37<br />
3.3. A bílis e a formação de biliverdina 38<br />
3.3.1. A bílis 38<br />
3.3.2. A formação de biliverdina 39<br />
4. Monitoramento ambiental 41<br />
4.1. Biomarcadores 42<br />
5. Ecologia e biologia do peixe Mugil liza (tainha) 46<br />
5.1. Mugil liza (tainha) 46<br />
5.2. Análise biométrica 48<br />
5.2.1. Estimativa do Peso Total (W T ) e Comprimento Padrão (L P ) 49<br />
5.2.2. Fator de condição (K) 49<br />
5.3. Órgãos reprodutores 50<br />
5.3.1. Estágios de maturação sexual 51<br />
6. Determinação de HPAs em peixes 53<br />
6.1. Técnicas de extração e clean-up 53
6.2. Determinação de HPAs em bílis de peixe 55<br />
6.3. Fluorescência molecular 57<br />
7. Áreas de estudo 60<br />
7.1. Baía de Guanabara, RJ 60<br />
7.1.1. Poluição por petróleo e derivados na Baía de Guanabara 63<br />
7.1.2. Estudos de HPAs na Baía de Guanabara 65<br />
7.1.3. Praia de Ipiranga, Magé 67<br />
7.2. Itaipu, Niterói 68<br />
8. Parte experimental 71<br />
8.1. Coleta dos peixes e medição dos parâmetros físico-químicos 71<br />
8.2. Amostragem dos peixes 72<br />
8.3. Análise <strong>da</strong> bílis 74<br />
8.3.1. Escolha do sistema solvente 74<br />
8.3.2. Determinação dos comprimentos de on<strong>da</strong> de excitação e emissão 75<br />
8.3.3. Curva analítica 75<br />
8.3.4. Absorção molecular 75<br />
8.3.5. Estudo do efeito de matriz 76<br />
8.3.6. Determinação de HPAs total por fluorescência na bílis de peixe 76<br />
8.3.7. Limpeza do material 77<br />
8.4. Análise de HPAs totais em água 77<br />
8.4.1. Determinação dos comprimentos de on<strong>da</strong> de excitação e emissão 77<br />
8.4.2. Curva analítica 77<br />
8.4.3. Coleta de água 78<br />
8.4.4. Extração de HPAs totais 78<br />
8.4.5. Determinação de HPAs total por fluorescência em água 79<br />
8.4.6. Limpeza do material 79<br />
8.5. Análise estatística dos <strong>da</strong>dos 79<br />
9. Resultados e discussões 81<br />
9.1. Otimização <strong>da</strong> análise de HPAs em bílis de peixe 81<br />
9.1.1. Escolha do sistema solvente 81<br />
9.1.2. Determinação dos comprimentos de on<strong>da</strong> de excitação e emissão 83<br />
9.1.3. Parâmetros de desempenho analítico 84<br />
9.1.4. Efeito de matriz 87<br />
9.1.5. Adição de analito 89
9.2. Comparação entre Baía de Guanabara e Itaipu 92<br />
9.2.1. Parâmetros físico-químicos 92<br />
9.2.2. Análise morfométrica dos peixes 93<br />
9.2.3. Análise <strong>da</strong> bílis 98<br />
9.2.4. Análise por fluorescência - método sincronizado 102<br />
9.2.5. Correlação entre as variáveis 104<br />
9.2.6. Determinação de HPAs totais em água 106<br />
10. Conclusões e Considerações finais 109<br />
11. Referências bibliográficas 114
Lista de figuras<br />
Figura 1. Representação estrutural de alguns HPAs. 24<br />
Figura 2. Representação <strong>da</strong> distribuição dos hidrocarbonetos no meio aquático.<br />
29<br />
Figura 3. Esquema de biotransformação de xenobióticos. 35<br />
Figura 4. Mecanismo de ativação dos HPAs. 36<br />
Figura 5. Representação esquemática simplifica<strong>da</strong> do metabolismo do<br />
benzo[a]pireno. 37<br />
Figura 6. Estrutura do pireno. 38<br />
Figura 7. Canalículo bilífero. 39<br />
Figura 8. Oxi<strong>da</strong>ção do anel heme até a formação de biliverdina. 40<br />
Figura 9. Representação esquemática <strong>da</strong> ordem sequencial de respostas ao<br />
estresse causado por poluentes em um sistema biológico. 43<br />
Figura 10. Mugil liza. 47<br />
Figura 11. Diagrama do corpo do peixe e as medi<strong>da</strong>s utiliza<strong>da</strong>s. 48<br />
Figura 12. Métodos de determinação de HPAs em bílis de peixe. 56<br />
Figura 13. Diagrama parcial de energia de um sistema fotoluminescente. 58<br />
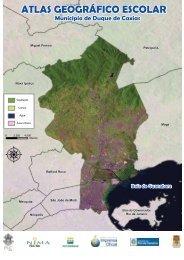
Figura 14. Mapa do estado do <strong>Rio</strong> de Janeiro, destacando em vermelho a região<br />
metropolitana e em azul a Baía de Guanabara. 60<br />
Figura 15. Curral próximo a praia de Ipiranga, Magé. 67<br />
Figura 16. trecho <strong>da</strong> Carta náutica 1501 indicando a região dos currais próximos<br />
a praia de Ipiranga, Magé. 68<br />
Figura 17. Mapa do Estado do <strong>Rio</strong> de Janeiro, com destaque para a ci<strong>da</strong>de de<br />
Niterói. 69<br />
Figura 18. Abertura do indivíduo. 72<br />
Figura 19. Identificação do sexo do peixe pela análise visual <strong>da</strong>s gôna<strong>da</strong>s. 73<br />
Figura 20. Localização <strong>da</strong> vesícula biliar. 73<br />
Figura 21. Retira<strong>da</strong> do líquido biliar. 73<br />
Figura 22. Espectro de excitação (λ em = 383 nm) e emissão (λ ex = 332 nm) do<br />
pireno em etanol 48%. 84<br />
Figura 23. Curva analítica <strong>da</strong> solução de pireno em etanol 48% (n=4) em<br />
condições otimiza<strong>da</strong>s. 85<br />
Figura 24. Coloração do líquido biliar <strong>da</strong>s amostras utiliza<strong>da</strong>s no teste do efeito<br />
de matriz. 88
Figura 25. Gráfico do aumento do efeito de matriz com a diminuição <strong>da</strong>s<br />
diluições <strong>da</strong>s amostras. 88<br />
Figura 26. Gráfico de adição de analito usando a bílis dos peixes coletados na<br />
Baía de Guanabara. 90<br />
Figura 27. Gráfico de adição de analito usando a bílis dos peixes coletados em<br />
Itaipu. 91<br />
Figura 28. Distribuição de frequência do comprimento total dos indivíduos<br />
coletados 94<br />
Figura 29. Gráfico de Boxplot do comprimento total, classificado por coleta. 94<br />
Figura 30. Proporção sexual dos indivíduos capturados. 95<br />
em to<strong>da</strong>s as coletas <strong>da</strong> Baía de Guanabara e Itaipu. 95<br />
Figura 31. Gráfico de Boxplot do peso, classificado por sexo. 96<br />
Figura 32. Gráfico de Boxplot do comprimento total, classificado por sexo. 96<br />
Figura 33. Espectros de emissão fluorescente <strong>da</strong>s bílis diluí<strong>da</strong>s <strong>da</strong> Baía de<br />
Guanabara e Itaipu. 98<br />
Figura 34. Gráfico de Boxplot <strong>da</strong> concentração de HPAs na bílis dos peixes, por<br />
coleta. 100<br />
Figura 35. Espectro de fluorescência sincroniza<strong>da</strong> (∆λ=51 nm) para bílis de<br />
peixes coletados na Baía de Guanabara. 103<br />
Figura 36. Dendograma de similari<strong>da</strong>de dos valores absolutos <strong>da</strong>s correlações<br />
absolutas <strong>da</strong>s distâncias pelo método de Ward. 105<br />
Figura 37. Curva analítica de soluções de pireno em diclorometano (n=3). 106
Lista de tabelas<br />
Tabela 1. Concentração de alguns HPAs em diferentes derivados de petróleo. 25<br />
Tabela 2. Valores máximos permitidos para alguns HPAs (µg L -1 ). 26<br />
Tabela 3. Parâmetros físico-químicos de alguns HPAs. 28<br />
Tabela 4. Concentrações de HPAs encontrados na água, sedimento e biota <strong>da</strong><br />
Baía de Guanabara. 66<br />
Tabela 5. Valores de referência para o HPAs totais para estimar o nível de<br />
contaminação em tecido de peixes (peso úmido). 66<br />
Tabela 6. Análise de variância do experimento. 82<br />
Tabela 7. Estimativas dos efeitos e coeficientes com os respectivos intervalos de<br />
confiança de 95%. 82<br />
Tabela 8. Valores de Ŷ para a equação de regressão obti<strong>da</strong> do experimento<br />
fatorial 2 3 . 83<br />
Tabela 9. Análise de variância <strong>da</strong> curva de regressão. 85<br />
Tabela 10. Parâmetros físico-químicos. 93<br />
Tabela 11. Número de machos e fêmeas capturados. 95<br />
Tabela 12. Estimativa <strong>da</strong> média do peso (kg) dos peixes coletados*. 95<br />
Tabela 13. Estimativa <strong>da</strong> média do comprimento total (cm) dos peixes<br />
coletados*. 96<br />
Tabela 14. Análise de variância do fator de condição em relação as coletas. 97<br />
Tabela 15. Análise de variância <strong>da</strong> média <strong>da</strong>s concentrações de HPAs por sexo,<br />
coleta <strong>da</strong> Baía de Guanabara, agosto/2005. 99<br />
Tabela 16. Análise de variância <strong>da</strong> média <strong>da</strong>s concentrações de HPAs por sexo,<br />
coleta de Itaipu, agosto/2005. 99<br />
Tabela 17. Análise de variância <strong>da</strong> média <strong>da</strong>s concentrações de HPAs por sexo,<br />
coleta de Itaipu, setembro/2005. 99<br />
Tabela 18. Análise de variância <strong>da</strong>s concentrações de HPAs por coleta. 100<br />
Tabela 19. Matriz de correlação <strong>da</strong>s variáveis. 104<br />
Tabela 20. Análise de variância <strong>da</strong> curva de regressão. 107<br />
Tabela 21. Concentração de HPAs medidos em amostras de água*. 108
Lista de quadros<br />
Quadro 1. Carcinogenici<strong>da</strong>de, genotoxici<strong>da</strong>de e mutagenici<strong>da</strong>de de alguns<br />
HPAs. 33<br />
Quadro 2. Fatores e níveis do experimento. 81<br />
Quadro 3. Parâmetros de desempenho analítico. 86<br />
Quadro 4. Cor e valores de absorvância à 380 nm <strong>da</strong>s amostras utiliza<strong>da</strong>s no<br />
teste do efeito de matriz. 87<br />
Quadro 5. Cor e valor de absorvância <strong>da</strong>s amostras utiliza<strong>da</strong>s no teste de adição<br />
de analito. 89<br />
Quadro 6. Equações <strong>da</strong>s regressões lineares <strong>da</strong>s adições de analito e seu<br />
coeficiente de correlação (R 2 ). 90<br />
Quadro 7. Data e coordena<strong>da</strong>s <strong>da</strong> coletas. 92<br />
Quadro 8. Estimativa <strong>da</strong>s médias dos valores do fator de condição (K)*. 97<br />
Quadro 9. Média <strong>da</strong> concentração de HPAs em mg L -1 de equivalentes de pireno<br />
na bílis dos peixes (Mugil liza) capturados, separados por sexo*. 99<br />
Quadro 10. Estimativa <strong>da</strong>s médias <strong>da</strong>s concentrações de HPAs (µg de<br />
equivalentes de pireno mL -1 de bile) por coleta*. 100<br />
Quadro 11. Concentrações de HPAs em bílis de peixe em locais contaminados.<br />
102<br />
Quadro 12. Codificação <strong>da</strong>s variáveis categóricas. 104<br />
Quadro 13. Concentrações de HPAs na água <strong>da</strong> Baía de Guanabara. 108
Antes tarde do que muito tarde.<br />
Wagner Pacheco, num final de tarde chuvoso.
1<br />
Introdução<br />
A crescente deman<strong>da</strong> pelo uso do petróleo para obtenção de energia, faz<br />
com que aumente a extração de petróleo e as ativi<strong>da</strong>des a ela associa<strong>da</strong>s,<br />
contribuindo para o crescente número de derrames de óleo crônicos ou agudos,<br />
afetando o meio ambiente. Em geral, essas ativi<strong>da</strong>des se concentram nas zonas<br />
costeiras, sendo essas as mais impacta<strong>da</strong>s por este tipo de ativi<strong>da</strong>de.<br />
O petróleo é uma mistura complexa de hidrocarbonetos. Na sua<br />
composição destacam-se os hidrocarbonetos policíclicos aromáticos (HPAs),<br />
compostos potencialmente tóxicos pelo seu potencial carcinogênico.<br />
Os HPAs podem atingir o meio ambiente por fontes naturais, como<br />
percolação de óleo do fundo oceânico e incêndios naturais em florestas, ou<br />
fontes antropogênicas, tais como a queima incompleta de matéria orgânica,<br />
incluindo as emissões veiculares e o uso de combustíveis fósseis, e derrames de<br />
petróleo e derivados. Atualmente, as fontes antropogênicas são as que mais<br />
contribuem para a contaminação do meio ambiente por HPAs, sendo as regiões<br />
costeiras uma <strong>da</strong>s regiões mais afeta<strong>da</strong>s já que a produção de petróleo se<br />
concentra principalmente nestas áreas.<br />
O principal exemplo de região costeira potencialmente impacta<strong>da</strong> pela<br />
ativi<strong>da</strong>de petrolífera no <strong>Rio</strong> de Janeiro é a Baía de Guanabara, que é ameaçado<br />
por várias formas de poluição, onde efluentes domésticos e industriais afetam<br />
seu ecossistema. Existem no entorno <strong>da</strong> Baía duas refinarias de petróleo, 16<br />
terminais de óleo, 6000 indústrias e dois portos comerciais sendo libera<strong>da</strong>s,<br />
diariamente, sete tonela<strong>da</strong>s de óleo na Baía, entre outros (CEDAE, 199-).<br />
Há portanto a necessi<strong>da</strong>de de se estabelecer parâmetros indicadores <strong>da</strong><br />
contaminação por hidrocarbonetos de petróleo que possam ser utilizados na<br />
implementação de um programa de avaliação ambiental no monitoramento <strong>da</strong><br />
quali<strong>da</strong>de desses ecossistemas aquáticos.<br />
Entre as várias formas de monitoramento que podem ser empregados para<br />
monitorar ou predizer os efeitos destes poluentes no ambiente, o<br />
biomonitoramento tem sido utilizado como ferramenta promissora nos programas<br />
de avaliação ambiental.
Introdução 18<br />
Entre os organismos que vêm sendo propostos para o uso no<br />
biomonitoramento, os peixes destacam-se por possuírem um papel fun<strong>da</strong>mental<br />
na cadeia alimentar e representarem uma importante fonte de alimentação para<br />
a população. A presença dos produtos <strong>da</strong> metabolização dos HPAs na bílis de<br />
peixes pode ser um bom indicador de contaminação crônica uma vez que a<br />
metabolização destes compostos é eficiente, sendo a bílis o principal meio de<br />
excreção destes compostos.<br />
Embora o uso de metabólitos como marcadores seja promissor na<br />
avaliação ambiental de rotina ou em casos de derrames, estudos de vali<strong>da</strong>ção<br />
<strong>da</strong> técnica e de seleção dos organismos mais adequados necessitam ser<br />
conduzidos antes de sua aplicação.<br />
Assim, este estudo busca avaliar a viabili<strong>da</strong>de do monitoramento ambiental<br />
preliminar <strong>da</strong> contaminação por óleo na Baía de Guanabara, utilizando a análise<br />
de metabólitos de HPAs na bílis de peixe como biomarcadores.<br />
Esta técnica permite avaliar a contaminação de petróleo e derivados em<br />
ambientes aquáticos, neste caso avaliando o uso <strong>da</strong> espécie Mugil liza (tainha)<br />
como biomonitor. Por ser uma prática rápi<strong>da</strong> e de baixo custo permite a análise<br />
de grande número de amostras em curto espaço de tempo e sendo a primeira<br />
vez em que esta técnica é utiliza<strong>da</strong> para avaliação do pescado <strong>da</strong> região <strong>da</strong> Baía<br />
de Guanabara, RJ.<br />
Inicialmente foi realizado um levantamento bibliográfico sobre a utilização<br />
<strong>da</strong> análise de metabólitos de HPAs na bílis de peixes como biomarcador de<br />
HPAs no ambiente aquático e sobre as metodologias analíticas disponíveis. A<br />
metodologia seleciona<strong>da</strong> para a análise dos metabólitos dos HPAs na bílis de<br />
peixes por fluorescência foi otimiza<strong>da</strong> e seus parâmetros analíticos de<br />
desempenho foram determinados. Estudos adicionais como a influência <strong>da</strong><br />
matriz, bílis, na análise química, foram também realizados.<br />
Paralelamente foram feitos levantamentos de campo, incluindo entrevista<br />
com os pescadores locais, a fim de conhecer as espécies de peixes possíveis de<br />
serem utiliza<strong>da</strong>s como biomonitores no presente estudo, investigando seus<br />
hábitos alimentares, abundância, forma de captura, entre outros parâmetros, e<br />
estabelecer as regiões escolhi<strong>da</strong>s para a captura dos indivíduos.<br />
A proposta inicial era utilizar peixes <strong>da</strong>s espécies Micropogonias furnieri<br />
(corvina) e Mugil liza (tainha), encontra<strong>da</strong>s em abundância na Baía e<br />
consumi<strong>da</strong>s pela população local, principalmente, do entorno <strong>da</strong> Baía de<br />
Guanabara, RJ. Entretanto, em laboratório, alguns exemplares dessas e de<br />
outras espécies foram dissecados na tentativa de identificação <strong>da</strong> vesícula biliar
Introdução 19<br />
para extração <strong>da</strong> bílis par análise, mas nem sempre com sucesso. Após várias<br />
tentativas, a espécie escolhi<strong>da</strong> para utilização neste estudo foi a Mugil liza<br />
(tainha) por apresentar-se em abundância na região, ser consumi<strong>da</strong> pela<br />
população local, ser de fácil captura e fácil identificação <strong>da</strong> vesícula biliar.<br />
A parte experimental deste estudo contempla os trabalhos em campo e<br />
laboratório. Os trabalhos de campo consistiam <strong>da</strong> captura e seleção dos<br />
exemplares, caracterização físico-química do ambiente onde os peixes foram<br />
coletados, coleta de água para análises e registros rotineiros de campo<br />
(coordena<strong>da</strong>s, tábuas de marés, etc.). Em laboratório foram feitas as análises<br />
morfométricas dos indivíduos, a análise química <strong>da</strong> bílis e as análises de água. A<br />
concentração de HPAs na água coleta<strong>da</strong> nas regiões de onde os peixes foram<br />
capturados também foi determina<strong>da</strong>. Os resultados obtidos foram então tratados<br />
estatisticamente, respal<strong>da</strong>ndo as discussões e conclusões apresenta<strong>da</strong>s neste<br />
trabalho.<br />
1.1.<br />
Objetivo geral<br />
O objetivo deste trabalho é estu<strong>da</strong>r a viabili<strong>da</strong>de do uso <strong>da</strong> determinação<br />
de metabólitos de HPAs em bílis de peixe, por fluorescência, em programas de<br />
monitoramento ambiental.<br />
1.2.<br />
Objetivos específicos<br />
Em sintonia com seu objetivo geral, essa dissertação possui os seguintes<br />
objetivos específicos:<br />
• otimização <strong>da</strong> metodologia para a determinação de metabólitos de<br />
HPAs na bílis de peixe, avaliando sistema solvente mais adequado<br />
para as diluições emprega<strong>da</strong>s;<br />
• avaliação <strong>da</strong> influência <strong>da</strong> matriz (bílis) no composto de referência;<br />
• avaliação do uso do peixe Mugil liza (tainha) como biomonitor ;<br />
• determinação semi-quantitativa dos HPAs totais e seus metabólitos<br />
na bílis do peixe Mugil liza;
Introdução 20<br />
• avaliação <strong>da</strong>s possíveis relações entre tamanho e peso dos peixes<br />
coletados, volume de bílis retira<strong>da</strong> e absorvância <strong>da</strong>s amostras<br />
diluí<strong>da</strong>s, com a concentração dos compostos estu<strong>da</strong>dos;<br />
• avaliação <strong>da</strong>s possíveis variações sazonais <strong>da</strong>s concentrações de<br />
HPAs obti<strong>da</strong>s e demais parâmetros;<br />
• avaliação <strong>da</strong> ocorrência ou não de fontes de poluição crônica por óleo<br />
na região estu<strong>da</strong><strong>da</strong> <strong>da</strong> Baía de Guanabara;<br />
• obtenção de <strong>da</strong>dos pretéritos para as regiões estu<strong>da</strong><strong>da</strong>s.
2<br />
Petróleo no meio ambiente aquático<br />
2.1.<br />
Fontes de contaminação por óleo<br />
As fontes de contaminação do oceano por óleo são varia<strong>da</strong>s e podem ser<br />
separa<strong>da</strong>s em quatro grandes grupos: percolação natural no fundo oceânico,<br />
extração de petróleo, transporte de óleo e consumo de petróleo. A quanti<strong>da</strong>de de<br />
óleo que atinge os mares anualmente pode variar muito, dependendo <strong>da</strong><br />
ocorrência de acidentes ou guerras.<br />
Estimativas do Comitê de Estudo de Óleo no Mar do National Research<br />
Council (2003) indicam que o volume total de óleo que atinge os oceanos<br />
anualmente é de cerca de 1.400.000 m 3 .<br />
A percolação natural ocorre quando o óleo cru, a fração pesa<strong>da</strong> do<br />
petróleo, atravessa o extrato geológico do fundo marinho até a coluna d’água.<br />
Este fenômeno natural é responsável por quase metade de todo óleo que é<br />
lançado anualmente (680.000 m 3 ) no ambiente marinho, mas sua taxa de<br />
liberação é suficientemente baixa para que o ecossistema circunjacente possa<br />
se a<strong>da</strong>ptar.<br />
A extração de petróleo pode resultar no vazamento de óleo cru e produtos<br />
refinados. A natureza e tamanho destes derrames variam e se restringem às<br />
áreas de exploração de óleo e gás natural, sendo um risco potencial para os<br />
ambientes costeiros. Estima-se que sejam liberados 41.000 m 3 de óleo no mar<br />
anualmente, correspondendo a 5% de todo óleo que atinge o ambiente marinho.<br />
No transporte de óleo podem ocorrer enormes vazamentos como<br />
acidentes com navios tanque, tal como o vazamento de 13.000 m 3 de óleo do<br />
navio Exxon Valdez, ocorrido no Alasca em 1989. A contribuição dos<br />
vazamentos decorrentes do transporte anual de óleo para o mar é estima<strong>da</strong> em<br />
165.000 m 3 , 12% do total mundial.<br />
Já o consumo de óleo corresponde a maior contribuição antrópica de<br />
vazamento de óleo para o mar. Este tipo de fonte difusa libera nos oceanos
Petróleo no meio ambiente aquático 22<br />
530.000 m 3 de óleo anualmente, de forma lenta e crônica (National Research<br />
Council, 2003).<br />
A fim de melhor avaliar o impacto dos derrames de óleo no meio<br />
ambiente é necessário conhecer algumas de suas características. Em geral, os<br />
óleos são classificados como persistentes e não-persistentes. Os óleos nãopersistentes,<br />
mais leves, tendem a desaparecer rapi<strong>da</strong>mente quando lançados<br />
na superfície do mar (gasolina, nafta e querosene), enquanto os óleos<br />
persistentes, mais pesados, dissipam mais vagarosamente (óleos crus e<br />
resíduos de refino).<br />
A persistência de um óleo depende de algumas proprie<strong>da</strong>des tais como:<br />
solubili<strong>da</strong>de, volatili<strong>da</strong>de, gravi<strong>da</strong>de específica, viscosi<strong>da</strong>de, tensão superficial,<br />
entre outras. Essas proprie<strong>da</strong>des influenciam como o petróleo vai se comportar<br />
no ambiente aquático e determinar seus efeitos sobre a biota.<br />
Os efeitos do óleo sobre os organismos marinhos podem ser divididos em<br />
efeitos físicos, resultantes do recobrimento dos organismos por óleo e, efeitos<br />
químicos, associados à toxici<strong>da</strong>de dos compostos presentes. Estes efeitos não<br />
são excludentes, podendo ocorrer simultaneamente. Nos óleos de alta<br />
densi<strong>da</strong>de, o efeito físico de recobrimento é predominante, enquanto nos óleos<br />
de baixa densi<strong>da</strong>de o efeito químico é mais representativo (CETESB, 2005).<br />
Assim, após um derrame, <strong>da</strong>dos devem ser coletados a fim de conhecer a<br />
natureza do óleo, o tamanho <strong>da</strong> mancha de óleo e resultados de análises<br />
químicas para água, sedimentos e biota.<br />
Quando ocorre um derrame de óleo algumas decisões urgentes devem ser<br />
toma<strong>da</strong>s, tais como, restringir ou suspender a pesca, avaliar a segurança do<br />
consumo de frutos do mar e pescado e comunicar os riscos à saúde para<br />
população (Yender et al., 2002). Alguns exemplos de derrames que levaram a<br />
suspensão <strong>da</strong> pesca foram: o acidente com o navio Exxon Valdez no Alasca, e o<br />
vazamento de 1.300 m 3 de óleo na Baía de Guanabara, RJ, em janeiro de 2000,<br />
onde a pesca foi suspensa por um mês, com grandes prejuízos para a<br />
comuni<strong>da</strong>de pesqueira <strong>da</strong> região.<br />
Como os derrames são dinâmicos, as condições devem ser monitora<strong>da</strong>s e<br />
os riscos para o pescado reavaliados até serem reduzidos. A determinação <strong>da</strong><br />
contaminação de alimentos pode ser bastante longa sendo, portanto, é<br />
necessário o desenvolvimento de métodos de monitoramento que possam<br />
fornecer uma resposta rápi<strong>da</strong> ao fator de risco.<br />
Em uma tentativa de prevenir os derrames de óleo foram feitas várias<br />
convenções internacionais. A mais importante delas foi a MARPOL 73/78. Ela é
Petróleo no meio ambiente aquático 23<br />
resultante <strong>da</strong> Convenção Internacional para a Prevenção <strong>da</strong> Poluição por<br />
Navios, realiza<strong>da</strong> em 1973, que não chegou a entrar em vigor, sendo absorvi<strong>da</strong><br />
pelo protocolo <strong>da</strong> Conferência sobre Segurança de Petroleiros realiza<strong>da</strong> em<br />
1978 (International Maritime Organisation (IMO), 2006). A MARPOL 73/78 foi<br />
aprova<strong>da</strong> com reservas pelo Brasil em 1987.<br />
Ain<strong>da</strong> segundo a IMO, em 1990 foi realiza<strong>da</strong> em Londres a Convenção<br />
Internacional sobre Preparo, Resposta e Cooperação em Caso de Poluição por<br />
Óleo (OPRC), que estabelece medi<strong>da</strong>s para li<strong>da</strong>r com incidentes de poluição por<br />
óleo, seja nacional ou em cooperação com outros países. Esta convenção<br />
também foi aprova<strong>da</strong> pelo Brasil pelo decreto legislativo n o 43, de 29 de maio de<br />
1998 e pelo decreto n o 2.870, de 10 de dezembro de 1998.<br />
Além <strong>da</strong>s convenções internacionais, está em vigor atualmente no Brasil a<br />
lei federal no 9.966, de 28 de abril de 2000, conheci<strong>da</strong> como “a lei do óleo”, que<br />
dispões sobre a prevenção, o controle e a fiscalização <strong>da</strong> poluição causa<strong>da</strong> por<br />
lançamento de óleo e outras substâncias (Brasil, 2005; <strong>da</strong> Costa, 2003). Existe<br />
ain<strong>da</strong> uma série de outras regulamentações federais e estaduais relaciona<strong>da</strong>s à<br />
poluição por óleo e à conservação do meio ambiente brasileiro.<br />
2.2.<br />
Hidrocarbonetos Policíclicos Aromáticos<br />
O petróleo é composto basicamente por hidrocarbonetos (97%), e<br />
elementos como nitrogênio, enxofre e oxigênio (Yender et al., 2002; National<br />
Research Council, 1985 apud National Research Council, 2003). Os<br />
hidrocarbonetos podem ser classificados em dois grandes grupos: alifáticos e<br />
aromáticos. Os hidrocarbonetos aromáticos são formados por pelo menos um<br />
anel aromático e podem ser separados em dois grupos: os compostos<br />
monoaromáticos e os poliaromáticos também chamados de hidrocarbonetos<br />
policíclicos aromáticos (HPAs) (Figura 1).<br />
Embora os HPAs correspon<strong>da</strong>m à menor fração presente no petróleo,<br />
destacam-se por serem estáveis, persistentes no meio ambiente e podem<br />
apresentar efeitos tóxicos nos organismos aquáticos.
Petróleo no meio ambiente aquático 24<br />
Figura 1. Representação estrutural de alguns HPAs.<br />
2.2.1.<br />
Fontes de contaminação por HPAs<br />
Os HPAs podem ser formados a altas ou baixas temperaturas. A<br />
combustão incompleta de matéria orgânica produz HPAs em ambientes com<br />
temperatura entre 500 e 800 o C. A diagênese 1 de material orgânico sedimentar<br />
em temperaturas baixas ou modera<strong>da</strong>s, em longos períodos de tempo, também<br />
leva à formação de HPAs no carvão ou depósitos de óleo. Os HPAs também<br />
podem ser formados por plantas clorofila<strong>da</strong>s, fungos e bactérias (Hoffman,<br />
2003).<br />
1 diagênese: processos físicos, químicos e biológicos sofridos por um sedimento após a sua<br />
deposição.
Petróleo no meio ambiente aquático 25<br />
Nos processos a baixas temperaturas a distribuição de HPAs é governa<strong>da</strong><br />
por proprie<strong>da</strong>des termodinâmicas e nos processos a altas temperaturas a<br />
distribuição é governa<strong>da</strong> por características cinéticas. Assim, misturas de HPAs<br />
forma<strong>da</strong>s durante a combustão de combustíveis fósseis são geralmente<br />
caracteriza<strong>da</strong>s pela predominância de HPAs de alta massa molecular.<br />
Segundo Silva (2004) para diferenciar HPAs originados em combustão<br />
<strong>da</strong>queles de origem petrogênica, podem ser usados índices baseados na razão<br />
<strong>da</strong> concentração de HPAs selecionados. Assim, pode-se usar a razão entre<br />
HPAs de baixa massa molecular e HPAs de alta massa molecular, onde valores<br />
menores que 1 sugerem fonte de contaminação por combustão. Pode-se usar<br />
também as razões entre componentes homólogos como Fenantreno e<br />
Antraceno, Benzo(a)antraceno e criseno (Lima, 2001).<br />
Apesar de existirem fontes naturais de HPAs para o meio ambiente tais<br />
como, incêndios naturais em florestas, a percolação natural de óleo, erupções<br />
vulcânicas e bactérias, as fontes antropogênicas são as mais importantes<br />
(Bjørseth, 1983). Segundo Hoffman (2003), as fontes antropogênicas são:<br />
extração, transporte e consumo de óleo, incineração de lixo, motores de<br />
combustão, principalmente os movidos a óleo diesel, entre outros, sendo a<br />
contaminação <strong>da</strong>s regiões costeiras causa<strong>da</strong> por derramamentos de óleo,<br />
esgoto urbano e industrial, escoamento urbano (runoff) e deposição atmosférica.<br />
A concentração de HPAs presentes nos derivados de petróleo pode variar<br />
bastante conforme mostrado na Tabela 1. Um óleo cru típico pode conter de<br />
0,2% a 7% de HPAs e sua abundância geralmente diminui com o aumento <strong>da</strong><br />
massa molecular do HPA.<br />
Tabela 1. Concentração de alguns HPAs em diferentes derivados de petróleo.<br />
Meio Uni<strong>da</strong>de Pireno Benzo(e)pireno Benzo(a)pireno<br />
8 óleos crus de diferentes origens mg kg -1 1,6 – 10,7 1,2 – 28,9 0,1 – 3,6<br />
Gasolina mg L -1 0,03 – 4,8 0,031 – 0,95<br />
óleo lubrificante mg kg -1 5,10 – 99,0 0,70 – 37,3 0,79 – 34,8<br />
óleo para motor, usado mg kg -1 86 - 791 37 – 334 31 – 100<br />
Sedimento contaminado com óleo mg kg -1 1410 270 440<br />
de piche (matéria seca)<br />
Fonte: Kornmüller & Wiesmann, 2003.
Petróleo no meio ambiente aquático 26<br />
Em relação a contaminação por HPAs está em vigor a resolução n o 357 do<br />
CONAMA, de 17 de março de 2005 que classifica as águas em doces, salobras<br />
e salinas, definindo qual a destinação de ca<strong>da</strong> uma delas e os padrões de<br />
quali<strong>da</strong>de de água que devem ser periodicamente monitorados pelo Poder<br />
Público. Dentre os vários parâmetros de quali<strong>da</strong>de de água estabelecidos, foram<br />
estipulados limites individuais para alguns HPAs de acordo com a destinação do<br />
corpo d’água (Tabela 2).<br />
Tabela 2. Valores máximos permitidos para alguns HPAs (µg L -1 ).<br />
Tipo de corpo d’água<br />
Água destina<strong>da</strong> para Pesca ou<br />
Água doce<br />
Água doce<br />
Cultivo de organismos para fins<br />
Classe 1 e 2 1<br />
Classe 3 3<br />
HPA<br />
de consumo intensivo 2<br />
benzo(a)antraceno 0,05 0,018 -<br />
benzo(a)pireno 0,05 0,018 0,7<br />
benzo(b)fluoranteno 0,05 0,018 -<br />
benzo(k)fluoranteno 0,05 0,018 -<br />
criseno 0,05 0,018 -<br />
dibenzo(a,h)antraceno 0,05 0,018 -<br />
indeno(1,2,3,-cd)pireno 0,05 0,018 -<br />
Fonte: CONAMA,2005.<br />
1 Água doce classe 1: podem ser destina<strong>da</strong>s ao abastecimento para consumo humano após<br />
tratamento adequado; à proteção <strong>da</strong>s comuni<strong>da</strong>des aquáticas; recreação de contato primário;<br />
irrigação de hortaliças que são consumi<strong>da</strong>s cruas e frutas que se desenvolvem rente ao chão e<br />
serão consumi<strong>da</strong>s cruas e sem remoção de película;<br />
Água doce classe 2: podem ser destina<strong>da</strong>s ao abastecimento para consumo humano após<br />
tratamento convencional; à proteção <strong>da</strong>s comuni<strong>da</strong>des aquáticas; recreação de contato primário;<br />
irrigação de hortaliças que são consumi<strong>da</strong>s cruas e frutas que se desenvolvem rente ao chão e<br />
serão consumi<strong>da</strong>s cruas e sem remoção de película, aqüicultura e ativi<strong>da</strong>de de pesca;<br />
2 Valores para água doce, água salga<strong>da</strong> e água salobra;<br />
3 Água doce classe 3: podem ser destina<strong>da</strong>s ao abastecimento para consumo humano após<br />
tratamento adequado; irrigação de culturas arbóreas, cerealíferas e forrageiras; pesca amadora;<br />
recreação de contato secundário; dessedentação de animais.<br />
2.2.2.<br />
Proprie<strong>da</strong>des físico-químicas dos HPAs<br />
Os HPAs são formados por dois ou mais anéis aromáticos fundidos em<br />
sua estrutura, incluindo os compostos alquilados. Estes compostos variam de<br />
dois anéis (naftaleno) até sete anéis (coroneno), como representado na Figura 1.
Petróleo no meio ambiente aquático 27<br />
Suas proprie<strong>da</strong>des físicas e químicas estão relaciona<strong>da</strong>s com a massa<br />
molecular, sendo divididos em HPAs de baixo peso molecular (2 a 3 anéis<br />
benzênicos) e alto peso molecular (4 a 7 anéis benzênicos). Os HPAs de baixo<br />
peso molecular apresentam toxici<strong>da</strong>de agu<strong>da</strong> significativa para os organismos<br />
aquáticos enquanto os de alto peso molecular podem ser carcinogênicos e estão<br />
amplamente distribuídos no meio ambiente (Newman & Unger, 2003).<br />
Pela grande varie<strong>da</strong>de de tamanho e massa molecular as proprie<strong>da</strong>des<br />
físicas dos HPAs variam muito, dependendo do composto de interesse. A Tabela<br />
3 apresenta algumas características gerais dos HPAs: são sólidos à temperatura<br />
ambiente, têm alto ponto de fusão e ebulição e baixa solubili<strong>da</strong>de em água. Com<br />
o aumento <strong>da</strong> massa molecular a solubili<strong>da</strong>de diminui, os pontos de fusão e<br />
ebulição aumentam e a pressão de vapor diminui. Consequentemente, estes<br />
compostos variam bastante de comportamento, tanto em relação à sua<br />
distribuição no ambiente aquático quanto em seus efeitos nos sistemas<br />
biológicos (Lima, 2001).<br />
O coeficiente de partição octanol-água (K ow ) descreve a tendência de<br />
partição de um composto entre uma fase orgânica e uma fase aquosa. Este<br />
parâmetro tem sido correlacionado com fatores de bioconcentração em<br />
organismos aquáticos, já que simula a partição <strong>da</strong> substância entre água e o<br />
tecido adiposo. Pode-se observar na Tabela 3 que moléculas maiores têm maior<br />
valor de K ow .<br />
2.3.<br />
Distribuição dos HPAs no ambiente aquático<br />
Contaminantes orgânicos como os HPAs estão presentes em todo o meio<br />
ambiente aquático. Sua distribuição é controla<strong>da</strong> por diversos processos físicos,<br />
químicos e biológicos. Deve-se considerar a interação ar-água, água-sedimento,<br />
água-biota, água-matéria orgânica dissolvi<strong>da</strong> para entender os processos a que<br />
eles estão sujeitos (Figura 2) (Lima, 1996).<br />
A maioria dos HPAs que entra nos sistemas aquáticos permanece<br />
relativamente próxima às suas fontes, decrescendo aproxima<strong>da</strong>mente de forma<br />
logarítmica, com a distância <strong>da</strong> origem. Assim, a grande maioria dos HPAs<br />
encontrados está localiza<strong>da</strong> em rios, estuários e águas costeiras (Lima, 2001).
Petróleo no meio ambiente aquático 28<br />
Tabela 3. Parâmetros físico-químicos de alguns HPAs.
Petróleo no meio ambiente aquático 29<br />
Uma <strong>da</strong>s fontes de HPAs para os oceanos é a deposição atmosférica. Os<br />
HPAs liberados na atmosfera têm grande afini<strong>da</strong>de por partículas orgânicas<br />
presentes no ar, sendo deposita<strong>da</strong>s no mar tanto por deposição seca quanto<br />
úmi<strong>da</strong> (Hoffman, 2003). Pode haver também solubilização de compostos<br />
gasosos através <strong>da</strong> interface atmosfera-água.<br />
Figura 2. Representação <strong>da</strong> distribuição dos hidrocarbonetos no meio aquático<br />
(Fonte: Lima, 1996).<br />
Nos casos de derrame de óleo a volatilização é um fator importante na<br />
remoção dos hidrocarbonetos já que os compostos com maior pressão de vapor<br />
vão evaporar mais facilmente. A quanti<strong>da</strong>de evapora<strong>da</strong> pode variar de 10% para<br />
óleos crus até 75% para os óleos leves (Ferreira, 1995). Entretanto, a<br />
volatilização não provoca uma redução significativa dos hidrocarbonetos com<br />
mais de quatro anéis benzênicos (Azevedo, 1998).<br />
A solubili<strong>da</strong>de é de grande importância no comportamento de compostos<br />
orgânicos no ambiente aquático. Apesar de, como um grupo, serem<br />
considerados hidrofóbicos, os HPAs apresentam uma grande faixa de solubili<strong>da</strong>de<br />
em água. Segundo Varanasi (1989), Whitehouse, em 1984, demonstrou que<br />
existe uma relação inversamente proporcional entre salini<strong>da</strong>de e solubili<strong>da</strong>de dos<br />
HPAs, como previsto pela teoria de salting out, onde a adição de eletrólitos na<br />
fase aquosa diminui a solubili<strong>da</strong>de dos HPAs. A solubili<strong>da</strong>de pode variar por um<br />
fator de até dois na faixa de salini<strong>da</strong>de de 0 a 36 o / oo . Já a variação <strong>da</strong><br />
solubili<strong>da</strong>de dos HPAs com a temperatura pode chegar a um fator de cinco.
Petróleo no meio ambiente aquático 30<br />
Como compostos com baixa solubili<strong>da</strong>de em água tendem a se ligar com o<br />
material particulado presente, o comportamento de partição dos HPAs entre<br />
água, sedimento e biota é principalmente determinado pelo conteúdo lipídico e<br />
de carbono orgânico presentes.<br />
Um importante parâmetro é o coeficiente de partição octanol-água (K ow ).<br />
Este descreve a tendência de partição de um composto entre a fase orgânica e<br />
uma fase aquosa e é relacionado à solubili<strong>da</strong>de (S) pela Equação:<br />
log K ow = a – b (log S) (1)<br />
onde a e b são constantes e S é a solubili<strong>da</strong>de do compostos em água.<br />
Este coeficiente pode ser relacionado ao coeficiente de partição de<br />
carbono orgânico (K oc ), pela Equação (2). Esta equação descreve a tendência de<br />
um composto orgânico ser adsorvido no solo ou sedimento quando em contato<br />
com água, quando o conteúdo de carbono orgânico do sorvente (f oc ) é<br />
conhecido:<br />
K oc = f oc x K ow (2)<br />
Vários mecanismos como a troca iônica, ponte de hidrogênio, transferência<br />
de carga, ligação covalente e adsorção hidrofóbica, controlam a interação <strong>da</strong><br />
matéria orgânica dissolvi<strong>da</strong> (DOM) com compostos orgânicos, aumentando a<br />
solubili<strong>da</strong>de dos HPAs na água, reduzindo sua volatilização e aumentando as<br />
taxas de fotólise (Haitzer et al., 1998).<br />
Segundo os autores op citem, apesar de aumentar a solubili<strong>da</strong>de dos<br />
HPAs em água a DOM nem sempre aumenta sua biodisponibili<strong>da</strong>de, uma vez<br />
que nem sempre há tempo suficiente para o xenobiótico se dissociar do<br />
complexo DOM/substância química e se difundir pelas membranas <strong>da</strong>s guelras<br />
dos peixes, por exemplo.<br />
Além <strong>da</strong> volatilização e solubilização, os HPAs podem sofrer<br />
transformações fotoquímicas e metabólicas no ambiente aquático. Os HPAs<br />
expostos à luz do sol podem ser convertidos à compostos polares por fotooxi<strong>da</strong>ção<br />
ou fotólise, durante a permanência desses na zona eufótica 1 , onde há<br />
1 zona eufótica: cama<strong>da</strong> de mar ou lago penetra<strong>da</strong> pela luz solar com intensi<strong>da</strong>de suficiente para<br />
permitir a fotossíntese.
Petróleo no meio ambiente aquático 31<br />
luz para que estes processos ocorram. Já os HPAs que permanecem pouco<br />
tempo na coluna d’água são mais resistentes à foto-oxi<strong>da</strong>ção (Sauer et al., 1993<br />
apud Ke et al., 2002).<br />
Na transformação metabólica os HPAs são degra<strong>da</strong>dos através de reações<br />
de alguns organismos aquáticos, envolvendo a participação de enzimas<br />
específicas. De 40 a 80% do óleo cru pode ser degra<strong>da</strong>do por ação microbiana<br />
(Hoffman, 2003).<br />
Em relação a biota, os HPAs podem ser bioacumulados. Para que haja a<br />
bioacumulação de um xenobiótico, a taxa de assimilação deve exceder a taxa de<br />
eliminação deste. Muitos compostos lipofílicos como os HPAs, podem se<br />
acumular quase que indefini<strong>da</strong>mente, se o organismo não for capaz de<br />
transformá-los em metabólitos hidrofílicos, que são mais facilmente excretados.<br />
Os peixes são capazes de metabolizar hidrocarbonetos e só o acumulam<br />
em áreas muito poluí<strong>da</strong>s. Já os organismos invertebrados têm metabolismo mais<br />
lento acumulando maiores quanti<strong>da</strong>des de HPAs (Meador et al., 1995).
3<br />
Toxici<strong>da</strong>de dos HPAs<br />
3.1.<br />
Considerações Gerais<br />
O primeiro relato de câncer como efeito <strong>da</strong> exposição ao piche, ao alcatrão<br />
e à fuligem foi feita pelo cirurgião Sir Percival Pott, em 1775, quando reportou a<br />
alta incidência de câncer no órgão reprodutor masculino entre limpadores de<br />
chaminés na Grã-Bretanha (Pereira Netto et al., 2000; Bjørseth & Ram<strong>da</strong>hl, 1985<br />
apud Lima, 2001), embora, somente em 1931, o benzo(a)pireno do carvão tenha<br />
sido isolado e sintetizado (Costa, 2001).<br />
Atualmente, pesquisas <strong>da</strong> Agência Internacional de Estudo do Câncer<br />
(IARC) classificam alguns HPAs como carcinogênicos e/ou mutagênicos e/ou<br />
genotóxicos (Quadro 1).<br />
Compostos carcinogênicos são aqueles capazes de induzir um carcinoma,<br />
tumor maligno com tendência a produzir metástase. Evidências sobre a<br />
carcinogenici<strong>da</strong>de dos HPAs são indica<strong>da</strong>s principalmente por estudos de<br />
exposição ocupacional a misturas de HPAs resultantes de processos como a<br />
produção de coque, refinamento do petróleo, entre outros (EPA, 2000).<br />
Já compostos mutagênicos são capazes de induzir ou aumentar a<br />
frequência de mutação no cromossomo de um organismo e compostos<br />
genotóxicos são aqueles com capaci<strong>da</strong>de de induzir alterações no material<br />
genético de organismos a eles expostos.<br />
Uma substância genotóxica é tóxica para o DNA. Ela pode se unir<br />
diretamente a ele ou atuar indiretamente afetando as enzimas liga<strong>da</strong>s a sua<br />
replicação, levando a mutações que podem levar ao aparecimento de um<br />
câncer. No entanto, vale ressaltar que substâncias genotóxicas não são<br />
necessariamente cancerígenas.<br />
Estudos in vitro mostram que o benzo[a]pireno induz <strong>da</strong>nos em células<br />
procarióticas, eucarióticas e células de mamíferos produzindo efeitos<br />
genotóxicos variados, incluindo mutações genéticas em células somáticas,<br />
formação de adutos de DNA, síntese de DNA não programa<strong>da</strong>, entre outros
Toxici<strong>da</strong>de dos HPAs 33<br />
(EPA, 2000). É importante ressaltar que muitos desses compostos, ao serem<br />
metabolizados, podem <strong>da</strong>r origem a compostos mais tóxicos do que o original.<br />
Nos Estados Unidos, a Agência de Proteção Ambiental americana (US<br />
EPA) prioriza o monitoramento de 16 HPAs baseado em suas características<br />
tóxicas, mutagênicas e carcinogênicas: naftaleno, antraceno, pireno, criseno,<br />
fenantreno, benzo(a)pireno, dibenzo[a,h]antraceno, benzo[a]antraceno,<br />
benzo[g,h,i]perileno, acenafteno, acenaftileno, fluoreno, fluoranteno,<br />
benzo[k]fluoranteno, benzo[b]fluoranteno, indeno[1,2,3-cd]pireno.<br />
A exposição humana (e de outros animais) aos HPAs ocorre por diferentes<br />
vias. As mais importantes são a inalação de ar poluído e a ingestão de alimentos<br />
ou água contamina<strong>da</strong>.<br />
Quadro 1. Carcinogenici<strong>da</strong>de, genotoxici<strong>da</strong>de e mutagenici<strong>da</strong>de de alguns HPAs.<br />
HPA Carcinogenici<strong>da</strong>de 1 Genotoxici<strong>da</strong>de 2 Mutagenici<strong>da</strong>de 3<br />
Fluoreno I L<br />
Fenantreno I L +<br />
Antraceno N N -<br />
Fluoranteno N L +<br />
Pireno N L +<br />
Benzo(a)antraceno S S +<br />
Criseno L L +<br />
Benzo(e)pireno I L +<br />
Benzo(a)pireno S S +<br />
Perileno I I +<br />
Indeno(1,2,3-cd)pireno S I +<br />
Benzo(g,h,i)perileno I I +<br />
Dibenzo(a,h)antraceno S S +<br />
Coroneno I I +<br />
Fonte: Costa, 2001<br />
S = suficientes; I = insuficientes; L = limitados; N = não carcinogênico. Genotoxici<strong>da</strong>de foi avalia<strong>da</strong><br />
através dos testes de deterioração do DNA; aberração cromossômica e mutagenici<strong>da</strong>de.<br />
Mutagenici<strong>da</strong>de (teste de Ames): + (positivo), - (negativo).<br />
3.2.<br />
Metabolismo dos HPAs em peixes<br />
Para assegurar sua sobrevivência, os organismos desenvolveram<br />
mecanismos de defesa para a proteção de suas células na presença de
Toxici<strong>da</strong>de dos HPAs 34<br />
xenobióticos. Estes envolvem: a absorção, a distribuição, a biotransformação e a<br />
excreção <strong>da</strong>s substâncias estranhas.<br />
A absorção em peixes ocorre por várias rotas, incluindo a alimentação e o<br />
transporte direto através <strong>da</strong>s membranas externas, sendo então distribuídos<br />
para as diversas partes do corpo.<br />
A biotransformação (metabolização) geralmente leva a formação de<br />
compostos mais polares, portanto, mais hidrofílicos, consequentemente mais<br />
facilmente excretados do que seu composto original. O órgão mais comumente<br />
envolvido neste processo é o fígado. O fígado atua na emulsão de gorduras<br />
através <strong>da</strong> produção <strong>da</strong> bílis, na metabolização de substâncias presentes na<br />
corrente sanguínea e produção de vários compostos, como por exemplo,<br />
proteínas. Esta atuação é devi<strong>da</strong> a sua posição estratégica e por suas células<br />
(hepatócitos) estarem entre as células mais ricamente perfundi<strong>da</strong>s do organismo<br />
(Livingstone, 1998; van der Oost, 2003).<br />
A biotransformação geralmente envolve dois estágios distintos, referidos<br />
como reações <strong>da</strong> Fase I e <strong>da</strong> Fase II (Figura 3). Na Fase I, a biotransformação<br />
de xenobióticos ocorre através de reações de redução, hidrólise e/ou oxi<strong>da</strong>ção,<br />
sendo responsáveis por introduzir grupos funcionais no xenobiótico (Livingstone,<br />
1998). A principal reação é a oxi<strong>da</strong>ção, catalisa<strong>da</strong> principalmente pelo citocromo<br />
P-450 monooxigenase, pelas monoamino oxi<strong>da</strong>ses (MAO) e pelas flavinas<br />
monooxigenase (FMO) (Bastos, 2001).<br />
As monooxigenases do citocromo P-450 são hemeproteínas associa<strong>da</strong>s a<br />
membranas principalmente do retículo endoplasmático. O nome P-450 vem de P<br />
para pigmento e 450 para o comprimento de on<strong>da</strong> 450 nm, onde a absorção de<br />
luz é máxima quando ligados a uma carbonila (CO) (Newman & Unger, 2003).<br />
Na membrana, as isoenzimas estão associa<strong>da</strong>s ao NADPH citocromo P-450<br />
redutase que transfere elétrons ao conjunto de isoenzimas. Estas substâncias e<br />
a membrana fosfolipídica formam a uni<strong>da</strong>de responsável pela maior parte <strong>da</strong>s<br />
oxi<strong>da</strong>ções <strong>da</strong> Fase I através <strong>da</strong> reação (Newman & Unger, 2003):<br />
RH + NADPH + O 2 + H + → ROH +NADP + +H 2 O (3)<br />
onde:<br />
RH é um composto orgânico a ser hidroxilado e NADPH é nicotina-adeninadinucleotídeo<br />
fosfato.
Toxici<strong>da</strong>de dos HPAs 35<br />
FASE I<br />
FASE II<br />
Glicuroni<strong>da</strong>ção,<br />
Xenobiótico<br />
Oxi<strong>da</strong>ção,<br />
Redução, Hidrólise<br />
Monooxigenases do Cit. P-450<br />
Produtos<br />
Primários<br />
Sulfoconjugação,<br />
Conjugação com GSH<br />
GST, UGT,<br />
ST<br />
Produtos<br />
Secundários<br />
Monoaminooxi<strong>da</strong>des (MAO)<br />
Flavinas Monooxigenases<br />
Excreção<br />
Lipofílico<br />
Hidrofílico<br />
GST: Glutation S-transferases<br />
UGT: Uridina Difosfoglicuronosil transferases<br />
ST: Sulfotransferases<br />
Figura 3. Esquema de biotransformação de xenobióticos (a<strong>da</strong>ptado de Bastos, 2001).<br />
Segundo Newman & Unger (2003) as monooxigenases do citocromo P-450<br />
estão envolvi<strong>da</strong>s no metabolismo de uma grande varie<strong>da</strong>de de xenobióticos e<br />
também no metabolismo de ácidos graxos, colesterol e hormônios esteróides.<br />
Mu<strong>da</strong>nças bioquímicas associa<strong>da</strong>s a indução do citocromo P-450 foram usa<strong>da</strong>s<br />
por vários pesquisadores como biomarcadores na presença de contaminantes<br />
orgânicos tais como os HPAs (Eggens et al., 1996; Camus et al., 1998; Barra et<br />
al., 2001; Jewett et al., 2002).<br />
As reações de hidrólise são catalisa<strong>da</strong>s principalmente pelas epóxido<br />
hidrolases como também pelas pepti<strong>da</strong>ses e pelas A-estearases. As reduções<br />
são catalisa<strong>da</strong>s por várias enzimas, dentre elas as carbonil redutases e as<br />
glutation redutases, como também por processos não enzimáticos através de<br />
agentes redutores (Bastos, 2001).<br />
A Fase II freqüentemente envolve reações de conjugação na tentativa de<br />
neutralizar o xenobiótico. Estas reações de conjugação são catalisa<strong>da</strong>s pelas<br />
glutation S-transferases (GST), uridina difosfoglicuronosil transferases (UGT) e<br />
sulfotransferases (ST).
Toxici<strong>da</strong>de dos HPAs 36<br />
Além disso, em múltiplas reações metabólicas de transferência de elétrons<br />
em células aeróbicas são forma<strong>da</strong>s espécies reativas de oxigênio (ERO). Estas<br />
espécies reativas também podem resultar do metabolismo de certos<br />
xenobióticos e causam peroxi<strong>da</strong>ção de lipídios, alterações em proteínas e em<br />
ácidos nucléicos, produzindo <strong>da</strong>nos às células. A proteção contra estas ERO é<br />
feita pelas enzimas superóxido dismutase, catalase, GST, glutation peroxi<strong>da</strong>se<br />
selênio-dependente, aldo-ceto redutase e enzimas de reparo do DNA.<br />
Em geral, o aumento <strong>da</strong> polari<strong>da</strong>de <strong>da</strong> molécula leva à per<strong>da</strong> do potencial<br />
tóxico do composto sendo biotransformado, levando a desintoxicação. Porém,<br />
em alguns casos, pode ocorrer a ativação metabólica <strong>da</strong> molécula e o<br />
xenobiótico pode ser convertido em um produto com maior potencial tóxico<br />
(bioativação).<br />
Atualmente, o mecanismo mais aceito para a ativação dos HPAs é a<br />
oxi<strong>da</strong>ção enzimática segui<strong>da</strong> de hidrólise com a formação de diolepóxidos<br />
(Figura 4). A ligação entre os diolepóxidos, resultantes <strong>da</strong> ativação metabólica<br />
destas substâncias, e o DNA é favoreci<strong>da</strong> quando diolepóxidos vicinais são<br />
formados, principalmente nas moléculas não lineares, que contenham regiões de<br />
baía, como o benzo(a)pireno (Figura 5) (Pereira Netto et al., 2000; Bastos, 2001;<br />
Hosnedl et al., 2003).<br />
Figura 4. Mecanismo de ativação dos HPAs. (A<strong>da</strong>ptado de Pereira Netto et al., 2000)
Toxici<strong>da</strong>de dos HPAs 37<br />
Figura 5. Representação esquemática simplifica<strong>da</strong> do metabolismo do benzo[a]pireno.<br />
3.2.1.<br />
O metabolismo do pireno<br />
Como nesta dissertação o composto usado como referência é o pireno é<br />
importante conhecermos os metabólitos que são gerados na sua biotransformação.<br />
Apesar de não ser considerado tóxico, o pireno é muito usado como<br />
referência pela relativa simplici<strong>da</strong>de <strong>da</strong> sua biotransformação e por sua<br />
abundância no meio ambiente aquático.<br />
O principal metabólito gerado na Fase I é o 1-hidroxipireno já que, por ser<br />
simétrica, a hidroxilação na molécula de pireno se dá preferencialmente nos<br />
átomos de carbono C-1, C-3, C-6 e C-8 (Figura 6) sendo o metabólito obtido em<br />
todos os casos chamado de 1-hidroxipireno (Luthe et al., 2002). Na Fase II é<br />
formado principalmente o metabólito pireno-1-glucoronídeo (Bains & Kennedy,<br />
2004) e em menor quanti<strong>da</strong>de o pireno-1-sulfato que são então excretados na<br />
bílis dos peixes.
Toxici<strong>da</strong>de dos HPAs 38<br />
Figura 6. Estrutura do pireno.<br />
3.3.<br />
A bílis e a formação de biliverdina<br />
3.3.1.<br />
A bílis<br />
Uma <strong>da</strong>s funções do fígado é a formação de bílis. A bílis desempenha<br />
papel importante na digestão e absorção de gorduras, aju<strong>da</strong>ndo a emulsificar as<br />
grandes moléculas de gordura transformando-as em moléculas menores. Além<br />
disso, a bílis serve como meio de excreção de xenobióticos, entre outras<br />
substâncias (Guyton & Hall, 2002; Kierszenbaum, 2004).<br />
A eliminação biliar de xenobióticos foi pouco estu<strong>da</strong><strong>da</strong> durante a primeira<br />
metade do século XX. A partir de 1950, com o aparecimento de uma grande<br />
varie<strong>da</strong>de de substâncias químicas sintéticas, foi reconheci<strong>da</strong> a importância <strong>da</strong><br />
bílis como via de excreção destes compostos (Klaassen & Watkins, 1984).<br />
A bílis é secreta<strong>da</strong> pelos hepatócitos, células funcionais metabólicas do<br />
fígado. Esta secreção é forma<strong>da</strong> por ácidos biliares, colesterol e outros<br />
constituintes orgânicos. Em segui<strong>da</strong>, a bílis flui pelos canalículos biliares (Figura<br />
7) até atingir o ducto hepático e o colédoco, podendo ser libera<strong>da</strong> diretamente no<br />
duodeno e principalmente desvia<strong>da</strong> para a vesícula biliar (Guyton & Hall, 2002).<br />
Segundo os autores op citem, a bílis inicial recebe uma segun<strong>da</strong> secreção<br />
aquosa de íons sódio e bicarbonato a fim de neutralizar o ácido proveniente do<br />
estômago que deságua no duodeno. Em condições normais esta se encontra<br />
concentra<strong>da</strong> na vesícula biliar por cerca de cinco vezes, podendo chegar a um<br />
máximo de 20 vezes.
Toxici<strong>da</strong>de dos HPAs 39<br />
Figura 7. canalículo bilífero (Kierszenbaum, 2004).<br />
A bílis é forma<strong>da</strong> basicamente de água (~97%) e sais biliares (1-2%),<br />
quando secreta<strong>da</strong> pelo fígado. Na vesícula biliar o conteúdo de água diminuiu<br />
para 87% como resultado de sua concentração. São encontra<strong>da</strong>s outras<br />
substâncias tais como os pigmentos biliares, biliverdina e bilirrubina, substâncias<br />
deriva<strong>da</strong>s <strong>da</strong> degra<strong>da</strong>ção <strong>da</strong> hemoglobina, além de metabólitos de xenobióticos.<br />
Quando o peixe se alimenta, o início <strong>da</strong> digestão na porção superior do<br />
trato gastrintestinal leva ao esvaziamento <strong>da</strong> vesícula biliar, sobretudo quando<br />
alimentos gordurosos chegam ao duodeno. Acredita-se que ao esvaziar a<br />
mesma se encha rapi<strong>da</strong>mente de água, diminuindo a concentração de<br />
xenobióticos presentes (Richardson et al., 2004).<br />
Dessa forma, um peixe que passe maior período de tempo sem se<br />
alimentar terá maior quanti<strong>da</strong>de de metabólitos de HPAs sulfatados e<br />
glicuroni<strong>da</strong>dos na vesícula biliar (Beyer et al., 1997; Richardson et al., 2004) e,<br />
consequentemente, maior concentração de HPAs na bílis, quando comparado a<br />
outro recém alimentado.<br />
As quanti<strong>da</strong>des de biliverdina e de proteína biliar, indicativos de densi<strong>da</strong>de<br />
<strong>da</strong> bílis, podem ser utiliza<strong>da</strong>s como indicadores <strong>da</strong> situação (status) alimentar do<br />
peixe.<br />
3.3.2.<br />
A formação de biliverdina<br />
A principal função dos eritrócitos (hemácias) consiste em transportar<br />
hemoglobina, esta é responsável pelo transporte de oxigênio para os tecidos.
Toxici<strong>da</strong>de dos HPAs 40<br />
Quando a membrana eritrocitária dos eritrócitos se torna frágil, as células se<br />
rompem durante sua passagem por algum ponto estreito <strong>da</strong> circulação, liberando<br />
a hemoglobina que é quase imediatamente fagocita<strong>da</strong> por macrófagos do<br />
sistema reticuloendotelial. Isto ocorre em muitas partes do organismo porém,<br />
particularmente pelas células de Kupffer do fígado e por macrófagos no baço e<br />
na medula óssea, liberando globina e heme (Guyton & Hall, 2002).<br />
O anel heme é oxi<strong>da</strong>do a α-meso-hidroxiheme, que no estado<br />
desprotonado tem características de radical livre, reagindo com oxigênio para<br />
produzir verdoheme e carbonila (Figura 8). A verdoheme é então, converti<strong>da</strong> a<br />
biliverdina e ferro livre em uma reação que requer um NADPH-citocromo P-450-<br />
redutase e O 2 . A liberação <strong>da</strong> biliverdina é uma etapa lenta, mas que pode ser<br />
acelera<strong>da</strong> na presença de biliverdina redutase, enzima que converte a biliverdina<br />
em bilirrubina (Montellano, 2000), sendo então, gradualmente libera<strong>da</strong> no plasma<br />
pelos macrófagos (Guyton & Hall, 2002).<br />
A biliverdina é responsável pela pigmentação característica de alguns<br />
peixes, anfíbios, répteis e insetos e pela coloração <strong>da</strong> casta do ovo de alguns<br />
pássaros (Colleran & Heirwegh, 1979).<br />
Em mamíferos os pigmentos biliares não parecem ter nenhum papel<br />
funcional claro. Eles aparentemente servem como produtos finais do catabolismo<br />
<strong>da</strong> heme <strong>da</strong> hemoglobina, destinados à rápi<strong>da</strong> excreção.<br />
Figura 8. Oxi<strong>da</strong>ção do anel heme até a formação de biliverdina.
4<br />
Monitoramento ambiental<br />
O monitoramento ambiental é uma importante ferramenta para a<br />
administração dos recursos naturais. Este oferece conhecimento e informações<br />
básicas para avaliar a presença de contaminantes, para compreender os<br />
sistemas ambientais e para <strong>da</strong>r suporte as políticas ambientais.<br />
O monitoramento consiste em observações repeti<strong>da</strong>s de uma substância<br />
química químico ou mu<strong>da</strong>nça biológica, com um propósito definido de acordo<br />
com um planejamento prévio ao longo do tempo e espaço, utilizando métodos<br />
comparáveis e padronizados. Segundo van der Oost e colaboradores (2003), os<br />
cinco métodos de monitoramento ambiental que devem ser seguidos para avaliar<br />
o risco de contaminantes para os organismos e classificar a quali<strong>da</strong>de ambiental<br />
dos ecossistemas são:<br />
- monitoramento químico – avalia a exposição medindo os níveis de<br />
contaminantes bem conhecidos nos compartimentos ambientais;<br />
- monitoramento <strong>da</strong> bioacumulação – avalia a exposição medindo os níveis<br />
de contaminantes na biota ou determinando a dose crítica no local de<br />
interesse (bioacumulação);<br />
- monitoramento do efeito biológico – avalia a exposição e o efeito<br />
determinando as primeiras alterações adversas que são parcial ou<br />
totalmente reversíveis (biomarcadores);<br />
- monitoramento <strong>da</strong> saúde – avalia o efeito através do exame <strong>da</strong> ocorrência<br />
de doenças irreversíveis ou <strong>da</strong>nos no tecido dos organismos;<br />
- monitoramento dos ecossistemas – avalia a integri<strong>da</strong>de de um<br />
ecossistema através de um inventário de composição, densi<strong>da</strong>de e<br />
diversi<strong>da</strong>de <strong>da</strong>s espécies, entre outros.
Monitoramento ambiental 42<br />
Quando organismos vivos são usados no monitoramento ambiental para<br />
avaliar mu<strong>da</strong>nças no meio ambiente ou na quali<strong>da</strong>de <strong>da</strong> água o monitoramento é<br />
chamado de monitoramento biológico ou biomonitoramento. Para que um<br />
biomonitoramento seja bem sucedido é importante a escolha do biomonitor que<br />
aten<strong>da</strong> as seguintes características (Figueira, 2006):<br />
• capaci<strong>da</strong>de de acumulação mensurável <strong>da</strong> substância química de<br />
interesse;<br />
• distribuição generaliza<strong>da</strong> na área de estudo;<br />
• ausência de variações sazonais na quanti<strong>da</strong>de disponível para<br />
amostragem;<br />
• capaci<strong>da</strong>de de acumulação diferencia<strong>da</strong> do poluente, relacionando a<br />
intensi<strong>da</strong>de de exposição ao fator ambiental. Esta relação deve poder ser<br />
descrita de uma forma quantitativa ou semi-quantitativa;<br />
• ausência de variações sazonais na capaci<strong>da</strong>de de acumulação;<br />
• acumulação <strong>da</strong> substância química apenas pela via que se quer avaliar;<br />
• identificação taxonômica fácil;<br />
• que tenha sua fisiologia, ecologia e morfologia suficientemente estu<strong>da</strong><strong>da</strong>.<br />
Assim, durante o biomonitoramento são utilizados biomarcadores<br />
(celulares, tecido, fluidos corporais, mu<strong>da</strong>nças bioquímicas, entre outros) para<br />
indicar a presença de poluentes ou como sistema de aviso de efeitos iminentes.<br />
4.1.<br />
Biomarcadores<br />
O biomarcador é uma característica que pode ser: bioquímica, fisiológica,<br />
morfológica ou histológica, utiliza<strong>da</strong> para indicar a exposição ou o(s) efeito(s) de<br />
uma substância sobre o organismo de um ser vivo. A quali<strong>da</strong>de de um<br />
biomarcador está relaciona<strong>da</strong> a capaci<strong>da</strong>de de uma mu<strong>da</strong>nça ser medi<strong>da</strong> antes<br />
que alguma consequência adversa significativa ocorra no organismo de<br />
interesse. Um biomarcador ideal deve ser específico para um composto ou<br />
classe de compostos, podendo ser utilizado em diferentes espécies (IPCS,<br />
1993).
Monitoramento ambiental 43<br />
Convém salientar que é necessário que o sistema envolvido seja bem<br />
conhecido para que se possa interpretar a influência que o meio ambiente<br />
exerce sobre ele.<br />
A ordem seqüencial de resposta ao estresse causado por um poluente em<br />
um sistema biológico é visualizado na Figura 9. O efeito em nível hierárquico<br />
superior é sempre precedido por mu<strong>da</strong>nças no processo biológico. Desta forma,<br />
o biomarcador é utilizado como um sinal prévio refletindo a resposta biológica<br />
causa<strong>da</strong> por uma toxina.<br />
primeiros sinais<br />
(biomarcadores)<br />
molecular<br />
subcelular (organelas)<br />
Exposição a um<br />
poluente<br />
celular<br />
tecido<br />
sistêmico (órgãos)<br />
organismo<br />
efeitos tardios<br />
Figura 9. Representação esquemática <strong>da</strong> ordem sequencial de respostas ao estresse<br />
causado por poluentes em um sistema biológico (a<strong>da</strong>ptado de van der Oost et al., 2003).<br />
Biomarcadores podem ser divididos em três classes (National Research<br />
Council, 2003; IPCS, 1993):<br />
- biomarcadores de exposição: são aqueles que detectam e<br />
mensuram a quanti<strong>da</strong>de de uma substância exógena, seus<br />
metabólitos ou o produto <strong>da</strong> interação entre o xenobiótico e a<br />
molécula ou célula alvo em um compartimento do organismo;<br />
- biomarcadores de efeito: são aqueles que incluem alterações<br />
bioquímicas, fisiológicas ou outra alteração nos tecidos ou fluidos
Monitoramento ambiental 44<br />
corporais de um organismo que podem ser reconhecidos e<br />
associados com uma doença ou possível prejuízo a saúde;<br />
- biomarcadores de suscetibili<strong>da</strong>de: são aqueles que indicam a<br />
habili<strong>da</strong>de adquiri<strong>da</strong> ou inerente de um organismo a responder a<br />
exposição a um xenobiótico específico, incluindo fatores genéticos e<br />
mu<strong>da</strong>nças nos receptores que alteram a suscetibili<strong>da</strong>de de um<br />
organismo a uma <strong>da</strong><strong>da</strong> exposição.<br />
Os biomarcadores de exposição podem ser usados para confirmar ou<br />
estimar a exposição de indivíduos ou de uma população a uma determina<strong>da</strong><br />
substância ou grupo de substâncias fornecendo uma relação entre a exposição<br />
externa e a dose interna. De acordo com a definição, a bioacumulação de certos<br />
contaminantes persistentes em tecido de animais pode ser considera<strong>da</strong> com um<br />
biomarcador de exposição.<br />
Os biomarcadores de efeito podem ser usados para documentar<br />
alterações pré-clínicas ou efeitos adversos a saúde devido a exposição externa e<br />
absorção de determina<strong>da</strong> substância.<br />
Os biomarcadores de suscetibili<strong>da</strong>de aju<strong>da</strong>m a eluci<strong>da</strong>r a variação no grau<br />
de resposta <strong>da</strong> exposição a substâncias tóxicas observa<strong>da</strong>s em diferentes<br />
indivíduos.<br />
O uso de biomarcadores de peixes no estudo <strong>da</strong> resposta biológica e<br />
bioquímica a contaminantes tem atraído grande interesse já que podem ser<br />
encontrados praticamente em todos os ambientes aquáticos e desempenham<br />
importante papel na cadeia alimentar, já que têm a função de transportar energia<br />
de níveis tróficos inferiores para níveis superiores (Beyer et al., 1996).<br />
No entanto, as variações na fisiologia de diferentes espécies de peixes<br />
podem repercutir de forma diferencia<strong>da</strong> nas respostas de um biomarcador.<br />
Apesar disso e de sua alta mobili<strong>da</strong>de, peixes são considerados bons<br />
organismos para o monitoramento <strong>da</strong> poluição em ambientes aquáticos.<br />
Baseados nos critérios formulados por Stegeman e colaboradores (1992),<br />
van der Oost e colaboradores (2003) propõem seis critérios que devem ser<br />
observados para avaliar um biomarcador em peixes:<br />
(1) Confiabili<strong>da</strong>de na quantificação do biomarcador (com controle de<br />
quali<strong>da</strong>de) resultante de ensaios simples e de baixo custo;
Monitoramento ambiental 45<br />
(2) Sensibili<strong>da</strong>de <strong>da</strong> resposta do biomarcador a exposição ou a efeitos de<br />
poluentes utilizados como parâmetros de aviso;<br />
(3) Definição clara dos <strong>da</strong>dos de base de modo a permitir a distinção<br />
entre a variabili<strong>da</strong>de natural (ruído) e o estresse induzido pelo<br />
contaminante (sinal);<br />
(4) Conhecimento dos fatores que possam dificultar a interpretação <strong>da</strong><br />
resposta do biomarcador à exposição ao poluente;<br />
(5) Estabelecimento do mecanismo de relação entre a resposta do<br />
biomarcador e a exposição ao poluente (dosagem e tempo);<br />
(6) Estabelecimento do valor toxicológico do biomarcador, tal como a<br />
relação entre sua resposta e o impacto ao organismo.
5<br />
Ecologia e biologia do peixe Mugil liza (tainha)<br />
5.1.<br />
Mugil liza (tainha)<br />
Nesta dissertação serão feitos estudos para a medição de metabólitos de<br />
HPAs na bílis de tainhas, sendo este um dos peixes mais comuns na região <strong>da</strong><br />
Baía de Guanabara, de fácil captura e cuja vesícula biliar é de fácil localização.<br />
Para evitar variações no metabolismo entre indivíduos de diferentes espécies <strong>da</strong><br />
mesma família, a espécie escolhi<strong>da</strong> para estudo foi Mugil liza Valenciennes,<br />
1836 que tem a seguinte taxonomia:<br />
Classe OSTEICHTHYES<br />
Subclasse ACTINOPTERYGII<br />
Subdivisão TELEOSTEI<br />
Série PERCOMORPHA<br />
Ordem Perciformes<br />
Família Mugili<strong>da</strong>e<br />
Gênero Mugil<br />
Espécie liza<br />
A classe Osteichthyes corresponde a classe dos peixes ósseos, onde a<br />
subclasse Actinopterygii corresponde aos peixes com na<strong>da</strong>deira de raios e<br />
aberturas branquiais protegi<strong>da</strong>s por um opérculo ósseo.<br />
Os teleósteos constituem o último grupo dos peixes de na<strong>da</strong>deira raia<strong>da</strong> e<br />
são atualmente os peixes dominantes. Sua na<strong>da</strong>deira cau<strong>da</strong>l é simétrica,<br />
embora o eixo ain<strong>da</strong> se curve para cima. As na<strong>da</strong>deiras pares são pequenas; as<br />
peitorais podem atuar como freio e as na<strong>da</strong>deiras pélvicas estão freqüentemente<br />
localiza<strong>da</strong>s bem à frente. Os teleósteos são os mais numerosos dos vertebrados,<br />
devendo-se em parte, a uma eficiente organização corporal e reprodução.<br />
Devido à sua abundância, constituem uma importante fonte de alimento para o<br />
homem.
Ecologia e biologia do peixe Mugil liza 47<br />
Os peixes <strong>da</strong> família Mugili<strong>da</strong>e têm ampla distribuição, ocorrendo em<br />
águas tropicais e subtropicais de todo o mundo, principalmente nas regiões<br />
costeiras estuarinas (Fishbase, 2005). São peixes detritívoros que se alimentam<br />
de material orgânico derivado de corpos de organismos mortos ou fragmentos<br />
destes e excreções deixa<strong>da</strong>s por organismos vivos. Além disso, uma grande<br />
varie<strong>da</strong>de de invertebrados pode ocorrer no detrito (Oliveira, 1997).<br />
No sudeste do Brasil ocorre apenas o gênero Mugil, representado por sete<br />
espécies (Menezes, 1983). Na identificação <strong>da</strong>s espécies a contagem de<br />
escamas ao longo <strong>da</strong>s séries laterais do corpo é feita a partir <strong>da</strong> escama que fica<br />
imediatamente acima <strong>da</strong> base <strong>da</strong> na<strong>da</strong>deira peitoral e atrás <strong>da</strong> margem<br />
membranosa superior do opérculo até a base cau<strong>da</strong>l, sem incluir as pequenas<br />
escamas que recobrem a base dos raios medianos <strong>da</strong> na<strong>da</strong>deira cau<strong>da</strong>l.<br />
A espécie Mugil liza foi primeiro descrita por Valenciennes em 1836. Esta<br />
espécie possui corpo alongado, fusiforme, com estrias escuras longitudinais<br />
alterna<strong>da</strong>s com estrias claras e a ausência quase total de escamas nas<br />
na<strong>da</strong>deiras anal e segun<strong>da</strong> dorsal (Figura 10). Sua maturi<strong>da</strong>de sexual é atingi<strong>da</strong><br />
quando seu tamanho chega a aproxima<strong>da</strong>mente 40 cm (Menezes, 1983).<br />
Figura 10. Mugil liza.<br />
A espécie é pelágica, vivendo na coluna d’água ou na superfície, os jovens<br />
permanecem no estuário, ambientes calmos, abrigados e ricos em alimentos, até<br />
que suas gôna<strong>da</strong>s iniciem a maturação. Sua desova ocorre em alto mar, porém<br />
uma fase estuarial é obrigatória para os juvenis, à qual se segue o período de<br />
migração reprodutiva para o mar (Bizerril & Costa, 2001).<br />
A Mugil liza forma grandes cardumes, principalmente durante a migração<br />
reprodutiva, quando entram nos estuários, que são áreas onde a boca do rio<br />
entra no mar, havendo mistura de água doce e salga<strong>da</strong>.
Ecologia e biologia do peixe Mugil liza 48<br />
5.2.<br />
Análise biométrica<br />
A Análise Biométrica ou Biometria é dividi<strong>da</strong> em análises merísticas, que<br />
analisa tudo que pode ser contado, e análise morfométrica, que analisa tudo que<br />
pode ser medido.<br />
Como informação básica que permitisse garantir a homogenei<strong>da</strong>de dos<br />
indivíduos <strong>da</strong> espécie estu<strong>da</strong><strong>da</strong> (uni<strong>da</strong>des amostrais) foi feita a análise<br />
morfométrica a partir <strong>da</strong>s seguintes grandezas (Figura 11):<br />
a) Comprimento total (L T ): obtido com o exemplar colocado com o flanco<br />
direito sobre o ictiômetro, com o focinho encostado ao braço vertical do mesmo.<br />
Considera-se a medição horizontal <strong>da</strong> ponta do focinho à maior extremi<strong>da</strong>de <strong>da</strong><br />
na<strong>da</strong>deira cau<strong>da</strong>l;<br />
b) Comprimento padrão (L P ): distância <strong>da</strong> ponta do focinho à porção<br />
distal do pedúnculo cau<strong>da</strong>l (base dos raios <strong>da</strong> na<strong>da</strong>deira cau<strong>da</strong>l);<br />
c) Comprimento <strong>da</strong> cabeça (L C ): distância <strong>da</strong> ponta do focinho à margem<br />
posterior do opérculo;<br />
d) Altura do corpo (A C ): distância vertical, em ângulo reto com o eixo<br />
longitudinal do peixe, entre os contornos dorsal e ventral do corpo, na altura <strong>da</strong><br />
inscrição <strong>da</strong> na<strong>da</strong>deira peitoral, obti<strong>da</strong> a partir de um paquímetro;<br />
Figura 11. Diagrama do corpo do peixe e as medi<strong>da</strong>s utiliza<strong>da</strong>s.<br />
Além destas variáveis, obteve-se também o peso total do exemplar (W T ),<br />
antes de qualquer manipulação.
Ecologia e biologia do peixe Mugil liza 49<br />
5.2.1.<br />
Estimativa do Peso Total (W T ) e Comprimento Padrão (L P )<br />
Segundo Vazzoler (1982) é de fun<strong>da</strong>mental importância para o estudo do<br />
ciclo de vi<strong>da</strong> de uma população conhecer seu crescimento e peso. Populações<br />
distintas de uma mesma espécie apresentam taxas diferentes de crescimento e<br />
peso.<br />
Para estimar o peso total do peixe (W T ) a partir do seu comprimento<br />
padrão (L P ) utiliza-se a seguinte equação:<br />
W T = α ⋅ L P<br />
β<br />
(4)<br />
com α e β obtidos após a transformação logarítmica <strong>da</strong> equação acima:<br />
log (W T ) = log (α) + β log (L P ) (5)<br />
Inicialmente, os valores de peso e comprimento padrão são obtidos para<br />
sexos em separado. Esta separação é necessária devido à uma ocorrência mais<br />
generaliza<strong>da</strong> de dimorfismo relacionado com a estratégia de reprodução, visto<br />
que a fecundi<strong>da</strong>de aumenta com o comprimento dos indivíduos (Okumus &<br />
Bascinar, 1997; Lowe-McConnell, 1999).<br />
Ajusta-se aos <strong>da</strong>dos a equação (2) e aplicando o teste t-student aos<br />
valores de α e β relativos à regressão entre sexos para constar diferença entre<br />
ambos. Quando não há diferença significativa os <strong>da</strong>dos podem ser agrupados e<br />
calcula-se a expressão para a espécie.<br />
5.2.2.<br />
Fator de condição (K)<br />
O estado fisiológico de um peixe é condicionado pela interação de fatores<br />
bióticos e abióticos, sendo a variação nesse estado expressa através do Fator<br />
de Condição (K). Este fator indica condições alimentares recentes e varia<br />
durante o ciclo de maturi<strong>da</strong>de sexual de um peixe.
Ecologia e biologia do peixe Mugil liza 50<br />
Admite-se que o peixe cresce isometricamente em to<strong>da</strong>s as dimensões,<br />
sendo os valores do fator de condição comparáveis somente quando os mesmos<br />
são sexualmente maduros.<br />
O Fator de Condição aqui considerado é o alométrico, que é expresso<br />
pela relação:<br />
W<br />
K = (6)<br />
L<br />
T<br />
β<br />
P<br />
onde W T é o peso total (g) e L P é o comprimento padrão do peixe (cm).<br />
Outros índices usados com o mesmo fim são os índices gona<strong>da</strong>l (IG) e o<br />
de maturi<strong>da</strong>de (IM), <strong>da</strong>dos por:<br />
W<br />
IG = (7)<br />
L<br />
G<br />
3<br />
T<br />
W<br />
G<br />
IM = (8)<br />
L<br />
C<br />
onde W G é o peso <strong>da</strong>s gôna<strong>da</strong>s e W C = W T – W G .<br />
5.3.<br />
Órgãos reprodutores<br />
Para a identificação dos órgãos reprodutores deve-se realizar uma incisão<br />
cui<strong>da</strong>dosa para não atingir e <strong>da</strong>nificar os órgãos internos. Na cavi<strong>da</strong>de<br />
abdominal localizam-se:<br />
Testículos: em geral apresentam forma alonga<strong>da</strong>, sendo na fase inicial de<br />
desenvolvimento tubulares; nas fases seguintes apresentam lobulares. A<br />
coloração é esbranquiça<strong>da</strong>;
Ecologia e biologia do peixe Mugil liza 51<br />
Ovários: apresentam forma alonga<strong>da</strong>-tubular; nas fases iniciais são<br />
translúcidos e nas seguintes sua coloração varia de amarelo, amarelo-rosado e<br />
avermelhado. Após as fases iniciais de desenvolvimento, os ovócitos tornam-se<br />
visíveis.<br />
5.3.1.<br />
Estágios de maturação sexual<br />
Os estágios de maturi<strong>da</strong>de <strong>da</strong>s gôna<strong>da</strong>s são classificados utilizando um<br />
estereomicroscópio, com a escala proposta por Vazzoler (1982) como:<br />
a) Imaturos: os ovários são filiformes, translúcidos, de tamanho reduzido,<br />
juntos a coluna vertebral; a olho nu não se observam os ovócitos. Os testículos<br />
também são reduzidos, filiformes, com posição semelhante a dos ovócitos;<br />
b) Em maturação: os ovários ocupam cerca de 1/3 a 2/3 <strong>da</strong> cavi<strong>da</strong>de<br />
abdominal, com intensa rede capilar; a olho nu observam-se grânulos opacos de<br />
tamanho variado, os ovócitos. Os testículos, do mesmo modo que os ovários,<br />
apresentam-se desenvolvidos, com forma lobula<strong>da</strong>, sendo que, com uma certa<br />
pressão, sua membrana rompe-se eliminando esperma leitoso, viscoso;<br />
c) Maduro: os ovários aparecem túrgidos, ocupam quase que totalmente<br />
a cavi<strong>da</strong>de abdominal; a olho nu observam-se ovócitos maduros que se<br />
apresentam como grânulos esféricos e opacos e/ou translúcidos e grandes, cuja<br />
freqüência varia com o progresso <strong>da</strong> maturação. Os testículos também<br />
aparecem túrgidos, ocupam quase que totalmente a cavi<strong>da</strong>de abdominal; com<br />
uma fraca pressão, sua membrana rompe-se eliminando esperma menos<br />
viscoso que o estado anterior;<br />
d) Esvaziado: os ovários apresentam-se com aspecto hemorrágico,<br />
completamente flácidos, ocupando menos 1/3 <strong>da</strong> cavi<strong>da</strong>de abdominal,<br />
observando-se poucos ovócitos, em estado de reabsorção. Os testículos<br />
também apresentam-se flácidos, com aspecto hemorrágico; a membrana não se<br />
rompe sob fraca pressão;
Ecologia e biologia do peixe Mugil liza 52<br />
e) Em repouso: tem caracterização macroscópica bastante difícil, por<br />
apresentarem aspectos semelhantes ao aspecto B, contudo suas membranas<br />
são mais espessas ocorrendo em exemplares acima de 200 mm em épocas bem<br />
defini<strong>da</strong>s do ano.<br />
Os ovários no estágio D ocorrem em baixíssima freqüência,<br />
provavelmente, devido a curta duração desta fase.<br />
A proporção entre jovens e adultos entre as diferentes épocas e locais de<br />
coleta pode indicar períodos e áreas de recrutamento, assim pode-se considerar<br />
peixes jovens como aqueles tiveram o estágio de maturi<strong>da</strong>de gono<strong>da</strong>l<br />
classificado como imaturo (A) e adultos aqueles nos demais estágios.
6<br />
Determinação de HPAs em peixes<br />
Várias técnicas analíticas têm sido usa<strong>da</strong>s para determinar os níveis de<br />
HPAs e seus metabólitos em peixes. As técnicas mais comumente usa<strong>da</strong>s<br />
incluem a cromatografia gasosa com detector de ionização de chama (CG/FID),<br />
cromatografia em fase gasosa acopla<strong>da</strong> a espectrometria de massas (CG/EM),<br />
cromatografia em fase líqui<strong>da</strong> de alta eficiência com detector de ultravioleta ou<br />
de fluorescência (CLAE/UV, CLAE/F), cromatografia de cama<strong>da</strong> fina com<br />
detector de fluorescência. Além destas técnicas quantitativas podem ser usa<strong>da</strong>s<br />
técnicas semi-quantitativas de fluorescência, técnicas de imunoensaio, entre<br />
outras.<br />
Como matrizes podemos ter o tecido de diversos órgãos, e fluidos<br />
biológicos como sangue e bílis. Por ser uma matriz complexa, a análise do tecido<br />
exige uma etapa de extração dos HPAs <strong>da</strong> matriz e “clean up” antes <strong>da</strong> análise<br />
propriamente dita, sendo um procedimento caro e demorado. Já a análise <strong>da</strong><br />
bílis do peixe é uma técnica mais simples pois não são necessárias etapas de<br />
extração.<br />
6.1.<br />
Técnicas de extração e clean-up<br />
O objetivo <strong>da</strong> extração é separar o HPA <strong>da</strong> matriz, com mínima coextração<br />
de outros compostos e mínima degra<strong>da</strong>ção do HPA extraído. As amostras<br />
devem ser extraí<strong>da</strong>s o mais rápido possível após sua coleta, para minimizar a<br />
degra<strong>da</strong>ção, sublimação e outras rotas de per<strong>da</strong> dos HPAs. Como exemplo de<br />
per<strong>da</strong> por armazenagem temos a adsorção de HPAs nas paredes dos frascos de<br />
vidro de amostras aquosas. Já em solventes orgânicos o HPA parece ser estável<br />
(Bjørseth, 1983).<br />
Como os HPAs se degra<strong>da</strong>m facilmente na presença de radiação ultravioleta,<br />
deve-se evitar expor as amostras durante as etapas de extração e<br />
análise, a fim de evitar sua fotodecomposição. A degra<strong>da</strong>ção térmica e a
Determinação de HPAs em peixes 54<br />
sublimação também podem causar per<strong>da</strong>s de HPA durante a extração. É<br />
recomen<strong>da</strong>do que sejam usados solventes relativamente voláteis em<br />
procedimentos de refluxo ou destilação para permitir a concentração do extrato<br />
em baixas temperaturas. Manter a temperatura abaixo de 45 o C reduz ou até<br />
elimina as per<strong>da</strong>s de HPAs. Mas, a per<strong>da</strong> de HPAs com dois anéis pode chegar<br />
até a 80% na concentração do extrato por evaporador rotativo (Bjørseth, 1983).<br />
Os métodos de extração mais comuns são:<br />
• Extração com solvente: Soxhlet, ultra-som, extração mecânica de<br />
alta intensi<strong>da</strong>de e extração líquido-líquido;<br />
• Extração por métodos térmicos: sublimação e destilação;<br />
• Extração em fase sóli<strong>da</strong>: carbono, resinas macroreticulares, sílica<br />
gel, florisil, alumina, fase sóli<strong>da</strong> liga<strong>da</strong> a sílica;<br />
• Métodos de digestão.<br />
Na extração com solvente, a eficiência <strong>da</strong> extração dos HPAs depende <strong>da</strong><br />
polari<strong>da</strong>de do solvente usado, <strong>da</strong> natureza <strong>da</strong> matriz e <strong>da</strong> preparação <strong>da</strong>s<br />
amostras.<br />
Matrizes complexas como alimentos contém uma série de compostos<br />
hidrofóbicos e é necessário que haja uma etapa de clean-up para que estes<br />
sejam removidos.<br />
Para o clean-up de amostras existe uma série de procedimentos que<br />
podem ser usados tais como: fracionamento solvente:solvente, extração em fase<br />
sóli<strong>da</strong>, cromatografia de cama<strong>da</strong> fina, cromatografia em coluna e cromatografia<br />
por exclusão. Um dos métodos mais eficientes e seletivos é a coluna<br />
cromatográfica com Al 2 O 3·H 2 O de ativi<strong>da</strong>de IV. Eluentes como o hexano,<br />
extraem todos os hidrocarbonetos alifáticos e aromáticos não polares enquanto<br />
os componentes que correspondem a maior quanti<strong>da</strong>de de material dissolvido,<br />
como os lipídios, ficam adsorvidos na coluna. Este procedimento foi sugerido<br />
como método de escolha para o padrão ISO (Stolyhwo & Sikorski, 2005). Já para<br />
matrizes de alto teor de lipídio, foi demonstrado que o uso <strong>da</strong> cromatografia por<br />
permeação em gel, embora seja uma técnica mais cara, dá melhores resultados<br />
(Rizel, 2003).
Determinação de HPAs em peixes 55<br />
6.2.<br />
Determinação de HPAs em bílis de peixe<br />
Como o metabolismo de vertebrados é eficaz na biotransformação e<br />
eliminação de HPAs, eles não se acumulam no tecido de peixes. Assim, os<br />
níveis de HPAs no tecido não são considerados um bom marcador de<br />
bioacumulação destes compostos já que não refletem os níveis destes<br />
xenobióticos no meio ambiente (van der Oost et al., 2003). Assim, vários<br />
cientistas passaram a usar a análise de metabólitos de HPAs em bílis de peixe<br />
para monitorar o meio ambiente e demonstrar sua correlação com a exposição a<br />
estes compostos (Krahn et al, 1984; Beyer et al., 1996, 1998; Lin et al., 1996;<br />
Aas et al., 1998, 2000; Verweij et al., 2004; Haugland et al., 2005).<br />
Neste tipo de análise os compostos presentes na bílis são metabólitos,<br />
produto <strong>da</strong> biotransformação dos HPAs no seu fígado, sendo compostos<br />
hidroxilados e conjugados. Estes metabólitos refletem a exposição dos peixes<br />
aos HPAs de 2 a 3 dias, onde a migração dos peixes não deve exercer influência<br />
nos resultados (Ariese et al., 1993).<br />
O primeiro trabalho onde os metabólitos de HPAs na bílis de peixe foram<br />
usados como biomarcadores foi publicado em 1984 por Krahn e colaboradores.<br />
Neste trabalho foi usa<strong>da</strong> a Cromatografia Líqui<strong>da</strong> de Alta Eficiência com detector<br />
de fluorescência (CLAE-F), sem a separação completa ou identificação dos<br />
metabólitos individuais. Os comprimentos de on<strong>da</strong> de excitação e emissão<br />
usados foram, respectivamente, 380/430 nm para medir metabólitos do tipo<br />
benzo(a)pireno e 290/335 nm para medir metabólitos do tipo naftaleno.<br />
Em 1993 Ariese e colaboradores, usando peixes contaminados em<br />
cativeiro, demonstraram existir correlação entre o método de determinação por<br />
CLAE-F e por fluorescência sincroniza<strong>da</strong> (Synchronous Fluorescence<br />
Spectroscopy - SFS) para os comprimentos de on<strong>da</strong> de excitação e emissão de<br />
380/430 nm. No ano seguinte, Lin e colaboradores publicam um segundo<br />
trabalho usando esta mesma técnica.<br />
Em 1996 Lin e colaboradores estu<strong>da</strong>ram o uso <strong>da</strong> medição por<br />
fluorescência fixa (Fixed Fluorescence - FF) de metabólitos do tipo naftaleno e<br />
metabólitos do tipo benzo(a)pireno, comparando com análises por cromatografia.<br />
Neste estudo foram usados 3 diferentes tipos de peixes. Foi encontra<strong>da</strong> forte<br />
correlação entre as duas técnicas, sendo as medições por FF, em geral,
Determinação de HPAs em peixes 56<br />
menores que as medições feitas por CLAE-F. Além disso, foi demonstrado que<br />
com a utilização desta técnica foi possível discriminar locais impactados de<br />
outros não impactados.<br />
Atualmente, são emprega<strong>da</strong>s usualmente 5 técnicas diferentes, sendo três<br />
semi-quantitativas: fluorescência com comprimentos de on<strong>da</strong> de excitação e<br />
emissão fixos (FF) e comprimentos de on<strong>da</strong> de excitação e emissão<br />
sincronizados (SFS) e Cromatografia Líqui<strong>da</strong> de Alta Eficiência com detector de<br />
Fluorescência (CLAE/F). Para a separação e quantificação dos HPAs podem ser<br />
usa<strong>da</strong>s técnicas de Cromatografia Líqui<strong>da</strong> de Alta Eficiência com detector de<br />
Fluorescência (CLAE/F) ou Cromatografia Gasosa acopla<strong>da</strong> a um espectrômetro<br />
de Massas (CG/EM) (Figura 12) (Ariese et al., 2005b).<br />
Figura 12. Métodos de determinação de HPAs em bílis de peixe (a<strong>da</strong>ptado de Ariese et<br />
al., 2005b).<br />
A vantagem de usar as técnicas semi-quantitativas é a sua rapidez e baixo<br />
custo, já que não é necessária uma etapa de “clean up”, sendo indica<strong>da</strong>s para o<br />
monitoramento ambiental em casos de derrame de óleo. No caso <strong>da</strong> CLAE,<br />
para que esta técnica seja quantitativa a bílis deve ser hidrolisa<strong>da</strong><br />
enzimaticamente, permitindo a detecção dos compostos hidroxilados livres. Para<br />
a análise por cromatografia gasosa é necessária uma etapa de extração para<br />
separar os HPAs hidrolisados <strong>da</strong> matriz e a derivatização pode ser usa<strong>da</strong> para<br />
aumentar a separação e sensibili<strong>da</strong>de. Este método é o mais indicado para a
Determinação de HPAs em peixes 57<br />
análise de HPAs com 2 e 3 anéis por sua seletivi<strong>da</strong>de, sendo indicado para a<br />
análise de exposição à petróleo. Já o CLAE é mais indicado para a detecção de<br />
compostos com 4 ou 5 anéis, sendo indicado para contaminação por HPAs<br />
resultantes de processos de combustão (Ariese et al., 2005b).<br />
Além de sua simplici<strong>da</strong>de e baixo custo, alguns autores demonstraram que<br />
as análises de bílis de peixe por fluorescência fixa têm uma boa correlação com<br />
as análises feitas por CLAE com detetor de fluorescência, indicando que esta<br />
técnica é uma boa ferramenta para o monitoramento de HPAs na bílis de peixe.<br />
(Lin et al., 1996; Vuontisjärvi et al., 2004).<br />
Nesta dissertação foi usa<strong>da</strong> a técnica espectroscópica de Fluorescência<br />
Fixa (Fixed Fluorescence) para o estudo semi-quantitativo dos metabólitos de<br />
HPAs na bílis dos peixes coletados na Baía de Guanabara.<br />
6.3.<br />
Fluorescência molecular<br />
Quando orbitais atômicos se combinam formam um orbital molecular<br />
ligante, de energia mais baixa, e um orbital molecular anti-ligante, de energia<br />
mais alta. No estado fun<strong>da</strong>mental, os elétrons de uma molécula ocupam os<br />
orbitais de energia mais baixos. A ligação dupla em uma molécula orgânica<br />
contém dois tipos de orbitais moleculares, um orbital sigma (σ), correspondente<br />
a um par de elétrons ligantes e um orbital molecular pi (π) associado a outro par.<br />
Os orbitais π são formados pela superposição paralela de orbitais p atômicos.<br />
Muitos compostos orgânicos contém elétrons não-ligantes e esses elétrons nãocompartilhados<br />
são designados pelo símbolo n.<br />
No estado fun<strong>da</strong>mental, os HPAs são sistemas onde todos os orbitais π<br />
ligantes estão ocupados por dois elétrons com spins opostos e todos os orbitais<br />
π antiligantes (π*) estão desocupados e os orbitais estão em simetria. As<br />
energias dos orbitais mais externos são particularmente importantes para as<br />
proprie<strong>da</strong>des físico-químicas dos HPAs, já que suas energias determinam as<br />
proprie<strong>da</strong>des dos HPAs. Os elétrons responsáveis pela formação dos orbitais<br />
moleculares π são os elétrons 2p z do carbono (Bjørseth, 1983).<br />
Conforme mostrado na Figura 13, as energias dos vários tipos de orbitais<br />
moleculares diferem significativamente. Quase sempre o nível de energia de um<br />
elétron não-ligante situa-se entre os níveis de energia dos orbitais σ e π ligantes
Determinação de HPAs em peixes 58<br />
e antiligantes. As transições eletrônicas entre certos níveis de energia podem<br />
ocorrer por absorção de radiação (Skoog, 2002).<br />
Figura 13. Diagrama parcial de energia de um sistema fotoluminescente (fonte: Skoog,<br />
2002).<br />
Todos os compostos orgânicos são capazes de absorver radiação<br />
eletromagnética já que todos contém elétrons de valência que podem ser<br />
excitados a níveis de energia mais altos. As energias de excitação associa<strong>da</strong>s a<br />
elétrons formando a maior parte ligações simples são altas, de modo que a<br />
absorção por elas está restrita à chama<strong>da</strong> região ultravioleta de vácuo<br />
(comprimento de on<strong>da</strong> (λ) < 185 nm). As dificul<strong>da</strong>des experimentais associa<strong>da</strong>s<br />
com o ultravioleta de vácuo são significativas e como conseqüência, a maioria<br />
<strong>da</strong>s investigações espectrofotométricas de compostos orgânicos envolve a<br />
região de comprimento de on<strong>da</strong> maior que 185 nm.<br />
A absorção de radiação visível e de ultravioleta de maior comprimento de<br />
on<strong>da</strong> está restrita a um número limitado de grupos funcionais (grupos<br />
cromóforos) que contém elétrons de valência com energia de excitação<br />
relativamente baixas. Como o estado excitado é instável os elétrons excitados<br />
pela absorção de fótons voltam ao seu estado fun<strong>da</strong>mental (processo de<br />
relaxação ou desativação) (Figura 13). Os processos de relaxação podem ser
Determinação de HPAs em peixes 59<br />
não radiativos como a relaxação vibracional, a conversão interna e a conversão<br />
externa (Skoog, 2002). Quando ocorre o cruzamento intersistema o spin de um<br />
elétron excitado é invertido e se tornando não-emparelhado com o elétron no<br />
estado fun<strong>da</strong>mental. A probabili<strong>da</strong>de dessa transição é aumenta<strong>da</strong> se os níveis<br />
vibracionais dos dois estados se interpenetram (Figura 13). Após o cruzamento<br />
para um estado triplete pode ocorrer desativação do estado eletrônico excitado<br />
por conversão interna ou externa ou por emissão de fóton (fosforescência).<br />
Se a diferença de energia entre o estado singleto excitado e o estado<br />
fun<strong>da</strong>mental é significativa, o retorno do estado excitado singleto para o estado<br />
fun<strong>da</strong>mental pode ocorrer por emissão de fóton, fluorescência e o grupo<br />
cromóforo é chamado de fluoróforo.<br />
As moléculas aromáticas, com sua estrutura rígi<strong>da</strong>, têm menos graus de<br />
liber<strong>da</strong>de vibracional que as moléculas alifáticas e são a classe de compostos<br />
que mais frequentemente apresentam fluorescência (Sharma & Schulman,<br />
1999).<br />
A intensi<strong>da</strong>de de fluorescência (I F ) é diretamente proporcional à<br />
intensi<strong>da</strong>de do feixe de excitação (I 0 ), a absorvância (εbC) e o rendimento<br />
quântico (Φ F ) <strong>da</strong> espécie, definidos pela equação:<br />
I F = K F I 0 Φ F ε b C ( 9 )<br />
onde K F é uma constante de proporcionali<strong>da</strong>de, função <strong>da</strong> resposta instrumental<br />
no momento <strong>da</strong> detecção, ε é a absortivi<strong>da</strong>de molar, b é o comprimento<br />
percorrido pelo feixe na amostra e C a concentração <strong>da</strong> espécie fluorescente.<br />
O rendimento quântico é a razão do número de moléculas luminescentes<br />
pelo número total de moléculas excita<strong>da</strong>s. A maioria dos hidrocarbonetos<br />
aromáticos não-substituídos fluoresce em solução e a eficiência quântica<br />
aumenta com o número de anéis e seu grau de condensação.
7<br />
Áreas de estudo<br />
7.1.<br />
Baía de Guanabara, RJ<br />
A Baía de Guanabara encontra-se situa<strong>da</strong> na região metropolitana do<br />
estado do <strong>Rio</strong> de Janeiro (Figura 14) e ao longo <strong>da</strong>s suas margens estão<br />
situa<strong>da</strong>s a ci<strong>da</strong>de do <strong>Rio</strong> de Janeiro, Duque de Caxias, São Gonçalo, Niterói,<br />
Petrópolis, entre outras. Ao redor <strong>da</strong> baía residem 7,6 milhões de pessoas,<br />
correspondendo a 2/3 <strong>da</strong> população <strong>da</strong> região metropolitana do <strong>Rio</strong> de Janeiro.<br />
Localiza<strong>da</strong> na latitude S 22 o 50’ e na longitude W 43 o 10’, a baía tem uma área<br />
de 381 km 2 , espelho d’água de 328 km 2 e 65 ilhas que somam 59 km 2 de área.<br />
O perímetro <strong>da</strong> baía mede 131 km e o volume médio de água é de 1,87 x 10 9 m 3<br />
(Kjerfve et al., 1997; Weber, 2001, <strong>da</strong> Costa, 2003; Instituto Baía de Guanabara,<br />
2006).<br />
Baía de Guanabara<br />
Figura 14. Mapa do estado do <strong>Rio</strong> de Janeiro, destacando em vermelho a região<br />
metropolitana e em azul a Baía de Guanabara.
Áreas de estudo 61<br />
A Baía de Guanabara pode ser considera<strong>da</strong> um estuário e sua bacia de<br />
drenagem mede 4.080 km 2 sendo forma<strong>da</strong> por 45 rios, onde apenas 6 são<br />
responsáveis por 100 m 3 s -1 <strong>da</strong> descarga média total anual de água fresca ,<br />
sendo os mais importantes os rios Acari, Sarapuí, Pavuna, Suruí, Roncador,<br />
Macacu, Guapimirim, Estrela e Iguaçu (Kjerfve et al., 1997; CEDAE, 199-;<br />
Weber, 2001).<br />
O clima na Baia de Guanabara é tropical úmido com verões quentes e<br />
chuvosos e invernos frios e secos, com grande influência marinha. A<br />
temperatura média anual é de 23,7 o C e a umi<strong>da</strong>de relativa é 78% ao nível do<br />
mar (DENEMET, 1992 apud Kjerfve et al., 1997). A profundi<strong>da</strong>de média <strong>da</strong> Baía<br />
de Guanabara é de 7,6 m, sendo 3 m no fundo <strong>da</strong> baía, 8,2 m no meio e 16,9 m<br />
na entra<strong>da</strong> sendo a profundi<strong>da</strong>de máxima de 50 m (Weber, 2001; Instituto Baía<br />
de Guanabara, 2006).<br />
A Baía é caracteriza<strong>da</strong> por alta salini<strong>da</strong>de e temperatura. Durante o<br />
período de 1980-1993 a salini<strong>da</strong>de média foi de 29,5 ± 4,8 o / oo variando de 9,9 a<br />
36,8 o / oo . A salini<strong>da</strong>de decresce <strong>da</strong> entra<strong>da</strong> do oceano até o fundo <strong>da</strong> baía, em<br />
resposta a descarga de água doce nas margens do interior. A temperatura <strong>da</strong><br />
água foi medi<strong>da</strong> no mesmo período sendo sua temperatura média de 24,2 ± 2,6<br />
o C, variando de 17,0 a 31,0 o C. A temperatura aumenta <strong>da</strong> entra<strong>da</strong> <strong>da</strong> baía até o<br />
fundo, em resposta a advecção de água do mar, mais fria, para a baía (Kjerfve et<br />
al., 1997).<br />
A maré na baía é classifica<strong>da</strong> como semi-diurna, com período de cerca de<br />
12,5 horas. Na superfície a duração <strong>da</strong> enchente é de 4,5 h aproxima<strong>da</strong>mente, e<br />
a vazante é de 8 h. No fundo, a enchente e a vazante apresentaram a mesma<br />
duração, com aproxima<strong>da</strong>mente 6 h (JICA, 1994 apud <strong>da</strong> Costa, 2003).<br />
No entorno <strong>da</strong> baía existem 6000 indústrias e mais 6000 na bacia de<br />
drenagem, 2 portos comerciais, 12 estaleiros, 16 terminais de óleo, além de duas<br />
refinarias de petróleo, o que demonstra a importância econômica <strong>da</strong> área.<br />
Comparando com outras baías que propiciaram o surgimento de importantes<br />
ci<strong>da</strong>des como a Baía de Tóquio (ci<strong>da</strong>de de Tóquio, espelho d’água: 1400 km 2 ;<br />
extensão 800 km) e a Baía de Chesapeake (ci<strong>da</strong>des de Baltimore e Washington;<br />
espelho d’água: 6.400 km 2 ; extensão: 322 km), pode-se dizer que a importância<br />
<strong>da</strong> Baía de Guanabara não é proporcional à sua dimensão (<strong>da</strong> Costa, 2003).<br />
Embora invadi<strong>da</strong> pela expansão urbana, o fundo <strong>da</strong> baía ain<strong>da</strong> é<br />
margeado por 68,7 km 2 de manguezais dos quais 43 km 2 pertencem a área de<br />
proteção ambiental de Guapimirim (Kjerfve et al., 1997; Weber, 2001; Instituto<br />
Baía de Guanabara, 2006). Os manguezais são áreas extremamente
Áreas de estudo 62<br />
importantes pois apresentam condições propícias para alimentação, proteção e<br />
reprodução de muitas espécies animais.<br />
As principais fontes de poluição <strong>da</strong> Baía de Guanabara são o esgoto<br />
industrial, onde 80% dele é proveniente de apenas 52 indústrias, 7 t/dia de óleo,<br />
20 m 3 /s de esgoto doméstico e 800 m 3 /dia de chorume (CEDAE, 199-).<br />
Dados <strong>da</strong> FEEMA (2006) sobre a deman<strong>da</strong> bioquímica de oxigênio,<br />
coliformes e clorofila-a de vários pontos <strong>da</strong> Baía de Guanabara indicam que, de<br />
1990 a 2000 houve maior deterioração <strong>da</strong> quali<strong>da</strong>de <strong>da</strong> água <strong>da</strong> porção nordeste<br />
<strong>da</strong> baía, que, no entanto, tem ain<strong>da</strong> melhor quali<strong>da</strong>de do que as áreas noroeste<br />
e oeste.<br />
Em 1991, apesar dos grandes investimentos feitos no Programa de<br />
Despoluição <strong>da</strong> Baía de Guanabara (PDBG), apenas 15% do esgoto doméstico<br />
e industrial receberam alguma forma de tratamento. Atualmente este valor subiu<br />
para cerca de 25% (Marqueiro & Brandão, 2005).<br />
Segundo Kjerfve e colaboradores (1997) a maior concentração de<br />
nutrientes é encontra<strong>da</strong> na margem oeste <strong>da</strong> baía por causa do enriquecimento<br />
do escoamento urbano de esgoto e <strong>da</strong> renovação de água menos eficiente,<br />
sendo as concentrações de nutrientes eleva<strong>da</strong>s na superfície, com água menos<br />
salina, refletindo a fonte de escoamento urbano. A profundi<strong>da</strong>de do disco de<br />
Secchi é menor que 0,75 m e a concentração de sólidos suspensos é maior que<br />
25 mg L -1 (JICA, 1994 apud Kjerfve et al., 1997).<br />
As concentrações de oxigênio dissolvido mostram grande flutuações<br />
temporais e o valor médio não varia significativamente horizontalmente, com<br />
exceção dos locais perto de pontos de descarga do escoamento urbano poluído.<br />
A concentração média foi de 8,4 mg L -1 (124% de saturação) sendo a água <strong>da</strong><br />
superfície freqüentemente supersatura<strong>da</strong> refletindo altas taxas de produção<br />
primária (Kjerfve et al., 1997).<br />
Os grandes aportes de nutrientes levaram a eutrofização <strong>da</strong>s águas <strong>da</strong><br />
baía e segundo a FEEMA o pescado diminuiu para 10% do que era há três<br />
déca<strong>da</strong>s atrás (Kjerfve et al., 1997). Apesar disso, a Baía de Guanabara mantém<br />
uma produção pesqueira importante, tanto pelas quanti<strong>da</strong>des desembarca<strong>da</strong>s<br />
como pelo número de pescadores envolvidos (IBAMA, 2002).<br />
No período de abril de 2001 a março de 2002 o IBAMA registrou que a<br />
pesca <strong>da</strong> tainha ao longo do ano foi um importante recurso pesqueiro,<br />
correspondendo a 6% do total pescado no período. Se for considerado apenas o<br />
grupo de peixes sem destinação industrial o número de tainhas e corvinas<br />
pescados/capturados passa a corresponder a 54% <strong>da</strong> produção (IBAMA, 2002).
Áreas de estudo 63<br />
7.1.1.<br />
Poluição por petróleo e derivados na Baía de Guanabara<br />
Em relação ao petróleo e seus derivados as fontes de poluição na baía<br />
podem ser crônicas ou agu<strong>da</strong>s. Dentre as ativi<strong>da</strong>des realiza<strong>da</strong>s na bacia <strong>da</strong> Baía<br />
de Guanabara que geram efluentes oleosos rotineiramente estão compreendi<strong>da</strong>s<br />
as refinarias de petróleo, os estaleiros, os terminais marítimos e terrestres e os<br />
postos de serviço de combustível. Nos últimos cinco anos ocorreram 8 acidentes<br />
com petróleo e derivados na Baía de Guanabara.<br />
O vazamento de 1,3 milhão de litros de óleo combustível ocorrido em um<br />
duto <strong>da</strong> Petrobrás em janeiro de 2000 foi o mais comentado na mídia e sua<br />
mancha se estendeu por mais de 50 km 2 , não sendo este o primeiro acidente,<br />
nem o mais grave com este duto. Em 1997 já haviam vazado 2,8 milhões de<br />
litros de óleo combustível deste mesmo duto.<br />
Por causa deste acidente a pesca foi proibi<strong>da</strong> pelo IBAMA durante um mês<br />
e libera<strong>da</strong> quando as determinações de HPAs nos tecidos dos peixes (corvina e<br />
tainha) antes e depois do acidente não indicaram modificações nas<br />
concentrações de HPAs encontra<strong>da</strong>s nas amostras (Meniconi et al., 2001).<br />
Abaixo estão listados os principais acidentes ocorridos na Baía (<strong>da</strong> Costa,<br />
2003; de Cassia, 2005; Gomes, 2005 ; Ambientebrasil, 2006):<br />
03/set/2005<br />
vazamento de 2 mil litros de óleo na Baía de Guanabara<br />
após um acidente com o navio Saga Mascot durante sua<br />
atracação, atingindo as praias <strong>da</strong> Flecha e Icaraí em<br />
Niterói;<br />
12/ago/2005<br />
vazamento de óleo de um navio na altura do Cais do<br />
Porto, com a mancha atingindo cerca de 1,5 km;<br />
31/mai/2005<br />
vazamento de mais de 4 mil litros de óleo do navio<br />
Alminufiyah, na altura do Cais do Porto;<br />
26/abr/2005<br />
despejo de mais de 60 mil litros de óleo diesel no <strong>Rio</strong><br />
Caceribu (rio afluente <strong>da</strong> Baía de Guanabara), na Área de<br />
Proteção Ambiental de Guapimirim, pelo descarrilamento
Áreas de estudo 64<br />
de um trem <strong>da</strong> Ferrovia Centro-Atlântica (FCA), controla<strong>da</strong><br />
pela Companhia Vale do <strong>Rio</strong> Doce, no Porto de Caxias;<br />
mar/2004<br />
vazamento de 2 mil litros de petróleo de um navio<br />
desativado pertencente a uma empresa priva<strong>da</strong>;<br />
fev/2002<br />
vazamento de 50 mil litros de óleo combustível do<br />
transatlântico inglês Caronia;<br />
jun/2000<br />
380 litros de óleo combustível foram lançados ao mar pelo<br />
navio Cantagalo, que presta serviços à Petrobrás;<br />
jan/2000<br />
rompimento de um duto <strong>da</strong> Petrobrás que liga a Refinaria<br />
de Duque de Caxias (RJ) ao terminal <strong>da</strong> Ilha d’Água,<br />
provocando o vazamento de 1,3 milhões de litros de óleo<br />
combustível;<br />
ago/1997<br />
vazamento de 2 mil litros de óleo combustível atingindo<br />
cinco praias <strong>da</strong> Ilha do Governador (RJ);<br />
mar/1997<br />
rompimento de um duto <strong>da</strong> Petrobrás que liga a Refinaria<br />
de Duque de Caxias (RJ) ao terminal <strong>da</strong> Ilha d’Água,<br />
provocando o vazamento de 2,8 milhões de litros de óleo<br />
combustível;<br />
mar/1975<br />
derramamento de 6 milhões de litros de óleo cru por um<br />
cargueiro fretado pela Petrobrás.<br />
Há um alto risco de acidentes por derramamento de petróleo e derivados já<br />
que os diversos ecossistemas <strong>da</strong> baía são atravessados por muitos quilômetros<br />
de oleodutos, através dos quais são continuamente bombeados dezenas de<br />
milhões de litros de óleo e derivados entre seus terminais, navios, petroleiros e<br />
balsas (<strong>da</strong> Costa, 2003).<br />
Como fonte crônica é registrado um aporte de 7t/dia de óleo proveniente<br />
do escoamento urbano e <strong>da</strong>s indústrias, sendo 0,65 tonela<strong>da</strong>s provenientes <strong>da</strong><br />
REDUC (CEDAE, 199-). Ou seja, em menos de um ano teríamos quanti<strong>da</strong>de<br />
comparável a do acidente ocorrido em janeiro de 2000.
Áreas de estudo 65<br />
7.1.2.<br />
Estudos de HPAs na Baía de Guanabara<br />
Na Tabela 4 estão relacionados os trabalhos envolvendo estudos de<br />
HPAs realizados na Baía de Guanabara, nos compartimentos água, sedimento<br />
ou biota. Deve-se tomar cui<strong>da</strong>do ao analisar estes resultados já que distintas<br />
técnicas analíticas nem sempre são comparáveis e muitas vezes foram usados<br />
pontos de coleta em diferentes pontos <strong>da</strong> Baía.<br />
Os resultados pré e pós derrame de janeiro/2000 mostram que não<br />
houve impacto significativo no sedimento e na coluna d’água <strong>da</strong> Baía de<br />
Guanabara (Meniconi et al., 2002).<br />
Comparando-se os valores obtidos para organismos vertebrados e<br />
invertebrados nota-se a diferença existente nos níveis de HPAs presentes no<br />
tecido, como o esperado, já que o metabolismo de HPAs em invertebrados é<br />
mais lento do que em vertebrados.<br />
De acordo com o critério adotado pela National Oceanic and Atmospheric<br />
Administration (NOAA) no acidente com o navio Exxon Valdez no Alasca em<br />
1989, as amostras de tecido de peixe são dividi<strong>da</strong>s em quatro categorias como<br />
na Tabela 5. Levando-se em consideração a diferença entre peso seco e peso<br />
úmido, os valores de tecido de peixe <strong>da</strong> Baía de Guanabara estariam<br />
enquadrados nas amostras não contamina<strong>da</strong>s ou de contaminação mínima, não<br />
representando uma ameaça a saúde pública.
Áreas de estudo 66<br />
Tabela 4. Concentrações de HPAs encontrados na água, sedimento e biota <strong>da</strong> Baía de<br />
Guanabara.<br />
Concentrações Referência<br />
Observações<br />
de HPAs<br />
ÁGUA (µg L -1 )<br />
0,06 – 1,59 Silva, 2004<br />
0,66 – 1,18 (F)<br />
0,79 – 2,79 (NF)<br />
Lima, 2001 amostras coleta<strong>da</strong>s em 1999.<br />
Resultados em equivalentes de criseno.<br />
0,93 (F)<br />
1,52 (NF)<br />
Lima, 2001<br />
amostra coleta<strong>da</strong> após o acidente de<br />
janeiro/2000. Resultados em<br />
equivalentes de criseno.<br />
1000<br />
Fonte: Meniconi et al., 2001.
Áreas de estudo 67<br />
7.1.3.<br />
Praia de Ipiranga, Magé<br />
A praia de Ipiranga localiza-se no município de Magé, RJ, e sua principal<br />
ativi<strong>da</strong>de econômica é a pesca. A produção de pescado é comercializa<strong>da</strong> no<br />
local, adquiri<strong>da</strong> por intermediários e destina<strong>da</strong> a feiras, peixarias e para o<br />
CEASA (IBAMA, 2002).<br />
O relatório do IBAMA de 2002 sobre a ativi<strong>da</strong>de pesqueira na Baía de<br />
Guanabara indica que de abril de 2001 a março de 2002 existiam 511 currais<br />
(Figura 15) em ativi<strong>da</strong>de, sendo 37 deles localizados na praia de Ipiranga<br />
(IBAMA, 2002). Como a vi<strong>da</strong> útil de um curral varia de 11 a 12 meses, o número<br />
de armadilhas em operação efetiva pode variar ao longo do tempo.<br />
Os currais são artes de pesca fixas, confeccionados com esteiras de<br />
bambu e tendo como fun<strong>da</strong>ção, troncos de árvores dos manguezais ou de<br />
eucalipto. Para a construção de um curral são necessários 150 a 180 troncos,<br />
com diâmetro variando de 3 a 8 cm e altura entre 5 e 7 metros (IBAMA, 2002).<br />
Figura 15. Curral próximo a praia de Ipiranga, Magé.<br />
A praia de Ipiranga foi um dos locais afetados pelo derrame de óleo de<br />
janeiro de 2000 e por sua proximi<strong>da</strong>de com o duto de transporte de óleo <strong>da</strong><br />
Petrobrás é de interesse que sejam monitorados os peixes <strong>da</strong> região quanto a<br />
presença de HPAs no meio ambiente (Figura 16).
Áreas de estudo 68<br />
região dos<br />
currais<br />
Figura 16. trecho <strong>da</strong> Carta náutica 1501 indicando a região dos currais próximos a praia<br />
de Ipiranga, Magé.<br />
7.2.<br />
Itaipu, Niterói<br />
A praia de Itaipu é uma tradicional vila de pescadores que encontra-se<br />
situa<strong>da</strong> na região oceânica <strong>da</strong> ci<strong>da</strong>de de Niterói, no estado do <strong>Rio</strong> de Janeiro<br />
(Figura 17). Localiza<strong>da</strong> na latitude S 22 o 58’ e longitude W 43 o 05’, a praia de<br />
Itaipu é liga<strong>da</strong> a Lagoa de Itaipu por um canal construído em 1970 (IBAMA,<br />
2000; Weber, 2001). Com a construção do canal o arco praial original de 3300 m<br />
foi dividido em duas praias denomina<strong>da</strong>s Camboinhas e Itaipu (<strong>Santos</strong> et al.,<br />
2004).<br />
A profundi<strong>da</strong>de <strong>da</strong> água varia de um mínimo de 3-4 m logo após a<br />
arrebentação até um máximo de 28 m. Itaipu é um ambiente clástico com on<strong>da</strong>s,<br />
tendo uma variação de maré semi-diurna com uma flutuação máxima de 1,4 m e
Áreas de estudo 69<br />
a veloci<strong>da</strong>de <strong>da</strong>s correntes raramente excedem 10 cm/s (Salvador et al., 2002;<br />
<strong>Santos</strong> et al., 2004).<br />
Segundo o Censo Demográfico de 1991, o bairro de Itaipu possui 11.136<br />
habitantes, correspondendo a 2,55% do total de Niterói. Não existe uma rede<br />
geral de esgotos e a maioria dos moradores utilizam como alternativa o sistema<br />
de fossas sépticas (Prefeitura de Niterói, 2005). Assim, a lagoa de Itaipu recebe<br />
esgoto doméstico não tratado que pode atingir a praia já que a renovação de sua<br />
água é fortemente controla<strong>da</strong> pelas marés (Weber, 2001). Não existem relatos<br />
de acidentes com petróleo e derivados nesta região.<br />
Figura 17. Mapa do Estado do <strong>Rio</strong> de Janeiro, com destaque para a ci<strong>da</strong>de de Niterói.
Áreas de estudo 70<br />
O tipo de pesca mais comumente usado na região é a rede de espera ou o<br />
arrastão de praia. A presença de tainhas é sazonal, dependendo do seu ciclo<br />
reprodutivo. Oliveira (1997) descreve que mugilídeos estu<strong>da</strong>dos na laguna de<br />
Itaipu entram no sistema lagunar durante o final do período quente e/ou início do<br />
frio e ao atingirem os maiores tamanhos saem do sistema, possivelmente para<br />
fins reprodutivos, correspondendo ao final do período frio e/ou início do quente.<br />
Esta freqüência também foi observa<strong>da</strong> neste trabalho, onde a quanti<strong>da</strong>de de<br />
peixes coletados no verão (janeiro/2005 e janeiro/2006) foi sensivelmente menor<br />
do que no inverno (setembro/2004 e agosto/2005). Dados fornecidos pelas<br />
indústrias pesqueiras dos municípios do <strong>Rio</strong> de Janeiro, Niterói e São Gonçalo<br />
revelam que as maiores capturas de tainhas em alto mar correspondem ao<br />
período quente (IBAMA, 1996 apud Oliveira, 1997).
8<br />
Parte experimental<br />
8.1.<br />
Coleta dos peixes e medição dos parâmetros físico-químicos<br />
O peixe escolhido para monitoramento foi a tainha, especificamente <strong>da</strong><br />
espécie Mugil liza já que junto com a corvina este é um dos peixes mais<br />
pescados na região <strong>da</strong> Praia de Ipiranga, Magé, RJ (IBAMA, 2002).<br />
Os peixes foram coletados tanto em área de contaminação crônica por<br />
óleo (Baía de Guanabara, RJ) quanto em área sem histórico de contaminação,<br />
área controle (Itapu, Niterói).<br />
Foram feitas duas amostragens iniciais, para reconhecimento dos pontos<br />
de coleta, na estação chuvosa (verão) em fevereiro/2005. Foram feitas mais três<br />
coletas, duas representando a estação seca (agosto/2005) e a outra<br />
representando a estação chuvosa (dezembro/2005). Também foi feita uma<br />
coleta em Itaipu, Niterói em setembro/2005, 4 dias após um derrame de óleo na<br />
entra<strong>da</strong> <strong>da</strong> Baía de Guanabara que atingiu as praias <strong>da</strong> Flecha e Icaraí em<br />
Niterói.<br />
Na Baía de Guanabara os peixes foram capturados em currais localizados<br />
na região próxima a praia de Ipiranga, Magé, tendo suas coordena<strong>da</strong>s<br />
registra<strong>da</strong>s em um GSP Garmin 12 (S22 o 44’, W43 o 11’). Já os peixes <strong>da</strong> área<br />
controle foram capturados na praia de Itaipu, Niterói (S22 o 56’, W43 o 03’),<br />
usando-se rede de espera ou arrasto de praia. Segundo a tábua <strong>da</strong>s marés <strong>da</strong><br />
Diretoria de Hidrografia e Navegação <strong>da</strong> Marinha (DHN) para o Porto do <strong>Rio</strong> de<br />
Janeiro, as coletas foram feitas em maré baixa a enchente. Após a captura, os<br />
peixes foram conservados em gelo até a chega<strong>da</strong> no laboratório.<br />
No local de amostragem foram feitas medições de temperatura, pH,<br />
condutivi<strong>da</strong>de e oxigênio dissolvido usando-se uma son<strong>da</strong> multi-parâmetros Insitu<br />
Troll 9000. A transparência foi medi<strong>da</strong> com disco de Secchi. No laboratório<br />
foi feita a medição <strong>da</strong> turbidez usando um turbidímetro Alfa Tecnoquimica AT2K.
Parte experimental 72<br />
8.2.<br />
Amostragem dos peixes<br />
Para evitar grandes variações de metabolismo e buscando maior<br />
repetitivi<strong>da</strong>de dos resultados foram selecionados peixes <strong>da</strong> mesma espécie e<br />
tamanhos semelhantes.<br />
Pela semelhança entre as espécies de mugilídeos e para evitar que<br />
fossem usa<strong>da</strong>s espécies diferentes foi feita a identificação de gênero e espécie<br />
<strong>da</strong>s tainhas captura<strong>da</strong>s de acordo com o método de Menezes (1983). Para tal,<br />
foi verifica<strong>da</strong> a presença de escamas na segun<strong>da</strong> na<strong>da</strong>deira dorsal e na<br />
na<strong>da</strong>deira anal. Em segui<strong>da</strong>, foram conta<strong>da</strong>s as séries de escamas laterais que<br />
deveriam estar presentes em número de 29 a 34. Um indivíduo de ca<strong>da</strong> local de<br />
coleta foi retirado para ser analisado por técnicos do setor de Ictiologia do Museu<br />
Nacional (UFRJ) para confirmação <strong>da</strong> espécie e para ser guar<strong>da</strong>do como<br />
testemunho. O tamanho mínimo de captura foi 35 cm, tamanho permitido pelo<br />
IBAMA (portaria n o 73/2003), até 51 cm.<br />
Após a identificação <strong>da</strong>s espécies foram feitas medições morfométricas<br />
(comprimento total, comprimento padrão, comprimento <strong>da</strong> cabeça, altura <strong>da</strong><br />
cabeça) utilizando-se um ictiômetro e um paquímetro calibrados pela Rede<br />
Brasileira de Calibração (RBC) e foi medido também o peso dos peixes<br />
utilizando-se uma balança analítica.<br />
Em segui<strong>da</strong>, os peixes foram abertos para dissecação (Figura 18), sendo<br />
feita a identificação do sexo de ca<strong>da</strong> indivíduo (Figura 19). Após a localização <strong>da</strong><br />
vesícula biliar (Figura 20) foi retirado o líquido biliar com o auxílio de uma seringa<br />
(Figura 21). A bílis foi estoca<strong>da</strong> em geladeira (10 o C) até que todos os indivíduos<br />
fossem abertos e seu líquido biliar retirado, para em segui<strong>da</strong> proceder as<br />
diluições e análises.<br />
Figura 18. Abertura do indivíduo.
Parte experimental 73<br />
Figura 19. Identificação do sexo do peixe pela análise visual <strong>da</strong>s gôna<strong>da</strong>s, neste caso,<br />
fêmea.<br />
Figura 20. Localização <strong>da</strong> vesícula biliar.<br />
Figura 21. Retira<strong>da</strong> do líquido biliar.
Parte experimental 74<br />
8.3.<br />
Análise <strong>da</strong> bílis<br />
8.3.1.<br />
Escolha do sistema solvente<br />
O solvente comumente usado para diluição <strong>da</strong> bílis para determinação de<br />
metabólitos de HPAs por fluorescência é o etanol diluído em água na proporção<br />
48:52 v/v (Ariese et al., 1993, Lin et al.1994, Aas et al., 2000). Com o objetivo de<br />
avaliar o desempenho de outros sistemas solvente na presença de HPAs foi feito<br />
um planejamento experimental usando-se os solventes Etanol P.A. Merck,<br />
Propanol P.A. Merck e água deioniza<strong>da</strong>. As proporções solvente/água usa<strong>da</strong>s<br />
foram 25:75 v/v, 48:52 v/v e 75:25 v/v. Metanol não foi testado devido a sua alta<br />
toxici<strong>da</strong>de. Solventes apolares também não foram testados já que a bílis é<br />
composta principalmente por água.<br />
O HPA utilizado como referência foi o Pireno <strong>da</strong> Sigma (St. Louis, EUA)<br />
com 97% de pureza. Apesar de o benzo[a]pireno ser o HPA mais estu<strong>da</strong>do já<br />
que foi o primeiro HPA a ter seu potencial carcinogênico reconhecido, os HPAs<br />
menores são absorvidos, metabolizados e excretados em maior quanti<strong>da</strong>de<br />
(Krahn et al., 1987). No caso do pireno, o metabólito de interesse é o 1-<br />
hidroxipireno, principal metabólito formado pelas reações de FASE I <strong>da</strong> sua<br />
biotransformação. No entanto, este padrão não estava disponível durante o<br />
período deste trabalho devido a dificul<strong>da</strong>des de importação.<br />
Devido a sua alta hidrofobici<strong>da</strong>de, a solubilização do pireno em<br />
etanol/água exige agitação vigorosa, sendo testa<strong>da</strong> também a influência no<br />
tempo de agitação no ultra-som utilizado durante o preparo <strong>da</strong>s soluções<br />
estoque.<br />
A partir de soluções estoque independentes foram preparados padrões em<br />
duplicata e sua análise feita no espectrofluorímetro Perkin Elmer LS 55<br />
Luminescence Espectrometer. Foram usa<strong>da</strong>s ban<strong>da</strong>s espectrais de passagem<br />
de 4 nm para excitação e emissão e cubetas de quartzo, em to<strong>da</strong>s análises. A<br />
detecção foi feita no comprimento de on<strong>da</strong> de excitação de 341 nm e o<br />
comprimento de on<strong>da</strong> de emissão variou de 350 nm a 450 nm, de acordo com o<br />
descrito na literatura (Ariese et al., 1993, Lin et al.1994, Aas et al., 2000).
Parte experimental 75<br />
8.3.2.<br />
Determinação dos comprimentos de on<strong>da</strong> de excitação e emissão<br />
Após a escolha do sistema solvente, foram otimizados os comprimentos<br />
de on<strong>da</strong> de excitação e emissão através <strong>da</strong> análise dos espectros com<br />
comprimento de on<strong>da</strong> de emissão fixo, variando o comprimento de on<strong>da</strong> de<br />
excitação de 200 nm até 400 nm. Assim, é possível verificar qual o comprimento<br />
de on<strong>da</strong> de excitação dá a melhor resposta de intensi<strong>da</strong>de de sinal.<br />
8.3.3.<br />
Curva analítica<br />
A curva analítica foi obti<strong>da</strong> com 8 pontos, incluindo o branco, com soluções<br />
padrão diluí<strong>da</strong>s na faixa de 1 a 20 µg L -1 , prepara<strong>da</strong>s a partir de uma solução<br />
estoque de pireno em etanol/água 48% de concentração de aproxima<strong>da</strong>mente<br />
10 mg L -1 . Foram feitas quatro replicatas de ca<strong>da</strong> ponto. Foram feitas também<br />
curvas de adição padrão com amostras de bílis diluí<strong>da</strong>s (1:2000).<br />
8.3.4.<br />
Absorção molecular<br />
A fim de ter uma referência do status alimentar dos peixes coletados,<br />
vários autores indicam que deve ser feita a medição <strong>da</strong> concentração de<br />
biliverdina através de medições de absorção molecular (Ariese et al., 1997; Aas<br />
et al., 2000; Richardson et al., 2004). De acordo com estes autores, foram<br />
prepara<strong>da</strong>s soluções de bílis diluí<strong>da</strong>s em etanol 48% (1:100 v/v) e as<br />
absorvâncias medi<strong>da</strong>s em 380 nm, em um espectrofotômetro UV-Visível DMS-<br />
100 Intralab.
Parte experimental 76<br />
8.3.5.<br />
Estudo do efeito de matriz<br />
Com o objetivo de analisar se a concentração <strong>da</strong> amostra pode interferir na<br />
análises por fluorescência foram feitas quatro diluições diferentes para algumas<br />
amostras de bílis (1:2000, 1:1500, 1:1000, 1:500). Foram então feitas medições<br />
<strong>da</strong> transmitância <strong>da</strong>s amostras diluí<strong>da</strong>s em um espectrofotômetro Spec 20 MV<br />
Coml. Indl. Dourado Lt<strong>da</strong>. no comprimento de on<strong>da</strong> de 332 nm.<br />
A fim de observar se havia influência <strong>da</strong> densi<strong>da</strong>de <strong>da</strong> bílis devi<strong>da</strong> aos<br />
diferentes status alimentar dos peixes coletados foram escolhi<strong>da</strong>s 5 amostras<br />
com cores variando do marrom ao verde musgo e valores diferentes de<br />
absorvância.<br />
8.3.6.<br />
Determinação de HPAs total por fluorescência na bílis de peixe<br />
Antes <strong>da</strong>s medições de fluorescência as amostras de bílis foram diluí<strong>da</strong>s<br />
1:2000 em etanol 48% a fim de obter uma amostra suficientemente transparente<br />
(Ariese et al., 1993). A detecção foi feita no comprimento de on<strong>da</strong> de excitação<br />
de 332 nm e o comprimento de on<strong>da</strong> de emissão variou de 350 nm a 450 nm.<br />
Foi usa<strong>da</strong> uma curva analítica feita com padrões de pireno em etanol 48% na<br />
faixa de 1 a 20 µg L –1 , sendo os resultados reportados em mg de equivalente de<br />
pireno L -1 .<br />
Além do comprimento de on<strong>da</strong> de excitação de 332 nm, otimizado para o<br />
pireno (4 anéis), foram feitas leituras nos comprimentos de on<strong>da</strong> de excitação e<br />
emissão de 290/335 nm e 380/430 nm. Estes comprimentos de on<strong>da</strong> são<br />
recomen<strong>da</strong>dos na literatura para a análise do grupo de HPAs de 2-3 anéis e 5-6<br />
anéis, respectivamente.<br />
Foram feitas também leituras onde os comprimentos de on<strong>da</strong> de excitação<br />
e de emissão variavam simultaneamente, com um intervalo fixo de comprimento<br />
de on<strong>da</strong> (∆λ). A varredura sincroniza<strong>da</strong> pode fornecer espectros de fluorescência<br />
bem característicos, dependendo do metabólitos de HPAs presentes.
Parte experimental 77<br />
8.3.7.<br />
Limpeza do material<br />
To<strong>da</strong> a vidraria volumétrica e os frascos usados para o armazenamento do<br />
líquido biliar foram lavados com detergente (Detertec 3%) e enxagua<strong>da</strong> com<br />
água. Em segui<strong>da</strong>, todo o material foi enxaguado três vezes com água<br />
deioniza<strong>da</strong> e rinsado com etanol 48%.<br />
8.4.<br />
Análise de HPAs totais em água<br />
8.4.1.<br />
Determinação dos comprimentos de on<strong>da</strong> de excitação e emissão<br />
Como os padrões usados na análise de HPAs totais em água são<br />
preparados com o solvente diclorometano Mallinckrodt (grau HPLC) foi<br />
necessário otimizar os comprimentos de on<strong>da</strong> de excitação e emissão que dão a<br />
melhor resposta para o novo solvente. Foram analisados os espectros de<br />
emissão, com o comprimento de on<strong>da</strong> de emissão fixo, variando o comprimento<br />
de on<strong>da</strong> de excitação de 200 nm até 400 nm.<br />
8.4.2.<br />
Curva analítica<br />
A curva analítica foi obti<strong>da</strong> com 8 pontos, incluindo o branco, com soluções<br />
padrão diluí<strong>da</strong>s na faixa de 10 a 150 µg L -1 , prepara<strong>da</strong>s a partir de uma solução<br />
estoque de pireno em diclorometano de concentração de aproxima<strong>da</strong>mente 10<br />
mg L -1 . Foram feitas triplicatas de ca<strong>da</strong> ponto.
Parte experimental 78<br />
8.4.3.<br />
Coleta de água<br />
As amostras foram coleta<strong>da</strong>s com o auxílio de uma garrafa coletora de<br />
acrílico de 1 L, a cerca de 50 cm abaixo <strong>da</strong> superfície e transferi<strong>da</strong>s para<br />
garrafas de vidro previamente limpas. Parte <strong>da</strong> amostra inicial foi usa<strong>da</strong> para<br />
rinsar a garrafa e despreza<strong>da</strong> em segui<strong>da</strong>. As amostras foram conserva<strong>da</strong>s em<br />
gelo até a chega<strong>da</strong> ao laboratório.<br />
8.4.4.<br />
Extração de HPAs totais<br />
Após as amostras atingirem a temperatura ambiente, foi feita a extração<br />
dos HPAs segundo a metodologia a<strong>da</strong>pta<strong>da</strong> do International Oceanographic<br />
Commission (IOC-UNESCO) (1984). Foi realiza<strong>da</strong> a filtração de parte <strong>da</strong>s<br />
amostras devido a grande quanti<strong>da</strong>de de plâncton presente nas mesmas. Um<br />
litro <strong>da</strong> amostra de água filtra<strong>da</strong> foi transferi<strong>da</strong> para funil de separação de 2 L,<br />
onde foram adicionados 50 mL de Diclorometano (Tedia grau HPLC), sendo a<br />
extração dos HPAs foi feita por agitação manual durante 5 minutos. Após a<br />
separação <strong>da</strong>s fases, a fase orgânica foi recolhi<strong>da</strong> em balão de vidro de fundo<br />
chato e armazena<strong>da</strong> em local abrigado de luz.<br />
Em segui<strong>da</strong>, realizou-se nova extração adicionando-se mais 50 mL de<br />
diclorometano que foi recolhi<strong>da</strong> no mesmo frasco que o primeiro extrato. O<br />
extrato obtido foi centrifugado durante 3 minutos para separar a emulsão<br />
forma<strong>da</strong> durante a agitação devido a grande quanti<strong>da</strong>de de matéria orgânica<br />
presente na amostra, do diclorometano. Foi adicionado sulfato de sódio para a<br />
quebra <strong>da</strong> emulsão e centrifugado novamente (Petrobrás, 200?).<br />
O extrato final obtido foi concentrado em evaporador rotatório, à pressão<br />
reduzi<strong>da</strong> de 200 mmHg e temperatura de aproxima<strong>da</strong>mente 36 o C. O<br />
concentrado obtido foi transferido para balão volumétrico de 10 mL e avolumado<br />
com diclorometano.
Parte experimental 79<br />
8.4.5.<br />
Determinação de HPAs total por fluorescência em água<br />
A análise de fluorescência para determinação de HPAs totais foi realiza<strong>da</strong><br />
em um espectrofluorímetro Perkin Elmer LS 55 Luminescence Spectrometer. A<br />
ban<strong>da</strong> espectral de passagem foi de 4 nm para excitação e emissão e foram<br />
usa<strong>da</strong>s cubetas de quartzo em to<strong>da</strong>s as análises. A detecção foi feita no<br />
comprimento de on<strong>da</strong> de excitação de 334 nm e o comprimento de on<strong>da</strong> de<br />
emissão foi variado de 350 a 450 nm. Foram feitos brancos do processo usandose<br />
água do mar artificial, prepara<strong>da</strong> de acordo com a recomen<strong>da</strong>ção de Riley &<br />
Shirrow (1975), a qual passou pelo mesmo processo de extração <strong>da</strong>s amostras.<br />
8.4.6.<br />
Limpeza do material<br />
To<strong>da</strong> a vidraria volumétrica e os funis de separação foram lavados com<br />
detergente (Detertec 3%) e enxagua<strong>da</strong> com água. Em segui<strong>da</strong>, todo o material<br />
foi enxaguado três vezes com água destila<strong>da</strong> segui<strong>da</strong> de rinsagem com acetona.<br />
Após seco, todo o material foi rinsado com diclorometano.<br />
8.5.<br />
Análise estatística dos <strong>da</strong>dos<br />
Para a escolha do melhor sistema solvente para a diluição <strong>da</strong>s amostras<br />
foi usado o Planejamento Fatorial, modelo 2 3 , onde foram escolhidos 3 fatores<br />
diferentes para estudo, em dois diferentes níveis. Pela análise de variância<br />
(ANOVA) dos resultados, os efeitos que apresentam valores de p < 0,05 são<br />
considerados estatisticamente significativos. Foram também testa<strong>da</strong>s a<br />
normali<strong>da</strong>de dos resíduos usando o teste de Anderson-Darling e a<br />
homogenei<strong>da</strong>de de variância pelo teste de Bartlett já que para o uso <strong>da</strong> ANOVA<br />
as premissas de normali<strong>da</strong>de e homoce<strong>da</strong>stici<strong>da</strong>de não podem ser viola<strong>da</strong>s.<br />
Para a análise dos parâmetros de desempenho analítico a curva analítica<br />
foi construí<strong>da</strong> usando-se o método dos mínimos quadrados. Pela análise de<br />
variância testou-se a vali<strong>da</strong>de <strong>da</strong> regressão. Foram também testa<strong>da</strong>s a
Parte experimental 80<br />
normali<strong>da</strong>de usando o teste de Anderson-Darling e a homogenei<strong>da</strong>de de<br />
variância pelo teste de Bartlett.<br />
Para a análise morfométrica dos peixes foram construídos gráficos de<br />
boxplot onde são mostrados os valores extremos (máximo e mínimo) dos <strong>da</strong>dos,<br />
e sua mediana.<br />
Para comparação dos <strong>da</strong>dos obtidos para os metabólitos de HPAs <strong>da</strong><br />
bílis dos peixes <strong>da</strong> Baía de Guanabara e Itaipu foi usa<strong>da</strong> a análise de variância<br />
onde a hipótese a ser testa<strong>da</strong>, H 0 , seria aceita se os valores de p < 0,05. A<br />
rejeição <strong>da</strong> H 0 leva a aceitação <strong>da</strong> hipótese H 1 . Neste caso, a hipótese H 0<br />
corresponde à hipótese de que as médias dos resultados <strong>da</strong> Baía de Guanabara<br />
e de Itaipu são iguais:<br />
H 0 : µ Baía de Guanabara = µ Itaipu<br />
H 1 : µ Baía de Guanabara ≠ µ Itaipu<br />
A fim de atender ao critério de homogenei<strong>da</strong>de de variância foi necessário<br />
transformar os <strong>da</strong>dos usando o logarítmo na base 10. A comparação <strong>da</strong>s médias<br />
foi feita usando o teste de Tukey com intervalo de confiança de 95%.
9<br />
Resultados e discussões<br />
9.1.<br />
Otimização <strong>da</strong> análise de HPAs em bílis de peixe<br />
9.1.1.<br />
Escolha do sistema solvente<br />
A fim de otimizar o sistema solvente para a diluição <strong>da</strong> bílis foi utilizado o<br />
modelo fatorial 2 3 , em duplicata visando estu<strong>da</strong>r o efeito de três fatores: tipo de<br />
solvente, proporções solvente/água e o tempo de ultra-som em minutos. Antes<br />
do uso do ultra-som partículas de pireno eram visíveis na solução. Estes fatores<br />
foram distribuídos nos seguintes níveis do Quadro 2:<br />
Quadro 2. Fatores e níveis do experimento.<br />
Níveis<br />
Fator<br />
-1 +1<br />
S i Solvente Etanol Propanol<br />
P j Proporção 25% 48%<br />
T k Tempo de ultra-som 15 30<br />
A análise de variância acusou como significativos: o tempo de ultra-som,<br />
as interações duplas e a interação tripla (p
Resultados e discussões 82<br />
Tabela 6. Análise de variância do experimento<br />
Causa de Variação Grau de Soma dos Média dos F<br />
p<br />
liber<strong>da</strong>de Quadrados Quadrados<br />
Solvente (S) 1 0,3 0,3 0,01 0,919<br />
Proporção (P) 1 46,0 46,0 1,85 0,211<br />
Tempo de ultra-som (T) 1 1789,7 1789,7 71,83 0,000<br />
(S) x (P) 1 2602,2 2602,2 104,45 0,000<br />
(S) x (T) 1 364,0 364,0 14,61 0,005<br />
(P) x (T) 1 1810,2 1810,2 72,66 0,000<br />
(S) x (P) x (T) 1 2574,6 2574,6 103,34 0,000<br />
Resíduo 8 199,3 24,9<br />
Total 15 9386,3<br />
Tabela 7. Estimativas dos efeitos e coeficientes com os respectivos intervalos de<br />
confiança de 95%.<br />
Causa de variação Efeito t(8) p Coeficiente Erro-padrão IC I 95% IC S95%<br />
Média 41,000 32,856 0,000 41,000 1,248 38,123 43,878<br />
Solvente (S) 0,262 0,105 0,919 0,131 1,248 -2,746 3,009<br />
Proporção (P) -3,391 -1,359 0,211 -1,696 1,248 -4,573 1,182<br />
Tempo (T) 21,152 8,475 0,000 10,576 1,248 7,699 13,454<br />
(S) x (P) -25,506 -10,220 0,000 -12,753 1,248 -15,631 -9,875<br />
(S) x (T) -9,540 -3,822 0,005 -4,770 1,248 -7,647 -1,892<br />
(P) x (T) 21,273 8,542 0,000 10,637 1,248 7,759 13,514<br />
(S) x (P) x (T) -25,370 -10,165 0,000 -12,685 1,248 -15,563 -9,807<br />
Utilizando apenas os efeitos considerados significativos e substituindo as<br />
variáveis codifica<strong>da</strong>s de acordo com o Quadro 2 na equação 10 a melhor<br />
resposta ou o melhor sinal ( Ŷ ), é para o solvente etanol, na proporção de 48% e<br />
tempo de ultra-som de 30 minutos (Tabela 8), sendo esta a condição otimiza<strong>da</strong><br />
utiliza<strong>da</strong> na metodologia de análise de HPAs em bílis de peixe.<br />
Cabe ressaltar que a proporção etanol/água de 48% já vem sendo utiliza<strong>da</strong><br />
por muitos autores para a análise de metabólitos de HPAs na bílis de peixe<br />
(Beyer et al., 1996; Aas et al., 1998) mas não sendo informado como foi feita<br />
esta escolha.
Resultados e discussões 83<br />
Tabela 8. Valores de Ŷ para a equação de regressão obti<strong>da</strong> do experimento fatorial 2 3 .<br />
Média T (P) x (T) (S) x (T) (S) x (P) (S) x (T) x (P)<br />
41,000 10,576 10,637 -4,770 -12,753 -12,865<br />
Ŷ T P S<br />
-1 1 1 1 -1 36,223 -1 -1 -1<br />
-1 1 -1 -1 1 45,899 -1 -1 1<br />
-1 -1 1 -1 1 15,085 -1 1 -1<br />
-1 -1 -1 1 -1 24,489 -1 1 1<br />
1 -1 -1 1 1 20,271 1 -1 -1<br />
1 -1 1 -1 -1 61,607 1 -1 1<br />
1 1 -1 -1 -1 92,421 1 1 -1<br />
1 1 1 1 1 32,005 1 1 1<br />
9.1.2.<br />
Determinação dos comprimentos de on<strong>da</strong> de excitação e emissão<br />
Para determinação do melhor comprimento de on<strong>da</strong> de excitação (λ exc ) e<br />
emissão (λ em ) foram obtidos espectros de excitação mantendo o λ em fixo e<br />
variando o λ exc de 200 a 400 nm.<br />
Apesar de vários autores reportarem o uso do λ exc e λ em de 341 nm e 383<br />
nm, respectivamente, para os HPAs de quatro anéis, após o refinamento dos<br />
espectros podemos observar pelo espectro que o pico de excitação e emissão<br />
que têm intensi<strong>da</strong>des correspondentes são os picos nos λ exc e λ em foram de 332<br />
e 383 nm (Figura 22). Esta diferença observa<strong>da</strong> dos valores reportados em<br />
literatura para os valores aqui obtidos pode estar relaciona<strong>da</strong> a diferença <strong>da</strong><br />
matriz usa<strong>da</strong> e do composto de referência, já que o composto normalmente<br />
estu<strong>da</strong>do é o 1-hidroxipireno.<br />
Ariese e colaboradores (2005b) reportaram que para otimizar o<br />
comprimento de on<strong>da</strong> foi usado a bílis de um peixe contaminado em laboratório<br />
com pireno a fim de ter apenas o metabólito de interesse em seu meio natural.<br />
Esta maneira de abor<strong>da</strong>r o problema é a mais indica<strong>da</strong> já que os λ exc e λ em dos<br />
compostos de referência não serão exatamente os mesmos <strong>da</strong>s espécies<br />
conjuga<strong>da</strong>s.<br />
Um parâmetro que não foi otimizado foi a o tamanho <strong>da</strong> ban<strong>da</strong> espectral<br />
de passagem de excitação e emissão. As ban<strong>da</strong>s de 4 nm foram utiliza<strong>da</strong>s neste<br />
trabalho uma vez que já vinham sendo utiliza<strong>da</strong>s com sucesso em trabalhos<br />
prévios desenvolvidos no Laboratório de Estudos Ambientais <strong>da</strong> <strong>PUC</strong>-<strong>Rio</strong> (Melo<br />
et al., 2005). Além disso, alguns artigos reportam o uso de ban<strong>da</strong>s espectrais de
Resultados e discussões 84<br />
passagem de 2,5 nm ou 5 nm como as ideais para este tipo de medição (Lin et<br />
al., 1996; Vuontisjärvi et al., 2004; Ariese et al., 2005b).<br />
1000<br />
Intensi<strong>da</strong>de f<br />
900<br />
800<br />
332 383<br />
700<br />
600<br />
500<br />
400<br />
300<br />
200<br />
100<br />
0<br />
300 320 340 360 380 400 420 440<br />
comprimento de on<strong>da</strong> (nm)<br />
Excitação<br />
Emissão<br />
Figura 22. Espectro de excitação (λ em = 383 nm) e emissão (λ ex = 332 nm) do pireno em<br />
etanol 48%.<br />
9.1.3.<br />
Parâmetros de desempenho analítico<br />
Para a determinação <strong>da</strong> faixa analítica de trabalho construiu-se uma<br />
curva analítica utilizando 7 soluções-padrão com concentrações entre 1 a 20 µg<br />
L -1 , obtidos pela diluição <strong>da</strong> solução estoque de pireno. Esta faixa de trabalho foi<br />
escolhi<strong>da</strong> já que to<strong>da</strong>s as amostras coleta<strong>da</strong>s se encontravam dentro desta faixa<br />
de trabalho, em sua maioria no meio <strong>da</strong> curva, região de menor incerteza <strong>da</strong><br />
curva. Foram feitas 4 replicatas de ca<strong>da</strong> concentração, obtendo-se a seguinte<br />
curva analítica (Figura 23):<br />
ˆ 2<br />
Y c<br />
= 5,401+<br />
9,653 x,<br />
R = 99,98%<br />
( 11 )<br />
( ± 0,300)<br />
( ± 0,030)
Resultados e discussões 85<br />
200<br />
Intensi<strong>da</strong>de<br />
100<br />
Regressão<br />
Intervalo de Confiança 95%<br />
0<br />
0<br />
10<br />
Concentração (ug/L)<br />
20<br />
Figura 23. Curva analítica <strong>da</strong> solução de pireno em etanol 48% (n=4) em condições<br />
otimiza<strong>da</strong>s.<br />
A Tabela 9 mostra a análise de variância <strong>da</strong> curva de regressão com p =<br />
0,000. Os pressupostos de normali<strong>da</strong>de e homogenei<strong>da</strong>de de variância também<br />
foram testados apresentando p=0,216 e p=0,932 para o teste de Anderson-<br />
Darling e Bartlett respectivamente.<br />
Tabela 9. Análise de variância <strong>da</strong> curva de regressão.<br />
Causa de Grau de Soma dos Média dos F<br />
p<br />
variação liber<strong>da</strong>de Quadrados Quadrados<br />
Regressão 1 131919,000 131919,000 106961,351 0,000<br />
Resíduo 30 37,000 1,233<br />
Total 31 131956,000<br />
Como os pressupostos de normali<strong>da</strong>de e homogenei<strong>da</strong>de de variância<br />
foram válidos, o mínimo valor detectável (ou limite de detecção) referente à<br />
concentração, x 0 , e o mínimo valor quantificável (ou limite de quantificação)<br />
referente à concentração x 0 , podem ser obtidos pelas equações (13) e (14):
Resultados e discussões 86<br />
3,29 QME<br />
x D<br />
= ( 13 )<br />
Bˆ<br />
1<br />
onde ˆB 1<br />
corresponde ao coeficiente angular <strong>da</strong> curva analítica calcula<strong>da</strong> e QME<br />
corresponde a média do quadrado dos resíduos.<br />
3,29<br />
1,233<br />
−1<br />
x D<br />
= = 0,3785µg<br />
⋅ L<br />
9,653<br />
10 QME<br />
x Q<br />
= ( 14 )<br />
Bˆ<br />
1<br />
onde<br />
ˆB 1 corresponde ao coeficiente angular <strong>da</strong> curva analítica calcula<strong>da</strong> e QME<br />
corresponde a média do quadrado dos resíduos (de Freitas, 2003).<br />
10 1,233<br />
−<br />
x Q<br />
= = 1,504µg<br />
⋅ L<br />
9,653<br />
1<br />
O cálculo do mínimo valor detectável (ou limite de detecção) foi baseado<br />
na teoria do teste estatístico de hipótese, com probabili<strong>da</strong>des de falso positivo<br />
(α) e falso negativo (β), considerando-se α = β = 5%.<br />
Os parâmetros de desempenho analítico se encontram no Quadro 3:<br />
Quadro 3. Parâmetros de desempenho analítico.<br />
ˆ 2<br />
Equação Y c<br />
= 5,401+<br />
9,653 x,<br />
R = 99,98%<br />
( ± 0,300)<br />
( ± 0,030)<br />
Faixa de trabalho 2 – 20 µg L -1<br />
Limite de detecção 0,3785 µg L -1<br />
Limite de quantificação 1,504 µg L -1
Resultados e discussões 87<br />
9.1.4.<br />
Efeito de matriz<br />
Outros constituintes <strong>da</strong> bílis, além dos HPAs, podem absorver a luz que<br />
chega na cubeta durante a medição de fluorescência <strong>da</strong>s amostras. Para<br />
observarmos como o efeito de matriz pode afetar o sinal de fluorescência<br />
medido, foram feitas medições <strong>da</strong> transmitância, à 332 nm, comprimento de<br />
on<strong>da</strong> de excitação usado nas análises de fluorescência.<br />
Neste estudo foram usa<strong>da</strong>s soluções com diferentes diluições do líquido<br />
biliar em etanol 48%. As amostras de bílis utiliza<strong>da</strong>s neste teste foram escolhi<strong>da</strong>s<br />
buscando variação de cor do líquido biliar e diferentes valores <strong>da</strong> absorvância<br />
<strong>da</strong>s amostras diluí<strong>da</strong>s a 1% medi<strong>da</strong>s em 380 nm (Quadro 4 e Figura 24). To<strong>da</strong>s<br />
as bílis usa<strong>da</strong>s neste teste foram retira<strong>da</strong>s de peixes coletados na Baía de<br />
Guanabara.<br />
É importante monitorar os parâmetros de cor <strong>da</strong> bílis e absorvância à 380<br />
nm já que, quanto maior o tempo que o peixe ficar sem se alimentar mais<br />
concentra<strong>da</strong> estará sua bílis. Isto ocorre porque quando o peixe se alimenta, a<br />
bílis é libera<strong>da</strong> no duodeno e a vesícula biliar se enche de água e concentrando<br />
ao longo do tempo em que o peixe estiver em jejum. Vários autores usam a<br />
concentração de biliverdina, pigmento presente na bílis, como indicativo do<br />
“status alimentar” do peixe (Ariese et al., 1997; Aas et al., 2000; Richardson et<br />
al., 2004). Para tal, medições espectrofotométricas <strong>da</strong>s amostras foram feitas no<br />
comprimento de on<strong>da</strong> de 380 nm. Como o padrão de biliverdina não estava<br />
disponível para este trabalho foram feitas medições de absorvância para fins<br />
comparativos.<br />
Quadro 4. Cor e valores de absorvância à 380 nm <strong>da</strong>s amostras utiliza<strong>da</strong>s no teste do<br />
efeito de matriz.<br />
Código <strong>da</strong> amostra Cor do líquido biliar Absorvância<br />
51 verde musgo 1,069<br />
52 verde musgo 0,900<br />
53 castanho 0,531<br />
54 marrom 1,005<br />
58 castanho claro 0,590
Resultados e discussões 88<br />
51 52 53 54 58<br />
Figura 24. Coloração do líquido biliar <strong>da</strong>s amostras utiliza<strong>da</strong>s no teste do efeito de matriz.<br />
Pela Figura 25 percebe-se que o efeito de matriz se torna mais acentuado<br />
a medi<strong>da</strong> que a concentração do líquido biliar aumenta. Assim, neste trabalho foi<br />
adota<strong>da</strong> a diluição de 1:2000, já que, para to<strong>da</strong>s as amostras coleta<strong>da</strong>s, ela foi<br />
suficiente para obter valores dentro <strong>da</strong> faixa de trabalho <strong>da</strong> curva analítica e as<br />
amostras indicaram que estas eram suficientemente transparentes, evitando<br />
assim problemas de interferência de outros compostos presentes na bílis. Aas e<br />
colaboradores (2000) concluíram que uma diluição 1:1000 a 1:2000 deve ser, em<br />
geral, suficiente para evitar esse efeito mas, em alguns casos, pode ser<br />
necessária uma diluição maior para que o sinal medido esteja dentro <strong>da</strong> faixa de<br />
trabalho.<br />
120.00<br />
Transmitância f<br />
100.00<br />
80.00<br />
60.00<br />
40.00<br />
20.00<br />
51<br />
52<br />
53<br />
54<br />
58<br />
0.00<br />
1:2000 1:1500 1:1000 1:500<br />
Diluição<br />
Figura 25. Gráfico do aumento do efeito de matriz com a diminuição <strong>da</strong>s diluições <strong>da</strong>s<br />
amostras.
Resultados e discussões 89<br />
9.1.5.<br />
Adição de analito<br />
Outro teste que pode ser feito para estu<strong>da</strong>r se a matriz afeta o sinal<br />
analítico dos compostos de interesse é a adição de analito. Uma curva analítica<br />
é feita com a adição <strong>da</strong> substância de referência na amostra e compara<strong>da</strong> com<br />
uma curva analítica sem a presença <strong>da</strong> matriz. Um indício de que não há<br />
interferência de matriz é o caso em que as curvas analíticas sejam paralelas<br />
(Ribani et al., 2004).<br />
Foram feitas três adições de analito tanto para amostras provenientes <strong>da</strong><br />
Baía de Guanabara quanto para as oriun<strong>da</strong>s de Itaipu. Foram escolhi<strong>da</strong>s bílis<br />
com cores e valores de absorvância diferentes para uma maior heterogenei<strong>da</strong>de<br />
<strong>da</strong>s amostras (Quadro 5 e Quadro 6).<br />
No gráfico <strong>da</strong> Figura 26 nota-se que há pouca interferência <strong>da</strong> matriz já<br />
que as curvas obti<strong>da</strong>s com as soluções contendo a bílis dos peixes coletados na<br />
Baía de Guanabara são aproxima<strong>da</strong>mente paralelas à curva obti<strong>da</strong> para as<br />
soluções-padrão, mesmo para as bílis que apresentaram mais compostos<br />
fluorescentes. No caso <strong>da</strong>s bílis de peixes de Itaipu, as retas foram praticamente<br />
coincidentes (Figura 27), independente <strong>da</strong> cor <strong>da</strong> amostra. Para a análise <strong>da</strong>s<br />
amostras utilizou-se então, a curva analítica prepara<strong>da</strong> somente com solvente,<br />
sem a presença <strong>da</strong> matriz, por ser uma técnica mais simples de análise.<br />
Quadro 5. Cor e valor de absorvância <strong>da</strong>s amostras utiliza<strong>da</strong>s no teste de adição de<br />
analito.<br />
Código <strong>da</strong> amostra Cor do líquido biliar Absorvância<br />
Baía de Guanabara<br />
51 verde musgo 1,069<br />
53 castanho 0,531<br />
54 marrom 1,005<br />
Itaipu<br />
31 marrom 0,654<br />
38 verde musgo 0,908<br />
40 castanho claro 0,237
Resultados e discussões 90<br />
Quadro 6. Equações <strong>da</strong>s regressões lineares <strong>da</strong>s adições de analito e seu coeficiente de<br />
correlação (R 2 ).<br />
Amostra Equação <strong>da</strong> reta R 2<br />
Solvente 6,248 9,503 ,<br />
ˆ<br />
Y s<br />
+<br />
( ± 1,510) ( ± 0,181)<br />
= x<br />
99,20 %<br />
Baía de Guanabara (BG) 51 ˆ = 141,386 + 8,1188 x<br />
99,40 %<br />
Y BG<br />
( ± 8,119) ( ± 0,353)<br />
53 ˆ = 25,354+<br />
9,078 x<br />
99,98 %<br />
Y BG<br />
( ± 0,588) ( ± 0,070)<br />
54 ˆ = 76,923+<br />
8,617 x<br />
99,85 %<br />
Y BG<br />
( ± 1,437) ( ± 0,172)<br />
Itaipu 31<br />
ˆ = 10,109 + 8,939 x 99,94 %<br />
Y Itaipu<br />
( ± 1,216) ( ± 0,146)<br />
38<br />
ˆ = 7,801+<br />
8,686 x<br />
99,71 %<br />
Y Itaipu<br />
( ± 2,372) ( ± 0,284)<br />
40<br />
ˆ = 14,699+<br />
8,826 x 99,94 %<br />
Y Itaipu<br />
( ± 7,511) ( ± 0,900)<br />
350<br />
Intensi<strong>da</strong>de f<br />
300<br />
250<br />
200<br />
150<br />
100<br />
50<br />
0<br />
0 5 10 15 20 25<br />
Concentração (µg L -1 )<br />
soluções-padrão<br />
adição de analito - amostra 51<br />
adição de analito - amostra 53<br />
adição de analito - amostra 54<br />
Figura 26. Gráfico de adição de analito usando a bílis dos peixes coletados na Baía de<br />
Guanabara.
Resultados e discussões 91<br />
250<br />
Intensi<strong>da</strong>de F<br />
200<br />
150<br />
100<br />
50<br />
adição de analito - amostra 31<br />
adição de analito - amostra 38<br />
adição de analito - amostra 40<br />
soluções-padrão<br />
0<br />
0 5 10 15 20 25<br />
Concentracao (µg L -1 )<br />
Figura 27. Gráfico de adição de analito usando a bílis dos peixes coletados em Itaipu.<br />
O teste de adição de analito também foi usado para verificação <strong>da</strong><br />
exatidão do método. Para tal, usando-se a curva analítica obti<strong>da</strong> para os padrões<br />
diluídos com solvente, foram calcula<strong>da</strong>s as concentrações <strong>da</strong>s amostras<br />
fortifica<strong>da</strong>s com padrões e compara<strong>da</strong>s com a concentração espera<strong>da</strong>. Foi<br />
obtido uma média de concentração correspondente a 86% <strong>da</strong> concentração<br />
espera<strong>da</strong>, com valores variando de 81% a 93%.<br />
Outra maneira de verificarmos a exatidão do método seria a análise de<br />
materiais certificados de referência. No entanto, apesar de Ariese e<br />
colaboradores (2005a, 2005b) terem desenvolvido materiais certificados de<br />
referência preparados com a bílis dos peixes Platichthys flesus (Linguado) e<br />
Pleuronectes platessa (Solha) coletados em locais considerados não-poluídos e<br />
expostos em laboratório a sedimentos contaminados e a óleo, respectivamente,<br />
este material ain<strong>da</strong> não está disponível para compra.<br />
Além disso, a exatidão do método também poderia ser estu<strong>da</strong><strong>da</strong> pela<br />
comparação de resultados obtidos com outras técnicas já estabeleci<strong>da</strong>s. No<br />
entanto, está é a primeira vez que estão sendo feitas determinações de HPAs<br />
em bílis de peixes coletados na Baía de Guanabara e não foi possível organizar<br />
um ensaio interlaboratorial a fim de comparar os resultados obtidos pela<br />
impossibili<strong>da</strong>de de organizar o teste no tempo disponível para a conclusão deste<br />
trabalho.
Resultados e discussões 92<br />
9.2.<br />
Comparação entre Baía de Guanabara e Itaipu<br />
9.2.1.<br />
Parâmetros físico-químicos<br />
Foram feitas 3 coletas na Baía de Guanabara e 3 coletas em Itaipu<br />
conforme o Quadro 7. A primeira coleta na Baía de Guanabara e a primeira<br />
coleta de Itaipu foram coletas de reconhecimento do local e os resultados<br />
obtidos não foram considerados para as conclusões desta dissertação.<br />
Como em setembro de 2005 houve o derrame de 2.000 L de óleo na Baía<br />
de Guanabara que atingiu as praias <strong>da</strong> Flecha e Icaraí em Niterói, foi feita uma<br />
coleta de peixes em Itaipu para avaliar se houve alteração nos valores de<br />
metabólitos de HPAs medidos, em relação aos valores de agosto.<br />
Quadro 7. Data e coordena<strong>da</strong>s <strong>da</strong> coletas.<br />
Local Data Coordena<strong>da</strong>s<br />
Baía de Guanabara 16/02/2005 S 22 o 44.696’ W 43 o 11.483’<br />
Itaipu 23/02/2005 S 22 o 58.359’ W 43 o 02.915’<br />
Baía de Guanabara 10/08/2005 S 22 o 44.654’ W 43 o 11.496’<br />
Itaipu 17/08/2005 S 22 o 56.550’ W 43 o 03.030’<br />
Itaipu 06/09/2005 - -<br />
Baía de Guanabara 27/12/2005 S 22 o 44.774’ W 43 o 11.529’<br />
Pelos parâmetros físico-químicos medidos nos locais de amostragem<br />
(Tabela 10) vemos que há uma grande diferença entre a transparência e turbidez<br />
<strong>da</strong> Baía de Guanabara e Itaipu, indicando que existe mais material particulado<br />
em suspensão na Baía de Guanabara do que em Itaipu. A condutivi<strong>da</strong>de de<br />
Itaipu é mais alta do que na Baía de Guanabara, como esperado, já que em<br />
Itaipu a água é salina e na Baía de Guanabara a água é salobra. Nota-se<br />
também o aumento <strong>da</strong> temperatura <strong>da</strong> água de ~11% no verão em relação ao<br />
inverno.
Resultados e discussões 93<br />
Tabela 10. Parâmetros físico-químicos.<br />
Baía de<br />
Guanabara<br />
(fev/2005)<br />
Itaipu<br />
(fev/2005)<br />
Baía de<br />
Guanabara<br />
(ago/2005)<br />
Itaipu<br />
(ago/2005)<br />
Baía de<br />
Guanabara<br />
(dez/2005)<br />
temperatura ( o C) 27,0 26,0 23,8 23,2 26,1<br />
pH - 8,09 - - 8,02<br />
condutivi<strong>da</strong>de (mS cm -1 ) - 52,8 - 41,8 33,8<br />
oxigênio dissolvido (mg L -1 ) 5,8 - - 9,1 5,7<br />
transparência (m) 0,66 2,70 0,64 3,78 0,66<br />
turbidez (NTU) 11,7 4,2 17,4 0,38 -<br />
9.2.2.<br />
Análise morfométrica dos peixes<br />
Na Figura 28 encontra-se a distribuição de frequência do comprimento<br />
padrão dos indivíduos capturados na Baía de Guanabara e em Itaipu. A<br />
normali<strong>da</strong>de dos <strong>da</strong>dos foi analisa<strong>da</strong> pelo teste de Anderson-Darling (p = 0,394).<br />
Houve maior incidência de indivíduos (n=10) na faixa de tamanho de 42 a 44 cm.<br />
Apenas na coleta de setembro de 2005, em Itaipu, foram coletados indivíduos<br />
com comprimento total menor que 35 cm (Figura 29), tamanho menor que o<br />
permitido pelo IBAMA (Portaria n o 73/2003). É importante ressaltar que esta foi<br />
uma coleta não programa<strong>da</strong>, referente a um evento isolado decorrente de um<br />
derramamento de óleo que ocorreu acidentalmente em Itaipu. A intenção desta<br />
coleta foi aplicar a um caso real o método de determinação de metabólitos de<br />
HPAs em bílis de peixes.<br />
Excetuando-se a coleta de setembro, houve predominância de machos<br />
nas demais coletas, correspondendo a 76% do total de indivíduos capturados<br />
(Tabela 11 e Figura 30). Yender e colaboradores (2002) relatam que o risco de<br />
exposição de peixes de estuário aumenta em áreas com menor profundi<strong>da</strong>de e<br />
durante a época de desova. Apesar de não ser conclusivo, este fato explicaria a<br />
predominância de fêmeas observa<strong>da</strong> somente nesta coleta.
Resultados e discussões 94<br />
Figura 28. Distribuição de frequência do comprimento total dos indivíduos coletados<br />
50<br />
Comprimento total (cm)<br />
40<br />
30<br />
BG Itaipu BG Itaipu<br />
Ago/2005 Ago/2005 Dez/2005 Set/2005<br />
n=19 n=11 n=8 n=12<br />
Figura 29. Gráfico de Boxplot do comprimento total, classificado por coleta<br />
(BG: Baía de Guanabara).
Resultados e discussões 95<br />
Tabela 11. Número de machos e fêmeas capturados.<br />
Local Mês Macho Fêmea Total<br />
Baía de Guanabara Agosto/2005 17 2 19<br />
Itaipu Agosto/2005 6 5 11<br />
Itaipu Setembro/2005 3 5 8<br />
Baía de Guanabara Dezembro/2005 12 0 12<br />
Total 38 12 50<br />
24%<br />
76%<br />
Macho<br />
Fêmea<br />
Figura 30. Proporção sexual dos indivíduos capturados<br />
em to<strong>da</strong>s as coletas <strong>da</strong> Baía de Guanabara e Itaipu.<br />
Apesar de estarem presentes em maior número, os machos, em média,<br />
são menores e pesam menos que as fêmeas (Tabela 12 e Tabela 13, Figura 31<br />
e Figura 32).<br />
Tabela 12. Estimativa <strong>da</strong> média do peso (kg) dos peixes coletados*.<br />
Local Mês Macho Fêmea Total<br />
Baía de Guanabara Agosto/2005 0,520 ±1,128 1,128 ± 0,045 0,584 ± 0,284<br />
Itaipu Agosto/2005 0,707 ± 0,102 0,813 ± 0,106 0,755 ± 0,113<br />
Itaipu Setembro/2005 0,308 ± 0,030 0,464 ± 0,124 0,406 ± 0,125<br />
Baía de Guanabara Dezembro/2005 0,673 ± 0,216 0,673 ± 0,216<br />
Total 0,581 ± 0,223 0,720 ± 0,272 0,614 ± 0,240<br />
* média ± desvio-padrão
Resultados e discussões 96<br />
Tabela 13. Estimativa <strong>da</strong> média do comprimento total (cm) dos peixes coletados*.<br />
Local Mês Macho Fêmea Total<br />
Baía de Guanabara Agosto/2005 39,329 ± 5,018 50,800 ± 0,283 40,537 ± 5,955<br />
Itaipu Agosto/2005 43,983 ± 2,301 45,560 ± 2,809 44,700 ± 2,546<br />
Itaipu Setembro/2005 32,183 ± 2,426 36,880 ± 4,452 35,119 ± 4,350<br />
Baía de Guanabara Dezembro/2005 42,208 ± 3,895 42,208 ± 3,895<br />
Total 40,409 ± 5,057 42,817 ± 6,412 40,987 ± 5,442<br />
* média ± desvio-padrão<br />
1.2<br />
1.1<br />
1.0<br />
0.9<br />
Peso (kg)<br />
0.8<br />
0.7<br />
0.6<br />
0.5<br />
0.4<br />
0.3<br />
Macho<br />
Fêmea<br />
Figura 31. Gráfico de Boxplot do peso, classificado por sexo.<br />
50<br />
Comprimento total (cm)<br />
40<br />
30<br />
Macho<br />
Fêmea<br />
Figura 32. Gráfico de Boxplot do comprimento total, classificado por sexo.
Resultados e discussões 97<br />
Segundo Vazzoler (1996, in Costa, 2005) o valor do coeficiente angular<br />
de regressão entre peso total (W T ) e comprimento padrão (L P ) varia de 2,5 a 4,0.<br />
Pela equação 4 (seção 5.2.1.) foi calculado o modelo que relaciona W T , a partir<br />
de L P :<br />
ˆ 2,790<br />
= 0,0354 × L , R<br />
2<br />
T<br />
P<br />
W<br />
= 93,02%<br />
com ambas estimativas significativas e o valor de p = 0,735 para o pressuposto<br />
de normali<strong>da</strong>de dos resíduos. O valor de β foi 2,79, próximo de 3,0, valor<br />
característico de espécies que apresentam crescimento isométrico.<br />
A partir do cálculo de β foi possível calcular o fator de condição (K) para<br />
ca<strong>da</strong> indivíduo usando-se a equação 6 (5.2.2) (Quadro 8). Pela análise de<br />
variância dos <strong>da</strong>dos não foi encontra<strong>da</strong> diferença significativa entre os valores<br />
obtidos para ca<strong>da</strong> coleta (Tabela 14), indicando que os peixes coletados tinham<br />
mesmas condições de desenvolvimento. No entanto, é reportado que o fator de<br />
condição é variável durante o ciclo de maturi<strong>da</strong>de sexual do indivíduo, reduzindo<br />
na época de reprodução, já que este pode ser influenciado, entre outros fatores,<br />
pela variação do peso <strong>da</strong>s gôna<strong>da</strong>s e estômago. Esta tendência foi vista neste<br />
trabalho nos peixes coletados na Baía de Guanabara em dezembro, época de<br />
reprodução observa<strong>da</strong> para a Mugil liza (Oliveira, 1997).<br />
Quadro 8. Estimativa <strong>da</strong>s médias dos valores do fator de condição (K)*.<br />
Local Mês K<br />
Baía de Guanabara Agosto/2005 0,037 ± 0,009<br />
Itaipu Agosto/2005 0,037 ± 0,003<br />
Itaipu Setembro/2005 0,039 ± 0,008<br />
Baía de Guanabara Dezembro/2005 0,033 ± 0,003<br />
* média ± desvio-padrão<br />
Tabela 14. Análise de variância do fator de condição em relação as coletas.<br />
Causa de Grau de Soma dos Média dos F<br />
p<br />
variação liber<strong>da</strong>de Quadrados Quadrados<br />
Local 3 0,0001932 0,0000644 1,24 0,306<br />
Erro 46 0,0023885 0,0000519<br />
Total 49 0,0025817
Resultados e discussões 98<br />
9.2.3.<br />
Análise <strong>da</strong> bílis<br />
Na Figura 33 observa-se a diferença entre os espectros <strong>da</strong> bílis dos<br />
peixes coletados na Baía de Guanabara e em Itaipu. Os espectros <strong>da</strong> Baía de<br />
Guanabara apresentam dois picos em 383 nm e 405 nm, respectivamente.<br />
Ariese e colaboradores, em seu artigo de 1993, reportam que o espectro <strong>da</strong> bílis<br />
do linguado (Platichthys flesus) também apresenta dois picos nos mesmos<br />
comprimentos de on<strong>da</strong>, que eles relacionaram com o espectro do metabólito 1-<br />
pireno-glicuronídeo padrão, principal metabólito <strong>da</strong> fase II <strong>da</strong> biotransformação<br />
do pireno. Os cálculos <strong>da</strong>s concentrações de HPAs totais foi calculado a partir <strong>da</strong><br />
altura dos picos em 383 nm, comprimento de on<strong>da</strong> otimizado para o pireno, e as<br />
concentrações são reporta<strong>da</strong>s em equivalentes de pireno.<br />
80<br />
.<br />
70<br />
Intensi<strong>da</strong>de f<br />
60<br />
50<br />
40<br />
30<br />
383 nm<br />
2 (Baía de Guanabara)<br />
4 (Baía de Guanabara)<br />
7 (Baía de Guanabara)<br />
30 (Itaipu)<br />
31 (Itaipu)<br />
20<br />
39 (Itaipu)<br />
10<br />
0<br />
350 370 390 410 430 450 470 490<br />
comprimento de on<strong>da</strong> (nm)<br />
Figura 33. Espectros de emissão fluorescente <strong>da</strong>s bílis diluí<strong>da</strong>s <strong>da</strong> Baía de Guanabara e<br />
Itaipu.<br />
O Quadro 9 apresenta as médias <strong>da</strong>s concentrações de HPAs na bílis<br />
dos peixes (Mugil liza) capturados em ca<strong>da</strong> coleta, em relação ao sexo dos<br />
indivíduos. Através <strong>da</strong> análise de variância verifica-se que não existe diferença<br />
significativa entre as médias (Quadro 9, Tabela 15, Tabela 16, Tabela 17) e<br />
portanto, os <strong>da</strong>dos serão tratados como um todo, sem a separação por sexo.
Resultados e discussões 99<br />
Quadro 9. Média <strong>da</strong> concentração de HPAs em mg L -1 de equivalentes de pireno na bílis<br />
dos peixes (Mugil liza) capturados, separados por sexo*.<br />
Local Mês Macho Fêmea<br />
Baía de Guanabara Agosto/2005 7,4 ± 3,4 (n=17) 3,8 ± 0,7 (n=2)<br />
Itaipu Agosto/2005 1,8 ± 1,1 (n=6) 1,0 ± 0,4 (n=5)<br />
Baía de Guanabara Dezembro/2005 10,4 ± 6,4 (n=12)<br />
Itaipu Setembro/2005 1,7 ± 0,7 (n=3) 6,4 ± 3,3 (n=5)<br />
* média ± desvio-padrão<br />
Tabela 15. Análise de variância <strong>da</strong> média <strong>da</strong>s concentrações de HPAs por sexo, coleta<br />
<strong>da</strong> Baía de Guanabara, agosto/2005.<br />
Causa de Grau de Soma dos Média dos F<br />
p<br />
variação liber<strong>da</strong>de Quadrados Quadrados<br />
Sexo 1 23,3 23,3 2,11 0,164<br />
Erro 17 187,9 11,1<br />
Total 18 211,3<br />
Tabela 16. Análise de variância <strong>da</strong> média <strong>da</strong>s concentrações de HPAs por sexo, coleta<br />
de Itaipu, agosto/2005.<br />
Causa de Grau de Soma dos Média dos F<br />
p<br />
variação liber<strong>da</strong>de Quadrados Quadrados<br />
Sexo 1 1,456 1,456 1,98 0,193<br />
Erro 9 6,625 0,736<br />
Total 10 8,081<br />
Tabela 17. Análise de variância <strong>da</strong> média <strong>da</strong>s concentrações de HPAs por sexo, coleta<br />
de Itaipu, setembro/2005.<br />
Causa de Grau de Soma dos Média dos F<br />
p<br />
variação liber<strong>da</strong>de Quadrados Quadrados<br />
Sexo 1 40,83 40,83 5,38 0,059<br />
Erro 6 45,50 7,58<br />
Total 7 86,34<br />
No Quadro 10 são apresenta<strong>da</strong>s as estimativas <strong>da</strong>s médias <strong>da</strong>s<br />
concentrações de HPAs na bílis dos peixes capturados em ca<strong>da</strong> coleta e a<br />
Figura 34 apresenta a distribuição <strong>da</strong>s medições em relação à mediana,<br />
mostra<strong>da</strong>s na forma de boxplot. Medi<strong>da</strong>s feitas na bílis diluí<strong>da</strong>s de três peixes
Resultados e discussões 100<br />
coletados em Itaipu estavam abaixo do limite de detecção de 0,3785 µg L -1 e não<br />
foram utiliza<strong>da</strong>s nos cálculos.<br />
Quadro 10. Estimativa <strong>da</strong>s médias <strong>da</strong>s concentrações de HPAs (µg de equivalentes de<br />
pireno mL -1 de bile) por coleta*.<br />
Local<br />
Mês<br />
HPAs (µg mL -1 )<br />
equivalentes de pireno<br />
Baía de Guanabara Agosto/2005 7,0 ± 3,4<br />
Itaipu Agosto/2005 1,8 ± 0,7<br />
Baía de Guanabara Dezembro/2005 10,4 ± 6,4<br />
Itaipu Setembro/2005 4,6 ± 3,5<br />
* média ± desvio-padrão<br />
30<br />
Concentração (ug/L)<br />
20<br />
10<br />
0<br />
BG Itaipu BG Itaipu<br />
Ago/2005 Ago/2005 Dez/2005 Set/2005<br />
Figura 34. Gráfico de Boxplot <strong>da</strong> concentração de HPAs na bílis dos peixes, por coleta.<br />
Pela análise de variância dos resultados obtidos nas diferentes coletas<br />
verificou-se que existe diferença significativa entre os valores medidos (Tabela<br />
18).<br />
Tabela 18. Análise de variância <strong>da</strong>s concentrações de HPAs por coleta.<br />
Grau de Soma dos Média dos F<br />
p<br />
liber<strong>da</strong>de quadrados quadrados<br />
Local 3 2,8798 0,9599 12,11 0,000<br />
Erro 43 3,4081 0,0793<br />
Total 46 6,2879
Resultados e discussões 101<br />
Usando-se o teste de Tukey foi feita a comparação entre as médias par a<br />
par. Esta análise indicou que não existe diferença significativa, para um nível de<br />
confiança de 95%, entre os valores obtidos para a Baía de Guanabara nas<br />
diferentes estações do ano, inverno e verão.<br />
Já comparando os valores obtidos para a Baía de Guanabara e Itaipu<br />
antes do derrame de setembro/2005, vemos que há diferença significativa, para<br />
um nível de confiança de 95%. Comparando os valores obtidos para Itaipu antes<br />
e depois do derrame vemos que também houve diferença significativa entre os<br />
resultados.<br />
Assim, pelos resultados preliminares obtidos, pode-se dizer que o método<br />
utilizado foi capaz de diferenciar um local contaminado de um local não<br />
contaminado, tanto em casos de contaminação crônica (Baía de Guanabara)<br />
quanto em casos de contaminações acidentais (Itaipu, setembro/2005).<br />
A comparação dos valores de concentração obtidos neste trabalho com<br />
os valores obtidos por outros autores fica prejudica<strong>da</strong> uma vez que os resultados<br />
são apresentados de formas distintas, além de, em muitas vezes, utilizarem<br />
metodologias e técnicas analíticas diferentes. O Quadro 11 apresenta o<br />
resultado de alguns trabalhos onde as concentrações são indica<strong>da</strong>s em<br />
equivalentes de 1-hidroxpireno. Verifica-se que os valores obtidos para os locais<br />
contaminados dos trabalhos de Lin e colaboradores (1994) e van der Oost e<br />
colaboradores (1994), encontram-se na mesma ordem de grandeza que os<br />
valores obtidos neste trabalho para os peixes coletados na Baía de Guanabara e<br />
em Itaipu após o derrame de setembro/2005.<br />
Com o objetivo de tentar minimizar possíveis variações nas<br />
concentrações de HPAs pela concentração dos compostos presentes na bílis, de<br />
acordo com o tempo de jejum de ca<strong>da</strong> peixe (status alimentar), alguns autores<br />
tentaram normalizar as concentrações de HPAs pela concentração de biliverdina<br />
ou proteína <strong>da</strong>s amostras. No entanto, foi observado que não houve diminuição<br />
na covariância dos resultados e aumentando a incerteza dos resultados (Ariese<br />
et al., 1997; Aas et al., 2000; Richardson et al., 2004). Ain<strong>da</strong> assim, recomen<strong>da</strong>se<br />
que sejam feitas estas medições para fins comparativos. Neste trabalho foram<br />
feitas medições de absorvância em soluções de bílis diluí<strong>da</strong>s em etanol 48%<br />
(1:100).
Resultados e discussões 102<br />
Quadro 11. Concentrações de HPAs em bílis de peixe em locais contaminados.<br />
Peixe Local Concentração Uni<strong>da</strong>de Referencia<br />
FF<br />
Ameiurus nebulosus Black river, rio que 27,9 – 126,1 (µg mg proteína -1 ) Lin et al., 1996<br />
desemboca no Lago<br />
Erie (Grandes Lagos,<br />
EUA)<br />
equivalentes de<br />
naftaleno<br />
FS<br />
Ameiurus nebulosus Black river, EUA. 2,63 – 19,5 (µg mLbílis -1 ) Lin et al., 1994<br />
equivalentes de<br />
1-hidroxipireno<br />
Anguilla anguilla Lago Nieuwe Meer,<br />
Holan<strong>da</strong><br />
9,4 ± 7,2 (µg mL bílis -1 )<br />
equivalentes de<br />
van der Oost et<br />
al., 1994<br />
1-hidroxipireno<br />
CLAE – F<br />
Paralichthys<br />
californicus<br />
Marina del Rey,<br />
Califórnia, EUA<br />
1,8 – 4,6 (µg mL bílis -1 )<br />
equivalentes de<br />
Brown &<br />
Steinert, 2003<br />
benzo(a)pireno<br />
Pleuronectes vetulus canal de Duwamish,<br />
Puget Sound, EUA<br />
0,3-0,6 (µg mL bílis -1 )<br />
equivalentes de<br />
benzo(a)pireno<br />
Myers et al.,<br />
1998<br />
9.2.4.<br />
Análise por fluorescência - método sincronizado<br />
Na fluorescência sincroniza<strong>da</strong>, os comprimentos de on<strong>da</strong> de excitação e<br />
emissão são variados simultaneamente, com um intervalo fixo ∆λ ou ∆E, onde o<br />
máximo de sinal ocorrerá quando a varredura atingir o λ exc .<br />
Ariese e colaboradores (1993) recomen<strong>da</strong>m que se use a análise de<br />
fluorescência sincroniza<strong>da</strong> já que o espectro obtido tem ban<strong>da</strong>s mais bem<br />
defini<strong>da</strong>s do que o espectro obtido com a fluorescência fixa. Já Lin e<br />
colaboradores (1996) indicam, para a análise de metabólitos de HPAs em bílis<br />
de peixe, o uso <strong>da</strong> análise por fluorescência fixa por ser uma técnica mais<br />
simples do que a fluorescência sincroniza<strong>da</strong>. Atualmente, vários fluorímetros<br />
comercialmente disponíveis oferecem a possibili<strong>da</strong>de de registro deste tipo de<br />
espectro.<br />
Aas e colaboradores (2000) ao estu<strong>da</strong>rem os metabólitos presentes na<br />
bílis de peixes expostos a determinados HPAs individualmente (naftaleno, pireno<br />
e benzo(a)pireno) demonstraram que existem diferentes espectros para as<br />
diferentes classes de HPAs, usando-se o mesmo ∆λ. Tendências espectrais
Resultados e discussões 103<br />
podem ser demonstra<strong>da</strong>s com bílis de peixes expostos a HPAs de fontes<br />
petrogênicas e pirogênicas.<br />
Neste trabalho, ao analisarmos as bílis dos peixes coletados na Baía de<br />
Guanabara, os espectros de fluorescência sincroniza<strong>da</strong> mostraram que existem<br />
duas classes de HPAs presentes, com picos nos comprimentos de on<strong>da</strong><br />
característicos de compostos com 2-3 anéis (λ = 280 nm) e 4 anéis (λ = 332 nm)<br />
(Figura 35). Não foi observado nenhum pico no comprimento de on<strong>da</strong><br />
característico de HPAs com 5-6 anéis (λ = 380 nm). Estes resultados seriam um<br />
indício de contaminação petrogênica já que a combustão incompleta de matéria<br />
orgânica dá origem preferencialmente a HPAs de alta massa molecular.<br />
Este resultado é esperado já que a Baía de Guanabara recebe<br />
diariamente 7 tonela<strong>da</strong>s de óleo (CEDAE, 199-) e está em concordância com<br />
estudos realizados por Lima (2001) em mexilhões <strong>da</strong> Baía de Guanabara, onde<br />
os HPAs predominantes foram fenantrenos alquilados e dibenzotiofenos, os<br />
quais destacam a origem, preferencialmente, petrogênica dos hidrocarbonetos<br />
presentes nos mexilhões.<br />
No entanto, não se deve ignorar o aporte de HPAs provenientes <strong>da</strong><br />
combustão incompleta de matéria orgânica, que podem chegar à Baía de<br />
Guanabara por deposição atmosférica, já que o grau de contaminação<br />
atmosférico está diretamente relacionado com a urbanização, ao tráfego de<br />
veículos automotores e com a industrialização <strong>da</strong> área (Pereira Netto et al.,<br />
2000) . HPAs de 5-6 anéis também foram detectados nos estudos em mexilhões<br />
feitos por Lima.<br />
300<br />
250<br />
280 nm<br />
Intensi<strong>da</strong>de f<br />
200<br />
150<br />
100<br />
332 nm<br />
51<br />
55<br />
56<br />
50<br />
0<br />
200 220 240 260 280 300 320 340 360 380 400<br />
comprimento de on<strong>da</strong> (nm)<br />
Figura 35. Espectro de fluorescência sincroniza<strong>da</strong> (∆λ=51 nm) para bílis de peixes<br />
coletados na Baía de Guanabara.
Resultados e discussões 104<br />
9.2.5.<br />
Correlação entre as variáveis<br />
As variáveis categóricas deste estudo foram codifica<strong>da</strong>s de acordo com o<br />
Quadro 12 a seguir. O critério utilizado para categorização do local levou em<br />
consideração também o derramamento de óleo ocorrido em Niterói em setembro<br />
de 2005.<br />
Quadro 12. Codificação <strong>da</strong>s variáveis categóricas.<br />
Sexo Local Cor <strong>da</strong> bílis<br />
Macho 1 Baía de Guanabara – Ago/2005 1 Verde musgo 1<br />
Fêmea 2 Itaipu – Ago/2005 2 Marrom 2<br />
Baía de Guanabara – Dez/2005 3 Castanho 3<br />
Itaipu – Set/2005 4 Castanho claro 4<br />
Assim, foi calcula<strong>da</strong> a matriz de correlação <strong>da</strong>s variáveis, onde é indicado<br />
o valor <strong>da</strong> correlação de Pearson entre ca<strong>da</strong> variável e construído o dendograma<br />
de similari<strong>da</strong>de pelo método de Ward, utilizando distâncias euclidianas como<br />
medi<strong>da</strong> de similari<strong>da</strong>de.<br />
Pode-se observar na Tabela 19 e Figura 36 que são significativas as<br />
correlações entre o peso, comprimento padrão e comprimento total, de acordo<br />
com o crescimento isométrico calculado anteriormente. Houve também<br />
correlação positiva entre o peso, comprimento total e comprimento padrão com o<br />
volume de bílis, indicando que quanto maior o peixe maior a quanti<strong>da</strong>de de bílis<br />
encontra<strong>da</strong>.<br />
Tabela 19. Matriz de correlação <strong>da</strong>s variáveis.<br />
W T L T L P K volume sexo local HPA Absorvância Cor<br />
W T 1<br />
L T 0,921 1<br />
L P 0,825 0,907 1<br />
K 0,293 -0,029 -0,254 1<br />
volume 0,603 0,606 0,500 0,066 1<br />
sexo 0,215 0,161 0,079 0,194 0,186 1<br />
local -0,152 -0,235 -0,102 -0,022 -0,160 0,277 1<br />
HPA 0,081 0,004 0,070 0,018 0,191 -0,237 0,025 1<br />
Absorvância -0,040 -0,109 -0,118 0,208 -0,021 0,158 0,143 0,567 1<br />
Cor 0,045 0,028 0,065 -0,038 -0,164 0,235 0,227 -0,488 -0,381 1
Resultados e discussões 105<br />
Similari<strong>da</strong>de<br />
-123.10<br />
-48.74<br />
25.63<br />
100.00<br />
Peso<br />
Lt<br />
Lp<br />
Volume<br />
K<br />
Sexo<br />
Local<br />
HPA<br />
Absorção<br />
Cor<br />
Figura 36. Dendograma de similari<strong>da</strong>de dos valores absolutos <strong>da</strong>s correlações absolutas<br />
<strong>da</strong>s distâncias pelo método de Ward.<br />
Além destas correlações, foram encontra<strong>da</strong>s correlações entre o valor de<br />
absorvância em 380 nm, a cor <strong>da</strong> bílis e a concentração de HPAs medi<strong>da</strong>,<br />
mostrando a relação que existe entre a maior densi<strong>da</strong>de <strong>da</strong> bílis e concentrações<br />
maiores de HPAs, apesar de já ter sido demonstrado que normalizar as<br />
concentrações de HPAs pela concentração de biliverdina, medi<strong>da</strong> por absorção<br />
molecular, não melhora a covariância dos resultados.<br />
Uma preocupação neste trabalho era saber se o tipo de pesca teria<br />
influência no status alimentar do peixe, afetando a concentração de HPAs<br />
medi<strong>da</strong>. Neste estudo o tipo de pesca usado na captura de peixes <strong>da</strong> Baía de<br />
Guanabara foi o curral. O curral tem formato externo circular com um<br />
prolongamento que sai de um ponto determinado e que serve para direcionar o<br />
peixe para dentro do curral, até serem retirados com uma rede. Já em Itaipu o<br />
tipo de pesca usado para captura dos peixes foi o arrasto de praia onde o<br />
pescado se acumula na rede durante o arrasto.<br />
Dos peixes capturados na Baía de Guanabara, 50% apresentaram bílis<br />
com coloração verde musgo enquanto em Itaipu apenas 28% apresentaram esta<br />
mesma coloração, podendo indicar que os peixes que ficam presos no curral<br />
ficam maior tempo sem se alimentar. No entanto, estes <strong>da</strong>dos não são<br />
conclusivos para se afirmar que há influência do tipo de pesca usado, curral ou<br />
arrasto, no status alimentar dos peixes capturados.
Resultados e discussões 106<br />
9.2.6.<br />
Determinação de HPAs totais em água<br />
Para a análise de HPAs totais em água foi obti<strong>da</strong> uma curva analítica<br />
utilizando soluções de pireno em diclorometano. Para a elaboração <strong>da</strong> curva<br />
analítica foram utilizados 6 soluções-padrão com concentrações entre 10 a 150<br />
µg L -1 , obtidos pela diluição <strong>da</strong> solução estoque de pireno. Foram feitas 3<br />
replicatas de ca<strong>da</strong> concentração, obtendo-se a seguinte curva analítica (Figura<br />
23):<br />
ˆ 2<br />
Y c<br />
= 0,570+<br />
1,865 x,<br />
R = 99,80%<br />
( 11 )<br />
( ± 1,639)<br />
( ± 0,020)<br />
300<br />
Intensi<strong>da</strong>de<br />
200<br />
100<br />
Regressão<br />
0<br />
Intervalo de Confiança 95%<br />
0<br />
50<br />
100<br />
Concentração (ng/mL)<br />
150<br />
Figura 37. Curva analítica de soluções de pireno em diclorometano (n=3).<br />
A Tabela 20 mostra a análise de variância <strong>da</strong> curva de regressão com p =<br />
0,000. O pressupostos de normali<strong>da</strong>de e homogenei<strong>da</strong>de de variância também<br />
foram testados apresentando p=0,147 e p=0,131 para a estatística teste de<br />
Anderson-Darling e Bartlett respectivamente.
Resultados e discussões 107<br />
A lineari<strong>da</strong>de <strong>da</strong> curva foi testa<strong>da</strong> pelo teste do ajuste do modelo linear<br />
(erro puro), sendo a faixa de trabalho considera<strong>da</strong> linear com p = 0,788.<br />
Tabela 20. Análise de variância <strong>da</strong> curva de regressão.<br />
Causa de Grau de Soma dos Média dos F<br />
p<br />
variação liber<strong>da</strong>de Quadrados Quadrados<br />
Regressão 1 194.532 194.532 8.684,66 0,000<br />
Resíduo 19 426 22<br />
Total 20 194.958<br />
Como os pressupostos de normali<strong>da</strong>de e homogenei<strong>da</strong>de de variância<br />
foram válidos, o mínimo valor detectável referente à concentração, x 0 , e o<br />
mínimo valor quantificável referente à concentração x 0 , podem ser obtidos pelas<br />
equações (13) e (14):<br />
3,29<br />
22<br />
−1<br />
x D<br />
= = 8,274µg<br />
⋅ L<br />
1,865<br />
10 22<br />
−<br />
x Q<br />
= = 25,15 µg ⋅ L<br />
1,865<br />
1<br />
O mínimo valor detectável e o mínimo valor quantificável foram,<br />
respectivamente, 8,274 µg L -1 e 21,15 µg L -1 .<br />
Os HPAs foram medidos em amostras de água do mar filtra<strong>da</strong>s e não<br />
filtra<strong>da</strong>. No entanto, os extratos obtidos para a água do mar não filtra<strong>da</strong><br />
encontravam-se intensamente coloridos, verdes, devido ao fitoplâncton presente<br />
nas amostras, interferindo nas análises por fluorescência. e os resultados foram<br />
expressos em equivalentes de pireno (µg L -1 ) (Tabela 21). Foram preparados<br />
brancos do processo e seu valor de intensi<strong>da</strong>de foi descontado do valor de<br />
intensi<strong>da</strong>de obtido para as amostras.
Resultados e discussões 108<br />
Tabela 21. Concentração de HPAs medidos em amostras de água*.<br />
Local Data Concentração (µg L -1 )<br />
equivalentes de pireno<br />
Baía de Guanabara agosto/2005 0,0921 ± 0,0053<br />
Itaipu agosto/2005 0,0225 ± 0,0164<br />
Baía de Guanabara dezembro/2005 0,1097 ± 0,0009<br />
* média ± desvio-padrão<br />
Os valores obtidos neste estudo, apesar de reportados em equivalentes<br />
de pireno, tiveram a mesma ordem de grandeza dos menores valores reportados<br />
por Azevedo (1998) e Meniconi e colaboradores (2002), que reportaram seus<br />
resultados em equivalentes de criseno (Quadro 13).<br />
Quadro 13. Concentrações de HPAs na água <strong>da</strong> Baía de Guanabara.<br />
Concentrações de HPAs Uni<strong>da</strong>de Referência Observações<br />
0,06 – 1,59 (µg L -1 ) Silva, 2004<br />
0,66 – 1,18 (F) (µg L -1 )<br />
Lima, 2001 amostras coleta<strong>da</strong>s em 1999.<br />
0,79 – 2,79 (NF) equivalentes de criseno<br />
0,93 (F)<br />
1,52 (NF)<br />
(µg L -1 )<br />
equivalentes de criseno<br />
Lima, 2001<br />
amostra coleta<strong>da</strong> após o acidente<br />
de janeiro/2000.<br />
10<br />
Conclusões e Considerações finais<br />
No presente trabalho foi otimiza<strong>da</strong> uma metodologia analítica simples e<br />
de baixo custo para a determinação de metabólitos de HPAs em bílis de peixes<br />
por fluorescência. Ao utilizar a análise por fluorescência deve-se ter em mente<br />
que esta não é uma técnica seletiva e não possibilita a quantificação dos HPAs<br />
individuais, sendo portanto, uma técnica semi-quantitativa.<br />
Entretanto, o enfoque principal deste estudo não foi a quantificação dos<br />
HPAs e sim desenvolver uma metodologia capaz de detectar a presença ou<br />
ausência de contaminação por petróleo no ambiente no qual os indivíduos foram<br />
capturados (peixes). Assim, para fins de monitoramento ambiental preliminar,<br />
esta técnica é indica<strong>da</strong> já que não são necessárias etapas de extração e cleanup<br />
, tornando o processo de análise mais rápido e econômico se comparado a<br />
outros processos usualmente utilizado para a análise de HPAs.<br />
Para a análise de metabólitos de HPAs em bílis de peixe foram otimizados<br />
os principais parâmetros envolvidos na metodologia e na técnica analítica, sendo<br />
os resultados obtidos para o limite de detecção (LD = 0,3785 µg L -1 ) e de<br />
quantificação (LQ = 1,504 µg L -1 ) indicando uma aplicação favorável ao uso a<br />
que se destina.<br />
Após o uso de um planejamento experimental para determinar o melhor<br />
sistema solvente para preparação <strong>da</strong>s soluções-padrão e para a diluição <strong>da</strong>s<br />
amostras, verificou-se que a proporção etanol/água de 48% foi a condição mais<br />
adequa<strong>da</strong>. Cabe ressaltar que esta já vem sendo utiliza<strong>da</strong> por outros autores<br />
para a análise de metabólitos de HPAs na bílis de peixe.<br />
Deve ser enfatizado que ao utilizar a metodologia proposta deve-se tomar<br />
cui<strong>da</strong>do com a proporção <strong>da</strong> diluição <strong>da</strong>s amostras devido o efeito de matriz ser<br />
significativo. A diluição sugeri<strong>da</strong> neste trabalho é a proporção 1:2000, bílissolvente.<br />
A exatidão do método foi verifica<strong>da</strong> através <strong>da</strong> adição de analito, onde o<br />
valor médio <strong>da</strong>s concentrações determina<strong>da</strong>s para a adição de analito<br />
correspondeu a 86% <strong>da</strong> concentração espera<strong>da</strong>.
Conclusões e Considerações finais 110<br />
Pela análise dos resultados obtidos para a Baía de Guanabara e Itaipu<br />
conclui-se que o método proposto neste estudo é capaz de diferenciar um local<br />
contaminado de um local não contaminado por compostos de petróleo, tanto em<br />
casos de contaminação crônica (Baía de Guanabara) quanto em casos de<br />
contaminações acidentais (Itaipu, setembro/2005).<br />
Adicionalmente, apesar de não ser o objetivo principal do estudo, pôdese<br />
obter também informações preliminares <strong>da</strong> origem dos HPAs. Neste trabalho,<br />
ao analisarmos as bílis dos peixes coletados na Baía de Guanabara, os<br />
espectros de fluorescência sincroniza<strong>da</strong> mostraram que existem duas classes de<br />
HPAs presentes, com picos nos comprimentos de on<strong>da</strong> característicos de<br />
compostos com 2-3 anéis (λ = 280 nm) e 4 anéis (λ = 332 nm). Não foi<br />
observado nenhum pico no comprimento de on<strong>da</strong> característico de HPAs com 5-<br />
6 anéis (λ = 380 nm). Estes resultados seriam um indício de contaminação<br />
petrogênica.<br />
Cabe ressaltar ain<strong>da</strong> a importância dos cui<strong>da</strong>dos tomados no<br />
planejamento amostral dos indivíduos capturados, selecionando e monitorando o<br />
tamanho dos peixes entre outros <strong>da</strong>dos morfométricos. Se a cadeia de custódia<br />
<strong>da</strong>s amostras não é bem estabeleci<strong>da</strong>, principalmente neste tipo de estudo que<br />
envolve grande parte de trabalho de campo, o resultado do trabalho pode ser<br />
questionado, mesmo que estejam analiticamente corretos. Assim, estudos<br />
adicionais e informações sobre a distribuição de frequência do comprimento total<br />
dos indivíduos coletados, a proporção sexual dos indivíduos capturados, estágio<br />
de maturação, fator de condição, entre outros são extremamente relevantes para<br />
aplicações na área ambiental. O histórico e os <strong>da</strong>dos (físico-químicos,<br />
geográficos, climatológicos, entre outros) sobre o ambiente onde os indivíduos<br />
foram capturados também devem fazer parte do estudo para uma melhor<br />
compreensão e discussão dos resultados.<br />
A análise de correlação entre os <strong>da</strong>dos obtidos indicou que são<br />
significativas as correlações entre o peso, comprimento padrão e comprimento<br />
total, de acordo com o crescimento isométrico dos indivíduos. Houve também<br />
correlação positiva entre o peso, comprimento total e comprimento padrão com o<br />
volume de bílis, indicando que quanto maior o peixe maior a quanti<strong>da</strong>de de bílis<br />
encontra<strong>da</strong> para a Mugil liza. Isto indica que em programas de monitoramento<br />
ambiental devam ser escolhidos para estudo indivíduos maiores, garantindo<br />
assim sua maturi<strong>da</strong>de sexual e a fácil retira<strong>da</strong> do líquido biliar.<br />
Além destas correlações, foram encontra<strong>da</strong>s correlações entre o valor de<br />
absorvância em 380 nm, a cor <strong>da</strong> bílis e a concentração de HPAs medi<strong>da</strong>,
Conclusões e Considerações finais 111<br />
mostrando a relação que existe entre a maior densi<strong>da</strong>de <strong>da</strong> bílis e concentrações<br />
maiores de HPAs, apesar de já ter sido demonstrado que normalizar as<br />
concentrações de HPAs pela concentração de biliverdina, medi<strong>da</strong> por absorção<br />
molecular, não melhora a covariância dos resultados.<br />
Um aspecto importante que precisa ser mais estu<strong>da</strong>do para alguma<br />
conclusão é verificar se o tipo de pesca influencia o status alimentar do peixe,<br />
afetando a concentração de HPAs medi<strong>da</strong>.<br />
Para uma melhor compreensão e discussão dos resultados é<br />
fun<strong>da</strong>mental a análise de HPAs no ambiente onde o biomonitor foi capturado. As<br />
concentrações de HPAs obti<strong>da</strong>s na água, tanto <strong>da</strong> Baía de Guanabara quanto<br />
em Itaipu, apresentaram a mesma ordem de grandeza dos menores valores<br />
reportados anteriormente por outros autores. A idéia inicial era tentar verificar a<br />
existência de alguma correlação entre as concentrações de HPAs na bílis do<br />
peixe com as concentrações no ambiente onde os mesmos foram capturados.<br />
Entretanto, esta correlação não pode ser avalia<strong>da</strong> devido ao baixo número de<br />
amostragens de água para esse tipo de conclusão.<br />
É importante ressaltar que esta dissertação é o primeiro trabalho que relata<br />
a utilização dos metabólitos de HPAs em bílis de peixes como biomarcadores no<br />
monitoramento <strong>da</strong> contaminação por petróleo no Brasil. Este trabalho foi<br />
apresentado em dois congressos durante o seu desenvolvimento (SBQ/2005 e<br />
ENQA/2005), e atualmente outros grupos vem iniciando pesquisas na mesma<br />
linha. To<strong>da</strong>s essas pesquisas vão contribuir para geração de <strong>da</strong>dos pretéritos<br />
que futuramente poderão gerar mais conhecimento dos ecossistemas brasileiros<br />
estu<strong>da</strong>dos. Salienta-se aqui que o uso <strong>da</strong> análise de HPAs na bílis de peixe já<br />
vem sendo usado com sucesso em outros países para o monitoramento<br />
ambiental <strong>da</strong> contaminação por petróleo. Pela primeira vez esta técnica foi usa<strong>da</strong><br />
para o monitoramento de peixes <strong>da</strong> Baía de Guanabara, RJ.<br />
Existem na literatura estudos que avaliam a quanti<strong>da</strong>de de HPAs<br />
presentes no tecido de peixes coletados na Baía de Guanabara. No entanto,<br />
este não é considerado um bom biomarcador de HPAs no ambiente aquático<br />
devido ao seu rápido metabolismo em vertebrados, apesar de este tipo de<br />
estudo ser importante do ponto de vista de saúde pública.<br />
A tainha <strong>da</strong> espécie Mugil liza indicou ter potencial para ser um bom<br />
biomonitor para a região <strong>da</strong> Baía de Guanabara, já que foi facilmente captura<strong>da</strong><br />
em épocas do ano distintas, pela fácil localização <strong>da</strong> vesícula biliar e por não<br />
haver diferenças significativas entre os valores de HPAs medidos nas diferentes<br />
estações do ano, inverno e verão.
Conclusões e Considerações finais 112<br />
Apesar <strong>da</strong> sua proximi<strong>da</strong>de com o <strong>Rio</strong> de Janeiro, facilitando a coleta de<br />
indivíduos para o monitoramento, Itaipu não foi o local de controle mais<br />
adequado, já que o biomonitor escolhido não foi facilmente coletado na estação<br />
chuvosa (verão), época de sua reprodução em alto mar. Assim, é necessário<br />
buscar um novo local para captura<strong>da</strong> dos peixes usados como controle.<br />
Como conclusão geral, pode-se dizer que diante <strong>da</strong> crescente ameaça<br />
ambiental que a Baía de Guanabara vem enfrentando, este trabalho torna-se<br />
altamente interessante e com perspectivas muito promissoras para os protocolos<br />
de avaliação ambiental. Haja visto que esta avaliação, basea<strong>da</strong> na determinação<br />
de HPAs em peixes, pode fornecer <strong>da</strong>dos pretéritos para a Baía de Guanabara,<br />
nos casos de acidentes futuros, e contribuir para o monitoramento <strong>da</strong>s emissões<br />
crônicas por óleo, muitas vezes apresentando um potencial altamente tóxico,<br />
oferecendo um grande perigo ao meio ambiente.<br />
Os bons resultados obtidos fazem supor uma grande potenciali<strong>da</strong>de para<br />
um uso mais amplo <strong>da</strong> metodologia otimiza<strong>da</strong> para o biomonitoramento<br />
buscando outros possíveis biomonitores, ou seja, testando outras espécies de<br />
peixes. Entretanto, é necessário salientar uma limitação: o líquido biliar não pode<br />
ser sempre considerado um bioindicador ideal, uma vez que há espécies de<br />
peixes que não apresentam facili<strong>da</strong>de de localização e obtenção <strong>da</strong> bílis.<br />
Por último, vale ressaltar que praticamente inexistem <strong>da</strong>dos sobre a<br />
contaminação de HPAs em peixes <strong>da</strong> espécie Mugil liza (tainha) na Baía de<br />
Guanabara; além de serem pouco conclusivos, visto que os peixes são<br />
transitórios no ambiente sendo, portanto, necessário um número maior de <strong>da</strong>dos<br />
para sua caracterização e avaliação.<br />
Considera-se de fun<strong>da</strong>mental importância para as discussões e conclusões<br />
dos resultados obtidos a continui<strong>da</strong>de <strong>da</strong>s pesquisas com trabalho de campo<br />
baseado em um amplo planejamento amostral, com registros detalhados e que<br />
monitore in situ os parâmetros físico-químicos e biológicos georeferenciados.<br />
Finalmente, vale salientar que este trabalho contou com o apoio e a<br />
colaboração de vários pesquisadores de áreas distintas o que faz deste um<br />
trabalho de caráter interdisciplinar, contribuindo ain<strong>da</strong> mais para as discussões<br />
na área.<br />
Como trabalho futuro será estu<strong>da</strong><strong>da</strong> se existe correlação entre as<br />
determinações feitas usando-se a fluorescência fixa e a fluorescência<br />
sincroniza<strong>da</strong>. Além disso, deverá ser pesquisa<strong>da</strong> nova área de controle onde o
Conclusões e Considerações finais 113<br />
peixe Mugil liza esteja presente o ano inteiro e estu<strong>da</strong>r como o ciclo reprodutivo<br />
<strong>da</strong>s tainhas pode influenciar os resultados. Deve ser estu<strong>da</strong><strong>da</strong> também as<br />
possíveis relações entre o tipo de pesca e o status alimentar do peixe e a<br />
viabili<strong>da</strong>de do uso de novas espécies de peixes como biomonitores.
11<br />
Referências bibliográficas<br />
AAS, E.; BEYER, J.; GOKSØYR, . PAH in fish bile detected by fixed wavelength<br />
Fluorescence. Marine Environmental Research, v. 46, n.1-5, p. 225-228, 1998.<br />
AAS, E.; BEYER, J.; GOKSØYR. Fixed wavelength fluorescence (FF) of bile as a<br />
monitoring tool for polyaromatic hydrocarbon exposure in fish: na evaluation of<br />
compound specificity, inner filter effect and signal interpretation. Biomarkers, v.<br />
5, n. 1, p. 9-23, 2000.<br />
AMBIENTEBRASIL. Apresenta textos sobre meio ambiente. Disponível em:<br />
. Acesso em: 05 jan. 2006.<br />
ARIESE, F. et al. Synchronous fluorescence spectrometry of fish bile: a rapid<br />
screening method for the biomonitoring of PAH exposure. Aquatic toxicology, v.<br />
26, p. 273-286, 1993.<br />
ARIESE, F. et al. Comparison of Analytical Approaches for PAH metabolites<br />
in fish bile samples for marine and estuarine monitoring. Vrije Universiteit,<br />
Institute for Environmental Studies, pp. 29, 1997.<br />
ARIESE, F.; BEYER, J.; WELLS, D. Two fish bile reference materials certified for<br />
PAH metabolites. Journal of Environmental Monitoring, v. 7, p. 869-876,<br />
2005a.<br />
ARIESE, F. et al. Review of analytical methods for determining metabolites<br />
of polycyclic aromatic compounds (PACs) in fish bile. ICES Techniques in<br />
Marine Environmental Sciences, n. 39, pp. 41, 2005b.<br />
AZEVEDO, L.A.C. Determinação de hidrocarbonetos em amostras de água<br />
e mexilhões <strong>da</strong> Baía de Guanabara. Dissertação de mestrado apresenta<strong>da</strong> ao<br />
Programa de Pós-graduação em Química <strong>da</strong> Pontifícia Universi<strong>da</strong>de Católica do<br />
<strong>Rio</strong> de Janeiro, <strong>Rio</strong> de Janeiro, pp. 103, 1998.<br />
BAINS, O.S.; KENNEDY, C.J. Energetic costs of pyrene metabolism in isolated<br />
hepatocytes of rainbow trout, Oncorhynchus mykiss. Aquatic Toxicology, v. 67,<br />
p. 217-226, 2004.<br />
BARRA, R. et al. Bioavailability of PAHs in the Biobio river (Chile): MFO activity<br />
and biliary fluorescence in juvenile Oncorhynchus mykiss. Chemosphere, v. 45,<br />
p. 439-444, 2001.<br />
BASTOS, V.L.F. <strong>da</strong> C. Enzimas do Metabolismo de Xenobióticos em<br />
Piaractus mesopotamicus (PACU). Tese de doutorado apresenta<strong>da</strong> ao Instituto<br />
de Biologia Roberto Alcântara Gomes – UERJ, <strong>Rio</strong> de Janeiro, pp 164, 2001.<br />
BEYER, J. et al. Contaminant accumulation and biomarker responses in flounder<br />
(Platichthys flesus L.) and Atlantic cod (Gadus morhua L.) exposed by caging to<br />
polluted sediments in Sørfjorden, Norway. Aquatic Toxicology, v. 36, p. 75-98,<br />
1996.<br />
BEYER, J. et al. Time- and Dose-dependent biomarker responses in Flounder<br />
(Platichthys flesus L.) exposed to Benzo[a]pyrene, 2,3,3’,4,4’,5-
Referências bibliográficas 115<br />
hexachlorobiphenyl (PCB-156) and cadmium. Biomarkers, v. 2, n. 1, p. 35-44,<br />
1997.<br />
BIZERRIL, C.R.S.F.; COSTA, P.A.S. Peixes Marinhos do Estado do <strong>Rio</strong> de<br />
Janeiro. Fun<strong>da</strong>ção de Estudos do Mar - Secretaria de Estado de Meio Ambiente<br />
e Desenvolvimento Sustentável do Estado do <strong>Rio</strong> de Janeiro, <strong>Rio</strong> de Janeiro, pp.<br />
233, 2001.<br />
BJØRSETH, A. Handbook of polycyclic aromatic hydrocarbons. 1. ed., EUA,<br />
pp. 727, 1983.<br />
BRASIL. Lei n. o 9.966, de 28 de abril de 2000. Diário Oficial <strong>da</strong> República<br />
Federativa do Brasil, Brasília, DF, 29 abr. 2000. Disponível em<br />
. Acesso em: 18 dez. 2005.<br />
BROWN, J.S.; STEINERT, S.A. DNA <strong>da</strong>mage and biliary PAH metabolites in<br />
flatfish from Southern California and harbors and the Channel Islands.<br />
Ecological Indicators, v. 3, p. 263-274, 2003.<br />
CAMUS, L.; AAS E.; BØRSETH, J.F. Ethoxyresorufin-O-deethylase activity and<br />
fixed wavelenght fluorescence detection of PAHs metabolites in bile in turbot<br />
(Scophthalmus maximus L.) Exposed to a Dispersed Topped Crude Oil in a<br />
Continuous Flow System. Marine Environmental Research, v. 46, n. 1-5, p. 29-<br />
32, 1998.<br />
CETESB. Apresenta textos sobre meio ambiente. Disponível em:<br />
. Acesso em: 18 dez. 2005.<br />
COLLERAN, E.; HEIRWEGH, K.P.M. Comparative aspects of bile pigment<br />
formation and excretion. Comparative Biochemistry and Physiology, v. 64B,<br />
p. 133-139, 1979.<br />
COMMITTEE ON BIOLOGICAL MARKERS OF THE NATIONAL RESEARCH<br />
COUNCIL Biological Markers in Environmental Health Research. Environmental<br />
Health Persperctives, v. 74, p. 3-9, 1987.<br />
CEDAE. Programa de despoluição <strong>da</strong> Baía de Guanabara. <strong>Rio</strong> de Janeiro:<br />
Companhia Estadual de Águas e Esgotos, 199-?. 1 disco a laser para<br />
computador.<br />
COSTA, A.F. Avaliação <strong>da</strong> contaminação humana por hidrocarbonetos<br />
policíclicos aromáticos (PAHS): 1-hidroxipireno urinário. Tese de mestrado<br />
apresenta<strong>da</strong> ao Centro de Estudos de Saúde do Trabalhador e Ecologia<br />
Humana <strong>da</strong> Fun<strong>da</strong>ção Oswaldo Cruz, Escola Nacional de Saúde Pública, <strong>Rio</strong> de<br />
Janeiro, pp 80, 2001.<br />
COSTA, A.P.R. et al. Indicadores quantitativos <strong>da</strong> biologia reprodutiva de fêmeas<br />
de piau-vermelho no <strong>Rio</strong> Paraíba do Sul. Pesquisa Agropecuária Brasileira, v.<br />
40, n. 8, p. 789-795, 2005.<br />
DA COSTA, A.O. Poluição por óleo na Baía de Guanabara: o caso do<br />
complexo industrial REDUC-DTSE. Tese de mestrado apresenta<strong>da</strong> a<br />
Coordenação dos Programas de Pós-Graduação de Engenharia <strong>da</strong> Universi<strong>da</strong>de<br />
Federal do <strong>Rio</strong> de Janeiro, <strong>Rio</strong> de Janeiro, pp 156, 2003.<br />
DE CÁSSIA, C. Mancha de óleo já afeta reserva. Jornal O Globo, <strong>Rio</strong> de<br />
Janeiro, 28 abr. 2005. Caderno principal, p. 12.<br />
DE FREITAS, S.M. Metodologia estatística para vali<strong>da</strong>ção de métodos<br />
analíticos aplicável à metrologia em química. Dissertação de mestrado
Referências bibliográficas 116<br />
apresenta<strong>da</strong> ao Programa de Pós-Graduação do Departamento de Metrologia <strong>da</strong><br />
Pontifícia Universi<strong>da</strong>de Católica, <strong>Rio</strong> de Janeiro, pp. 106, 2003.<br />
EGGENS, M.L.; OPPERHUIZEN, A.; BOON, J.P. Temporal variation of CYP1A<br />
indices, PCB and 1-OH pyrene concentration in flounder, Platichthys flesus, from<br />
the Dutch Wadden Sea. Chemosphere, v. 33, n. 8, p. 1579-1596, 1996.<br />
EPA. Gui<strong>da</strong>nce for Assessing Chemical Contaminant Data for Use in Fish<br />
Advisories – Volume 2: Risk Assessment and Fish Consumption Limits. 3.<br />
ed. Washington, DC: EPA, p. 5-88 – 5-93, 2000.<br />
FERREIRA, H.O. Aporte de hidrocarbonetos de petróleo para a Baía de<br />
Guanabara. Dissertação de mestrado apresenta<strong>da</strong> ao Programa de Pós-<br />
Graduação do Departamento de Geociência <strong>da</strong> Universi<strong>da</strong>de Federal<br />
Fluminense, Niterói, pp. 88, 1995.<br />
FIGUEIRA, R. Características de um biomonitor. Portal biomonitor. Disponível<br />
em: . Acesso em: 06 jan. 2006.<br />
FISHBASE. Apresenta textos sobre peixes. Disponível em:<br />
. Acesso em: 11 nov. 2005.<br />
FEEMA - Fun<strong>da</strong>ção Estadual de Engenharia do Meio Ambiente do Estado do <strong>Rio</strong><br />
de Janeiro. Apresenta textos sobre a quali<strong>da</strong>de <strong>da</strong>s águas <strong>da</strong> bacia <strong>da</strong> Baía de<br />
Guanabara. Disponível em: . Acesso em: 08 jan. 2006.<br />
GOMES, M. Vazamento de óleo na Baía de Guanabara. Jornal O Globo, <strong>Rio</strong><br />
de Janeiro, 12 ago. 2005. Disponível em: < http://www.<br />
oglobo.globo.com/online/rio/169422569.asp> Acesso em: 13 ago. 2005.<br />
GUYTON, A.C; HALL, J.E. Tratado de Fisiologia Médica, 10. ed. <strong>Rio</strong> de<br />
Janeiro: Guanabara Koogan., 2002.<br />
HAITZER, M. et al. Effects of dissolved organic matter (DOM) on the<br />
bioconcentration of organic chemicals in aquatic organisms – A review.<br />
Chemosphere, v. 37, n. 7, p. 1335-1362, 1998.<br />
HAMACHER, C. Determinação de hidrocarbonetos em amostras de água e<br />
sedimento <strong>da</strong> Baía de Guanabara. Dissertação de mestrado apresenta<strong>da</strong> ao<br />
Programa de Pós-Graduação do Departamento de Química <strong>da</strong> Pontifícia<br />
Universi<strong>da</strong>de Católica do <strong>Rio</strong> de Janeiro, <strong>Rio</strong> de Janeiro, pp. Geociência <strong>da</strong><br />
Universi<strong>da</strong>de Federal Fluminense, Niterói, pp. 103, 1996.<br />
HAUGLAND, C.; UGLAND, K.I.; Børseth, J.F.; Aas, E. Polycyclic aromatic<br />
hydrocarbons in capelin (Mallotus villosus) in the Barents Sea by use of fixed<br />
wavelength fluorescence measurements of bile samples. Marine Pollution<br />
Bulletin, v. 50, p. 95-104, 2005.<br />
HOFFMAN, D.J. (Ed.). Handbook of Ecotoxicology. 2 a ed. Boca Raton: CRC<br />
Press, pp. 1290, 2003.<br />
HOSNEDL, T. et al. 1-Hydroxypyrene as a Biomarker for Fish Exposure to<br />
Polycyclic Aromatic Hydrocarbons. Bulletin of Environmental Contamination<br />
and Toxicology, v. 71, p. 465-472, 2003.<br />
IBAMA. Aspectos Ambientais e ativi<strong>da</strong>de de Pesca em Lagoa Costeiras<br />
Fluminenses, 1. ed., Brasília, 2000.<br />
IBAMA. Levantamento de <strong>da</strong>dos <strong>da</strong> ativi<strong>da</strong>de pesqueira na Baía de<br />
Guanabara como subsídio para a avaliação de impactos ambientais e a<br />
gestão <strong>da</strong> pesca, <strong>Rio</strong> de Janeiro, 2002.
Referências bibliográficas 117<br />
INSTITUTO BAÍA DE GUANABARA. Apresenta textos sobre a Baía de<br />
Guanabara. Disponível em: . Acesso em:<br />
05 jan. 2006.<br />
INTERGOVERNMENTAL OCEANOGRAPHIC COMMISSION. Manual for<br />
monitoring oil and dissolved/dispersed petroleum hydrocarbons in marine<br />
waters and on beaches. UNESCO, Paris, p. 35,1984.<br />
INTERNATIONAL MARITIME ORGANISATION (IMO). Apresenta textos sobre a<br />
segurança <strong>da</strong> navegação internacional. Disponível em: .<br />
Acesso em: 07 jan. 2006.<br />
IPCS - INTERNATIONAL PROGRAMME ON CHEMICAL SAFETY. Biomarkers<br />
and Risk Assessment: Concepts and Principles. Environmental Health Criteria<br />
155. Organização Mundial de Saúde, pp. 52, 1993.<br />
JEWETT, S.C. et al. Exposure to hydrocarbons 10 years after the Exxon Valdez<br />
oil spill: evidence from cytochrome P4501A expression and biliary FACs in<br />
nearshore demersal fishes. Marine Environmental Research, v. 54, p. 21-48,<br />
2002.<br />
KE, L. et al. Fate of polycyclic aromatic hydrocarbon (PAH) contamination in a<br />
mangrove swamp in Hong Kong following na oil spill. Marine Pollution Bulletin,<br />
v. 45, p. 339-347, 2002.<br />
KIERSZENBAUM, A.L. Histologia e Biologia Celular: Uma Introdução à<br />
Patologia, 1. ed. <strong>Rio</strong> de Janeiro: Elsevier, p. 487-503, 2004.<br />
KJERFVE, B. et al. Oceanographic characteristics of na impacted coastal bay:<br />
Baía de Guanabara, <strong>Rio</strong> de Janeiro, Brazil. Continental Shelf Research, v. 17,<br />
n. 13, p. 1609-1643, 1997.<br />
KLAASSEN, C.D.; WATKINS, J.B. Mechanisms of bile formation, hepatic uptake,<br />
and biliary excretion. Pharmacological reviews, v. 36, n. 1, p. 1-67,1984.<br />
KORNMÜLLER, A.; WIESMANN, U. Ozonation of polycyclic aromatic<br />
hydrocarbons in oil/water-emulsions: mass transfer and reaction kinetics. Water<br />
research, v. 37, p. 1023-1032, 2003.<br />
KRAHN, M.M. et al. Determination of metabolites of xenobiotics in the bile of fish<br />
from polluted waterways. Xenobiotica, v. 14, p. 633-646. 1984.<br />
KRAHN, M.M. et al. Determination of Individual Metabolites of Aromatic<br />
Compounds in Hydrolyzed Bile of English Sole (Parophrys vetulus) from Polluted<br />
Sites in Puget Sound, Washington. Archives of Environmental Contamination<br />
and Toxicology, v. 16, p. 511-522, 1987.<br />
LIMA, A.L.C. Geocronologia de hidrocarbonetos poliaromáticos (PAHs) –<br />
Estudo de caso: Baía de Guanabara. Dissertação de mestrado apresenta<strong>da</strong> ao<br />
Programa de Pós-Graduação em Química <strong>da</strong> Pontifícia Universi<strong>da</strong>de Católica do<br />
<strong>Rio</strong> de Janeiro, <strong>Rio</strong> de Janeiro, pp. 106, 1996.<br />
LIMA, E.F. Acumulação de hidrocarbonetos policíclicos aromáticos e<br />
metais traço em invertebrados marinhos e avaliação do uso de<br />
biomarcadores celulares e bioquímicos no biomonitoramento. Tese de<br />
doutorado apresenta<strong>da</strong> ao Programa de Pós-Graduação em Química <strong>da</strong><br />
Pontifícia Universi<strong>da</strong>de Católica do <strong>Rio</strong> de Janeiro, <strong>Rio</strong> de Janeiro, pp 187, 2001.<br />
LIN, E.L.C.; CORMIER, S.M., RACINE, R.N. Synchronous fluorometric<br />
measurement of metabolites of polycyclic aromatic hydrocarbons in the bile of<br />
brown bullhead. Environmental Toxicology and Chemistry, v. 13, n. 5, p. 707-<br />
715, 1994.
Referências bibliográficas 118<br />
LIN, E.L.C.; CORMIER, S.M.; TORSELLA, J.A. Fish biliary polycyclic aromatic<br />
hydrocarbon metabolites estimated by fixed-wavelength fluorescence:<br />
comparison with HPLC-fluorescente detection. Ecotoxicology and<br />
Environmental Safety, v. 35, p. 16-23, 1996.<br />
LIVINGSTONE, D.R. The fate of organic xenobiotics in aquatic ecosystems:<br />
quantitative and qualitative differences in biotransformation by invertebrates and<br />
fish. Comparative Biochemistry and Physiology - Part A, v. 120, p. 43-49,<br />
1998.<br />
LOWE-Mc-CONNEL, R.H. Estudos Ecológicos em Comuni<strong>da</strong>des de Peixes<br />
Tropicais. São Paulo: Editora <strong>da</strong> Universi<strong>da</strong>de de São Paulo, pp. 534, 1999.<br />
LUTHE, G. et al. Metabolism of 1-fluoropyrene and pyrene in marine flatfish and<br />
terrestrial isopods. Environmental Toxicology and Pharmacology, v. 12, p.<br />
221-229, 2002.<br />
MARQUEIRO, P. & BRANDÃO, T. Esgoto a peso de ouro. Jornal O Globo, <strong>Rio</strong><br />
de Janeiro, 4 fev. 2005. Caderno principal, p. 13.<br />
MEADOR, J.P. et al. Bioaccumulation of polycyclic aromatic hydrocarbons by<br />
marine organisms. Reviews of Environmental Contamination and<br />
Toxicology, v. 143, p. 79-165, 1995.<br />
MELO, N.A. et al. Fluorescência <strong>da</strong> bílis de peixe Mugil liza (tainha) captura<strong>da</strong>s<br />
em regiões contamina<strong>da</strong>s e não contamina<strong>da</strong>s por óleo, no estado do RJ. In: 28 a<br />
Reunião Anual <strong>da</strong> Socie<strong>da</strong>de Brasileira de Química, Livro de Resumos, Poços<br />
de Cal<strong>da</strong>s, 2005.<br />
MENEZES, N. Guia Prático para conhecimento e identificação de tainhas e<br />
paratis (Pisces, Mugili<strong>da</strong>e) do litoral brasileiro. Revista Brasileira de Zoologia,<br />
v. 2, n. 1, p. 1-12, 1983.<br />
MENICONI et al. Fisheries safety monitoring in the Guanabara Bay, Brazil<br />
following a marine fuel oil spill. International Oil Spill Conference. Tampa,<br />
Flori<strong>da</strong>, p. 951-957, 2001.<br />
MENICONI, M.F.G. et al. Brazilian oil spill chemical characterization – case<br />
studies. Environmental Forensics, v. 3, p. 303 – 321, 2002.<br />
MONTELLANO, P.R.O. The mechanism of heme oxygenase. Current Opinion<br />
in Chemical Biology, v.4, p. 221-227, 2000.<br />
MYERS, M.S. et al. Toxicopathic hepatic lesions in subadult English sole<br />
(Pleuronectes vetulus) from Puget Sound, Washington, USA: relationships with<br />
other biomarkers of contaminant exposure. Marine Environmental Research, v.<br />
45, n. 1, p. 47-67, 1998.<br />
NATIONAL RESEARCH COUNCIL. Oil in the sea III: inputs, fates, and<br />
effects. 1. ed., EUA, pp. 265, 2003.<br />
NEWMAN, M.C.; UNGER, M.A. Fun<strong>da</strong>mentals of Ecotoxicology, 2. ed., Lewis<br />
Publishers, EUA, p. 33-34; p. 75-93; p. 113-129, 2003.<br />
OKUMUS, I. & BAŞCINAR, . Population structure, growth and reproduction of<br />
introduced Pacific mullet, Mugil so-iuy in the Black Sea. Fisheries Research, v.<br />
33, p. 131-137, 1997.<br />
OLIVEIRA, S.S. Estrutura de comuni<strong>da</strong>des ícticas do sistema lagunar de<br />
Piratininga-Itaipu, Niterói, RJ. Tese de doutorado apresenta<strong>da</strong> ao Programa de<br />
Pós Graduação em Ecologia e Recursos Naturais do Centro de Ciências<br />
Biológicas e <strong>da</strong> Saúde <strong>da</strong> Universi<strong>da</strong>de Federal de São Carlos, São Carlos, pp<br />
288, 1997.
Referências bibliográficas 119<br />
PEREIRA NETTO, A.D. et al. Avaliação <strong>da</strong> contaminação humana por<br />
hidrocarbonetos policíclicos aromáticos (HPAs) e seus derivados nitrados<br />
(NHPAS): uma revisão metodológica. Química Nova, v. 23, n. 6, p. 765-773,<br />
2000.<br />
PETROBRÁS. Monitoramento ambiental <strong>da</strong> ativi<strong>da</strong>de de produção de petróleo<br />
<strong>da</strong> Bacia de Campos. 200? I CD-ROM.<br />
PREFEITURA DE NITERÓI. Apresenta textos relacionados a ci<strong>da</strong>de de Niterói.<br />
Disponível em: .<br />
Acesso em: 12 dez. 2005.<br />
RIBANI, M. et al. Vali<strong>da</strong>ção em métodos cromatográficos e eletroforéticos.<br />
Química Nova, v. 27, n. 5, p. 771-780, 2004.<br />
RICHARDSON, D.M. et al. Effects of feeding on biliary PAH metabolite and<br />
biliverdin concentrations in plaice (Pleuronectes platessa). Environmental<br />
Toxicology and Pharmacology, v. 17, p. 79-85, 2004.<br />
RILEY, J.P.; SHIRROW, G. Chemical oceanography. 2. ed., vol. 1, Academic<br />
Press, 1975.<br />
RIZEL, P. Estudos qualitativos para determinação de metabólitos de pireno<br />
empregando CG/EM. Dissertação de mestrado apresenta<strong>da</strong> ao Programa de<br />
Pós-Graduação em Química <strong>da</strong> Pontifícia Universi<strong>da</strong>de Católica do <strong>Rio</strong> de<br />
Janeiro, <strong>Rio</strong> de Janeiro, pp 187, 2001.<br />
SALVADOR, M.V.S.; DA SILVA, M.A.M. Morphology and sedimentology of the<br />
Itaipu Embayment – Niterói/RJ. Anais <strong>da</strong> Academia Brasileira de Ciências, v.<br />
74, n. 1, p 127-134, 2002.<br />
SANTOS, C.L.; SILVA M.A.M.; SALVADOR, M.V.S. Dinâmica Sazonal e os<br />
Efeitos <strong>da</strong>s Ressacas nas Praias de Niterói/RJ. Revista Brasileira de<br />
Geociências, v. 34, n. 3, p. 355-360, 2004.<br />
SHARMA, A.; SCHULMAN, S.G. Introduction to fluorescence spectroscopy.<br />
Nova Iorque: Johna Wiley and Sons, Inc., pp. 173, 1999.<br />
SILVA, T.F. Monitoramento de hidrocarbonetos policíclicos aromáticos na<br />
Baía de Guanabara: sedimento, água e peixes. Dissertação de mestrado<br />
apresenta<strong>da</strong> ao Departamento de Química Orgânica do Instituto de Química <strong>da</strong><br />
Universi<strong>da</strong>de Federal do <strong>Rio</strong> de Janeiro, <strong>Rio</strong> de Janeiro, pp 102, 2004.<br />
SKOOG, D.A.; HOLLER, F.J.; NIEMAN, T.A. Princípios de análise<br />
instrumental. 5. ed. Porto Alegre: Bookman, p. 322-339, 2002.<br />
STOLYHWO, A.; SIKORSKI, Z.E. Polycyclic aromatic hydrocarbons in smoked<br />
fish – a critial review. Food Chemistry, v. 91, p. 303-311, 2005.<br />
VAN DER OOST, R. et al. Bioaccumulation, biotransformation and DNA binding<br />
of PAHs in feral eel (Anguilla anguilla) exposed to polluted sediments: a field<br />
survey. Environmental toxicology and chemistry, v. 13, n. 6, p. 859-870, 1994<br />
VAN DER OOST, R., BEYER, J., VERMEULEN, N.P.E., Fish bioaccumulation<br />
and biomarkers in environmental risk assessment: a review. Environmental<br />
Toxicology and Pharmacology, v. 13, p. 57-149, 2003.<br />
VARANASI, U. (Ed.). Metabolism of polycyclic aromatic hydrocarbons in the<br />
aquatic environment, 1. ed. Boca Raton: CRC Press, Inc., pp. 341, 1989.<br />
VAZZOLER, A.E.A.M. Manual de métodos para estudos biológicos de<br />
população de peixes, Reprodução e crescimento. Brasília, CNPq, p. 105,<br />
1982.
Referências bibliográficas 120<br />
VERWEIJ, F. et al. Assessment of bioavailable PAH, PCB and OCP<br />
concentrations in water, using semipermeable membrane devices (SPMDs),<br />
sediments and caged carp. Chemosphere, v. 54, p. 1675-1689, 2004.<br />
VUONTISJÄRVI, H. et al. A comparison of HPLC with fluorescence detection and<br />
fixed wavelength fluorescence methods for the determination of PAH metabolites<br />
in fish bile. Polycyclic Aromatic Compounds, v. 24, p. 333-342, 2004.<br />
WEBER, W. Ambiente <strong>da</strong>s Águas no Estado do <strong>Rio</strong> de Janeiro, Projeto<br />
PLANÁGUA-SEMADS/GTZ, <strong>Rio</strong> de Janeiro, 2001.<br />
YENDER, R.; MICHEL, J.; LORD, C. Managing seafood safety after oil spill.<br />
Hazardous Materials Response Division, Office of Response and Restoration,<br />
National Oceanic and Atmospheric Administration, EUA, pp. 72, 2002.