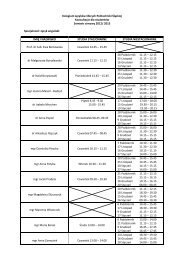
TLC - Politechnika Śląska
TLC - Politechnika Śląska
TLC - Politechnika Śląska
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
POLITECHNIKA ŚLĄSKA<br />
WYDZIAŁ CHEMICZNY<br />
KATEDRA CHEMII ORGANCZNEJ, BIOORGANICZNEJ I BIOTECHNOLOGII<br />
LABORATORIUM Z CHEMII OGRANICZNEJ<br />
Chromatografia Cienkowarstwowa (<strong>TLC</strong>)<br />
Prowadzący: mgr inż. Aurelia Zniszczoł<br />
mgr inż. Sebastian Budniok<br />
GLIWICE 2010
1. Wprowadzenie do chromatografii<br />
Chromatografia jest techniką analityczną i preparatywną wykorzystującą rozdzielanie<br />
mieszanin substancji na poszczególne składniki, bądź ich grupy (frakcje), dzięki różnicom<br />
w zachowaniu się tych składników w układzie dwóch faz, w których jedna nie zmienia swego<br />
położenia (faza nieruchoma, stacjonarna), druga zaś porusza się względem pierwszej<br />
w określonym kierunku (faza ruchoma, roztwór rozwijający).<br />
Ze względu na rodzaj dominującego mechanizmu procesu rozdziału chromatografie<br />
możemy podzielić na:<br />
a) adsorpcyjną - gdy fazą ruchomą jest ciecz lub gaz, a nieruchomą ciało stałe<br />
o właściwościach adsorbujących i odpowiednim rozdrobnieniu (np. żel krzemionkowy, tlenek<br />
glinowy, węgiel aktywny itp.). Rozdział jest powodowany różnicami współczynników<br />
adsorpcji.<br />
b) podziałową - gdy fazą ruchomą jest ciecz lub gaz, a stacjonarną ciecz zatrzymana na<br />
odpowiednim nośniku (bibuła, ziemia okrzemkowa, kulki szklane itp.). Rozdział jest<br />
wynikiem różnic współczynników podziału.<br />
c) jonowymienną - gdy fazą ruchomą jest ciecz, a stacjonarną wymieniacz jonowy. Rozdział<br />
zależy od różnic w sile wiązania składników przez wymieniacz.<br />
d) żelową - gdy fazą ruchomą jest ciecz, a nieruchomą granulowany, jednorodny spęczniały<br />
żel. Rozdział jest powodowany różnicami w zdolnościach dyfundowania do cząsteczek żelu,<br />
a więc różnicami w wielkości cząsteczek składników.<br />
W zależności od rodzaju fazy rozdzielczej i natury eluentu czyli substancji w której<br />
rozpuszcza się badaną mieszaninę rozróżnia się następujące techniki chromatograficzne:<br />
a) chromatografia gazowa – to analityczna technika chromatograficzna, w której fazą<br />
nośną jest gaz (zazwyczaj hel, argon lub wodór). Chromatografia gazowa jest<br />
najczęściej stosowaną metodą do szybkiej analizy złożonych mieszanin związków<br />
chemicznych oraz oceny czystości tych związków.<br />
b) chromatografia cieczowa –chromatografia, w której eluentem jest ciecz. Istotą każdej<br />
chromatografii cieczowej jest rozdział analizowanej mieszaniny na poszczególne
związki chemiczne poprzez przepuszczanie roztworu tej mieszaniny przez stałe lub<br />
żelowe złoża. Na skutek oddziaływań międzycząsteczkowych między związkami<br />
tworzącymi mieszaninę a złożem jedne z nich przechodzą przez złoże szybciej a inne<br />
wolniej.<br />
c) chromatografia kolumnowa - w której faza rozdzielcza jest umieszczona<br />
w specjalnej kolumnie, przez którą przepuszcza się następnie roztwór badanej<br />
mieszaniny. Przepływ roztworu przez kolumnę można wymuszać grawitacyjnie lub<br />
stosując różnicę ciśnień na wlocie i wylocie kolumny.<br />
d) chromatografia planarna - rozdział chromatograficzny jest prowadzony, gdy faza<br />
stacjonarna jest w postaci cienkiej warstwy.<br />
Chromatografię planarną można jeszcze podzielić na:<br />
· chromatografie bibułową (PC) której podstawą działania jest podział substancji<br />
rozdzielanych miedzy fazę nieruchomą, którą stanowi woda unieruchomiona przez<br />
celulozę dzięki jej higroskopijności, oraz fazę ruchomą rozpuszczalnik organiczny lub<br />
mieszaninę rozpuszczalników, często nawet z wodą, wędrujące po bibule dzięki siłom<br />
kapilarnym. Celuloza stanowiąca nośnik dla fazy stacjonarnej (wody) ma niewielkie<br />
właściwości adsorpcyjne i prawie nie zniekształca przebiegu rozdzielania opartego na<br />
podziale substancji między wodę a wędrujący rozpuszczalnik. Jeżeli współczynniki<br />
podziału substancji naniesionych na bibułę są różne, to w trakcie wędrówki po bibule<br />
następuje ich rozdzielenie<br />
· chromatografie cienkowarstwową (<strong>TLC</strong>) - w której fazę nieruchomą nanosi się<br />
w postaci cienkiej równomiernej warstewki na płytkę szklaną, arkusz folii<br />
aluminiowej czy tworzywa sztucznego.
2. Chromatografia cienkowarstwowa<br />
Chromatografia cienkowarstwowa (<strong>TLC</strong> – z ang. Thin Layer Chromatography) jest<br />
najpopularniejszą metodą szybkiego sprawdzania postępu reakcji chemicznej i czystości<br />
produktu. Może być także wykorzystywana do identyfikacji związków zarówno organicznych<br />
jak i nieorganicznych. W chromatografii cienkowarstwowej mieszanina substancji jest<br />
rozdzielana na poszczególne składniki ze względu na różnice w szybkości ich<br />
przemieszczania się na podłożu wykonanym z aktywnego adsorbenta stanowiącego fazę<br />
nieruchomą. Poszczególne składniki mieszaniny z różną siła wiążą się z polarnym<br />
adsorbentem, a następnie wymywane są z niego rozpuszczalnikiem stanowiącym fazę<br />
ruchomą. Im bardziej polarna jest badana substancja, tym silniej wiąże się z fazą stałą i tym<br />
trudniej jest wymywana przez eluent. Im bardziej polarny jest eluent, tym więcej polarnych<br />
centrów aktywnych fazy stałej jest przez niego blokowane, co zmniejsza „opory” przesuwania<br />
się eluowanych substancji.<br />
W chromatografii cienkowarstwowej faza stacjonarna jest naniesiona w postaci<br />
cienkiej warstwy o grubości od 0,1 do 0,25 mm na płytkę szklaną lub metalową lub<br />
z tworzywa sztucznego o wymiarach 200x200mm, 200x50 mm lub100x50 mm. Naniesiona<br />
warstwa musi być mechanicznie trwała i odporna na ocieranie Najczęściej do fazy<br />
stacjonarnej dodaje się 0.1 - 10 % tzw. lepiszcza, którym może być gips, skrobia, sole<br />
kwasów poliakrylowych i inne. Ze względu na detekcję substancji warstwy<br />
chromatograficzne zawierają także często trwale zaadsorbowany wskaźnik fluorescencyjny.<br />
W chromatografii cienkowarstwowej, podobnie jak w kolumnowej, do rozdzielania są<br />
wykorzystywane te same mechanizmy oddziaływań międzycząsteczkowych, a więc<br />
adsorpcja, wymiana jonowa, podział, czy warunki układu faz odwróconych. Jednakże ciągle<br />
dominującą rolę (w przeciwieństwie do chromatografii kolumnowej) odgrywa adsorpcja,<br />
a najczęściej stosowanymi adsorbentami są:<br />
· Żel krzemionkowy - jest jednym z najbardziej popularnych adsorbentów stosowanych<br />
w chromatografii cienkowarstwowej. Jest on otrzymywany przez hydrolizę krzemianu<br />
sodu, jego kondensację i polimeryzację w trakcie prażenia. Jego struktura wygląda<br />
w przybliżeniu następująco:
O<br />
O<br />
Si<br />
OH<br />
O<br />
O O<br />
O<br />
Si Si<br />
OH<br />
Aktywność żelu krzemionkowego zapewniają grupy Si-OH (silanolowe) obecne na<br />
jego powierzchni. Wytwórcy kontrolują aktywność na etapie prażenia. Żel stosowany<br />
w <strong>TLC</strong> ma średnicę ziaren w zakresię 5-10 mm. Typy żelu krzemionkowego<br />
oznaczane są często w sposób następujący:<br />
- Żel krzemionkowy G – zawiera 13% gipsu jako czynnika wiążącego<br />
- Żel krzemionkowy H bez środka wiążącego<br />
- Żel krzemionkowy F254 z fluorescentem<br />
- Żel krzemionkowy UV254 z fluorescentem<br />
OH<br />
Jako fluorescent zazwyczaj stosowany jest siarczek cynku.<br />
Żel krzemionkowy ma odczyn lekko kwaśny i może być stosowany do rozdziału<br />
sterydów, aminokwasów, węglowodorów, tłuszczów, alkaloidów itp.<br />
· Tlenek glinu - aktywność tlenku glinu związana jest z obecnością zarówno atomów<br />
tlenu jak i glinu. Metoda produkcji polega na kondensacji uwodnionego wodorotlenku<br />
glinu. Może on być<br />
O O O O O O<br />
Al<br />
O<br />
Al<br />
O<br />
produkowany w trzech odmianach kwasowości powierzchni: formie kwasowej,<br />
zasadowej i obojętnej. Zasadowy tlenek glinu z w/w jest najbardziej popularny.<br />
Tlenek glinu jest używany do rozdziału sterydów, barwników, witamin i alkaloidów.<br />
· Celuloza jest naturalnym polisacharydem zbudowanym z cząsteczek glukozy<br />
połączonych wiązaniami b(1,4) glikozydowymi. Płytki <strong>TLC</strong> pokryte są cząsteczkami<br />
celulozy o podobnej<br />
Al<br />
O<br />
O
·<br />
HO<br />
OH<br />
O<br />
OH<br />
O<br />
HO<br />
OH<br />
O<br />
O<br />
HO<br />
OH<br />
OH<br />
O<br />
OH<br />
O<br />
HO<br />
OH<br />
O<br />
O<br />
wielkości ziaren, co powoduje regularny przepływ rozpuszczalnika. Celuloza jest<br />
stosowana do rozdziału związków hydrofilowych, rozpuszczalnych jonów<br />
nieorganicznych i kwasów nukleinowych, które mogą zbyt silnie oddziaływać z<br />
tlenkiem glinu lub krzemionką. Oprócz tych typowych sorbentów w chromatografii<br />
cienkowarstwowej stosuje się także proszek poliamidowy, modyfikowane celulozy o<br />
właściwościach jonowymiennych oraz żele organiczne o właściwościach sit<br />
molekularnych np. Sephadex, BioGel P i inne.<br />
· Z nieorganicznych adsorbentów stosowanych w chromatografii cienkowarstwowej<br />
można wymienić szkło sproszkowane, krzemian wapnia, hydroksyapatyt, siarczan<br />
wapnia, tlenek cyrkonu, tlenek tytanu a nawet tlenek żelaza.<br />
Natomiast fazę ruchomą stanowią zazwyczaj rozpuszczalniki organiczne. Powinny<br />
one być neutralne w odniesieniu do rozdzielanych substancji, wykazywać znaczną lotność<br />
par, co znacznie ułatwia osiągnięcie równowagi ciecz-para, i niską gęstość, co przyspiesza<br />
usunięcie rozpuszczalnika z powierzchni płytki. W celu określenia siły oddziaływań<br />
pomiędzy fazą ruchomą a powierzchnią nośnika wprowadzono parametr siły rozpuszczalnika<br />
e 0 . Jest to energia adsorpcji na jednostkę powierzchni standardowego adsorbenta (e 0 jest<br />
równe zero na tlenku glinu eluowanym pentanem). Generalnie, im większe wartości e 0 tym<br />
silniej rozpuszczalnik oddziałuje z powierzchnią adsorbenta i tym łatwiej cząsteczki<br />
związku będą się przemieszczały co prowadzi do większej wartości Rf (Warto zauważyć,<br />
iż im większa polarność eluenta, tym większe e 0 ). Wartości Rf substancji w każdej fazie<br />
ruchomej będą zależne od różnicy w wartości siły rozpuszczalnika. Parametr mocy<br />
rozpuszczalnika, który może być zmierzony daje szereg elucyjny rozpuszczalników<br />
zamieszczony w tabeli poniżej.<br />
Rozpuszczalnik e 0 (Al2O3) Graniczna przepuszczalność w<br />
UV [nm]<br />
OH<br />
Temperatura wrzenia<br />
[ o C]
Pentan 0.001 210 36.0<br />
Heptan 0.01 210 98.4<br />
Cykloheksan 0.04 210 81.0<br />
Disiarczek węgla 0.15 380 45.0<br />
Czterochlorek węgla 0.18 265 76.7<br />
Eter diizopropylowy 0.28 220 69.0<br />
Toluen 0.29 285 110.6<br />
Chlorobenzen 0.30 280 132<br />
Benzen 0.32 280 80.1<br />
Eter dietylowy 0.38 220 34.6<br />
Chloroform 0.40 245 61.2<br />
Dichlorometan 0.42 245 41.0<br />
Tetrahydrofuran 0.45 220 65.0<br />
1,2-Dichloroetan 0.49 230 84.0<br />
Aceton 0.56 330 56.2<br />
1,4-Dioksan 0.56 220 104.0<br />
Octan etylu 0.58 260 77.1<br />
Octan metylu 0.60 260 57.0<br />
Dimetylosulfotlenek 0.62 270 190.0<br />
Nitrometan 0.64 3809 100.8<br />
Acetonitryl 0.65 210 80.1<br />
Pirydyna 0.71 305 115.5<br />
Izopropanol 0.82 210 82.4
Etanol 0.88 210 78.5<br />
Metanol 0.95 210 65.0<br />
Glikol etylenowy 1.11 210 198.0<br />
Kwas octowy Bardzo duży 251 118.5<br />
Dobór odpowiedniego układu rozpuszczalników opiera się na zasadzie: podobny<br />
rozpuszcza się w podobnym. Zazwyczaj wykonuje się kilka prób (zmieniając polarność<br />
eluentu), dążąc do osiągnięcia wartości Rf pomiędzy sąsiednimi plamkami przynajmniej<br />
0.1 mm. Przy czym najniższa z plamek powinna przesunąć się z linii startowej przynajmniej<br />
o kilka milimetrów. Często także korzysta się z danych literaturowych.<br />
W wielkim uproszczeniu zjawiska zachodzące w komorze chromatograficznej można<br />
przedstawić następująco: faza ruchoma dzięki siłom kapilarnym migruje wzdłuż warstwy<br />
sorbentu (fazy stacjonarnej) i w zależności od energii oddziaływań substancji z fazami<br />
wykazują one różny stopień retencji, tzn. mają różną drogę migracji i znajdują się w różnych<br />
miejscach warstwy.<br />
Rys.1. Schematyczny obraz procesów zachodzących w czasie rozwijania chromatogramu na<br />
płytce chromatograficznej<br />
Najbardziej powszechnym sposobem rozwijania płytek chromatograficznych jest<br />
sposób liniowy, który w najprostszej postaci wymaga tylko kontaktu jednego końca płytki<br />
(warstwy chromatograficznej) z rozpuszczalnikiem. Płytkę chromatograficzną ustawia się w
pozycji pionowej bądź pod kątem w kilku mililitrach rozpuszczalnika w odpowiednim<br />
pojemniku zwanym komorą chromatograficzną Rozwijanie liniowe może być<br />
jednokierunkowe lub dwukierunkowe. Płytkę można rozwijać pojedyncze lub wielokrotne. W<br />
rozwijaniu jednokierunkowym faza ruchoma przesuwa się w jednym kierunku zaś rozwijanie<br />
dwukierunkowe polega na tym, że po pierwszym rozwinięciu płytkę suszy się w celu<br />
usunięcia rozpuszczalnika a następnie zanurza w tym samym rozpuszczalniku lub innym, ale<br />
obróconą o 90 stopni. Przy wielokrotnym rozwijaniu płytkę po każdej analizie suszy się i<br />
ponownie rozwija stosując taką samą fazę ruchomą lub inną. Efektem tego sposobu<br />
rozwijania jest zwężenie pasma stężeniowego substancji i związane z tym zwiększenie<br />
sprawności układu jak również zwiększenie czułości metody.<br />
Po rozwinięciu płytki chromatograficznej i wysuszeniu wizualizacje „plamek” na<br />
warstwie chromatograficznej można dokonać m.in. metodami fizycznymi, chemicznymi lub<br />
biologicznymi.<br />
Do metod fizycznych zaliczamy fotometrie absorpcyjną, fluorescencje, fosforescencje<br />
(w przypadku substancji znakowanych izotopami promieniotwórczymi) oraz metody<br />
radiometryczne. Metody te nie powodują uszkodzenia próbki co ma istotne znaczenie jeśli<br />
stosuje się chromatografie cienkowarstwową do celów preparatywnych.<br />
Do wizualizacji plamek można także wykorzystać metody chemiczne. Wówczas<br />
rozdzielane substancje przeprowadza się w substancje barwne stosując do tego celu reagenty<br />
chemiczne, które ulegają reakcji z wybranymi grupami funkcyjnymi. Stosunkowo często<br />
stosowanym wywoływaczem jest stężony kwas siarkowy. Proces wywoływania polega na<br />
spalaniu substancji organicznych i pojawianiu się ciemnych plam na warstwie<br />
chromatograficznej. Inne popularne wywoływacze zostały zamieszczone w tabeli 4.<br />
Natomiast biologiczne metody wywoływania chromatogramów mają zastosowanie<br />
w badaniach substancji czynnych, występujących w żywych ustrojach, np. enzymów,<br />
koenzymów, aktywatorów i inhibitorów enzymatycznych. Na przykład w badaniach przemian<br />
enzymatycznych nanosi się badany materiał na bibułę i rozpyla roztwór preparatu<br />
enzymatycznego. Inkubację przeprowadza się w termostacie w temp. 37-38°C, a po jej<br />
zakończeniu, rozwinięciu chromatogramu i wywołaniu właściwym testem, identyfikuje się<br />
produkty reakcji enzymatycznej.
Tabela 4. Roztwory stosowane do wizualizacji substancji na płytkach <strong>TLC</strong><br />
Związek chemiczny Układ wywołujący<br />
Aldehydy alifatyczne Chlorowodorek hydrazonu 3-metylo-2-benzotiazolinonu<br />
Alkaloidy Heksachloroplatynian potasu, ninhydryna<br />
Antybiotyki Ninhydryna<br />
Aminokwasy Ninhydryna<br />
Węglowodany Roztwór kwasu siarkowego w metanolu<br />
Lipidy Chlorek antymonu(III), błękit tymolowy, ninhydryna, rodamina B<br />
Kwasy karboksylowe Zieleń bromokrezolowa<br />
Fenole Chloranil, kwas fosfomolibdenowy<br />
Terpeny Kwas fosfomolibdenowy<br />
Wykonanie analizy <strong>TLC</strong><br />
Badane substancje (10-20 mg) rozpuszcza się w niewielkiej ilości rozpuszczalnika ok.<br />
0.5 ml. Substancja powinna być dobrze rozpuszczalna w zastosowanym rozpuszczalniku,<br />
najczęściej stosuje się roztwory w metanolu, acetonie, chloroformie. W przypadku substancji<br />
bardzo polarnych np. aminokwasy do roztworu można dodać 1 kroplę wody. Przygotowuje<br />
się płytkę chromatograficzną o wymiarach zależnych od ilości substancji jakie zamierza się<br />
nałożyć na płytkę. Na przygotowanej płytce zaznacza się przy użyciu zwykłego ołówka<br />
punkty, na które następnie nanosi się roztwory substancji badanych, przy pomocy szklanej<br />
kapilary, w odległości ok. 0.5 cm od bocznej krawędzi płytki oraz ok. 0.5 cm od dolnej<br />
krawędzi. Roztwór nanosi się lekko dotykając powierzchni płytki końcem kapilary(czynność<br />
można powtórzyć kilkakrotnie). Dobrze naniesiona substancja tworzy na płytce tzw.<br />
„plamkę” o średnicy ok. 2 mm. Po nałożeniu wszystkich substancji płytkę suszy się,<br />
a następnie ostrożnie zanurza się dolną krawędzią w roztworze rozwijającym, znajdującym<br />
się w komorze chromatograficznej, tak by nie zanurzyć plamek. Komora powinna być<br />
umieszczona pod sprawnie działającym wyciągiem. Rolę komory chromatograficznej
z powodzeniem spełnia zwykły słoik przykryty szkiełkiem zegarkowym. Dla lepszego<br />
nasycenia komory parami rozpuszczalnika, ścianę boczną komory wyściela się paskiem<br />
z bibuły. Czoło rozpuszczalnika powoli przemieszcza się po płytce, aż do osiągnięcia linii<br />
końcowej tj. ok. 5 mm od górnej krawędzi płytki. Wówczas płytkę ostrożnie wyjmujemy z<br />
komory. Rozpuszczalnik pozostały na płytce usuwa się za pomocą zwykłej suszarki do<br />
włosów. W przypadku związków absorbujących w UV, wizualizację plamek dokonuje się<br />
przez włożenie płytki do komory lampy UV, pod warunkiem, że adsorbent znajdujący się na<br />
płytce zawiera dodatek fluorescenta. Wtedy na żółto zabarwionej w świetle UV płytce<br />
substancje widać jako ciemne plamki. Inna metoda wizualizacji plamek polega na<br />
umieszczeniu płytki w komorze jodowej lub krótkotrwałym zanurzeniu w naczyniu<br />
z odpowiednim roztworem wywołującym a następnie wygrzaniu płytki w podwyższonej<br />
temperaturze (zazwyczaj nie wyższej niż 120 o C). Wraz z przesuwaniem się rozpuszczalnika<br />
przemieściły się nałożone substancje. Szybkość ich przemieszczania jest ich cechą<br />
indywidualną i zależy od ich powinowactwa do podłoża płytki (adsorbcja) i wymywania<br />
(desorpcja). W wyniku różnej szybkości migracji poszczególnych substancji w danych<br />
warunkach, na płytce chromatograficznej powstaje seria plamek w różnej odległości od linii<br />
startowej. Położenie plamek zaznacza się przez lekkie obrysowanie ich krawędzi ołówkiem<br />
bezpośrednio po wywołaniu. Następnie obliczamy tzw. współczynnik Rf (współczynnik<br />
retencji). Mierzy się odległość środka plamki od linii startowej (w mm) i dzieli przez dystans<br />
pomiędzy linią startową i końcową też w mm. Pomiaru i obliczenia Rf dokonuje się dla każdej<br />
plamki. Na rys.2 przedstawiono sposób pomiaru Rf.<br />
Rf = a<br />
b<br />
b<br />
a'<br />
; Rf ' =<br />
b ;<br />
a<br />
a'<br />
x x x<br />
a''<br />
Rf '' =<br />
b<br />
Rys. 2. Sposób pomiaru i obliczania Rf.<br />
a''
Odmianą chromatografii cienkowarstwowej (<strong>TLC</strong>) jest preparatywna chromatografia<br />
cienkowarstwowa (P<strong>TLC</strong>) którą stosuje się w celu izolacji znacznie większych ilości<br />
substancji, które następnie mogłyby być stosowane dla celów preparatywnych. Jest to<br />
możliwe gdyż stosuje się płytki o znacznie większych wymiarach niż analityczne. Najczęściej<br />
stosowane są płytki wymiarach 20x20 cm i grubości warstwy 1,0-2,0 mm. Postępowanie<br />
w przypadku stosowania preparatywnej chromatografii cienkowarstwowej jest podobne jak<br />
w przypadku stosowania konwencjonalnej czy wysokosprawnej warstwy. Na warstwę<br />
chromatograficzną nakłada się rozdzielaną mieszaninę substancji w formie paska lub plamek<br />
obok siebie. Ilość nakładanej substancji zależy od grubości warstwy żelu oraz od trudności<br />
rozdzielczych w danym układzie. Po rozwinięciu płytki w komorze zawierającej układ<br />
rozwijający i po wysuszeniu płytkę wywołuje się stosując metody nieinwazyjne jak np.<br />
wizualizację za pomocą lampy UV.<br />
3. Wykonanie ćwiczenia<br />
Ćwiczenia składa się z trzech części:<br />
I. Wpływ polarności fazy ruchomej na Rf<br />
Z dużej płytki należy wyciąć trzy paski o długości 8 cm i szerokości 1,5 cm. Ołówkiem<br />
nanosi się, na każdym z nich, w odległości ok. 10 mm od dolnej krawędzi płytki,<br />
punkt startowy. Za pomocą kapilary nanosi się na każdą płytkę kilka mikrolitrów<br />
roztworu aminy aromatycznej a następnie, po wysuszeniu, ostrożnie zanurza się dolną<br />
krawędź płytki w roztworze rozwijającym. Pierwszą z płytek rozwija się w układzie:<br />
heksan:octan etylu (1:1) (roztwór A), drugą: metanol:chloroform (1:4) (roztwór B),<br />
trzecią: metanol:chloroform:r-r amoniaku (1:1:0.03) (roztwór C). Gdy czoło<br />
rozpuszczalnika osiągnie poziom ok. 5 mm od górnej krawędzi, płytkę należy wyjąć<br />
z komory, odrysować czoło fali i po wysuszeniu umieścić w komorze jodowej. Po<br />
wybarwieniu plamki należy zakreślić ołówkiem a następnie obliczyć Rf.<br />
II. Analiza jakościowa - reakcje barwne związków organicznych<br />
Przed tym ćwiczeniem każdy otrzymuje indywidualną próbkę do analizy, zawierającą jedną<br />
z substancji: aminokwas, amina aromatyczna, monosacharyd.<br />
Przygotować dwie płytki o wymiarach 2 cm x 1,5 cm.
Na pierwszą nanosimy próbkę aminokwasu oraz otrzymaną próbkę a na drugą monosacharyd<br />
oraz otrzymaną próbkę. Płytkę pierwszą wywołuje się przez spryskanie roztworem<br />
ninhydryny a następnie wygrzewanie w podwyższonej temperaturze. Aminokwasy<br />
wybarwiają się na kolor czerwony do fioletowego. Płytkę z naniesionym monosacharydem<br />
wybarwia się przez spryskanie roztworem kwasu siarkowego i wygrzanie w podwyższonej<br />
temperaturze. Monosacharydy wybarwiają się na kolor od zielonego do czarnego.<br />
Porównać reakcje barwne wzorców z próbką.<br />
Uwaga: wygrzewanie należy przeprowadzić ostrożnie, zbyt gwałtowne ogrzanie może<br />
doprowadzić do ściemnienia całej powierzchni płytki, co uniemożliwi obserwację plamek.<br />
III. Analiza jakościowa – właściwa analiza <strong>TLC</strong><br />
Na płytce o wymiarach 4 x 3 cm zaznaczamy cztery punkty startowe w odległości ok. 0,5 cm<br />
jeden od drugiego. Na zaznaczone punkty nanosimy roztwory wzorcowe w kolejności:<br />
aminokwas, monosacharyd, amina aromatyczna oraz roztwór próbki badanej. Płytkę<br />
umieszczamy w komorze zawierającej roztwór B metanol:chloroform (1:4). Po<br />
rozwinięciu, wywołujemy osuszoną płytkę w jodzie. Obrysowujemy powstałe plamki.<br />
Obliczamy Rf. Następnie desublimujemy jod z powierzchni płytki poprzez wygrzanie<br />
strumieniem ciepłego powietrza. Płytkę spryskujemy roztworem ninhydryny, wygrzewamy<br />
i obrysowujemy powstałe plamki. Postępujemy analogicznie z roztworem kwasu siarkowego.<br />
Na podstawie względnego położenia plamek i ćwiczenia II należy określić prawdopodobną<br />
przynależność związku nieznanego do jednej z trzech klas: aminokwasy, aminy<br />
aromatyczne, monosacharady.<br />
Zaliczenie ćwiczenia<br />
Zaliczenie ćwiczenia następuje po poprawnym wykonaniu wszystkich trzech składowych<br />
elementów analizy <strong>TLC</strong>, na podstawie opracowanego sprawozdania (wnioski!!!), oraz<br />
pozytywnym napisaniu kolokwium zaliczeniowego.<br />
UWAGA: Na ćwiczenia każdy student powinien przynieść: okulary, fartuch, rękawiczki<br />
np. lateksowe, ołówek, linijkę, nożyczki, taśmę klejąca. Dodatkowo na grupę –<br />
mydło, płyn do mycia naczyń i ścierkę. Jest to warunkiem przystąpienia do<br />
zajęć!!!!!!!!!!
LITERATURA<br />
1. Chromatografia cieczowa – praca zbiorowa pod redakcją M. Kamińskiego,<br />
CEEAM, Gdańsk 2004<br />
2. Z. Witkiewicz – Podstawy chromatografii, WNT, Warszawa 1995<br />
3. Berthillier - Chromatografia i jej zastosowanie - PWN, 1975.<br />
4. Opieńska-Blauth, H. Kraczkowski, H. Brzuszkiewicz - Zarys chromatografii<br />
cienkowarstwowej - PWRiL, 1971, 1976.<br />
5. Irena Baranowska - Wybrane działy analizy instrumentalnej