april - jazmp
april - jazmp
april - jazmp
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
Novosti na področju dovoljenj za promet z zdravili - JAZMP, <strong>april</strong><br />
2012<br />
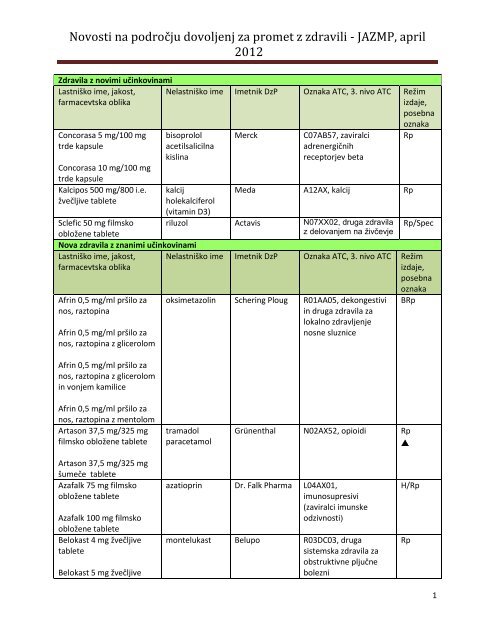
Zdravila z novimi učinkovinami<br />
Lastniško ime, jakost,<br />
farmacevtska oblika<br />
Nelastniško ime Imetnik DzP Oznaka ATC, 3. nivo ATC Režim<br />
izdaje,<br />
posebna<br />
Concorasa 5 mg/100 mg<br />
trde kapsule<br />
Concorasa 10 mg/100 mg<br />
trde kapsule<br />
Kalcipos 500 mg/800 i.e.<br />
žvečljive tablete<br />
bisoprolol<br />
acetilsalicilna<br />
kislina<br />
Sclefic 50 mg filmsko<br />
obložene tablete<br />
Nova zdravila z znanimi učinkovinami<br />
Lastniško ime, jakost,<br />
farmacevtska oblika<br />
Afrin 0,5 mg/ml pršilo za<br />
nos, raztopina<br />
Afrin 0,5 mg/ml pršilo za<br />
nos, raztopina z glicerolom<br />
Afrin 0,5 mg/ml pršilo za<br />
nos, raztopina z glicerolom<br />
in vonjem kamilice<br />
Merck<br />
C07AB57, zaviralci<br />
adrenergičnih<br />
receptorjev beta<br />
oznaka<br />
Rp<br />
kalcij<br />
holekalciferol<br />
(vitamin D3)<br />
Meda A12AX, kalcij Rp<br />
riluzol Actavis N07XX02, druga zdravila<br />
z delovanjem na živčevje<br />
Rp/Spec<br />
Nelastniško ime Imetnik DzP Oznaka ATC, 3. nivo ATC Režim<br />
izdaje,<br />
posebna<br />
oznaka<br />
oksimetazolin Schering Ploug R01AA05, dekongestivi<br />
in druga zdravila za<br />
lokalno zdravljenje<br />
nosne sluznice<br />
BRp<br />
Afrin 0,5 mg/ml pršilo za<br />
nos, raztopina z mentolom<br />
Artason 37,5 mg/325 mg<br />
filmsko obložene tablete<br />
tramadol<br />
paracetamol<br />
Grünenthal N02AX52, opioidi Rp<br />
Artason 37,5 mg/325 mg<br />
šumeče tablete<br />
Azafalk 75 mg filmsko<br />
obložene tablete<br />
Azafalk 100 mg filmsko<br />
obložene tablete<br />
Belokast 4 mg žvečljive<br />
tablete<br />
Belokast 5 mg žvečljive<br />
azatioprin Dr. Falk Pharma L04AX01,<br />
imunosupresivi<br />
(zaviralci imunske<br />
odzivnosti)<br />
montelukast Belupo R03DC03, druga<br />
sistemska zdravila za<br />
obstruktivne pljučne<br />
bolezni<br />
H/Rp<br />
Rp<br />
1
Novosti na področju dovoljenj za promet z zdravili - JAZMP, <strong>april</strong><br />
2012<br />
tablete<br />
Belokast 10 mg filmsko<br />
obložene tablete<br />
Bonoc 37,5 mg/325 mg<br />
filmsko obložene tablete<br />
tramadol<br />
paracetamol<br />
Grünenthal N02AX52, opioidi Rp<br />
Bonoc 37,5 mg/325 mg<br />
šumeče tablete<br />
Dolzep 5 mg<br />
orodisperzibilne tablete<br />
donepezil Sanofi Aventis N06DA02, zdravila za<br />
zdravljenje demence<br />
Rp<br />
∆<br />
Dolzep 10 mg<br />
orodisperzibilne tablete<br />
Donepezil Polfa Lodž 5 mg<br />
filmsko obložene tablete<br />
Donepezil Polfa Lodž<br />
10 mg filmsko obložene<br />
tablete<br />
Levetiracetam Pfizer<br />
250 mg filmsko obložene<br />
tablete<br />
donepezil<br />
Zaklady<br />
Farmaceutyczne<br />
Polfa Lodž<br />
N06DA02, zdravila za<br />
zdravljenje demence<br />
levetiracetam Pfizer N03AX14, antiepileptiki Rp<br />
∆<br />
Rp<br />
∆<br />
Levetiracetam Pfizer<br />
500 mg filmsko obložene<br />
tablete<br />
Levetiracetam Pfizer<br />
1000 mg filmsko obložene<br />
tablete<br />
Levetiracetam Pfizer<br />
100 mg/ml peroralna<br />
raztopina<br />
Lyvam 250 mg filmsko<br />
obložene tablete<br />
levetiracetam Alkaloid-INT N03AX14, antiepileptiki Rp<br />
∆<br />
Lyvam 500 mg filmsko<br />
obložene tablete<br />
Lyvam 750 mg filmsko<br />
obložene tablete<br />
Lyvam 100 mg filmsko<br />
obložene tablete<br />
2
Novosti na področju dovoljenj za promet z zdravili - JAZMP, <strong>april</strong><br />
2012<br />
Melodal 37,5 mg/325 mg<br />
filmsko obložene tablete<br />
tramadol<br />
paracetamol<br />
Grünenthal N02AX52, opioidi Rp<br />
Melodal 37,5 mg/325 mg<br />
šumeče tablete<br />
Mepranex 20 mg<br />
gastrorezistentne tablete<br />
Mepranex 40 mg<br />
gastrorezistentne tablete<br />
Paklitaksel Accord<br />
6 mg/ ml koncentrat za<br />
raztopino za infundiranje<br />
Rabeprazol Chemo Iberica<br />
10 mg gastrorezistentne<br />
tablete<br />
Rabeprazol Chemo Iberica<br />
20 mg gastrorezistentne<br />
tablete<br />
Ralic 10 mg<br />
gastrorezistentne tablete<br />
Ralic 20 mg<br />
gastrorezistentne tablete<br />
Rosuvastatin Mylan 10 mg<br />
filmsko obložene tablete<br />
Rosuvastatin Mylan 20 mg<br />
filmsko obložene tablete<br />
esomeprazol Specifar A02BC05, zdravila za<br />
zdravljenje peptične<br />
razjede in<br />
gastroezofagealnega<br />
refluksa<br />
paklitaksel<br />
Accord<br />
Healthcare<br />
L01CD01, rastlinski<br />
alkaloidi in druge<br />
naravne učinkovine<br />
(zaviralci mitoze)<br />
rabeprazol Chemo Iberica A02BC04, zdravila za<br />
zdravljenje peptične<br />
razjede in<br />
gastroezofagealnega<br />
refluksa<br />
rabeprazol Chemo Iberica A02BC04, zdravila za<br />
zdravljenje peptične<br />
razjede in<br />
gastroezofagealnega<br />
refluksa<br />
rosuvastatin Generics UK C10AA07, zdravila, ki<br />
spreminjajo raven<br />
lipidov, brez kombinacij<br />
Rp<br />
H<br />
Rp<br />
Rp<br />
Rp<br />
Rosuvastatin Mylan 40 mg<br />
filmsko obložene tablete<br />
Tialupin 12,5 mg filmsko<br />
obložene tablete<br />
Topotekan Logenex Pharm<br />
1 mg/ml prašek za<br />
koncentrat za raztopino za<br />
infundiranje<br />
Tramadolijev<br />
klorid/paracetamol<br />
Grünenthal<br />
37,5 mg/325 mg filmsko<br />
obložene tablete<br />
tianeptin Lupin (Europe) N06AX14, antidepresivi Rp<br />
∆<br />
topotekan Logenex Pharm L01XX17, druga zdravila H<br />
z delovanjem na<br />
novotvorbe (citostatiki)<br />
tramadol<br />
paracetamol<br />
Grünenthal N02AX52, opioidi Rp<br />
3
Novosti na področju dovoljenj za promet z zdravili - JAZMP, <strong>april</strong><br />
2012<br />
Tramadolijev<br />
klorid/paracetamol<br />
Grünenthal<br />
37,5 mg/325 mg šumeče<br />
tablete<br />
Xantrazol 20 mg<br />
gastrorezistentne tablete<br />
Xantrazol 40 mg<br />
gastrorezistentne tablete<br />
Zydrop 15 mg/g kapljice za azitromicin<br />
oko, raztopina v<br />
enoodmernem vsebniku<br />
Zdravila v novih farmacevtskih oblikah<br />
Lastniško ime, jakost,<br />
farmacevtska oblika<br />
/<br />
Zdravila z novimi jakostmi<br />
Lastniško ime, jakost,<br />
farmacevtska oblika<br />
Bisoprolol Pfizer 1,25 mg<br />
filmsko obložene tablete<br />
Bisoprolol Pfizer 2,5 mg<br />
filmsko obložene tablete<br />
Wilate 500 i.e./500 i.e.<br />
prašek in vehikel za<br />
raztopino za injiciranje<br />
Wilate 1000 i.e./1000 i.e.<br />
prašek in vehikel za<br />
raztopino za injiciranje<br />
omeprazol Bayer A02BC01, zdravila za<br />
zdravljenje peptične<br />
razjede in<br />
gastroezofagealnega<br />
refluksa<br />
Laboratoires<br />
Thea<br />
S01AA26, zdravila za<br />
preprečevanje in<br />
zdravljenje infekcij<br />
BRp<br />
Nelastniško ime Imetnik DzP Oznaka ATC, 3. nivo ATC Režim<br />
izdaje,<br />
posebna<br />
oznaka<br />
Nelastniško ime Imetnik DzP Oznaka ATC, 3. nivo ATC Režim<br />
izdaje,<br />
posebna<br />
oznaka<br />
bisoprolol Pfizer C07AB07, zaviralci Rp<br />
adrenergičnih<br />
receptorjev beta<br />
kombinacija von<br />
Willebrandoveg<br />
a faktorja in<br />
koagulacijskega<br />
faktorja VIII<br />
Octapharma<br />
Nove indikacije in druge pomembnejše spremembe<br />
Lastniško ime, jakost, farmacevtska oblika/nelastniško ime/oznaka ATC<br />
B02BD06, vitamin K in<br />
drugi hemostatiki<br />
GALVUS 50 mg tablete, vildagliptin, A10BH02<br />
Nova indikacija<br />
4.1 Terapevtske indikacije<br />
Kot monoterapija: pri bolnikih, katerih sladkorna bolezen ni ustrezno urejena samo z dieto in s telesno<br />
vadbo, metformin pa za njih ni primeren zaradi kontraindikacij ali neprenašanja zdravila<br />
Rp<br />
ZZ<br />
4
Novosti na področju dovoljenj za promet z zdravili - JAZMP, <strong>april</strong><br />
2012<br />
ESOMEPRAZOL Mylan 20 mg (40 mg) trde gastrorezistentne kapsule, esomeprazol, A02BC05<br />
Nova indikacija<br />
4.1 Terapevtske indikacije<br />
Mladostniki, stari 12 let in več<br />
Zdravljenje gastroezofagealne refluksne bolezni (GERB):<br />
zdravljenje erozivnega refluksnega ezofagitisa<br />
dolgotrajno zdravljenje bolnikov s pozdravljenim ezofagitisom za preprečevanje ponovitve<br />
bolezni<br />
simptomatsko zdravljenje gastroezofagealne refluksne bolezni (GERB)<br />
V kombinaciji z antibiotiki za zdravljenje duodenalnega ulkusa v povezavi z okužbo s Helicobacter<br />
pylori.<br />
4.2 Odmerjanje in način uporabe<br />
Mladostniki, stari 12 let in več<br />
Zdravljenje duodenalnega ulkusa v povezavi z okužbo s Helicobacter pylori<br />
Pri izbiri ustrezne kombinacije zdravil, je potrebno upoštevati uradne nacionalne, regionalne in lokalne<br />
smernice glede bakterijske rezistence, trajanje zdravljenja (najpogosteje 7 dni, včasih tudi do 14 dni) in<br />
ustrezne uporabe antibakterijskih zdravil. Zdravljenje mora nadzorovati specialist.<br />
Priporočeno odmerjanje je:<br />
Telesna masa<br />
Odmerjanje<br />
od 30 do 40 kg Kombinacija z dvema antibiotikoma: Esomeprazol Mylan 20 mg, amoksicilin 750<br />
mg in klaritromicin 7,5 mg/kg telesne mase; vzeta sočasno, dvakrat dnevno, 7 dni<br />
več kot 40 kg Kombinacija z dvema antibiotikoma: Esomeprazol Mylan 20 mg, amoksicilin 1 g in<br />
klaritromicin 500 mg; vzeta sočasno, dvakrat dnevno, 7 dni<br />
Otroci, stari do 12 let<br />
Za odmerjanje pri bolnikih, starih od 1 do 11 let, glejte povzetek glavnih značilnosti zdravila za<br />
Esomeprazol Mylan zrnca za peroralno suspenzijo.<br />
SEVIKAR HCT 20 mg/5 mg/12,5 mg filmsko obložene tablete<br />
SEVIKAR HCT 40 mg/5 mg/12,5 mg filmsko obložene tablete<br />
SEVIKAR HCT 40 mg/10 mg/12,5 mg filmsko obložene tablete<br />
SEVIKAR HCT 40 mg/5 mg/25 mg filmsko obložene tablete<br />
SEVIKAR HCT 40 mg/10 mg/25 mg filmsko obložene tablete<br />
medoksomilolmesartanat, amlodipin, hidroklorotiazid, C09DX03<br />
Nova indikacija<br />
4.1 Terapevtske indikacije<br />
Dodatno zdravljenje<br />
Zdravilo Sevikar HCT je indicirano pri odraslih bolnikih, kjer krvni tlak ni zadostno uravnan s kombinacijo<br />
5
Novosti na področju dovoljenj za promet z zdravili - JAZMP, <strong>april</strong><br />
2012<br />
medoksomilolmesartanata in amplodipina v enem zdravilu z dvema učinkovinama.<br />
4.2 Odmerjanje in način uporabe<br />
Dodatno zdravljenje<br />
Zdravilo Sevikar HCT 20 mg/5 mg/12,5 mg se lahko uporabi pri bolnikih, ki nimajo zadostno uravnanega<br />
krvnega tlaka z enim zdravilom z dvema učinkovinama (20 mg medoksomilolmesartanata in 5 mg<br />
amlodipina).<br />
Zdravilo Sevikar HCT 40 mg/5 mg/12,5 mg se lahko uporabi pri bolnikih, ki nimajo zadostno uravnanega<br />
krvnega tlaka z enim zdravilom z dvema učinkovinama (40 mg medoksomilolmesartanata in 5 mg<br />
amlodipina) ali pri bolnikih, ki nimajo zadostno uravnanega krvnega tlaka z zdravilom Sevikar HCT 20<br />
mg/5 mg/12,5 mg.<br />
Zdravilo Sevikar HCT 40 mg/5 mg/25 mg se lahko uporabi pri bolnikih, ki nimajo zadostno uravnanega<br />
krvnega tlaka z zdravilom Sevikar HCT 40 mg/5 mg/12,5 mg.<br />
Zdravilo Sevikar HCT 40 mg/10 mg/12,5 mg se lahko uporabi pri bolnikih, ki nimajo zadostno uravnanega<br />
krvnega tlaka z enim zdravilom z dvema učinkovinama (40 mg medoksomilolmesartanata in 10 mg<br />
amlodipina) ali z zdravilom Sevikar HCT 40 mg/5 mg/12,5 mg.<br />
Zdravilo Sevikar HCT 40 mg/10 mg/25 mg se lahko uporabi pri bolnikih, ki nimajo zadostno uravnanega<br />
krvnega tlaka z zdravilom Sevikar HCT 40 mg/10 mg/12,5 mg ali z zdravilom Sevikar HCT 40 mg/5 mg/25<br />
mg.<br />
Preden se zdravljenje nadaljuje z enim zdravilom, ki vsebuje tri učinkovine je priporočljiva postopna<br />
titracija odmerka posameznega zdravila. Če je klinično primerno, se lahko premisli o neposredni<br />
zamenjavi zdravila z dvema učinkovinama z zdravilom, ki vsebuje tri učinkovine.<br />
Nadomestno zdravljenje<br />
Bolniki, ki imajo urejen krvni tlak s stabilnimi odmerki medoksomilolmesartanata, amlodipina in<br />
hidroklorotiazida, uporabljenimi v enem zdravilu z dvema učinkovinama (medoksomilolmesartanat in<br />
amlodipin ali medoksomilolmesartanat in hidroklorotiazid) in enem zdravilu z eno učinkovino<br />
(hidroklorotiazid ali amlodipin) lahko preidejo zdravljenje na zdravilo Sevikar HCT, ki vsebuje enake<br />
odmerke zdravilnih učinkovin.<br />
Starejši (stari 65 let ali več):<br />
Na voljo so zelo omejeni podatki o uporabi zdravila Sevikar HCT pri bolnikih starih 75 let ali več. Zato se<br />
priporoča zelo strog nadzor, vključno s pogostejšimi kontrolami krvnega tlaka.<br />
4.6 Plodnost, nosečnost in dojenje<br />
Dojenje<br />
Hidroklorotiazid se izloča v materino mleko v majhnih količinah. Tiazidi v velikih odmerkih povzročajo<br />
močno diurezo, ki lahko zavre nastajanje mleka. Uporaba zdravila Sevikar HCT med dojenjem ni<br />
priporočljiva. Če se zdravilo Sevikar HCT uporablja med dojenjem, ga je potrebno vzdrževati v najmanjših<br />
možnih odmerkih.<br />
4.8 Neželeni učinki<br />
Dopolnjene so preglednice neželenih učinkov.<br />
Dopolnjeno poglavje 5.1 Farmakodinamične lastnosti (rezultati kliničnih študij).<br />
6
Novosti na področju dovoljenj za promet z zdravili - JAZMP, <strong>april</strong><br />
2012<br />
SYNFLORIX suspenzija za injiciranje v napolnjeni injekcijski brizgi, konjugirano, adsorbirano<br />
cepivo s pnevmokoknimi polisaharidi, J07AL52<br />
Dopolnitev poglavja<br />
4.8 Neželeni učinki<br />
Podatki po pridobitvi dovoljenja za promet<br />
Bolezni živčevja:<br />
Redki: hipotonično-hiporesponzivne epizode<br />
PROCORALAN 5 mg (7,5 mg) filmsko obložene tablete, ivabradin, C01EB17<br />
Nova indikacija<br />
4.1 Terapevtske indikacije<br />
Zdravljenje kroničnega srčnega popuščanja: Ivabradin je indiciran za zdravljenje kroničnega srčnega<br />
popuščanja II. do IV. razreda po funkcijski razvrstitvi Newyorškega društva za srce (NYHA) s sistolično<br />
disfunkcijo pri bolnikih v sinusnem ritmu, pri katerih je srčna frekvenca ≥ 75 utripov na minuto, v<br />
kombinaciji s standardno terapijo, vključno z zdravljenjem z antagonistom adrenergičnih receptorjev<br />
beta oziroma tudi ko je zdravljenje z antagonistom adrenergičnih receptorjev beta kontraindicirano ali<br />
ga bolnik ne prenaša dobro (glejte poglavje 5.1).<br />
4.2 Odmerjanje in način uporabe<br />
Zdravljenje kroničnega srčnega popuščanja<br />
Zdravljenje lahko začnete le pri bolnikih s stabilnim srčnim popuščanjem. Priporočljivo je, da je lečeči<br />
zdravnik izkušen v zdravljenju kroničnega srčnega popuščanja.<br />
Običajni priporočeni začetni odmerek ivabradina je 5 mg dvakrat na dan. Po dveh tednih zdravljenja<br />
lahko odmerek povečate na 7,5 mg dvakrat na dan, če srčna frekvenca med mirovanjem vztraja nad 60<br />
utripov na minuto, ali zmanjšate na 2,5 mg dvakrat na dan (eno polovico 5-mg tablete dvakrat na dan),<br />
če je srčna frekvenca med mirovanjem vztrajno pod 50 utripov na minuto ali se pojavijo simptomi,<br />
povezani z bradikardijo, kot so omotica, utrujenost ali hipotenzija. Če je srčna frekvenca med 50 in 60<br />
utripov na minuto, je potrebno ohraniti odmerek 5 mg dvakrat na dan.<br />
Če se med zdravljenjem srčna frekvenca vztrajno znižuje pod 50 utripov na minuto med mirovanjem ali<br />
če bolniki doživljajo simptome, povezane z bradikardijo, morate odmerek titrirati navzdol do<br />
naslednjega manjšega odmerka pri bolnikih, ki jemljejo 7,5 mg dvakrat dnevno ali 5 mg dvakrat dnevno.<br />
Če se srčna frekvenca med mirovanjem vztrajno povečuje nad 60 utripov na minuto, lahko odmerek<br />
titrirate navzgor do naslednjega večjega odmerka pri bolnikih, ki jemljejo 2,5 mg dvakrat na dan ali 5 mg<br />
dvakrat na dan.<br />
Zdravljenje morate prekiniti, če srčna frekvenca ostane pod 50 utripov na minuto ali simptomi<br />
bradikardije vztrajajo (glejte poglavje 4.4).<br />
4.3. Kontraindikacije<br />
- nestabilno ali akutno srčno popuščanje<br />
- odvisnost od srčnega spodbujevalnika (srčna frekvenca, ki jo narekuje izključno srčni<br />
spodbujevalnik)<br />
4.4 Posebna opozorila in previdnostni ukrepi<br />
Srčne aritmije<br />
Tveganje za razvoj atrijske fibrilacije lahko večje pri bolnikih s kroničnim srčnim popuščanjem, ki se<br />
zdravijo z ivabradinom. Atrijska fibrilacija je bila bolj pogosta pri bolnikih, ki sočasno jemljejo amiodaron<br />
ali močne antiaritmike iz I. skupine.<br />
Bolnike s kroničnim srčnim popuščanjem z motnjami intraventrikularne prevodnosti (levokračni blok,<br />
7
Novosti na področju dovoljenj za promet z zdravili - JAZMP, <strong>april</strong><br />
2012<br />
desnokračni blok) in prekatno dissinhronijo je potrebno pozorno spremljati.<br />
Kronično srčno popuščanje<br />
Srčno popuščanje naj bo stabilno, preden se odločite za zdravljenje z ivabradinom. Ivabradin je<br />
potrebno pri bolnikih s srčnim popuščanjem IV. razreda po funkcijski razvrstitvi Newyorškega<br />
društva za srce (NYHA) uporabljati previdno, ker pri tej skupini bolnikov ni dovolj podatkov.<br />
Bolniki s hipertenzijo, ki potrebujejo spremembo zdravljenja zvišanega krvnega tlaka<br />
V študiji SHIFT je imelo več bolnikov med zdravljenjem z ivabradinom obdobja zvišanega krvnega tlaka<br />
(7,1 %) v primerjavi z bolniki, ki so prejemali placebo (6,1 %). Ta obdobja so največkrat sledila kmalu po<br />
spremembi zdravljenja zvišanega krvnega tlaka, bila so prehodna in niso vplivala na učinek zdravljenja z<br />
ivabradinom. Kadar pri bolnikih s kroničnim srčnim popuščanjem, zdravljenih z ivabradinom, spremenite<br />
zdravljenje, je potrebno v primernem intervalu spremljati krvni tlak (glejte poglavje 4.8).<br />
4.7 Vpliv na sposobnost vožnje in upravljanja s stroji<br />
V obdobju trženja zdravila pa so poročali o primerih zmanjšane sposobnosti vožnje zaradi simptomov<br />
motenj vida.<br />
4.8 Neželeni učinki<br />
Srčne bolezni: zelo redki: atrijska fibrilacija, AV blok 2. stopnje, AV blok 3. Stopnje, sindrom<br />
bolnega sinusnega vozla<br />
Žilne bolezni: pogosti: nenadzorovan krvni tlak<br />
Dopolnjeno tudi poglavje 5.1 Farmakodinamične lastnosti.<br />
ACLASTA 5 mg raztopina za infundiranje, zoledronska kislina, M05BA08<br />
Nova Kontraindikacija in dopolnitev podatkov glede ponovnega zdravljenja Pagetove bolezni<br />
4.2 Odmerjanje in način uporabe<br />
Ponovno zdravljenje Pagetove bolezni: Po začetnem zdravljenju Pagetove bolezni z zdravilom Aclasta<br />
opažajo pri bolnikih, ki se odzovejo na zdravljenje, obdobje dolgotrajne remisije. Ponovno zdravljenje<br />
Pagetove bolezni kosti pomeni dodatno intravensko infuzijo zdravila Aclasta 5 mg eno leto ali več po<br />
začetnem zdravljenju bolnikov, pri katerih pride do ponovitve bolezni. O ponovnem zdravljenu Pagetove<br />
bolezni je na voljo omejeno število podatkov (glejte poglavje 5.1).<br />
4.3. Kontraindikacije<br />
Huda okvara ledvic z očistkom kreatinina < 35 ml/min (glejte poglavje 4.4).<br />
4.4 Posebna opozorila in previdnostni ukrepi<br />
Uporaba zdravila Aclasta pri bolnikih s hudo okvaro ledvic (očistek kreatinina < 35 ml/min) je<br />
kontraindicirana zaradi povečanega tveganja za odpoved ledvic pri tej populaciji.<br />
ADENURIC 80 mg (120 mg) filmsko obložene tablete, febuksostat, M04AA03<br />
Dopolnitev poglavij<br />
4.1 Terapevtske indikacije<br />
Zdravilo ADENURIC je indicirano pri odraslih.<br />
4.2 Odmerjanje in način uporabe<br />
Pediatrična populacija : Varnost in učinkovitost zdravila ADENURIC pri otrocih, starih do 18 let, še nista<br />
bili dokazani. Podatkov ni na voljo.<br />
Način uporabe: Peroralna uporaba<br />
Zdravilo ADENURIC se jemlje peroralno, s hrano ali brez hrane.<br />
4.4 Posebna opozorila in previdnostni ukrepi<br />
8
Novosti na področju dovoljenj za promet z zdravili - JAZMP, <strong>april</strong><br />
2012<br />
Prenos iz poglavja 4.8. v poglavje 4.4.: Poročila raziskovalcev kažejo na številčno večjo pojavnost srčnožilnih<br />
dogodkov APTC (opredeljenih kot končne točke v raziskavi Anti-Platelet Trialists' Collaboration<br />
(APTC), vključno s srčno-žilno smrtjo, miokardnim infarktom brez smrtnega izida, možgansko kapjo brez<br />
smrtnega izida) v skupini, zdravljeni s febuksostatom, v primerjavi s skupino, zdravljeno z alopurinolom v<br />
študijah APEX in FACT (1,3 v primerjavi z 0,3 dogodka na 100 bolniških let ), ne pa tudi v študiji<br />
CONFIRMS (glejte poglavje 5.1 za podrobnejši opis študij). Poročila raziskovalcev o srčno-žilnih dogodkih<br />
APTC v kombiniranih študijah 3. faze (APEX, FACT in CONFIRMS študijah) so bila 0,7 v primerjavi z 0,6<br />
dogodka na 100 bolniških let. Raziskovalci so v dolgotrajnih podaljšanih študijah poročali o pojavnosti<br />
dogodka APTC 1,2 za febuksostat in 0,6 dogodka za alopurinol na 100 bolniških let, vendar pa statistično<br />
pomembnih razlik niso potrdili. Vzročna povezava s febuksostatom ni bila dokazana. Pri teh bolnikih so<br />
bili ugotovljeni naslednji dejavniki tveganja: anamneza aterosklerotične bolezni in/ali miokardnega<br />
infarkta ali kongestivnega srčnega popuščanja.<br />
Alergija na zdravilo/preobčutljivost<br />
Izkušnje v obdobju po trženju kažejo, da so se redko pojavile resne alergijske/preobčutljivostne reakcije,<br />
vključno z življenjsko nevarnim Stevens-Johnsonovim sindromom in akutno anafilaktično<br />
reakcijo/šokom. V večini primerov so se te reakcije pojavile v prvih mesecih zdravljenja s febuksostatom.<br />
Pri nekaterih od teh bolnikov, vendar ne pri vseh, so poročali o ledvični okvari in/ali preobčutljivosti na<br />
alopurinol. Resnim preobčutljivostnim reakcijam je v nekaterih primerih pridružena prizadetost ledvic ali<br />
jeter.<br />
Bolnike je treba poučiti o znakih in simptomih ter pozorno spremljati simptome<br />
alergijskih/preobčutljivostnih reakcij (glejte poglavje 4.8). Zdravljenje s febuksostatom je treba<br />
nemudoma prekiniti, če nastane resna alergijska/preobčutljivostna reakcija, vključno s Stevens-<br />
Johnsonovim sindromom, saj je z zgodnjo ukinitvijo zdravljenja povezana boljša prognoza. Pri bolnikih,<br />
kjer pride do nastanka alergijske/preobčutljivostne reakcije, vključno s Stevens-Johnsonovim sindromom<br />
in akutno anafilaktično reakcijo/šokom, se febuksostata ne sme nikoli ponovno uvajati.<br />
4.6 Plodnost, nosečnost in dojenje<br />
Plodnost<br />
Študije o razmnoževanju na živalih v odmerkih do 48 mg/kg/dan so pokazale, da ni z odmerkom odvisnih<br />
neželenih učinkov na plodnost (glejte poglavje 5.3). Učinek zdravila ADENURIC na plodnost pri človeku ni<br />
znan.<br />
4.8 Neželeni učinki<br />
Povzetek varnostnega profila<br />
Neželeni učinki, o katerih so najpogosteje poročali v kliničnem preskušanju (4.072 bolnikov, zdravljenih z<br />
odmerkom zdravila od 10 mg do 300 mg) in v obdobju trženja so zagoni putike, nenormalnosti delovanja<br />
jeter, driska, navzea, glavobol, izpuščaj in edem. Ti neželeni učinki so bili glede na resnost v glavnem<br />
blagi do zmerni. V obdobju trženja so poročali o redkih resnih preobčutljivostnih reakcijah na<br />
febuksostat, pri čemer so bile nekatere povezane s sistemskimi simptomi.<br />
Razvrščeni neželeni učinki<br />
Pogosti (≥ 1/100 do < 1/10), občasni (≥ 1/1.000 do < 1/100) in redki ( 1/10.000 do < 1/1.000) neželeni<br />
učinki, ki so se pojavili pri bolnikih, ki so bili zdravljeni s febuksostatom, so našteti spodaj. V razvrstitvah<br />
pogostnosti so neželeni učinki navedeni po padajoči resnosti.<br />
Dopolnjena je Preglednica 1: Neželeni učinki v kombiniranih študijah 3. faze, dolgoročnih podaljšanih<br />
študijah<br />
in v obdobju trženja<br />
9
Novosti na področju dovoljenj za promet z zdravili - JAZMP, <strong>april</strong><br />
2012<br />
Bolezni krvi in limfnega sistema<br />
Bolezni imunskega sistema<br />
Bolezni endokrinega sistema<br />
Očesne bolezni<br />
Presnovne in prehranske motnje<br />
Psihiatrične motnje<br />
Bolezni živčevja<br />
Ušesne bolezni, vključno z motnjami labirinta<br />
Srčne bolezni<br />
Žilne bolezni<br />
Bolezni dihal<br />
Bolezni prebavil<br />
Bolezni jeter in žolčevodov<br />
Redki<br />
pancitopenija, trombocitopenija<br />
Redki<br />
anafilaktične reakcije*, preobčutljivost na<br />
zdravilo*<br />
Občasni<br />
povečanje ščitnico stimulirajočega hormona<br />
(TSH)<br />
Redki<br />
zamegljen vid<br />
Pogosti***<br />
zagoni protina<br />
Občasni<br />
diabetes mellitus, hiperlipidemija, zmanjšanje<br />
apetita, povečanje telesne mase<br />
Redki<br />
zmanjšanje telesne mase, povečanje apetita,<br />
anoreksija<br />
Občasni<br />
zmanjšanje libida, nespečnost<br />
Redki<br />
živčnost<br />
Pogosti<br />
glavobol<br />
Občasni<br />
omotica, parestezija, hemipareza, somnolenca,<br />
spremenjeno okušanje, hipestezija, zmanjšana<br />
sposobnost voha<br />
Redki<br />
tinitus<br />
Občasni<br />
atrijska fibrilacija, palpitacije, nenormalni EKG<br />
Občasni<br />
hipertenzija, zardevanje, navali vročine<br />
Občasni<br />
dispneja, bronhitis, okužba zgornjih dihal, kašelj<br />
Pogosti<br />
driska ** , navzea<br />
Občasni:<br />
bolečine v trebuhu, distenzija trebuha,<br />
gastroezofagealni refluks, bruhanje, suha usta,<br />
dispepsija, zaprtost, pogosto odvajanje blata,<br />
flatulenca, nelagodje v prebavilih<br />
Redki<br />
pankreatitis, razjede v ustih<br />
Pogosti<br />
10
Novosti na področju dovoljenj za promet z zdravili - JAZMP, <strong>april</strong><br />
2012<br />
Bolezni kože in podkožja<br />
Bolezni mišično-skeletnega sistema in vezivnega<br />
tkiva<br />
Bolezni ledvic in sečil<br />
Motnje reprodukcije in dojk<br />
Splošne težave in spremembe na mestu aplikacije<br />
Preiskave<br />
nenormalni rezutati jeterne funkcije**<br />
Občasni<br />
holelitiaza<br />
Redki<br />
hepatitis, zlatenica*<br />
Pogosti<br />
izpuščaj (vključno z različnimi tipi izpuščajev, ki so<br />
se pojavili z manjšo pogostnostjo, glejte spodaj)<br />
Občasni<br />
dermatitis, urtikarija, srbenje, razbarvanje kože,<br />
razjede na koži, petehije, makulozni izpuščaj,<br />
makulopapulozni izpuščaj, papulozni izpuščaj<br />
Redki<br />
Stevens-Johnsonov sindrom*, generaliziran<br />
izpuščaj (resen)*, eritem, eksfoliativni izpuščaj,<br />
folikularni izpuščaj, vezikularni izpuščaj,<br />
pustulozni izpuščaj, srbeč izpuščaj*, eritematozni<br />
izpuščaj, morbiliformni izpuščaj, alopecija,<br />
čezmerno znojenje<br />
Občasni<br />
artralgija, artritis, mialgija, mišično-skeletna<br />
bolečina, mišična oslabelost, mišični krči, mišična<br />
togost, burzitis<br />
Redki<br />
togost sklepov, togost skeletnega mišičja<br />
Občasni<br />
odpoved ledvic, nefrolitiaza, hematurija,<br />
polakisurija, proteinurija<br />
Redki<br />
tubulointersticijski nefritis*, nuja po odvajanju<br />
urina<br />
Občasni<br />
erektilna disfunkcija<br />
Pogosti<br />
edem<br />
Občasni<br />
utrujenost, bolečina v prsnem košu, nelagodje v<br />
prsnem košu<br />
Redki<br />
žeja<br />
Pogosti<br />
zvišanje amilaze v krvi, znižanje števila<br />
trombocitov, zmanjšano število belih krvnih celic,<br />
zmanjšano število limfocitov, povečane vrednosti<br />
kreatina v krvi, povečane vrednosti kreatinina v<br />
krvi, znižanje vrednosti hemoglobina, povečanje<br />
11
Novosti na področju dovoljenj za promet z zdravili - JAZMP, <strong>april</strong><br />
2012<br />
koncentracije sečnine v krvi, zvišanje vrednosti<br />
trigliceridov, zvišanje ravni holesterola v krvi,<br />
zmanjšan hematokrit, povečanje laktat<br />
dehidrogenaze v krvi, povečanje kalija v krvi<br />
Redki<br />
povečanje koncentracije glukoze v krvi, podaljšan<br />
aktiviran delni tromboplastinski čas, zmanjšano<br />
število rdečih krvnih celic, zvišanje ravni alkalne<br />
fosfataze v krvi<br />
Opis izbranih neželenih učinkov<br />
V obdobju trženja so se pojavile redke resne preobčutljivostne reakcije na febuksostat, vključno s<br />
Stevens-Johnsonovim sindromom in anafilaktično reakcijo/šokom. Stevens-Johnsonov sindrom je opisan<br />
kot progresiven kožni izpuščaj z mehurčki ali razjedami na sluznici in draženjem oči. Preobčutljivostne<br />
reakcije na febuksostat so lahko povezane z naslednjimi simptomi: kožne reakcije, za katere je značilno:<br />
infiltriran makulopapulozen izpuščaj, generalizirani ali eksfoliativni izpuščaji, pa tudi razjede na koži,<br />
edem obraza, vročina, hematološke nepravilnosti kot je trombocitopenija in prizadetost enega ali več<br />
organov (jeter in ledvic z vključno tubulointersticijskim nefritisom) (glejte poglavje 4.4).<br />
Izbruh putike se je pogosto pojavil takoj po začetku zdravljenja in v prvih mesecih. Zato pogostnost<br />
izbruhov putike pada v odvisnosti od časa. Kot pri drugih zdravilih za zaviranje nastajanja kristalov urata,<br />
se za preprečevanje ponovnega zagona protina priporoča preventivno zdravljenje (glejte poglavji 4.2 in<br />
4.4).<br />
VOTUBIA 2,5 mg (5 mg) tablete, everolimus, L01XE10<br />
Dopolnitev 4.8 Neželeni učinki<br />
Žilne bolezni: občasni: globoka venska tromboza<br />
VELCADE 1 mg (3,5 mg) prašek za raztopino za injiciranje, bortezomib, L01XX32<br />
Dopolnitev 4.8 Neželeni učinki<br />
Očesne bolezni: redki: optična nevropatija, različne stopnje okvare vida (vse do slepote)<br />
Vimpat 50 mg (100 mg, 150 mg, 200 mg) filmsko obložene tablete, Vimpat 10 mg/ml<br />
raztopina za infundiranje, Vimpat 10 mg/ml sirup, lakozamid, N03AX18<br />
Dopolnitev 4.8 Neželeni učinki<br />
Psihiatrične motnje: občasni: halucinacije (neželeni učinki dobljeni iz izkušenj v obdobju trženja)<br />
12