39 A Bohr-féle atommodell Az előbbiek szerint az atomok ...
39 A Bohr-féle atommodell Az előbbiek szerint az atomok ...
39 A Bohr-féle atommodell Az előbbiek szerint az atomok ...
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
Atomfizika 45 A hidrogénatom <strong>Bohr</strong>-<strong>féle</strong> elmélete<br />
állapotba kerülnek <strong>az</strong> elektronok <strong>az</strong> n = 3, 4, 5,… kvantumszámú állapotokból,<br />
akkor kapjuk a Balmer-sorozat vonalait. Hasonlóan keletkezik a<br />
többi vonalsorozat is, amint <strong>az</strong> <strong>az</strong> ábrákon világosan látszik. Ezt a sugárzási<br />
mechanizmust nevezzük gerjesztési sugárzásnak.<br />
A határkontinuum létezése is könnyen értelmezhető. Ha a hidrogénatommal<br />
ütköző elektron éppen<br />
akkora energiával rendelkezik, mint <strong>az</strong><br />
n = ∞ és <strong>az</strong> n = 1 nívóknak megfelelő<br />
energia E∞ - E1 különbsége, akkor a<br />
hidrogénatom elveszíti egyetlen elektronját,<br />
ionizálódik. <strong>Az</strong> elektron sebessége<br />
ebben <strong>az</strong> esetben <strong>az</strong> atommagtól<br />
igen nagy távolságban éppen nulla<br />
lesz. Ha a hidrogénion befog egy ilyen<br />
nulla sebességű elektront <strong>az</strong> n = 1 állapotba,<br />
más szóval rekombinálódik,<br />
és rögtön alapállapotba kerül, akkor a<br />
színképben a vonalas spektrum rövidhullámú<br />
határának megfelelő emissziós<br />
színképvonal jelenik meg. A befogott<br />
elektron sebessége <strong>az</strong>onban tetszőleges<br />
nullától különböző érték is lehet,<br />
így a befogáskor kisugárzott foton<br />
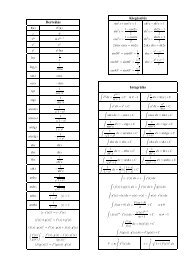
1 2<br />
energiájahν = E∞ + mv − E1<br />
, amely a<br />
16.ábra<br />
2<br />
határnak megfelelő E∞ - E1 különbségnél tetszőlegesen nagyobb lehet,<br />
vagyis a kisugárzott foton ν frekvencia tetszőleges értékkel nagyobb<br />
E∞ − E1<br />
lehet, mint a ν0 = határfrekvencia. Ez éppen <strong>az</strong>t jelenti, hogy a<br />
h<br />
színkép rövidhullámú határához folytonos spektrum csatlakozik. Ezt a<br />
sugárzást nevezik rekombinációs sugárzásnak.<br />
A 16. ábrán <strong>az</strong> egyes emissziós vonalsorozatokat valamint a<br />
határkontinuumot tüntettük fel <strong>az</strong> energia- és termértékekkel együtt.<br />
<strong>Az</strong> abszorpciós spektrum a következő módon keletkezik. Nem túl<br />
magas hőmérsékleten <strong>az</strong> <strong>atomok</strong> gyakorlatilag alapállapotban vannak.<br />
Ha ilyen „hideg” hidrogéngázon folytonos színképű fényt bocsátunk át,<br />
akkor <strong>az</strong> <strong>atomok</strong> <strong>az</strong> n = 2, 3, 4,… kvantumállapotokba gerjesztődnek, a<br />
folytonos színképből ekkor éppen a Lyman-sorozat vonalai fognak hiányozni.<br />
Ha a hidrogén<strong>atomok</strong> már eleve gerjesztett állapotban vannak,<br />
és <strong>az</strong> átbocsátott fény tovább gerjeszt, akkor nyelik el <strong>az</strong> <strong>atomok</strong> a<br />
Balmer-, Paschen,..stb vonalsorozatoknak megfelelő frekvenciájú foto-