You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
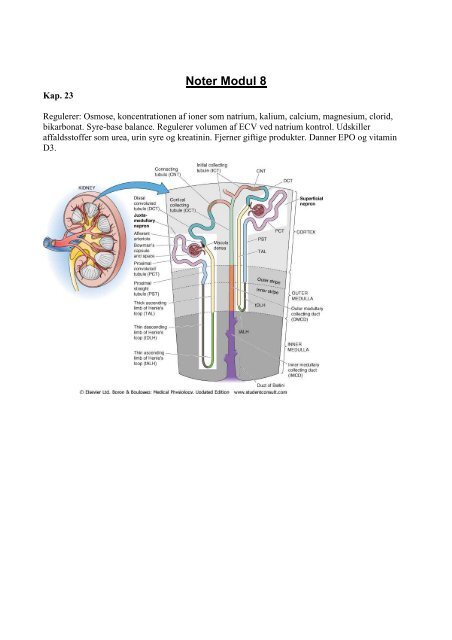
Kap. 23<br />
<strong>Noter</strong> <strong>Modul</strong> 8<br />
Regulerer: Osmose, koncentrationen af ioner som natrium, kalium, calcium, magnesium, clorid,<br />
bikarbonat. Syre-base balance. Regulerer volumen af ECV ved natrium kontrol. Udskiller<br />
affaldsstoffer som urea, urin syre og kreatinin. Fjerner giftige produkter. Danner EPO og vitamin<br />
D3.
Proximal<br />
tubule<br />
Thin limbs<br />
of loop of<br />
Henle<br />
Thick ascending<br />
limb of loop<br />
of Henle<br />
Collecting<br />
duct
Sympaticus T10-L1<br />
Juxtaglomerulære apparatus – Den del at det distale tubuli som lægger sig opad glumerolus. Består<br />
af macula densa (tætliggende epithelceller i den distale tubulus som ligger opad glumeolus),<br />
extraglomerular mesangial celler (lægger opad macula densa og kommunikerer ned til granula<br />
cellerne), granula cellerne (modificerede vaskulære glatte muskelceller, som ligger i det afferente<br />
arteriole). Dette JGA er sitet for produktion af Renin.
Excretion via nyren = Filtreret – reabsorberet + sekreret<br />
Når man taler clearance (udskillelse), menes der, at man fjerner et produkt via nyren (som egentlig<br />
er hovedfunktionen) fra plasma.<br />
V<br />
Formlen for clearance er: C x = U x * , hvor C er udskillelsen af substans X, U er urin<br />
Px<br />
koncentrationen af X, V er urin flow raten, P er plasma koncentrationen af substans X målt.<br />
Glomerular filtrations rate (GFR) = inulin clearance. Inulin er det bedst målte stof, da det bliver<br />
filtreret frit, bliver hverken sekreret eller reabsorberet, bliver ikke lagret eller syntetiseret i nyren, er<br />
ikke giftigt. Normale clearance mål for inulin er 110 +- 15 mL/min for kvinder og 125 +-<br />
15mL/min for mænd.<br />
Kreatinin (slutprodukt af muskel metabolisme) kan også bruges til et mål af GFR. Kreatinin bliver<br />
både filtreret og sekreret i urinen, hvilket øger clearance med 20%.<br />
Renal plasma flow = Clearance af PAF (p-aminohippurate) som gives IV.<br />
Raten hvorved nyre tubuli reabsorberer en substans er givet ved<br />
Treabsorbed = Px * GFR - Ux * V<br />
Raten hvorved nyre tubuli sekrerer en substans er givet ved<br />
Tsecreted = Ux * V - Px * GFR<br />
Det grafen viser er at GFR har en normal værdi<br />
på 180L/dag. Ændres det fra 180 – 90L/dag vil<br />
kreatinin koncentrationen i plasma fordobles fra<br />
1 – 2mg/dL. Så små ændringer i GFR giver stort<br />
udslag i kreatinin koncentrationen.<br />
Man skal dog være opmærksom på at det kan<br />
tage tid at opdage ændringerne i plasma<br />
koncentrationen af kreatinin. Desuden har<br />
muskelmassen betydning, og om medicinering<br />
gives, så det hindrer sekretion af kreatinin fra<br />
plasma.
Ved normale plasma glukose niveauer (100mg/dL)<br />
vil alt filtreret glukose reabsorberes igen. Ved en<br />
tærskelværdi på 200mg/dL vil man se glukose i<br />
urinen. Ved yderligere stigninger vil mere glukose<br />
udskilles. Dette er pga. at filtrationen overstiger<br />
reabsorptionen. TMG er tubulær transport<br />
maximum for glucose. Når denne reduceres, vil<br />
glukoses tærskelværdi også falde. Vil GRF falde<br />
stiger tærskelværdien. Splay er perioden fra<br />
tærskelværdi til TM opnås.<br />
Ved PAH givet IV, vil sekretionen stige hurtigt<br />
ved stigende plasma koncentrationer, indtil et<br />
plateau nås Tm. Den yderligere excretion er<br />
udelukkende pga. den øgede filtration da<br />
sekretionen er den samme.<br />
Det gennemsnitlige blodflow igennem nyren er på 1,2L/min (20% af CO). Dette gør nyrerne til det<br />
organ med en af de højeste perfussionsrater. Denne perfussion er nødvendig for at opretholde en høj<br />
GFR. Blodflowet er højest i cortex 4-5mL/min/gram væv hvor den ydre medulla får 0,7-<br />
1,0mL/min/gram væv og den indre får 0,2-0,25mL/min/gram væv.
kontraherer de afferente arterioler af mekanismer som ikke vides. Sympaticus kan også regulere<br />
blodflow til nyrerne, men er mere koncentreret til ”fight & flight”, så andre organer bliver<br />
perfusieret.<br />
Vasokonstriktorer i nyrerne: Adenosine, ANG II, endothelin, adrenalin & NA, Thromboxan A2,<br />
vasopressin.<br />
Vasodilatorer i nyrerne: dopamin, histamin, kinin, NO, PGE2 og PGI2.<br />
En øget synpaticus tonus eller øget plasma ANG II vil udløse prostaglandiner til at modsvare<br />
effekten, så nyrerne ikke kommer til skade af det øgede BT/stimulus.<br />
Glomerulær filtration<br />
RBF & GFR er autoreguleret. Når trykket stiger/falder i<br />
kredsløbet vil de corticale radiale arterier og afferente<br />
arterioler kontraheres eller dilateres respektivt, dermed<br />
bliver GFR også konstant.<br />
To mekanismer sørger for denne autoregulering. Den<br />
myogeniske mekanisme: Ved øget tryk stiger vil<br />
karvæggene strækkes og strækaktiverende kationkanaler<br />
åbnes i SMC. Dette følger til en membran depolarisering<br />
som åbner strømafhængige calcium kanaler som øger<br />
calcium IC og giver kontraktion.<br />
Tubuloglumerular feedback mekanismen. En øget GFR<br />
på baggrund af øget BT giver en øget koncentration af<br />
stof som vil registreres af macula densa. Der sker en<br />
øget dannelse af NaCl og dette bliver reabsorberet og<br />
For at ultrafiltrationen kan forekomme, skal det passerer den glomerulære filtrations barrierer<br />
(mellem kapillær lumen og rummet i den Bowmanske kapsel). Denne barriere består af tre lag.<br />
1) Karendothel – lamina fenestra 2) basal membran – fine fibriller inlejret i en gel matrix 3)<br />
Podocytter – disse spreder sig ud i primære-, sekundære og tertiære processer for så at ende i<br />
fodprocesserne, som er på den ydre del af basalmembranen. Imellem disse er en pore spalte som<br />
holdes sammen af nefron molekylet som danner en lynlås form.<br />
3 faktorer som er vigtig for filtrering af molekyler er 1) form 2) størrelse 3) ladning.<br />
Molekylder der vejer mindre end 10 000 bliver frit filtreret (vand, glucose, inulin), hvor vejer det<br />
mere har sværere ved at blive filtreret (myoglobin, hemoglobin, albumin). Vejer de mere end<br />
100,000 kan de slet ikke filtreres (plasma proteiner).<br />
Glomerulær endothelceller og podocytter har en negativ ladet flade (glycocalyx) og<br />
basalmembranen indeholder negativt ladet sialinsyre, sialinoproteiner og heparansulfat. Dette gør at<br />
negativt ladede molekyler bliver frastødt pga. de negative poler.<br />
Proteinuria = Abnorme mængder protein i urinen pga. nedsat negativ ladninger i filtrationsbarrieren
GFR = Kf * UP = Kf * (PGC - PBS - COP)<br />
Kf = Glomerulær filtrations koefficient.<br />
UP = Netto ultrafiltrationstryk gradient<br />
PGC = Glomerulær kapillær hydrostatisk tryk (normal 55mmHg). Dette tryk er det drivende tryk og<br />
står for hovedfiltrationen. Afhængig af BT og pga. autoregulationen er trykket relativt stabilt når<br />
MAP er mellem 80-180mmHg. Under 80mmHg nedsat PGC og GFR og GFR ophører ved 40-<br />
50mmHg.<br />
Afferent arteriolær dilation ↑glomerulær blodflow(GBF), ↑PGC & ↑GFR.<br />
Afferent arteriolær konstriktion ↓GBF, ↓PGC & ↓GFR.<br />
Efferent arteriolær dilation ↑GBF, ↓PGC & ↓GFR<br />
Efferent arteriolær konstriktion ↓GBF, ↑PGC<br />
Efferent arteriolær konstriktion (modest) ↑GFR & ↑PGC<br />
Efferent arteriolær konstriktion (ekstrem) ↓GFR & ↓GBF<br />
PBS = Det hydrostatiske tryk i den Bowmanske kapsel (normal 15mmHg). Dette tryk arbejder mod<br />
PGC, og er derfor afhængig af filtrationen og hvor hurtigt væsken fjernes fra tubulerne. Dette tryk<br />
er desuden med til at få væsken til at bevæge sig ned igennem tubule lumen. Hvis der opstår en<br />
blokade heri, f.eks. nyresten, vil væsken upstream herfra stige og GFR vil falde.<br />
COP = glomerulær kapillær kolloid osmotiske tryk (normal 30mmHg), er også et modsatrettet tryk i<br />
forhold til PGC. Opløsning af plasmaproteiner vil sænke COP og dermed øge GFR. Hvis der er en<br />
lav GBF vil der ske en hurtig filtration hvorefter COP vil stige drastisk og dermed vil nedsætte GFR<br />
og vice versa.<br />
Total ultrafiltrat i nyrernes glomeruli er 180L/dag pga.<br />
• Usædvanlig høj filtrationskoefficient i forhold til andre kapillærer<br />
• Kapillær hydrostatisk tryk er højere i glomeruli end andre kapillærer<br />
• Høj rate af RBF hjælper med at vedligeholde en høj GFR ved at begrænse COP, og dermed<br />
opretholde filtration langs hele det glomerulære kapillær.<br />
Transport i de proximale tubuli<br />
Den proximale tubuli er ansvarlig for at reabsorbere alt filtreret glucose og AA og størstedelen af<br />
det filtrerede Na+,K+,Ca2+,Cl-,HCO3- og vand.
På følgende måde kunne man<br />
udregne ved at måle koncentratet af<br />
inulin, at ca. 70% af vandet i PCT<br />
bliver reabsorberet.<br />
Jo længere tubulærvæsken kommer i PCR jo mere opkoncentreret bliver den.<br />
Na+, K+ har en rate på et og vil sige at osmolaliteten er konstant under hele det proximale tubulis<br />
længde. HCO3- får en lavere ratio fordi H+ bliver sekreret. PAH, Urea, Inulin og Cl- har en ratio<br />
større en 1 (sekretion?)<br />
• Isosmotisk transport<br />
• Reabsorberer ca. 70% af den filtrerede mængde vand, Na+, K+, og Cl-<br />
• Reabsorberer al glukose, alle aminosyrer og en meget stor del af filtreret bikabonat<br />
• Secernerer organiske anioner (ex PAH, probenecid, penicillin, salicylat, kreatinin)<br />
• Secernerer organiske kationer (ex quinin, cimetidin, cisplatin, noradrenalin/adrenalin,<br />
kreatinin (!))<br />
• Regulering af PT reabsorption<br />
• Absolut Proximal Reabsorption (APR)<br />
– Den reabsorberede mængde i absolutte tal<br />
• Fraktionel Proximal Reabsorption (FPR)<br />
– Den reabsorberede mængde i % af filtreret mængde (% af GFR)<br />
• Øget mængde ultrafiltrat øger reabsorption<br />
– øget filtration af bikarbonat og andre stoffer som øger reabsorptionen<br />
• Øget reabsorption øger ultrafiltrationen<br />
– Øget reabsorption medfører fald i tubulustryk og dermed øget netto<br />
ultrafiltrationstryk<br />
• Øget filtration bevirker øget kolloidosmotisk tryk i peritubulære kapillærer og dermed øget<br />
reabsorption<br />
• Alle 3 mekanismer afstemmer GFR og tubulær reabsorption (glomerulotubulær balance)
• Sympatisk nerveaktivitet<br />
• Angiotensin II<br />
Na+ reabsorption i PCt Cl- transport i PCT<br />
Cl- transport i PST PAH udskillelse i PCT<br />
AA, glucose og P er et sekundært optage<br />
(uphill) drevet af natrium (downhill).<br />
Na+/H+ på samme måde og gør urinen sur.<br />
Epithelet i PCR har høj permeabilitet for<br />
vand og bliver reabsorberet pga. forskellige<br />
stoffers evne til at danne en osmotisk<br />
gradient. Blodet i de peritubulære kapillære<br />
har et højt osmotisk tryk og lavt hydrostatisk<br />
tryk og derfor vil vand & ioner optages i<br />
blodbanen (starling).
Glucose optage i PT Ovenfor AA optag, Nedenfor Organisk cation<br />
SGLT2 = stor kapacitet lav affinitet<br />
SGLT1 = lav kapacitet høj affinitet<br />
Proteiner som albumin optages også i PCR. Andre oligopeptider omdannes til AA via brushborder<br />
enzymer som optages via en AA/Na+ symporter, og en AA pumpe basolateralt. Oligopeptider kan<br />
dog også optages med en H+/Oligopeptid symport (PepT 1) og nedbrydes i cytoplama af peptidaser<br />
til AA.<br />
Henles slynge<br />
Reabsorberer 20% af filtreret NA+, 25% af K+, 30% af Ca2+, 65% af Mg2+, 10% vand.<br />
Descenderende tynde ben:<br />
Ydre og indre medulla. Høj vandpermeabilitet. Moderat NaCl og urinstofpermeabilitet<br />
Ascenderende tynde ben:<br />
Kun i indre medulla Vandtæt. Høj NaCl permeabilitet. Urinstofpermeabelt<br />
Ascenderende tykke ben:<br />
Ydre medulla og cortex. Vandtæt. Urinstoftæt<br />
Langsomt flow - Lav NaCl for enden af Henles slynge
Hurtigt flow - Højere NaCl for enden af Henles slynge<br />
Distale tubuli<br />
Reabsorbere 9% af Na+, Cl- og 19% vand (er ukoblet). Tæt epithel. Secernerer K+ & H+.<br />
Samlerør<br />
K+ sekreres i samlerør ved høje koncentrationer & reabsorberes ved lave koncentrationer. Aktivt<br />
optag Na+/K+ ATPase basolateral, diffundere luminalt fordi koncentrationsgradienten er lavest<br />
luminalt (-50,-70) vil størstedelen diffundere herud. (membran dep. NA+ influx).<br />
Høj permeabilitet giver høj sekretion. ↑plasma K+ ↑sekretion. Diuretikua giver højt Na+ luminalt,<br />
hvilket giver øget ATP aktivitet og ↑K+sekretion.<br />
Lumens transepitheliale elektriske potentiale øger K+ sekretion.<br />
Øget membran potentiale for K+. Høj væske flow i samlerør holder en konstant gradient.<br />
ENaC – transport af Na ind i celle. Hastighedsbegrænsende, kan øges vha. aldosteron. Danner<br />
lumen negativ så H+ kan pumpes ud heri.<br />
Vigtige for salt-balance og blodtryk<br />
Vigtige for kalium balancen<br />
Vigtige for nyrens koncentreringsevne<br />
Vigtige for syre-base balancen
Cl-<br />
Urin koncentration og forynding<br />
AVP<br />
Koncentration Fortynding
Nyren kan udskille urin med osmolaliteter fra 50 mOsm/kg til 1200 mOsm/kg. Normal plasma<br />
osmolalitet er 300 mOsm/kg<br />
Nyren danner en koncentreret urin ved at skabe en osmotisk gradient ned gennem medulla, og<br />
derefter anvende denne gradient til reabsorption af vand i samlerørene.<br />
Koncentreringsmekanismen fungerer ved afstemt samspil mellem nefrondelenes forskellige<br />
permeabiliteter for vand, NaCl og urinstof, samt evne til aktiv transport af NaCl<br />
”Motoren” i systemet er en modstrømsforstærkning,<br />
(countercurrent multiplication) som udføres i ydre medulla af Henles slynges tykke ascenderende<br />
ben og tynde descenderende ben.<br />
Forudsætninger:<br />
1) Tykke ascenderende ben af Henles slynge er vandtæt og kan transportere NaCl mod en<br />
gradient op til en osmotisk koncentrationsforskel på ca. 200 mOsm/kg<br />
2) Tynde descenderende ben af Henles slynge er vandpermeabel<br />
Vigtig for at bringe tilbageresorberet vand væk fra medulla er en modstrømsudveksling<br />
(countercurrent exchange) i vasa recta<br />
I indre medulla sker opbygningen af den osmotiske gradient ved opkoncentrering af urinstof.<br />
Urea ficiliteres til udskillelse i den indre medulla via AVP.
Kap. 24<br />
TBW for kvinder (gennemsnitlig) er 50% af kropsvægten, for mænd er den 60%. Jo mere adipøst<br />
væv en person besidder, jo mindre er TBW, da adipøst væv ikke indeholde meget van (10%) i<br />
forhold til andet væv (muskelvæv 75%).<br />
2/3 dele af væske i kroppen er IC, dog er osmolariteten som regel ens pga. den høje<br />
vandpermeabilitet, og derfor ingen osmotisk trykforskel.<br />
Blodplasma = 3,5L for en mand på 70kg (1/4). Lymfe og interstitiel væske er ¾ af ECV.<br />
Transcellulær væske er ca. 1-3% af kroppens væske (sved, pancreassaft, galle mv.).<br />
Natrium og dets anioner står primært for 95% af osmolaliteten.<br />
1mEq for et ladet molekyle = 1mmol<br />
For et molekyle med to ladninger er 1mEq = 2mmol<br />
3 kationer = 3anioner<br />
93% af plasma er vand.<br />
Plasma calcium og magnesium er højere end i interstitielvæsken, pga. binding til proteiner.
Tab af kalium IC vil få cellerne til at skrumpe. Øget Na+ ECV vil øge væskemængden og vice<br />
versa.<br />
Vandbalance:<br />
B: 2 liter vand tilføjes. 2/3<br />
optages IC og 1/3 EC. IC<br />
osmolalitet falder.<br />
C: Isoton opløsning vedligeholder<br />
osmolaliteten.<br />
D: NaCl IV gør at vand forlader<br />
cellerne og skaber en større<br />
osmolalitet.
Thirst<br />
sensatio<br />
n<br />
Water<br />
intake<br />
&<br />
Vasopressi<br />
n<br />
secretion<br />
Central<br />
nervou<br />
s<br />
system<br />
Renal water<br />
reabsorptio<br />
Extracell.<br />
osmolalit<br />
y<br />
Extracel<br />
l<br />
volume<br />
Renal<br />
water<br />
excretion<br />
Renal<br />
water<br />
filtration<br />
Intracel<br />
l<br />
volume<br />
Central<br />
venous<br />
pressur<br />
e<br />
Arterial<br />
pressur<br />
e<br />
Glomerular<br />
filtration<br />
rate<br />
Renal<br />
Na+<br />
filtration<br />
Renal<br />
Na+<br />
excretion<br />
Intracell<br />
osmolalit<br />
y<br />
Card.vasc<br />
.<br />
center<br />
Sympatheti<br />
c<br />
tone<br />
Renal<br />
Na+<br />
reabsorpt.<br />
Natriuretic<br />
horm.secr<br />
.<br />
Higher<br />
nervou<br />
s<br />
centers<br />
Renin<br />
secretio<br />
n<br />
Angiotensi<br />
n<br />
II formation<br />
Aldosteron<br />
e<br />
secretion<br />
Plasma<br />
K+<br />
concentr.<br />
For en mand på 70kg vil vandbalancen input/output være 2,5 L. Input = væske, mad og vand fra<br />
oxidation (f.eks. 1mol glucose som oxideres giver 6mol vand). Output = sved og udåndingsluft,<br />
Fæces og urin.
AVP – lokaliseret i nucleus supraopticus og paraventriculus i den anteriore del af hypothalamus.<br />
Det frigives i lange neuroner (hvor det lagres) til den neurohypofysen, hvorefter det frigives til<br />
blodet. Mange faktorer har indflydelse på frigivelsen af AVP som smerte, traume stress, kvalme,<br />
besvimelse, nikotin, morfin og ANGII. Disse faktorer nedsætter urin output. Ethanol og atrial<br />
natriuretisk peptid inhiberer AVP frigivelsen. AVP frigives primært ved høj plasma osmolalitet.<br />
Når denne osmolalitet stiger, vil neuroner kaldet osmoreceptor celler lokaliseret i anteriore<br />
hypothalamus skrumpe. Dette stimulerer til frigivelse af AVP. Dette giver en mere koncentreret<br />
urin, da vandet trækkes tilbage i blodbanen.<br />
Forhøjede koncentrationer af f.eks. urea vil have en negativ effekt på osmoreceptorerne da disse<br />
ikke tilbageholder vand.<br />
EC NaCl er ene effektiv stimulator af AVP. Øget blodvolumen nedsætter frigivelsen af AVP.<br />
Hypovolæmi giver den modsatte effekt. Strækreceptorer i atrier mv. inhiberer også frigivelsen af<br />
AVP. Mere end 10% af blodet skal tabes før AVP frigives.<br />
Nedsat RBF giver øget renin frigivelse som øger ANGII og dermed AVP også.<br />
Diabetes incibidus = nedsat frigivelse af AVP. Fortyndet urin. Der kan desuden også forkomme en<br />
variant af denne hvor det er samlerørene som ikke reagere på AVP, Plasma AVP vil da være det<br />
samme, men en stadig fortyndet urin.<br />
Tørst er umiddelbart af vane først og fremmest, men<br />
ellers udløser mekanismerne på figuren tørst af<br />
forskellige veje.<br />
Hyponatremi – Na+ < 135mmol/L. Ses ved øget vand i plasma forbundet med hypoosmolalitet.<br />
Na+ balance – (højt EC konc.) kun 0,4% bliver udskilt. 70% reabsorberes i PCT. 20 % i henles<br />
slynge (10% vand), 6% i DCT (intet vand), og 3% i samlerør (19% vand).<br />
Na+ udskillelsen følger som regel GFR. Stiger GFR vil Na+ udskillelsen også stige hvis det er pga.<br />
øget ECV mængde og reabsorptionen kan ikke gennemføres fuldt ud, derfor vil NA+ udskillelsen<br />
stige. Hvis GFR falder (fx ved blodtab) vil kan der reabsorberes mere Na+ og dermed bliver
udskillelsen mindre. Glumerotubulær balance er en forsvarsmekanisme i tubuli for at regulerer Na+<br />
udskillelsen. Umiddelbart ville en øget GFR kunne udskille store mængder Na+, men denne balance<br />
øger rate af reabsorption af Na+ når GFR øges, og vice versa.<br />
Renin (fra granula celler i de afferente arterioler) frigives ved tre mekanismer<br />
1. Nedsat tryk i den afferente arteriole, hvor granula celler er stræk sensitive og fungerer som<br />
en baroreceptor.<br />
2. Stimulation af sympaticus ved aktivering af β2 receptorer på granula cellerne.<br />
3. Nedsat væskeflow til macula densa ved f.eks. nedsat GFR.<br />
Ved en langvarig stimulation af Renin frigivelse, vil glatte muskelceller i de afferente arterioler<br />
omdannes til granula celler og dermed forstærke frigivelsen af renin. Renin er et proteolytisk enzym<br />
som kløver angiotensinogen til ANG I. Når dette passerer lungerne vil ACE (befinder sig i<br />
overfladen af endothelcellen) konvertere dette til ANG II. ANG II stimulerer syntesen af aldosteron<br />
fra zona glomerulosa som derefter vil have effekt på de distale tubuli, til at reabsorbere Na+. ANGII<br />
stimulerer desuden tørst og frigivelsen af AVP, og er desuden en vasokonstrictor ved f.eks.<br />
blødninger. Ved øget vandmængder eller Na+ bliver RAAS hæmmet og udskillelsen stiger dermed.<br />
Ved addisons sygdom (binyrebark insufficiens) vil aldosteron ikke frigives og store mængder vand<br />
og salt vil udskilles (Na+ reabsorption vil falde fra 99,6% til 98% hvilket svarer til Na+ tab i 3L<br />
plasma). Disse patienter ”holdes i live” ved at have en trang til at indtage salt hele tiden.<br />
Øget hydrostatisk tryk eller nedsat kolloid osmotisk tryk i de peritubulære kapillærer vil nedsætte<br />
optaget af væske i blodet. Dette vil øge det væske i interstitiet og dermed udvide cellerne ved tight<br />
junctions så der siver væske og salte ud og reabsorptionen nedsættes.<br />
ANP i atrierne er sensitiv ved stræk pga. øget blodvolumen. Dette er med til at øge GFR og<br />
samtidig inhibere Na+ reabsorption i det indre medulla. ANP hæmmer også sekretion af aldosteron.<br />
ANP er en vasodilator og sænker dermed blodtrykket.<br />
PGE2 og PGI2 hæmmer Na+ reabsorption.<br />
Sympaticus nedsætter Na+ udskillelsen ved tre nekanismer<br />
1. Nedsætter GFR og RBF som nedsætter den filtrerede mængde af Na+ samt nedsat<br />
hydrostatisk tryk i de peritubulærer kapillærer.<br />
2. Direkte stimulatorisk effekt på reabsorptionen af Na+.<br />
3. Øget renin frigivelse som øger ANGII og aldosteron som øger reabsorptionen af Na+.<br />
Østrogener og glucocorticoider øger også Na+ reabsorption.<br />
Ved øget anion i urinen som HCO3- Cl- mv vil der også være øget kation i urinen, altså Na+. Dette<br />
kan dog erstattes af K+, NH4+ og H+.<br />
Diuretica – Furosemid, burosemid hæmmer Na/K/2Cl cotransporteren i det tykke ascenderende ben,<br />
Thiazid hæmmer Na/Cl cotransporteren i DCT og amilorid blokerer ENaC i samlerørerne. Disse<br />
gives typisk mod hypertension og ødemer.<br />
Indtagelse af Na+ i form af NaCl er ca. 100-300mmol/dag. Ca. 50% af kroppens Na+ er ECV, 40%<br />
er i knogle og 10% ICV. Na+ optages i tarmen.<br />
K+ balance – (høj IC konc.) Lav plasma K+ giver giver membran hyperpolarisering og reducerer<br />
excitabiliteten, muskelsvaghed. Høj plasma K+ giver membran depolarisering og øget excitabilitet.<br />
K+ i kroppen er på ca. 3700mmol. 2% er ECV, 8% er i knogle, 1% trancellulært og 90% IC.<br />
Normal plasma konc. er 3,5-5mmol/L under dette er hypokalæmi og over er hyperkalæmi.<br />
Skeletmuskulaturen bærer ca. 2/3 af kroppens K+.<br />
Flere faktorer er med til at fordele K+ i cellerne og ECV.
1. Na+/K+ ATPasen er vigtigt at vedligeholde. Inhiberes denne kan det give hyperkalæmi.<br />
2. Nedsat pH i ECV kan give øget K+ ECV. Den øgede mængde H+ vil pumpes ind i cellerne<br />
og K+ ud.<br />
3. Insulin promoverer optaget af K+ i skeletmuskulatur og leverceller.<br />
4. Adrenalin øger K+ optagelsen i celler via β2 receptorer.<br />
5. Hyperosmolalitet øger K+ i plasma da cellerne skrumper og derfor driver K+ ud af cellerne.<br />
6. Traume, iskæmi, infektion, hæmolyse og overdreven træning kan give et øget plasma K+.<br />
K+ optag via føde er ca. 50-150mmol/L<br />
Selvom K+ ekskretionen stiger med øget K+ i kroppen, kan den være for lille i forhold til hvad der<br />
bliver indtaget, og hyperkalæmi kan opstå. Addisons giver manglende udskillelse af K+ pga. den<br />
manglende aldosteron.<br />
Diuretika kan udskille for meget K+ og give hypokalæmi.<br />
Af den filtrerede del af K+ er det typisk 15% som bliver udskilt.<br />
Calcium balance<br />
calcium indtag = 1000mg/dag. 850mg/dag udkilles fecalt og 150mg/dag via urinen. Net absorption i<br />
tarmene er 150mg/dag.<br />
Normal plasma Ca2+ er 2,5mmol/L. 50% er frit 40% bundet til albumin og 10% bundet til fx citrat.<br />
Calcium som ikke er proteinbundet er er frit filterbart i glomeruli (60%). 60% af den filtrerede del<br />
bliver reabsorberet i PCT 2/3 af denne del bliver reabsorberet via solvent drag og den sidste 1/3 via
calcium kanaler i den apikale membran og calcium ATPaser. 30% i henles slynge primært i det<br />
tykke ascenderende ben via passiv transport. Reabsorptionen fortsætter i DCT hvor man desuden<br />
kan give thiazid for at øge optaget af calcium ved for store mængder i urinen. Normalt kun 0,2-<br />
0,5% af calcium bliver udskilt.<br />
Magnesium balance<br />
1000mmol af Mg2+, hvor 60% er i knogle 39% ICV og 1% ECV. Plasma Mg2+ er ca. 1mmol/L<br />
20% er bundet til plasma proteiner, 20% i komplex med anioner og 60% frit. 25% af filtreret Mg2+<br />
er reabsorberet i PCT, i henles loop primært TAL hvor 65% reabsorberes passivt.<br />
Fosfat balance<br />
Normal plasma koncentration er normalt 1mmol/L. Fosfat er normalt ikke bundet i plasma og derfor<br />
frit permeabelt for nyren. Ca. 60-70% af den filtrerede mængde er aktiv reabsorberet i PCR og 15%<br />
i PST via Na-fosfat cotransport. 5-20% af fosfat udskilles. Mængden af filtreret fosfat overskrider
somregel grænsen for genoptag, derfor mængden af udskillelsen er større end andre ioner (det er<br />
Tm begrænset).<br />
Hyperphosphatæmi giver ↓ Vit 3 og ↓ calcium reabsorption. ↑PTH giver øget udskillelse af fosfor.<br />
Desuden øget mobilisering af calcium hvilket kan give knogleskørhed.<br />
Kap. 25<br />
[H+] ca. 35-45nmol/L i arterielt blod. Holdes konstant i og udenfor celler.<br />
En syre kan frigive og donere H+ en base kan modtage et H+.<br />
En syre HA tilføjes vand og dissociere til H+ og A- hvor A- er en base. Ved ligevægt vil<br />
dissociation og association være det samme. Dissociationskonstanten er givet ved<br />
[ H + ] * [ A−]<br />
K a = , hvilket betyder at jo højere Ka er jo mere bliver syren ioniseret, H+ frigives, og<br />
[ HA]<br />
syren bliver stærk (større mængde i tæller ifht. nævner). HCl, H2SO4, H3PO4 og HNO3 er stærke<br />
syrer. En syre med lav Ka har en lav konc af H+. Disse er mælkesyre, H2CO3 og NH4+.<br />
Ka konverteres via logaritme til pKa. pKa = log10(1/Ka) = -<br />
log10Ka. Man skal da huske det samme ved pH, at pKa er omvendt<br />
proportional til Ka, så en stærk syre har en høj Ka og lav pKa og<br />
omvendt ved en svag syre.<br />
pH = log10(1/H+) = -log10H+<br />
Henderson-Hasselbach pH = pKa + log(A-/A)<br />
pH buffersystemet er et system som er med til at minimere<br />
ændringen i pH når en syre eller base bliver tilføjet, men dog sagt<br />
ikke at forhindre den. En god buffer er tilstede ved høje<br />
koncentrationer og har en pKa tæt på den givne pH.
HCO3-/CO2 er et vigtigt buffer par. Reaktionen H+ + HCO3- = H2CO3 = H2O + CO2<br />
Lav blod pH stimulerer til øget ventilation og omvendt. CO2 kan diffundere over BBB og danne<br />
syre som stimulerer til øget ventilation via medulla oblongata.<br />
Renal regulation af pH<br />
Nyrerne kan udskille både HCO- og H+.<br />
Kemisk regulation af pH.<br />
Fosfat er en vigtig buffer IC da pKa ligger tæt på pH her.<br />
Proteiner er gode buffere da de kan fungere både som syre<br />
og base, til føje eller fjerne H+, amforterisk. Disse er f.eks.<br />
plasma globuliner og serum albumin.
I urinen ser man kun en lille del frit H+ selvom pH kan være på 4,5. Når man måler urin syren i<br />
urinen er det ud fra titrerbare syrer, hvor man måler den stæke base NaOH, som skal bruges for at få<br />
den lave pH op mod normalen. Den største titrerbare syre er H2PO4-.<br />
Renal netto exkretion (35mmol/dag): Urin titrerbar syre (12mmol/dag) + Urin ammoniak<br />
(24mmol/dag) – Urin HCO3- (1mmol/dag).<br />
Urin ammoniak står for ca. 2/3 af H+ udskillelsen. HCO3- står for udskillelsen af base og<br />
subtraheres derfor.<br />
Tre processer forløber sig i nepronet og kaldes urin acidifikation – filtreret HCO3- reabsorberes,<br />
titrerbare syrer dannes og ammoniak bliver tilføjet.<br />
Acidifikation i PCR – H+ ioner sekreres i PCR epithelet. 2/3 via Na+/H+ exchanger og 1/3 er H?<br />
ATPase. Tubulær væsken falder fra 7,4 til 6,7. Det er kun et beskedent fald i pH fordi H+ som<br />
kommer ind i lumen vil minimere pH ved HCO3- buffersystemet. Desuden vil en del diffundere<br />
tilbage til blodet pga gradienten.<br />
Acidification i Henles slynge – pH stiger i det descenderende ben fra 6,7 til 7,4 pga reabsorption af<br />
vand. Langs TAL vil pH falde endnu engang pga. sekretion af H+ via en H+/Na exchanger og en<br />
H+ ATPase.<br />
Acidifikation i det distale nephron – Her er der færre H+ der bliver sekreret via en H+ ATPasen,<br />
men mere HCO3- reabsorberes og mindre H+ diffundere tilbage i blode pga. at cellerne er så tætte.<br />
Ammonium NH3 går sammen med H+ og danner ammoniak som ikke kan reabsorberes da cellerne<br />
i samlerørerne er impermeabel overfor disse. pH er ca. 6 men kan være ned til 4,5.
HCO3- er frit permeabelt i glomerulus ca. 2160mmol/dag. Et<br />
lille tab af dette vil gøre blodet meget syreholdigt og forringe<br />
kroppens buffer egenskab. HCO3- reabsorberes helt ved<br />
værdier under 13mmol/L, begynder værdierne at stige vil det<br />
udskilles i urinen.<br />
R&T siger H+/Na+ exhanger og HCO3-/Na exchanger<br />
Når H+ bruges til at danne titrerbare syrer vil nyt HCO3-<br />
frigives til blodet, som vil erstatte den del som går til buffer<br />
systemet til de stærke syre ved metabolisering. Den<br />
titrerbare syremængde afhænger af to faktorer, pH og<br />
buffere. Sænkes pH vil mere H+ kunne gå sammen med en<br />
buffer og danne syre. Bufferen er dog sædvanligvis<br />
begrænset, så mere frit H+ vil blive udskilt, hvis pH falder.<br />
R&T siger H+/Na+ exhanger og HCO3-/Na exchanger<br />
Mest NH4+ dannes i PCR og kommer via deamidering og<br />
deaminering af glutamine.<br />
NH4+ indtræder urinen<br />
ved to mekanismer. NH4+/Na+ exchanger og NH3 som<br />
diffunderer over og går sammen med H+.<br />
For hver mmol udskilt H+ som NH4+ vil en mmol HCO3-<br />
optages i blodet.
Ammoniak.<br />
Et fald i pH i lumen af tubuli cellerne, vil øge sekretionen af H+ fra IC og sekretionen vil omvendt<br />
falde hvis pH er høj i lumen.<br />
Øget Pco2 i blodet vil øge dannelsen af H2CO3 som øger renal sekretion af H+ og exkretion. En<br />
nedsat Pco2 vil give nedsat udskillelse af H+ og dermed en nedsat reabsorption af HCO3- og derfor<br />
en øget udskillelse af denne.<br />
Et fald i plasma K+ vil medføre at K+ fra cellerne vil søge ud i blodet, og dermed H+ ind i cellerne.<br />
H+ i tubulicellerne vil sekreres ud i lumen og øge pH. Hypokalæmi giver øget HCO3- i plasma.<br />
Hyperkalæmi giver det modsatte.<br />
Regulationen af IC H+ sker ved at stabiliserer ECV H+. ECV H+ er på 7,4 og IC ca. 6,9. Derfor er<br />
der ikke ligevægt over membranen og cellerne skal bruge aktiv transport ud af cellen vha. NA/H<br />
exchanger (NHE1-5). Denne exchanger ved IC pH og hormoner.
ANDET
Proximal<br />
tubule,<br />
S1<br />
Proximal<br />
tubule,<br />
S3<br />
LUMINAL<br />
[Na + ]<br />
TRANSEPITHELIAL<br />
CHEMICAL DRIVING<br />
FORCE*‡<br />
TRANSEPITHELIAL<br />
VOLTAGE (i.e.,<br />
ELECTRICAL DRIVING<br />
FORCE)†‡<br />
142 mM 0 mV -3 mV -3 mV<br />
142 mM 0 mV +3 mV +3 mV<br />
TAL 100 mM -9 mV +15 mV +6 mV<br />
DCT 70 mM -19 -5 to +5 mV -24 to -14 mV<br />
CCT 40 mM -34 mV -40 mV -74 mV<br />
A. Roles of Intracellular K +<br />
Cell-volume Maintenance Net loss of K + → Cell shrinkage<br />
Net gain of K + → Cell swelling<br />
Intracellular pH Regulation Net loss of K + → Cell acidosis<br />
Net gain of K + → Cell alkalosis<br />
TRANSEPITHELIAL<br />
ELECTROCHEMICAL<br />
DRIVING FORCE‡<br />
Cell Enzyme Functions K + dependence of enzymes: e.g., some ATPases, succinic dehydrogenase<br />
DNA/Protein Synthesis, Growth Lack of K + → reduction of protein synthesis, stunted growth<br />
B. Roles of Transmembrane [K + ] Ratio<br />
Resting Cell Membrane Potential Reduced [K + ]i/[K + ]o → membrane depolarization<br />
Increased [K + ]i/[K + ]o → membrane hyperpolarization<br />
Neuromuscular Activity Low plasma K + : muscle weakness, muscle paralysis, intestinal distention, peripheral<br />
vasodilation, respiratory failure<br />
High plasma K + : increased muscle excitability; later, muscle weakness (paralysis)<br />
Cardiac Activity Low plasma K + : slowed conduction of pacemaker activity, arrhythmias<br />
Vascular Resistance Low plasma K + : vasoconstriction<br />
High plasma K + : conduction disturbances, ventricular arrhythmias and ventricular<br />
fibrillation<br />
High plasma K + : vasodilation<br />
Gitelmans syndrom - er en autosomal, recessiv arvelig tilstand, der skyldes inaktiverende<br />
mutationer i det gen, der koder for den thiazidfølsomme NaCl-kotransportør i de distale tubuli. De<br />
biokemiske abnormiteter simulerer derfor kronisk thiazidbehandling: hypokaliæmi, metabolisk<br />
alkalose, hypomagnesiæmi, hypokalkuri og relativt lavt blodtryk. Gitelmans syndrom blev i mange<br />
år forvekslet med Bartters syndrom, indtil det patofysiologiske og genetiske grundlag blev klarlagt i<br />
1996. Ved Bartters syndrom, der omfatter transportdefekter i det tykke ascenderende ben i Henles<br />
slynge, er der ikke obligatorisk hypomagnesiæmi, og calciumudskillelsen i urinen er normal eller<br />
høj. Bartters syndrom diagnosticeres neonatalt eller i den tidlige barnealder og er ofte ledsaget af<br />
væksthæmning og nefrokalcinose. Gitelmans syndrom diagnosticeres derimod senere i livet ofte<br />
pga. tilfældigt fundet hypokaliæmi eller hypomagnesiæmi. Gitelmans syndrom er en fredelig og<br />
ofte symptomløs sygdom. Muskulær træthed kan ses og under specielle omstændigheder tillige<br />
muskelkramper. Behandlingen er magnesium- og kaliumtilskud samt evt. kaliumbesparende<br />
diuretika, hvorimod NSAID-præparater ikke har effekt.<br />
Liddles syndrom - pseudohyperaldosteronisme (Grant Winder Liddle, f. 1921, USA): meget<br />
sjælden, arveligt betinget tilstand hos yngre personer karakteriseret ved forhøjet blodtryk, lav<br />
kaliumkoncentration i blodet (hypokaliæmi), lav plasmakoncentration af renin og lav sekretion af<br />
binyrebarkhormonet aldosteron. Autosomal dominant·arvegang; skyldes mutation i genet for en<br />
subunit af nyreepitelets natriumkanal, locus på kromosom 16p.
Hyperaldosteronismus primarius - morbus Conn, Conns sygdom, Conns syndrom, primær<br />
hyperaldosteronisme (Jerome W. Conn, 1907-81, USA): sjælden sygdom der skyldes øget dannelse<br />
af binyrebarkhormonet ·aldosteron pga. svulst (·adenom) i, el. hyperplasi af, binyrebarkens zona<br />
glomerulosa, se ·cortex glandulae suprarenalis. Hovedsymptomet er forhøjet blodtryk, ·hypertensio<br />
arterialis. Der kan også ses paræstesier (føleforstyrrelser, se ·paraesthesia), muskelsvækkelse, lavt<br />
serumkalium og -magnesium (hhv. ·hypokaliæmi og ·hypomagnesiæmi), ·baseose og ·polyuri.<br />
Bartters syndrom - (Frederic Crosby Bartter, 1914-83, USA): hyperplasi af nyrernes<br />
juxtaglomerulære apparat ledsaget af ·hypokalæmisk·baseose, ·hyperreninæmi, sekundær<br />
hyperaldosteronisme (·hyperaldosteronismus secundarius), men normalt ·blodtryk; hos børn ofte<br />
forsinket vækst.<br />
Spironolacton, spironolakton: syntetisk fremstillet ·antagonist til det salttilbageholdende og<br />
kaliumdrivende binyrebarkhormon aldosteron. Anvendes sammen med diuretika specielt til<br />
patienter med kaliummangel.<br />
Diabetes insipidus (lat. insipidus uden smag; af sapidus velsmagende): en oftest kronisk sygdom<br />
karakteriseret ved at i øvrigt normalt fungerende nyrer ikke kan koncentrere urinen (se<br />
·hypostenuri). Patienterne generes af øget tørst, højt væskeindtag (·polydipsi) og stor vandladning<br />
(·polyuri). Sygdommen skyldes oftest manglende el. stærkt nedsat produktion af · antidiuretisk<br />
hormon (ADH) i hypofysens baglap (·neurohypofysen), typisk som følge af svulst, neurokirurgisk<br />
indgreb el. traume. En sjældnere form er arveligt betinget med ·autosomal dominant·arvegang;<br />
skyldes mutation i genet for ADH, ·locus (AVP) på kromosom 20p. Ved nefrogen diabetes<br />
insipidus er ·nyretubulis følsomhed for det antidiuretiske hormon nedsat; skyldes enten ·X-bundet<br />
recessiv defekt i ·receptoren pga. mutation i locus for denne på X-kromosomets lange arm, Xq, el.<br />
mutation(er) i genet for vandkanalproteinet aquaporin 2, locus på kroposom 12q; både dominant og<br />
recessiv arvegang er beskrevet.<br />
Acidosis renalis tubularis - renal tubulær acidose: ophobning af syre i kroppen pga. sygdom i<br />
·nyretubuli, med nedsat udskillelse af brintioner til følge. Inddeles i primære (oftest arveligt<br />
betingede) og sekundære former, sidstnævnte i forbindelse med andre nyresygdomme.<br />
Plasma-ekstraktions-fraktionen<br />
- Hvor stor en del af stof, som tilføres gennem nyrearterien, som ekstraheres i nyren.<br />
Filtrations-fraktionen<br />
- Hvor stor en del af det renale plasmaflow, som filtreres i glomeruli<br />
Tubulær passage-fraktion<br />
- Hvor stor en del af det filtrerede stof, som passerer et givet sted i tubulus.<br />
Ekskretions-fraktion<br />
- Hvor stor en del af det filtrerede. stof, som udskilles i urin<br />
Reabsorptions-fraktion<br />
- Hvor stor en del af det filtrerede stof, som reabsorberes
Erytrocytter<br />
Bikonkave uden kerne. Diameter på 7micro-m og en<br />
tykkelse på 2,5micro-m. Høj K+ IC og lav Ca2+ & Na+<br />
IC. Et hæmoglobin molekyle har 4hæm grupper og et<br />
globin molekyle. Molekylær vægt er 64500da. Har to<br />
alpha og to beta kæder (det der hedder HbA, Findes også<br />
HbA2 som kun udgør 1,5% af alt hæmoglobin i kroppen).<br />
Seglcelle anæmi er en fejl i aminosekvensen.<br />
MCHC (mean cell hæm conc.)= Hb (g/L)/Hæmatokrit =<br />
150g/L/0,45 = 333g/L<br />
Lave værdier viser nedsat hæmoglobin syntese.<br />
MCH (mean cell hæmaglobin) = Blod hæmoglobin/Antal<br />
røde blodceller = 150g/L/(5*10 12 celler/L) = 30*10 -<br />
12 g/celle.<br />
MCH er normalt lav når MCHC er lav.<br />
MCV (mean cell vol) = Hæmatokrit/antal røde blodceller<br />
= 0,45//(5*10 12 celler/L) = 0,09*10 -12 g/celle<br />
Et gram hæmohlobin kan transporterer 1,34 ml oxygen.<br />
Haptoglobin binder frit hæmoglobin i blodet. Hæmoglobin/haptoglobin komplekset fjernes hurtigt i<br />
leveren og bevarer jern i kroppen.<br />
Hemopexin danner kompleks med fri hæm i blodet, og fjernes i leveren.<br />
Transferrin transporterer jern i blodet og vedligeholder homeostasen.
Leveren fungerer også som en forstærkning af hormoner og modificering af disse.<br />
Hormoner bliver desuden også degraderet i leveren.<br />
Hæmatokrose = For meget jern i kroppen.<br />
Calcium, Phosphat & PTH<br />
Jern som kommer via transferrin afgives til<br />
hepatocytten og jern lagres som ferritin.<br />
Transferrin receptoren og apotransferrin<br />
gendannes, og apotransferrin kan nu binde<br />
til jern igen. Leveren står som et lager af<br />
jern, andre celler kan også bruge jern fra<br />
transferrin.<br />
Jo mere ferritin i leveren, jo lavere syntese<br />
af transferrin.<br />
Ferroportin eksporterer jern. Hepcidin<br />
inhiberer jern.<br />
Jern optages også via ødelagte røde<br />
blodceller hvor de phagocyteres, og hæm<br />
delen som indeholder jerne frasorteres og<br />
oplagres.<br />
Calcium balance – ca. 1kg er opbevaret i knogle. Dagligt indtag ca. 800-1200mg, hvor<br />
mælkeprodukter har den højeste værdi af calcium. Tarmene optager ca. halvedelen, dog sekreres der<br />
325mg/dag til tarmene og der er derfor et netto optag på 175mg/dag. Nyrerne filtrerer ca.<br />
10000mg/dag men reabsorbere 9825mg. 175mg udskilles via urinen. Calcium findes som tre former<br />
i blod. Frit 45%, bundet til albumin 45% og i komplex med citrat eller oxalat 10%. Total<br />
koncentration er 8,8-10,6mg/dl.<br />
Phosphat balance – 0,1 kg i bløddelsvæv som phospholipider, nukleinsyrer, nukleotider &<br />
phophoproteiner. 0,6kg i knogler. ECV 500mg. Dagligt optag ca. 1400mg mest inorganisk hvor<br />
mælkeprodukter er den vigtigste kilde hertil. Nettoabsorptionen fra tarmene er 900mg, og 900mg<br />
udskilles via nyrerne. Total koncentration er 2,5-4,5mg/dl.<br />
Osteoid er proteinmassen i knogle. Type I kollagen er dominerende med sine 90%. Osteocalcin og<br />
osteonectin er vigtige molekyler til mineraliseringsprocessen. Osteocalcin deriveres fra osteoblaster<br />
og Vitamin D inducerer syntesen heraf. Osteocalcin bindes til calcium. Osteonectin er også et<br />
osteoblast produkt og binder hypoxyapatit som osteocalcin også gør.
PTH<br />
4 parathyroide kirtler. Hovedsageligt hovedceller som syntetiserer og sekrerer pth. Regulatoren af<br />
disse hormoner er hovedsageligt calcium men også vitamin D.<br />
GEnekspressionen sker ved at et upstream regulatorisk element enten har et vit. A eller D respons<br />
element bundet. Når den intracelleulære vit D receptor binder vit D vel den danne en heterodimer<br />
med RXR som vil starte genekspressionen. PTH syntetiseres som et pre-pro hormon, hvor pre delen<br />
sørger for transport ind i ER, og i RER kløves pre delen og sendes videre i vesicler hvor pro delen<br />
kløves og PTH lagres i sekret granula.
PTH nedsætter kollagen syntese i osteoid, men igangsætter knogledannelse. Osteocytisk osteolyse =<br />
videreførsel af calcium via gap junctions. Calcium pumpes derefter ud i ECM og er med i<br />
mineraliseringsprocessen.<br />
Vit. D2<br />
Øget plasma calcium inhiberer frigivelse og<br />
syntese af PTH, ved at øge calcium IC og<br />
PKC, omvendt af før.<br />
Kolesterol<br />
↓<br />
dehydroxykolesterol<br />
↓ UVB-lys<br />
kolekalciferol (vitD3) + mad (10%)<br />
↓ i lever<br />
25 hydroxykolekalciferol (i lever)<br />
↓ i nyrer (1α hydroxylase)<br />
1,25 dihydroxykolekalciferol (for<br />
meget af dette hæmmer enzymet, PTH<br />
stimulerer)<br />
PTH 1R receptorer i nyrer (tubules) og<br />
knogle (osteoblaster).<br />
PTH stimulerer calcium reabsorption i<br />
nyrerne.<br />
Reducerer reabsorption af phosphat i<br />
nyrerne.<br />
PTH er med til at omdanne<br />
25hydroxyvitamin D til 1,25dihydrxyvitamin<br />
D, som er med til at fremme reabsorptionen<br />
af calcium i nyrerne, fremme calcium<br />
absorption i tarmene og modulere<br />
omsætningen af calcium og phosphat ind og<br />
ud af knoglevæv.<br />
PTH receptorer findes i rigt antal på<br />
osteoblaster, men ikke osteoklaster. Dog er<br />
PTH med til at frigive M-CSF som er med til<br />
at modne osteoklasterne. Desuden stimulerer<br />
både Vitamin D og PTH osteoblasterne til at<br />
frigive IL-6 som stimulerer osteoklaster til at<br />
opsuge knoglevæv.<br />
Øget plasma Ca2+ ↓PTH sekretion.
Findes i blodet bundet til albumin eller i chylomikroner.<br />
Vitamin D opbevares i fedtceller.<br />
Kun Duodenum↓<br />
Calcitonin bruges som plasma Calcium regulator og findes i C celler i thyroid kirtlen. Sekretet med<br />
calcitonin frigives ved forhøjet plasma calcium. Calcitoninreceptorer findes primært på osteoklaster.<br />
Testosteron, estradiol og glucocorticoider er også med til at regulere knoglemassen.<br />
Osteoprotegerin & cytokin???<br />
Fra Holdtimen<br />
PTH stimulerer calcium optag<br />
indirekte ved at danne vtamin D i<br />
nyrerne.<br />
Selve steppet af omdannelse til<br />
1,25dihydroxyvit. D har negativ<br />
feedback herpå.<br />
Se tidligere figur for Vit. D virkning<br />
på knogle.<br />
Calbindin holder den intracellulære<br />
koncentration nede ved at binde til<br />
calcium.<br />
Cytokin kommer fra osteoblast.<br />
Calcium optages af osteoklaster, går herigennem og ud i blodet.<br />
Hyperventilation ↓PCO2, ↑plasma pH, ↓frit calcium ↑prot. kap. Til calcium, ↑<br />
muskelexatibilitet.<br />
Letudskiftelig pulje på ca. 4g.<br />
Øget plasma calcium kan medføre døden ved laryngospasmer.<br />
Rhachitis :(gr. rhachis rygrad), rachitis, morbus anglicus, rakit(is), engelsk syge: knoglelidelse pga.<br />
·D-vitamin-mangel hos børn; karakteriseret ved forsinket forkalkning af knoglevæv (se<br />
·osteomalacia) og udvikling af ·osteoidt væv, tydeligst i de knogledele, der er i stærk vækst; hos de<br />
yngste børn kraniet: pergamentagtige knogler, ·craniotabes, firkantet hoved (caput quadratum).<br />
Senere opsvulmede epifysegrænser på ribbenene (rosenkrans); langs mellemgulvet (·diaphragma)<br />
dannes ·Harrisons fure ved indtrækning af bløde ribben; hønsebryst (·pectus carinatum) dannes ved<br />
sammentrykning af brystkassen (·thorax). Der ses epifysesvulst af hånd- og fodled, evt.<br />
dobbeltmalleol, samt hjulben. Der kan udvikles et stærkt deformeret, såkaldt ·pseudo-osteomalacisk<br />
bækken. I svære tilfælde rakitisk ·tetani med spasmer og kramper. Diagnosen stilles på klinik,<br />
typiske røntgenologiske forandringer ved knæ- og fodled samt lavt serumcalcium, ofte lavt<br />
serumfosfat og høje basiske fosfataser. Behandles med D-vitamin. Se yderligere eksempler<br />
nedenfor; se også ·hypophosphataemia familiaris.<br />
Glucocorticoider (GC) nedsætter omdannelsen af knoglevæv ved at hæmme proteinsyntesen &<br />
celledelingen. GC nedsætter absorption af calcium & phosphat fra tarmen (anti vitamin D effekt).<br />
GC fremmer udskillelsen af calcium & phosphat i urinen.<br />
Når steroider eller andet binder til et protein har det længere halveringstid.
Fra holdtimen<br />
Sygdomme som involverer Ca og P – Osteoporose, osteomalaci, rachitis, cancer, paget’s sygdom.<br />
Calcium<br />
- muskelkontraktion<br />
- exocytose<br />
- excavilitet<br />
- knogle<br />
- koagulation<br />
- 2nd messenger<br />
Total calcium = 1Kg<br />
Calcium I plasma: 2,2-2,7mM<br />
1) frit 45% 2) proteinbundet 45% 3) organisk anion 10%.<br />
Ved hyperventilation stiger den proteinbundne del. Hyperventalkalose↓H+H-Protein<br />
complex afgiver H+ og binder calcium I stedet.<br />
Dagligt indtag = 1g.<br />
Osteoid er knoglematrix der ikke er calcificeret.<br />
Osteocytisk osteolyse – 1-3 timer. Osteocytter optager calcium fra knogle og transporterer det til<br />
overflade via canaliculi ↑plasma calcium.<br />
Osteoklastisk osteolyse – 12-24timer. Osteoklaster nedbryder knoglematrix ↑plasma calcium og<br />
phosphat.<br />
PTH<br />
Effekt – PTH 1R – Gq(PKC & Ca) & Gs (ACcAMP)<br />
Nyre – 1) calcium reabsorption øges. 2) nedsat phosphate reabsorption 3) ↑ a-α-hydroxylase<br />
Knogle – 1)osteoklastisk osteolyse 2) osteocytisk osteolyse 3) (stim. Knogledannelse)<br />
Tarm – via vitamin D - ↑optag af calcium og phosphat.<br />
Vitamin D<br />
Nyre – 1) ↑calcium reabsorption 2) ↑phosphat reabsorption 3) ↓1-α-hydroxylase<br />
Knogle – 1) Osteoklastisk osteolyse 2) knogleopbygning pga. Deponering af calcium og phosphate.<br />
Tarm – ↑ calcium og phosphate optag via øget syntese af nødvendige proteiner.
Aldosteron<br />
Den primære regulator af salt og extracellulær volumen. Det er natrium som holder på vandet i<br />
kroppen og bestemmer derfor osmolaritet og ECV.<br />
Dep.<br />
↑[Ca]i<br />
Aldosterone dannes udfra de samme trin som<br />
corticol via cholesterol progesteron. Dog er<br />
det kun glumerulosa cellerne som indeholder<br />
aldosteron syntase, og kan derfor kun<br />
syntetiseres i disse celler.<br />
ACTH er også med til at regulere aldosteron<br />
udskillelsen, men er ikke så vigtig som ANG II<br />
og plasma K+. Ca. 37% er frit i blodet, 21% til<br />
CBG og 42% til albumin.<br />
Aldosteron har hovedsagelig til opgave at<br />
stimulere natrium reabsorption og øge kalium<br />
koncentrationen. Aldosteron fungerer på samme<br />
måde som cortisol rent signalleringsmæssigt.<br />
Øger antallet af Na+ transportere mv.<br />
ANG II binder til AT1 receptor som aktiverer et<br />
Gq-proetin PLCDAG & IP3. DAG aktiverer<br />
PKC og IP3 øger Calcium konc. IC. Dette giver<br />
øget aldosteron syntese i glumerulosa cellerne.<br />
↑K+ giver ↑Ca IC.<br />
Spontan øgelse af aldosteron pga. tumor kaldes<br />
conn syndrom.<br />
Renin frigives ved ↓BT & ↑sympaticus (β1)
Fysiologi hjerte/kredsløb<br />
Chemoreceptorer er i sinus carotis & aorticus, som fanger ændringer i Pco2, Po2 og pH. De fyrer<br />
som regel ved øget Pco2, som kan give lav pH i hjernen.<br />
Ach stimulerer til udskullelse af NO (endothel), som vasodilatere.<br />
Blodtryksændringer registreres af baroreceptorer. Der findes højtryksbaroreceptorer i aortabuen og<br />
arterie carotis, lige ved udfletningen fra carotis communis til carotis interna og externa.<br />
Baroreceptorernes funktion er, at måle tryk forskelle i det middel arterielle tryk(MAP) og derefter<br />
påvirke hjertet og karrene i negativ eller positiv retning , i et negativt feedback forløb. De fungerer<br />
som strækreceptorer (mekanoreceptorer), der måler distension i de vaskulære vægge, og derfra<br />
sender de et signal via afferente nervefibre til et kardiovaskulært kontrol center, der ligger i<br />
medulla. I medulla bliver signalet behandlet i NTS ( nucleus tractus solitarius), som tolker signalet<br />
og bestemmer om det skal sendes videre til et kardioinhibitor eller kardioaccelrator område i<br />
medulla. Når signalet er blevet færdigtolket, sendes det via efferente nervefibre ned til hjertet og<br />
karrene, der så ændrer rytme og størrelse.<br />
Hvis Map stiger, vil baroreceptorerne blive strukket og fyrer mere, det vil resultere i vasodilation og<br />
bradykardia (nedsat hjerterytme), som så tilsammen vil sænke blodtrykket til normalt niveau. Det<br />
sker blandt andet ved at mindske den sympatiske aktivitet på hjerte/kar. Omvendt vil et lavt MAP,<br />
gøre at baroreceptorerne bliver ”slappe”, hvilket resulterer i vasokonstriktion og tachykardia<br />
(forhøjet hjerterytme), så det normale blodtryk kan bibeholdes.<br />
Når hjertet og karrene ”slapper af”, for at nedsætte blodtrykket, er det det parasympatiske system,<br />
der er i brug. Acetylcholin udskilles via n.vagus, som binder sig til M2 receptorer i hjertet og<br />
påvirker hjertet til at nedsætte puls og samtidig øges omkredsene i karrene. Ved nedsat MAP er det,<br />
det sympatiske system der er i brug. Det påvirker hjertet ved hjælp af hjertenerverne, som udskiller<br />
norepinephrin, der binder sig til Beta-1 receptorer i hjertet og Alfa-1 receptorer i karrene, og derved<br />
for henholdsvis pulsen til at stige og kar til at trække sig sammen (symp har 3 effekter på hjertet,<br />
øger HR, øger ledningshast., øger kontraktilitet). (NB der er ikke tale om at der hhv. tændes og<br />
slukkes for det sympatiske og parasympatiske system). De to systemer virker sideløbende, hvor<br />
parasympatiske nervefibre kan inhibere frigivelse af norepinephrine fra sympatiske nervefibre,<br />
herved bliver sympatisk aktivitet reduceret, og hjertets kontraktion nedsættes. (2, s.291)<br />
Baroreceptorer fyrer hele tiden ,det er ændringen i fyringsfrekvensen der registreres.<br />
Ved fight and flight vil den metabolske aktivitet overvinde sympatikus og dilatere kar.<br />
Sympaticus<br />
β1 (pacemakerceller) = øget HR<br />
β1 (myocytter) = øget kontraktilitet
α1 (blodkar) = vasokonstriktion, øget SVR<br />
β2 (specielle blodkar – øget blod i muskel ved arbejde) = Vasodilation => vasodilation i coronarkar<br />
Adrenalin fra binyrebark opløses i blod. Noradrenalin fra neurotransmittere.<br />
Parasympaticus<br />
virker på M2 receptorer.<br />
- nedsat HR, nedsat konduktans, nedsat kontraktilitet, vasodilation => nedsat SVR.<br />
Acethylcholin er neurotransmitteren for parasympaticus. Hæmmer sympaticus.<br />
Long term regulering.<br />
ADH/AVP frigives ved øget osmolaritet, som øger optag af vand i nyrerne og giver<br />
tørstfornemmelse.<br />
ANP frigives ved stræk i arterier, øget udskillelse i nyrer, hæmmer sekretion af ADH, renin,<br />
aldosteron.<br />
EPO frigives fra nyren ved anæmi (nedsat hæmatokrit) som stimulerer til syntese af nye<br />
erytrocytter.<br />
RAAS: frigiver renin fra nyren ved nedsat blodflow og øget sympatikus.
Leveren er det største orgaan og får ca ¼ af cardiac output. V. Porta afgiver næring fra<br />
tarmsystemet til leveren som derefter optager og lagre dette. Leveren er også med til at regulere<br />
blodglukose niveauet og lipider i blodet i form af VLDL. Mange plasma proteiner bliver også<br />
syntetiseret i leveren.<br />
Anatomi: To hepatocytter ligger sig som regel omkring en galdekanal som er adskildt af et<br />
pericellulært rum ved tight junctions. Galden fra kanalerne tømmer sig i en galde dukt som derefter<br />
vil gå sammen med pancreas dukten og ud i duodenum. Drænagen af galde bliver reguleret af en<br />
spinchter nemlig Oddi’s Sphinchter.<br />
Det perisinusoidale rum også kaldt Disse’s rum separerer sinosoiden med dets endothellvæg fra<br />
hepatocytterne, hvor hepatocytterne har en form for cilier der øger kontakt overfladen til at optage<br />
den næring der udskilles fra sinusoiderne.<br />
I sinusoiderne finder man Kupffer celler som er nogle monocyte-macrophag celler. Disse laver<br />
endocytose på bakterier mv. fra blodet som ikke skal optages i levercellerne.<br />
Stellate celler er celler som indeholder lipid-dråber som oplagrer vitamin A. Under inflammatoriske<br />
processer omdannes disse celler til myofibroblaster som sekrerer type-I-kollagen.
Leverens lymfesystem ligger sig opad centrale vener, v. porta og langs a. hepatica. Størstedelen af<br />
drænagen sker fra sinusoiderne.<br />
Leveren er regenererende og kan både øges i masse eller tabe sin masse ved apoptose. Faktorer som<br />
TGF (transforming), HGF (Hepatic) og EGF (Epidermal) kan stimulere DNA-syntesen. TNF<br />
(tumor necrosis factor) kan forårsage ukontrolleret celledød.<br />
Stoffer som indtages kan være ”giftige” såsom alkohol. For at disse hydrofobe stoffer kan udskilles<br />
via nyrerne som urin, skal disse omdannes til hydrofile stoffer. Konversionen sker ved to faser.<br />
1.fase: Se figur.<br />
Fase 1.<br />
Fase 2: Slutproduktet fra fase 1<br />
undergår yderligere reaktioner så<br />
produktet bliver hydrofilt. Sulfate,<br />
glycin, taurin og glukoron syrer<br />
bruges i denne fase.<br />
Processen i disse faser forringes med<br />
alderen.
Farmakologi<br />
Angiotensiner<br />
Peptider – Angiotensinogen, lineært peptid, et α-globin, syntetiseret i leveren. Angiotensin I er et<br />
dekapeptid, dannes ved spaltning af angiotensinogen vha. renin. ANG I har ikke nogen virkning i<br />
det systemiske kredsløb. Fra ANG I til ANG II to er det ACE der katalyserer denne proces, og ANG<br />
II er det aktive stof.<br />
Receptorer – ANG II virker ved binding til to receptorer i 7TM familien, G-protein. AT1 og AT2,<br />
overvejende AT1. AT2 findes i større mængder i føtallivet. AT1 findes særligt i glatte muskelceller,<br />
lever, nyrer, binyrer og hjerne og aktiverer et Gq protein.<br />
Virkninger – ANG II virker vasokonstriktorisk, aldosteron sekrerende, aktivering af sympaticus,<br />
renale tubulære virkninger som reducerer natriumudskillelsen. Medieres via AT1.<br />
Klinisk potentiale – ACE hæmmere, renin hæmmere, AT1 & 2 blokkere. Primært i behandling mod<br />
hypertension. Losartan: - selv aktiv, kompetitiv binding til AT1 receptor. - Metabolit, nonkompetitiv<br />
antagonist, 10x affinitet. - Blodtrykssænkende efter 1 time, max effektefter 6 timer.<br />
Hæmmere af RAAS<br />
Hæmning af RAAS fører til nedsat BT hos normale og folk med forhøjet BT. Dette system kan<br />
hæmmes på flere måder.<br />
1. Nyrernes sekretion af Renin med βantagonister. Dog er dette meget uspecifikt.<br />
2. Reninhæmmerer som hæmmer kompetitivt reaktionen mellem renin og angiotensinogen.<br />
3. ACE hæmmere fra ANG I til ANG II<br />
4. ANG II’s virkninger kan også blokeres på receptor niveau. AT-1 specifikke midler.<br />
ACE hæmmere – Enalapril, benazepril, perindopril<br />
Virkemåde: Hæmmer omdannelsen fra ANG I til ANG II så plasma ANG II falder og virkningen<br />
hermed. Specielt svækkes den karkontraherende virkning og den aldosteronstimulerende virkning.<br />
ACE er identisk med kinase II som nedbryder bradykinin.<br />
Hæmodynamik – reducerer BT via en reduktion i den perifere modstand uden stigning i HR. Sker<br />
en natriuretisk virkning uden tab af væske.<br />
Kliniske effekter – Til patienter mod høj renin og ANG II koncentrationer. 50% effekt ved<br />
hypertension. Behandles ofte med thiazid (diuretika)<br />
Kontraindikationer – nyrearteriestenose, gravide.<br />
Sjældent bivirkninger.<br />
Gives NSAID samtidig vil denne hæmme den BT nedsættende virkning.<br />
ANG II receptor antagonister (AIIA)<br />
Losartan – kompetitive bindingsegenskaber til AT1. Losartan er aktivt i selv selv men metaboliseres<br />
i leveren som udviser ikke kompetitiv antagonisme men har 10 gange højere affinitet til AT1 end<br />
losartan. Losartan er BT nedsættende efter ca. 1-6 timer. Plasma ang II stiger og medfører<br />
aldosteron fald. Øget urinudskillelse hvilket ikke gælder for metabolitten.<br />
Absorberes hurtigt efter oralt indtag. Omkring 14% omdannes i leveren efter førstepassage. Effektiv<br />
med samtidig behandling af thiazid.<br />
Kontaindikationer som ved ACE hæmmere.<br />
Valsartan, Candesartan, Eprosartan, Irbesartan, telmisartan og olmesartan kan også gives. Tabel 21<br />
VIII
Alle AIIA har en lang række fælles egenskaber og fordele. De er stærk selektive og potente AT1<br />
antagonister. De binder ikke til andre receptorsystemer ve høje koncentrationer. Ingen<br />
agonistvirkning for AT1. Bivirkningsfrie. Første-dosis hypertension forekommer ikke. Effektive<br />
ved lavdosis tiazidbehandling.<br />
Kap. 3<br />
Cellebarrierer<br />
5 transportmekanismer til at passerer cellemembran.<br />
1. Passiv diffusion igennem lipidlaget<br />
2. Diffusionen igennem aquaporer<br />
3. Faciliteret transoport (cotrans eller ionkanal)<br />
4. Aktiv transport<br />
5. Pinocytose<br />
I praksis spiller 2,3 & 5 en mindre rolle.<br />
Diffusionshastighed = P(permeabilitetskoefficient)*A(Areal)*(Chøj-Clav)<br />
Aktiv transport<br />
Vigtig for at transportere lægemidler over membranen fra lav til høj konc. Ved infusion af flere<br />
lægemidler opstår konkurrence, og transporteren har desuden en begrænset kapacitet og mættes<br />
hurtigt.<br />
P-glykoproteinet er et 6TM protein og har som hovedmekanisme at opdage og dernæst sende<br />
molekyler tilbage til lumen inden de intræder i cytoplasma. Dette protein findes typisk i<br />
enterocytter, hepatocytter og nyretubuluceller. Findes desuden i BBB og blod testis barrieren.<br />
Substrater for disse er f.eks. morfin og digoxin.<br />
Et lægemiddel er absorberet, når det er diffunderet ind i den celle, der ligger tættest på<br />
applikationsstedet<br />
I praksis siger man, at et lægemiddel er absorberet, når det har bevæget sig fra applikationsstedet til<br />
målestedet, fx i perifert veneblod<br />
Fordeling i fedtvæv
Nogle farmaka kan ophobes i fedtvæv og udgør et inaktivt reservoir. Disse farmaka kan frigives til<br />
blodet efter man har stoppet med at indtage medicin, og dermed stadig spille en farmakologisk<br />
rolle.<br />
Albumin er det primære transportprotein i plasma. Mængden af lægemidlet bundet til albumin<br />
afhænger af koncentrationen af lægemidlet, albumin koncentrationen og affiniteten til albumin.<br />
Absorptionen afhænger om molekylet er fedt eller vandopløseligt. Desuden hvordan det gives,<br />
flydende, kapsel eller tablet. Og overfladearealet har også betydning<br />
Lægemidler gives som regel peroralt, sublingvalt, rektalt og parenteralt (IV, subkutant).<br />
Andre lægemidler optages via slimhinder i næsesvælget, øjet, vagina, urinblære, urethra og colon.<br />
Få lægemidler kan gives epidermalt, men er svært pga. de mange cellelag.<br />
Fordelingsvolumen A = lægemiddel V(konstant)*Plasmakoncentration (C). Er fordelingsvolumen<br />
på 2-5 liter findes det i karbanen, er den over er det ECV.<br />
Jo mere hydrofilt jo mere i ekstracellulære væske<br />
Eliminationshastighed = ke*A<br />
Eliminationskonstanten ke = Clearance/Fordelingsvolumen<br />
V = dosis/C(0), som er plasmakonc. til tiden 0.<br />
SE FORELÆSNINGS SLIDES!!!!!!<br />
Kap. 4<br />
Xenobiotika = molekyler som ikke indgår i de naturlige stofskifteprocesser (altså næsten alle<br />
lægemidler)<br />
Elimination sker ved to processer, 1) udskillelse 2) biotransformation – metabolismne<br />
Vigtigste eliminationsveje er Renalt, biliært, pulmonalt og via modermælken.<br />
Biotransformation fase-I processer<br />
Molekyler som undergår biotransformation er hyppigst lipofile stoffer, da disse reabsorberes i nyren<br />
og er vanskelige at udskille<br />
Oxidation – sker i leveren ved CYP enzymet. Hver CYP har et hæmmolekyle som prostetisk<br />
gruppe. Disse enzymer har den unikke egenskab at de kan inkorporere 1 iltatom, og omdannes til et<br />
hydroxylere, methyleret eller alkyleret stof.
D = Drug<br />
De 6 vigtigste CYP’er er CYP1A2, CYP2C9, CYP2C19, CYP2D6, CYP2E1 og CYP3A4.<br />
CYP1A2 udgør 15% af det det samlede CYP 450 indhold i leveren. Mængden kan øges ved<br />
tobaksrygning, broccoli. Kvinden har generelt lavere indhold end mænd. Mængden hæmmes<br />
desuden ved p-piller. Dette enzym er hovedenzymet ved oxidation af koffein, teofyllin, propranolol<br />
og klozapin. Hæmmes af antidepressiva fluvoxamin.<br />
CYP2E1 udgør 5-10% . induktor er alchohol og hæmmer er diethylidiokarbamat. Klinisk har det<br />
interesse fordi det oxiderer kræftfremkaldende stoffer. Jo større indhold af dette enzym jo større er<br />
risikoen for at få miljømedicinsk cancer. Nedbryder desuden paracetamol og ethanol.<br />
CYP3A4 er det mest dominerende og udgør ca. 30%. Findes i lever og tarmmucosa.<br />
Calciumantagonister kinisin og proteasehæmmere oxideres ved dette enzym. Den store mængde af<br />
enzymet gør at førstepassage metabolisme bliver større. Rifamizin er en induktor og grapejuice er<br />
hæmmer.<br />
Hydrolyse og reduktion er sidste trin i Fase I<br />
Fase II reaktioner<br />
Glukoronidering (konjugering) og N-acetylering er de vigtigste fase II reaktioner. Disse gør<br />
molekylerne stadigt inaktive så de kan udskilles i urin eller fæces. Da konjugerede stoffer er meget<br />
polære vil disse ikke reabsorberes i nyretubuli.<br />
Paracetamol – omdannes ved glukoronidering og sulfatering, få ved CYP til det toksiske NAPQ1.<br />
Ved overdosering vil leverens depot af glutation hurtigt blive opbrugt og metabolitten NAPQ1 vil<br />
være i større koncentration og er toksisk.
To faktorer der afgør om hæmningen fører til nedsat enzymaktivitet. 1) hæmmerens affinitet 2)<br />
hæmmerens koncentration.<br />
Induktion øges aktiviteten af enzymet. Hovedmekanismen er at øge mRNA syntese hastigheden.<br />
Den glomerulære filtrationshastighed = GFR*fu*C. GFR* fu er lig størrelsen af det volumen<br />
plasma, der indeholder den mængde lægemiddel, der pr. tidsenhed bliver fjernet fra plasma ved<br />
filtration i glomeruli, og derfor lig med den glomerulære filtrations- clearance.<br />
Lavt terapeutisk index, vil moderate udsving i plamakoncentrationen kunne få kliniske<br />
koncekvenser.<br />
Højt terapeutisk index, modsat.<br />
Hvis plasmakoncentrationen stiger hos en patient uden ordineret dosis er ændret, kan det skyldes at<br />
patenten tager mere end før, forøget absorption, nedsat biotransformation, bortfald af induktion eller<br />
nedsat renal ekskretion.<br />
Er den faldet er det modsat.<br />
Intra- og interindividuelle variationer af enzymerne er en vigtig faktor.<br />
Ældre skal som regel have en lavere dosis da renal clearance og biotransformation er nedsat.
Faktabokse:<br />
Fase I reaktioner fører som regel til dannelse af farmakologisk inaktive metabolitter, men der er<br />
også mange eksempler på aktive eller toksiske metabolitter dannet ved denne fase.<br />
Ofte udsættes metabolitter dannet ved fase I reaktion for fase II reaktioner, men der er også<br />
lægemidler, der elimineres direkte ved fase II processer.<br />
Metabolitter i fase II er storset altid inaktive polære så de nemt udskilles i urinen.<br />
Lægemidler kan også udskilles med galden og evt. indgå i det enteriske kredsløb.<br />
Polære eller ioniserede lægemidler reabsorbers ikke.<br />
Kap. 5<br />
Genetiske faktorer bidrager til, at samme dosis af samme lægegive forskellige virkning hos<br />
forskellige patienter.<br />
Genetisk polymorfi i oxidation af lægemidler. – CYP2C9 som er vigtig for nedbrydning af NSAID<br />
kan have SNP i form af CYP2C9*”,*3, hvor en aminosyrer er udskiftet og enzymet taber dermed en<br />
del af aktiviteten og egenskaberne for dette.
Kap. 64<br />
Polyfarmaci = behandling med flere lægemidler<br />
Farmakodynamik = lægemiddels indvirkning på organismen<br />
Farmakokinetik = organismens indvirkning på lægemiddelet<br />
De kliniske betydningsfulde interaktioner optræder, når plasmakoncentrationen ændrer sig med en<br />
faktor 2-5 eller mere for et lægemiddel, hvor det terapeutiske index er lille. Interaktion får særlig<br />
betydning, hvis den optræder hyppigt når de to lægemidler gives i kombination.<br />
Ændringer i gastrointestinal absorption kan ske ved plyfarmaci. Gives opioider nedsætter det<br />
paracetamols absorptionshastighed i ventriklen.<br />
Ændringer af plasmaproteinbinding kan ske ved displacering ved tilførsel af andet medikament.<br />
Øgning og hæmning af leveromsætningen sker ved induktorer og hæmmere.<br />
Ændringer ved receptorer f.eks. en patient der får antidepressiva som hæmmer reabsorptionen af<br />
NA over den præjunktionelle membran, kan ved eksogen tilførsel af NA elle A medføre stigning i<br />
BT og hjertearytmier. Det vil typisk være lokalanalgetika tilført NA og A.