Zeitlicher Verlauf chemischer Reaktionen - Wilke-j.de
Zeitlicher Verlauf chemischer Reaktionen - Wilke-j.de
Zeitlicher Verlauf chemischer Reaktionen - Wilke-j.de
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
<strong>Zeitlicher</strong> <strong>Verlauf</strong> <strong>chemischer</strong> <strong>Reaktionen</strong><br />
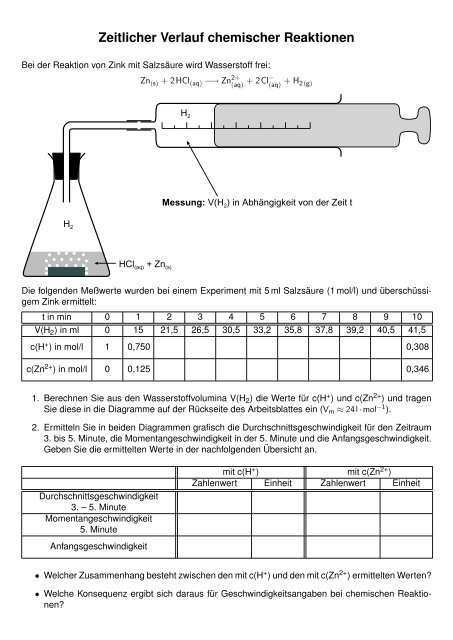
Bei <strong>de</strong>r Reaktion von Zink mit Salzsäure wird Wasserstoff frei:<br />
H 2<br />
Zn (s) + 2HCl (aq) −→ Zn 2+<br />
+ 2Cl−<br />
(aq) (aq) + H2(g) HCl (aq) + Zn (s)<br />
H 2<br />
Messung: V(H 2) in Abhängigkeit von <strong>de</strong>r Zeit t<br />
Die folgen<strong>de</strong>n Meßwerte wur<strong>de</strong>n bei einem Experiment mit 5 ml Salzsäure (1 mol/l) und überschüssigem<br />
Zink ermittelt:<br />
t in min 0 1 2 3 4 5 6 7 8 9 10<br />
V(H 2) in ml 0 15 21,5 26,5 30,5 33,2 35,8 37,8 39,2 40,5 41,5<br />
c(H + ) in mol/l 1 0,750 0,308<br />
c(Zn 2+ ) in mol/l 0 0,125 0,346<br />
1. Berechnen Sie aus <strong>de</strong>n Wasserstoffvolumina V(H 2) die Werte für c(H + ) und c(Zn 2+ ) und tragen<br />
Sie diese in die Diagramme auf <strong>de</strong>r Rückseite <strong>de</strong>s Arbeitsblattes ein (Vm ≈ 24l · mol −1 ).<br />
2. Ermitteln Sie in bei<strong>de</strong>n Diagrammen grafisch die Durchschnittsgeschwindigkeit für <strong>de</strong>n Zeitraum<br />
3. bis 5. Minute, die Momentangeschwindigkeit in <strong>de</strong>r 5. Minute und die Anfangsgeschwindigkeit.<br />
Geben Sie die ermittelten Werte in <strong>de</strong>r nachfolgen<strong>de</strong>n Übersicht an.<br />
Durchschnittsgeschwindigkeit<br />
3. – 5. Minute<br />
Momentangeschwindigkeit<br />
5. Minute<br />
Anfangsgeschwindigkeit<br />
mit c(H + ) mit c(Zn 2+ )<br />
Zahlenwert Einheit Zahlenwert Einheit<br />
• Welcher Zusammenhang besteht zwischen <strong>de</strong>n mit c(H + ) und <strong>de</strong>n mit c(Zn 2+ ) ermittelten Werten?<br />
• Welche Konsequenz ergibt sich daraus für Geschwindigkeitsangaben bei chemischen <strong>Reaktionen</strong>?
c(H + ) in mol/l<br />
c(Zn 2+ ) in mol/l<br />
1,00<br />
0,80<br />
0,60<br />
0,40<br />
0,20<br />
0,30<br />
0,20<br />
0,10<br />
0,00<br />
0 2 4 6 8 10<br />
t in min<br />
0 2 4 6 8 10<br />
t in min