Herstellen elektrokompetenter E. coli
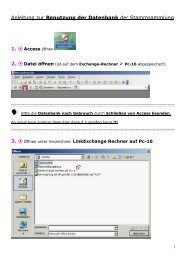
Herstellen elektrokompetenter E. coli
Herstellen elektrokompetenter E. coli
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
Herstellung Elektrokompetenter Zellen<br />
- Animpfen einer 10ml Übernachtkultur mit E.<strong>coli</strong> BL21 codon plus RIL (Stratagene) in<br />
LB Medium, am nächsten Morgen Messen der Optischen Dichte (OD) bei 600 nm<br />
- Animpfen von 2x 250 ml LB (in 1000 ml EM, vorgewärmt auf 37 o C) mit soviel von der<br />
Übernachtkultur, dass die OD 0.01 beträgt (typischerweise eine 1:200 Verdünnung)<br />
- bei 37 o C im Schüttler wachsen lassen für 5-6 Verdoppelungen, 3-4 h, bis die OD 0.5-1.0<br />
beträgt<br />
- in dieser Zeit alles Material für das weitere Arbeiten vorkühlen, die Waschlösung, die<br />
Zentrifugenflaschen und –röhrchen. Die 1,5 ml Mikrotubes für die fertigen<br />
elektrokompetenten Zellen bei –20 o C einfrieren<br />
- ungefähr eine Stunde bevor die Kulturen soweit sind, die Glycerinlösung in Eis stellen,<br />
das Eis seitlich ein wenig anhäufeln, die Flasche von Zeit zu Zeit schwenken, damit die<br />
Lösung wirklich gut durchgekühlt ist, alle Zentrifugenflaschen und –röhrchen ebenfalls<br />
ins Eis stellen, darauf achten, dass der Rotor ebenfalls 4 o C hat<br />
- wenn die Bakterienkultur die gewünschte OD hat die Kultur im Erlenmeyerkolben auf<br />
Eis stellen und durch Schütteln die Bakterienkultur schockkühlen, erst dann in gekühlte<br />
Zentrifugenbecher überführen<br />
- abzentrifugieren (RC-3B, H6000A, 3000 UpM, 4 o C, 15 min), Überstand abgiessen<br />
- Niederschlag in 250 ml kalter, steriler Glycerinlösung aufnehmen, dazu Pellet erst in<br />
wenig Glycerinlösung durch Auf- und Abpipettieren in 10 ml Glaspipette lösen,<br />
anschliessend restliche Lösung dazugeben<br />
- abzentrifugieren (Parameter wie gehabt), Waschlösung abgießen<br />
- Pellet erneut in 250 ml kalter, steriler Glycerinlösung suspendieren<br />
- abzentrifugieren (Parameter wie gehabt), Waschlösung abgießen<br />
- Bakterienpellet in 20 ml kalter, steriler Glycerinlösung suspendieren, mit kalter Pipette<br />
in 50 ml Zentrifugenröhrchen überführen
- abzentrifugieren (Parameter wie gehabt), Waschlösung abgießen<br />
- den Niederschlag in 1 ml kalter, steriler Glycerinlösung resuspendieren, es soll eine<br />
schöne, gleichmäßige Suspension entstehen, diese dann in die vorgekühlten Mikrotubes<br />
in 40 µl Portionen aufteilen, in flüssigem Stickstoff schockgefrieren und bei –80 o C<br />
aufbewahren<br />
Sterile Lösungen und Gerätschaften:<br />
500 ml Zentrifugenflaschen, 50 ml Zentrifugenröhrchen, 10ml Glaspipetten, 1,5 ml<br />
Micro-tubes,<br />
1000 ml 10% Glycerin in H 2 O<br />
10 ml LB in 100er EM für die Übernachtkultur<br />
2x 250 ml LB in 1000er EM für die Hauptkultur<br />
Bei der Messung der OD sollte bei Werten über 1.0 immer eine Verdünnung gemacht werden<br />
und zwar so lange, bis der Messwert unter 1.0 liegt. Nur in diesem Bereich gilt die lineare<br />
Beziehung zwischen Extinktion und Konzentration. Bei der Berechnung dann den<br />
Verdünnungsfaktor berücksichtigen.