2Diss_Jaskulsky_Mathis.pdf
2Diss_Jaskulsky_Mathis.pdf
2Diss_Jaskulsky_Mathis.pdf
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
48<br />
5.4 Laborwerte<br />
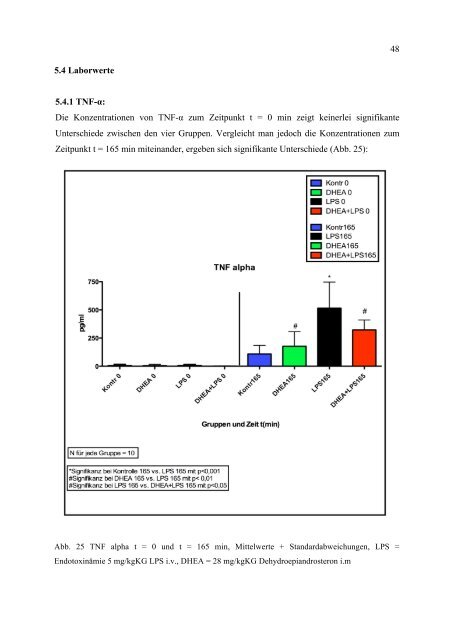
5.4.1 TNF-α:<br />
Die Konzentrationen von TNF-α zum Zeitpunkt t = 0 min zeigt keinerlei signifikante<br />
Unterschiede zwischen den vier Gruppen. Vergleicht man jedoch die Konzentrationen zum<br />
Zeitpunkt t = 165 min miteinander, ergeben sich signifikante Unterschiede (Abb. 25):<br />
Abb. 25 TNF alpha t = 0 und t = 165 min, Mittelwerte + Standardabweichungen, LPS =<br />
Endotoxinämie 5 mg/kgKG LPS i.v., DHEA = 28 mg/kgKG Dehydroepiandrosteron i.m
49<br />
5.4.2 Interferon-γ<br />
Wie aus Abb. 26 zu ersehen ist, war die Konzentration der Interferon-γ Konzentration zum<br />
Beginn des Versuchs unterhalb der Nachweisgrenze. Zum Zeitpunkt t = 165 min<br />
unterschieden sich folgende Gruppen voneinander: Kontrolle vs. DHEA+LPS mit p
50<br />
5.4.3 Interleukin-1 α<br />
Bei der Konzentration von Interleukin-1α zeigen sich signifikante Unterschiede folgender<br />
Gruppen zum Zeitpunkt t = 165 min: Kontrolle vs. LPS, Kontrolle vs. DHEA+LPS, DHEA<br />
vs. LPS, DHEA+LPS vs. LPS, jeweils mit p
51<br />
5.4.4 Granulocyte macrophage colony-stimulating factor (GM-CSF)<br />
Die GM-CSF Konzentration unterscheidet sich signifikant zum Zeitpunkt t = 165 min<br />
zwischen der Kontrollgruppe und der DHEA+LPS-Gruppe (p
52<br />
5.4.5 Interleukin-4<br />
Zum Zeitpunkt t = 0 gab es in der Konzentration des Interleukin-4 zwischen den Gruppen<br />
keinerlei Unterschiede. Jedoch zum Zeitpunkt t = 165 unterschieden sich die Kontrollgruppe<br />
gegen die LPS-Gruppe (p
53<br />
5.4.6 Laktat<br />
Die Bestimmung des Laktats aus dem arteriellen Blut zeigt, dass die LPS-Gruppe bei der<br />
zweiten Blutentnahme t = 165 min gegenüber allen anderen 3 Gruppen einen signifikant<br />
höheren Laktatwert aufweist, jeweils ist p
54<br />
6 Diskussion<br />
6.1 Temperatur<br />
Während des Experimentes kam es, auch unter Berücksichtigung der Temperaturregulierung<br />
durch die Wärmematte, in den verschiedenen Gruppen zu signifikant unterschiedlichen<br />
Temperaturverläufen: Sowohl die beiden nicht endotoxämischen Gruppen als auch die<br />
Kombinationsgruppe aus DHEA+LPS unterschieden sich zum Zeitpunkt t = 165 min in<br />
signifikantem Ausmaß von der LPS-Gruppe. Dies zeigt zum einen, dass der Temperaturanstieg<br />
durch das verabreichte Endotoxin verursacht wurde, zum anderen aber auch deutlich,<br />
dass DHEA in diesem Versuchsablauf in der Lage war, diesen Temperaturanstieg zu<br />
verhindern. Barckhausen et al. 4 veröffentlichten eine Arbeit, in der ebenfalls ein Effekt der<br />
DHEA-Behandlung auf die Temperatur der dort untersuchten Mäuse beobachtet wurde. Bei<br />
diesen Experimenten wurde jedoch ein verminderter Temperaturabfall im Rahmen einer CLP<br />
Sepsis (Cecal ligation and puncture) beobachtet.<br />
6.2 Herzfrequenz<br />
Die Herzfrequenz zeigt in den verschiedenen Gruppen variable Verläufe, die sich durch die<br />
LPS-Gabe erklären lassen. Wie in der Arbeit von Hsu et al. 34 beschrieben wird, kommt es<br />
durch LPS-Gabe zu einem Herzfrequenzanstieg. Gleiches konnte auch in dieser Arbeit<br />
nachgewiesen werden. DHEA-Therapie konnte keine Senkung der Herzfrequenz gegenüber<br />
der LPS-Gruppe herbeiführen. Der Anstieg der Herzfrequenz bei Endotoxämie ist eine<br />
Reflextachykardie, die durch eine sympathoadrenerge Gegenregulation auf Grund des<br />
gesunkenen MAP`s zustande kommt. Hierdurch versucht der Organismus einem sinkenden<br />
Herzminutenvolumen, ausgelöst durch einen sinkenden MAP, entgegenzuwirken. Die<br />
Kontrolltiere, welche ausschließlich DHEA erhielten, zeigten einen Trend zur Reduktion der<br />
Tachykardie.<br />
6.3 Mittlerer Arterieller Blutdruck<br />
Wie im vorherigen Abschnitt erläutert wurde, kam es bei den Experimenten dieser Arbeit zu<br />
teils starken Absenkungen des mittleren arteriellen Blutdrucks (MAP) sowie zu einer dadurch<br />
ausgelösten Reflextachykardie. Bereits in verschiedenen Arbeiten konnte aufgezeigt werden,<br />
dass eine Endotoxämie zu einem signifikanten Abfall des MAP führt 6,17,42,43,54,66 .<br />
Auch in dieser Arbeit wurden zwischen der Kontrollgruppe und der LPS-Gruppe<br />
signifikante Unterschiede festgestellt: Wie aus Abb. 11 ersichtlich ist fällt der Blutdruck der
55<br />
Kontrollgruppe signifikant geringer als der der LPS-Gruppe. Panayiotou et al. 54 untersuchten<br />
einen möglichen Zusammenhang einer LPS-Applikation bei Mäusen mit einer Plasma-NO-<br />
Konzentrationserhöhung. Auch wenn die klassischen Mediatoren des Sepsisgeschehens<br />
Zytokine sind, gibt es eine Vielzahl von Protein- und Lipidmediatoren, die zusätzlich<br />
freigesetzt werden. Solche sekundären Mediatoren oder Effektoren sind unmittelbar für die<br />
funktionellen und strukturellen Schäden verantwortlich. Hierzu zählt Stickstoffmonoxid<br />
(NO). Zudem fand Mailman heraus, dass abdominelle vagale Afferenzen an der frühen LPSinduzierten<br />
Hypotension beteiligt sind 37 . Beides könnte für die auch in dieser Arbeit<br />
gefundenen hypotensiven Werte verantwortlich sein. Wie verändert die Applikation von<br />
DHEA sowohl ohne als auch in Kombination mit einer LPS-Gabe den mittleren arteriellen<br />
Blutdruck? Pavlovic et al. 56 postulierten eine potentielle vasodilatierende Wirkung von DHEA<br />
in Rattenarterien. Verantwortlich hierfür ist eine Aktivierung der endothelialen Nitrit-Oxid-<br />
Synthase (eNOS) nach Bindung des DHEA an einen Steroid spezifischen, G-Protein<br />
gekoppelten Rezeptor.<br />
Eine solche vasodilatierende Wirkung konnte während der Experimente dieser Arbeit<br />
nicht beobachtet werden. Der MAP-Abfall in der DHEA+LPS-Gruppe erfolgt ähnlich schnell<br />
und drastisch wie in der LPS-Gruppe, jedoch erholten sich die Tiere schneller von dieser<br />
Kreis-laufdepression (keine statistische Signifikanz). Die Tiere der DHEA-Gruppe wiesen<br />
über den beobachteten Zeitraum den stabilsten Blutdruckverlauf auf. Dies ist möglicherweise<br />
auf eine DHEA-induzierte Katecholaminfreisetzung (Noradrenalin und Dopamin) zurückzuführen,<br />
welche durch Charalampopoulos und Kollegen postuliert wurde 16 .<br />
6.4 Leukozytenadhärenz<br />
Dass Endotoxin zu einer Zunahme der Anzahl adhärenter Leukozyten führt, ist hinlänglich<br />
bekannt und wurde durch zahlreiche Arbeiten belegt 7-9,59+60 . Auch in dieser Arbeit konnte eine<br />
Abnahme der temporär mit dem Endothel interagierenden Leukozyten gefunden werden.<br />
Dieses Ergebnis zeigte sich sowohl in Venolen 1. Grades als auch in Venolen 3. Grades.<br />
Lediglich in den Venolen 1. Grades konnte ein erhöhter Rolling-flow der DHEA-Kontroll-<br />
Gruppe gegenüber der Kontrollgruppe beobachtet werden. Eine Zunahme der Anzahl der<br />
temporär mit dem Endothel interagierenden Leukozyten durch DHEA in Kombination mit<br />
LPS konnte nicht gezeigt werden. Ayhan et al. 3 sowie Barkhausen et al. 5 konnten zeigen, dass<br />
DHEA zu einer Reduktion der Adhäsionsfaktoren und somit zu einer Reduktion der Leukozytenrekrutierung<br />
führt. Verantwortlich hierfür ist eine verminderte Expression von<br />
Adhäsionsmolekülen auf den Leukozyten durch DHEA (u.a. E-Selektin, CD-11b, CD-18,
56<br />
CD-44), aber auch die Expression von ICAM-1 und VCAM-1 als interzelluläre bzw.<br />
vaskuläre Adhäsionsmoleküle werden durch DHEA reduziert. Angenommen wird, dass<br />
DHEA durch eine Dephosphorilierung über eine Proteinphosphatase mehrere zelluläre<br />
Signaltrans-duktionen inhibiert. Zu diesen gehören unter anderem die Phosphoinositol-3-<br />
Kinase, die Mitogen-aktivierte Proteinkinase (MAPK) und die Glycogen-Synthase-Kinase 3,5 .<br />
Diese Effekte konnten in dieser Arbeit bei den Venolen 3. Grades aufgezeigt werden,<br />
hier war die Anzahl adhärenter Leukozyten sowohl in der DHEA-Kontroll-Gruppe als auch in<br />
der DHEA-LPS-Kombinationsgruppe signifikant reduziert. Ähnliche Trends zeigen sich in<br />
den Venolen 1. Grades, jedoch ohne Signifikanz.<br />
6.5 Funktionelle Kapillardichte<br />
Dem Gastrointestinaltrakt und vor allem dem Darm mit seiner Mukosa kommt in der<br />
Pathogenese der Sepsis eine herausragende Rolle zu 8-10,37,50,62,65,73 . Die intestinale funktionelle<br />
Kapillardichte ist von besonderer Bedeutung für den Verlauf der Sepsis. Im Rahmen einer<br />
Endotoxämie kommt es zur Abnahme der funktionellen Kapillardichte 9+10 . Hierfür sind<br />
mehrere Gründe verantwortlich:<br />
1. Durch das Kapillarleck kommt es zur Plasmaextravasation und somit zu einem<br />
Gewebeödem mit sich daraus ergebendem Druck auf die Kapillaren.<br />
2. Im septischen Schock kommt es zu einer Redistribution von Blut in vital wichtige<br />
Organe und somit zu einer Hypoperfusion der intestinalen Kapillaren.<br />
3. Im Rahmen einer disseminierten intravasalen Gerinnung (DIC) kann die funktionelle<br />
Kapillardichte reduziert werden.<br />
4. Durch eine vermehrte Leukozytenadhärenz kommt es zur Minderperfusion.<br />
5. Eine verminderte Verformbarkeit der Erythrozyten erschwert die Kapillarperfusion.<br />
Die Auswirkung verschiedenster Medikamente auf die durch Endotoxin<br />
beeinträchtigte Mikrozirkulation ist seit langem Bestandteil mehrerer Studien 26,27,62,65 .<br />
Unter anderem beschäftigte sich Birnbaum in einer seiner Arbeiten mit der Wirkung von<br />
Dopexamin auf den intestinal mikrovaskulären Blutfluss in einem Sepsismodell, in einer<br />
anderen Arbeit mit den Effekten des Koagulationsfaktors XIII auf die funktionelle<br />
Kapillardichte bei experimenteller Endotoxämie 9,10 . Kuebler et al. 37 beschäftigten sich, und<br />
das ist für diese Arbeit auf Grund der Stoffwechselnähe zu dem hier untersuchten DHEA<br />
besonders interessant, mit der Rolle von Estradiol auf die Perfusion des Splanchnikusgebietes
57<br />
bei Sepsis. Ayhan et al. 3 stellten fest, dass DHEA im Endotoxämiemodell die Leukozytenaktivität<br />
reduziert, die Geschwindigkeit der Erythrozyten erhöht und die Kapillarperfusion<br />
verbessert.<br />
Die Ergebnisse dieser Arbeit zeigen, dass DHEA die funktionelle Kapillardichte<br />
verbessert. Sowohl in der Lamina muskularis longitudinalis als auch in der Lamina<br />
muskularis circularis weist die DHEA+LPS-Gruppe signifikant weniger dysfunktionelle und<br />
nonfunktionelle Kapillaren auf, als die Endotoxämiegruppe. Zudem zeigt sich durch DHEA<br />
eine signifikante Reduktion der dysfunktionellen Kapillaren der Lamina mucosae. Dieser<br />
Effekt kann durch die Reduktion der Anzahl adhärenter Leukozyten erklärt werden, welche<br />
durch eine verminderte Expression von Adhäsionsmolekülen auf den Leukozyten zustande<br />
kommt (Kapitel 6.4). Eine mögliche mikrozirkulatorische Vasodilatation, welche durch<br />
Pavlovic et al. 56 nachgewiesen wurde und durch eine Aktivierung der endothelialen Nitrit-<br />
Oxid-Synthase (eNOS) nach Bindung des DHEA an einen Steroid spezifischen, G-Protein<br />
gekoppelten Rezeptor erklärbar ist, kann zu einer verbesserten Perfusion geführt haben.<br />
Möglicherweise hat DHEA auch antiödematöse Eigenschaften und vermag somit ebenfalls<br />
die funktionelle Kapillardichte zu verbessern.<br />
6.6 Zytokine<br />
Im Falle einer Sepsis werden Zytokine als Mediatoren des entzündlichen Geschehens<br />
freigesetzt 21,26,34,42,57,64,72,79 . Im Rahmen unserer Arbeit beschäftigten wir uns mit TNF-α,<br />
Interferon-γ, Interleukin-1 α, GM-CSF sowie Interleukin-4. Hier zeigt sich ein heterogenes<br />
Bild der Zytokinkonzentrationen. Unsere Ergebnisse sind größtenteils kongruent mit denen<br />
der existierenden Literatur und stimmen in der Vorstellung überein, dass es zu einer DHEAabhängigen<br />
Restoration der Immunantwort bei Sepsis kommt:<br />
TNF-α:<br />
Der Tumornekrosefaktor-α gilt als früher Mediator der Sepsis und ist bei experimenteller<br />
Endotoxinämie bereits nach wenigen Minuten nachweisbar. Hierdurch ist TNF-α ein idealer<br />
Indikator für die Sepsisinduktion.<br />
Gebildet wird er durch Monozyten, Makrophagen, T-Zellen, Neutrophile<br />
Granulozyten sowie NK-Zellen. Seine Produktion wird durch die Anwesenheit von IL-2,<br />
Interferon-γ und GM-CSF unterstützt, durch Interleukin-6, TGF-ß sowie PGE 2 jedoch<br />
inhibiert 39 . Die Zellbindung geschieht über spezielle Rezeptoren, welche eine Aktivierung
58<br />
von nukleären Faktoren (NF-κB, Transkriptionsfaktoren) sowie eine Expression von<br />
Adhäsionsmolekülen bewirken. Diese führen u.a. zur vermehrten Leukozytenadhärenz sowie<br />
zur Verstärkung der Zytokin-Expression. Neutrophile und Makrophagen/Monozyten steigern<br />
nach TNF-α-Stimulation die Phagozytose, die Produktion von Sauerstoffradikalen,<br />
degranulieren und setzen Enzyme frei 23 .<br />
Die Ergebnisse unserer Arbeit zeigen einen Konzentrationsanstieg von TNF-α bei<br />
experimenteller Endotoxinämie. Dieser ist unbestritten und durch diverse Arbeiten belegt 4,33 .<br />
Die signifikant höhere Konzentration der unbehandelten LPS-Gruppe ist als eindeutiger Beleg<br />
für die Sepsisinduktion zu werten. Den in den nicht-septischen Gruppen gesehenen Konzentrationsanstieg<br />
führen wir auf das operationsbedingte Trauma sowie den Stress der<br />
Versuchstiere zurück 74 .<br />
Unsere Arbeit zeigt einen Konzentrationsrückgang von TNF-α bei DHEA-<br />
Behandlung. Hildebrand und Kollegen 33 konnten aufzeigen, dass DHEA, in einem Model mit<br />
polymikrobieller Sepsis durch CLP, in der Lage ist die Konzentrationen von TNF-α zu<br />
senken. Die speziellen Rezeptoren Tumor-Nekrose-Faktor-Rezeptor-I und -II (TNF-RI und<br />
TNF-RII) scheinen hierfür verantwortlich zu sein. Jedoch konnte gezeigt werden, dass es<br />
ebenfalls in genmanipulierten TNF-Rezeptor Knockout-Mäusen zu einer Konzentrationsreduktion<br />
des TNF-α nach DHEA-Behandlung kam. Dies führt zu der Annahme, dass die<br />
DHEA-Wirkung durch weitere noch zu untersuchende Interaktionen geschieht.<br />
Barkhausen und Kollegen 4 konnten nachweisen, dass DHEA-Behandlung bei<br />
bestehender Endotoxinämie die mRNA-Expression des TNF-α reduziert. Also scheint ein<br />
weiterer Effekt der DHEA-Therapie in der transkriptionellen Modifikation der TNF-α<br />
Expression zu liegen.<br />
Weitere klinische Studien sind notwendig um den genauen molekularbiologischen<br />
Mechanismus der DHEA-Wirkung auf die TNF-α-Konzentration bei experimenteller Endotoxinämie<br />
herausfinden zu können.<br />
Interferon-γ<br />
Das Glykoprotein Interferon-γ wird durch natural killer-Cells (NK) und natural killer T<br />
(NKT)-Cells sowie von CD4 und CD8 zytotoxischen T-Lymphozyten (Effektorzellen, Th-1)<br />
nach Antigenkontakt produziert. Die Wirkung ist eine immunstimulierende durch Aktivierung<br />
der Makrophagen sowie durch Bildung reaktiver Sauerstoffradikale 68 . Interferon-γ fördert die<br />
LPS-induzierte NF-κB-Aktivierung und wirkt als Induktor der iNOS 32 , somit trägt es<br />
entscheidend zur Letalität bei Endotoxinämie bei.
59<br />
In unseren LPS-freien Gruppen zeigte sich über den gesamten Versuchsablauf kein<br />
Konzentrationsanstieg der IFN-γ Konzentration. Hingegen führte die Applikation von 5<br />
mg/kg LPS zu einer signifikanten Konzentrationszunahme des IFN-γ.<br />
Die Gabe des DHEA hatte auf diese Konzentration keinen Einfluss. Im Falle des IFNγ<br />
existieren in der Literatur keine Angaben zu molekularen Mechanismen und der genauen<br />
Wirkung. So zeigt sich in der Literatur ein uneinheitliches Bild: Choi 19 konnte zeigen, dass<br />
DHEA dosisabhängig zu einer Konzentrationssenkung des IFN-γ führt. Chang 15 hingegen<br />
wies einen Konzentrationsanstieg bei DHEA-Exposition nach; hier wurden jedoch nicht<br />
verschiedene, sondern lediglich eine Dosis von 200 mg/kg/d DHEA appliziert. Eine<br />
Konzentrationsreduktion proinflammatorischer Zytokine durch DHEAS über eine Inhibierung<br />
des inflammatorischen Transkriptionsfaktors NF-κB ist nachgewiesen 1 , genauso eine<br />
Reduktion des IFN-γ-Plasmaspiegels durch eine Inhibierung dieses Transkriptionsfaktors 41 .<br />
Vermutlich senkt DHEA über diesen Mechanismus die Produktion des IFN-γ, welches<br />
unter Berücksichtigung der weiteren Ergebnisse unserer Arbeit (Konzentrationssenkung<br />
anderer proinflammatorischer Zytokine) bei möglicherweise höherer DHEA-Dosis eine<br />
Konsequenz darstellen könnte. Der genaue molekulare Mechanismus verbleibt unklar, es<br />
bedarf weiterer experimenteller Studien um diesen bei experimenteller Endotoxinämie zu<br />
untersuchen.<br />
Interleukin-1α<br />
Interleukin-1α existiert zunächst als ProIL-1α intrazellulär und wird nach Zellschädigung<br />
durch extrazelluläre Proteasen zum Interleukin-1α gespalten. Über eine vermehrte Prostaglandinsynthese<br />
wird Fieber induziert, zudem ist IL-1α an der Chemotaxis von Leukozyten<br />
beteiligt und induziert Adhäsionsmoleküle.<br />
In den LPS-freien Gruppen unseres Experimentes konnte kein relevanter Anstieg der<br />
IL-1〈-Konzentrationen zum Zeitpunkt der zweiten Bestimmung registriert werden. Die endotoxinämischen<br />
Tiere wiesen zu diesem Zeitpunkt hingegen signifikant erhöhte Serumspiegel<br />
auf. Die Gabe des DHEA führte zu einem signifikanten Konzentrationsabfall des IL-1〈 im<br />
Vergleich zur Endotoxinämie-Gruppe.<br />
Mehrere Studien zeigen, dass das Vorhandensein einer Endotoxinämie zu einer<br />
Elevation der Interleukin-1α Genexpression führt 51 . Weitere Studien untersuchen die molekulare<br />
Wirkung des Interleukin-1α 25,70 : Unter anderem wirkt dieses Zytokin über eine Interaktion<br />
mit dem Toll-like-Rezeptor 2 (TLR-2), zudem ist eine Konzentrationserhöhung des<br />
Adhäsionsmoleküls ICAM-1 durch Interleukin-1α beschrieben, welches im Rahmen einer
60<br />
Endotoxinämie (Kapitel 6.4) zu einer Reduktion der mikrovaskulären Perfusion führen kann.<br />
DHEA-Therapie führt bei experimenteller Endotoxinämie zu einer signifikanten<br />
Reduktion der Interleukin 1-α-Konzentration im Vergleich zur LPS-Gruppe. Vergleichende<br />
Studien, die den molekularen Mechanismus der DHEA-Wirkung auf die IL-1〈−Konzentration<br />
beschreiben, existieren in der Literatur nicht. Möglicherweise können für diesen Effekt die im<br />
Zusammenhang mit dem IFN-γ gefundenen Mechanismen herangezogen werden.<br />
GM-CSF:<br />
Der Granulocyte macrophage colony-stimulating factor ist ein weiteres proinflammatorisches<br />
Zytokin und beeinflusst das Wachstum und die Differenzierung hämatopoetischer Vorläuferzellen.<br />
Es ist ein von T-Zellen, Makrophagen, Fibroblasten, Endothelzellen und vom<br />
Knochenmarkstroma produziertes Polypeptid.<br />
Zum Beginn unserer Arbeit stellten wir in allen Gruppen niedrige GM-CSF-<br />
Konzentrationen fest. Zum Ende des Versuchs war die Konzentration in den Endotoxinämie-<br />
Gruppen signifikant gesteigert. Die mit DHEA-behandelte Endotoxinämiegruppe weist die<br />
höchste Konzentration an GM-CSF zum Versuchsende auf.<br />
Eine Korrelation zwischen GM-CSF und dem Toll-like-Rezeptor 4 (TLR-4) ist<br />
beschrieben: Bozinovski et al. 12 wiesen nach, dass eine Neutralisation des GM-CSF über den<br />
Antikörper 22E9 zu einer Reduzierung der physiologischen Toll-like-Rezeptor 4-Expression<br />
führt. DHEA hingegen erhöht die mRNA-Expression der TLR-2 und 4 23 und so möglicherweise<br />
die Konzentration des GM-CSF. Das Vorhandensein einer Endotoxinämie scheint für<br />
diese Erhöhung Voraussetzung zu sein: die mit DHEA-behandelte Kontrollgruppe weist keine<br />
signifikante Konzentrationserhöhung zur Kontrollgruppe auf. Auch bezüglich des proinflammtorischen<br />
Zytokins GM-CSF sollten weitere Studien den genauen molekularen<br />
Mechanismus klären.<br />
IL-4:<br />
Das Interleukin-4 ist ein antiinflammatorisches Zytokin, welches von Mastzellen, basophilen<br />
Granulozyten sowie Th2-Zellen gebildet wird. Seine wesentliche Aufgabe besteht in der<br />
Ausdifferenzierung von naiven Th0-Zellen zu Th2-Zellen, des weiteren fördert es die<br />
Proliferation von T-Zellen, B-Zellen sowie Mastzellen. Eine Wirkung des Interleukin-4<br />
geschieht über eine Hemmung von Th1-Zellen, da diese über eine Interferon-γ Erhöhung<br />
Makrophagen aktivieren können.<br />
Caetano et al. 13 konnten zeigen, dass eine Endotoxinämie durch Trypanosoma cruzi zu
61<br />
einer Konzentrationserhöhung des Interleukin-4 führt. Gleiches ist in den Ergebnissen unserer<br />
Arbeit zu finden. Die Endotoxinämie-Gruppe weist zum Versuchsende die höchste IL-4-<br />
Konzentration auf. Dies ist dadurch zu erklären, dass während der systeischen Inflammation<br />
neben einer exzessiven Produktion und Freisetzung proinflammatorischer Zytokine auch<br />
antiinflammatorische Reaktionskaskaden mit deren Freisetzung von statten gehen 23 .<br />
Unsere Arbeit zeigt, dass DHEA zu einer signifikanten Konzentrationsreduktion des<br />
IL-4 nach 165 Minuten führt. DHEA scheint die T-helfer-Lymphozyten Balance der sich<br />
gegenseitig supprimierenden Zelllinien Th-1 und Th-2 zu modulieren 80 . Bezüglich des<br />
Interleukin-4 gibt es in der Literatur keine vergleichbaren Studien, die eine Klärung des<br />
molekularen Mechanismus bieten.<br />
6.7 Laktat<br />
In Skelettmuskel, Haut, Darmmukosa, Erythrozyten, Nieren und Gehirn werden zusammen<br />
etwa 0,7–1,3 mmol Laktat pro Stunde gebildet. Erhöhte Laktatspiegel werden häufig bei<br />
Endotoxinämie und Sepsis gemessen. Hierbei wird eine Hyperlaktatämie (2-5 mmol/l) von<br />
einer Laktatazidose (>5mmol/l) unterschieden 39 . Bei Darmischämie, Schock, aber auch bei<br />
Endotoxingabe können erhöhte Laktatwerte gemessen werden. Die Laktatdehydrogenase<br />
oxidiert Laktat zu Pyruvat und reduziert gleichzeitig NAD + zu NADH/H + .<br />
Auch wenn umstritten ist, ob die Elimination von Laktat bei Sepsis und MODS einen<br />
Benefit für die Genesung des Patienten erbringt, so gibt es dennoch Therapiekonzepte, bei<br />
denen NaHCO3 bei sehr niedrigen arteriellen pH Werten gegeben wird 58 .<br />
Ausschließlich die Tiere, die isoliert LPS erhielten wiesen zu diesem Zeitpunkt einen<br />
signifikant erhöhten Laktatspiegel, eine Hyperlaktatämie mit ca. 3 mmol/l, auf. Damit sind<br />
unsere Ergebnisse der Endotoxinämiegruppe kongruent mit denen der Versuchsreihe von<br />
Lehmann 39 , der bei Applikation von 5 mg/kg LPS nach 4 Stunden eine Hyperlaktatämie von<br />
3,5 mmol/l nachweisen konnte. Endotoxin selbst ist durch Stimulation der Glukose-<br />
Transporter-Protein-Synthese in der Lage die Glykolyse zu stimulieren und durch eine<br />
Hemmung der Pyruvatdehydrogenase die Laktatproduktion zu verstärken 14,20 .<br />
Beachtlich ist, dass es DHEA im Rahmen dieser Arbeit vermag den arteriellen<br />
Laktatspiegel zum Zeitpunkt der zweiten Blutentnahme, also t = 165 min, signifikant<br />
gegenüber der LPS-Gruppe zu senken. Arango et al. 2 wiesen in ihrem Versuch bei einem<br />
Ischämie-Reperfusions-Modell eine erniedrigte Konzentration des Enzyms Laktatdehydrogenase<br />
bei DHEA-Behandlung nach. Des weiteren erkannten sie eine schützende
62<br />
Funktion für die Membranintegrität-, -stabilität und -funktion, vermutlich ein antioxidativer<br />
Effekt. Die Entstehung und der Abbau von Laktat sind intrazelluläre Prozesse, welche bei<br />
Zellschädigung im Blut messbar werden.<br />
Übertragen auf die Darmmukosa würden die hier festgestellten niedrigeren Laktatwerte<br />
in der DHEA-behandelten Endotoxinämie Gruppe einen Zellschutz durch das DHEA<br />
vermuten lassen.<br />
6.8 Methodenkritik<br />
6.8.1 Versuchsmodell<br />
In der Literatur werden im wesentlichen zwei Modelle benutzt, um pathophysiologische<br />
Veränderungen wie bei klinischer Sepsis erzielen zu können 39 : Dazu gehören Modelle mit<br />
vitalen Infektionseregern, entweder von außen in den Organismus eingebracht oder innerhalb<br />
des Organismusses freigesetzt. Gegensätzlich hierzu existieren diverse Modelle mit der<br />
Verabreichung von Endotoxin (Lipopolysaccharid) gram-negativer-Bakterien. Modelle mit<br />
vitalen Infektionserregern kann man in vier Gruppen einteilen:<br />
1. Versuche mit Weichteilinfektionen als Sepsis-Fokus<br />
2. Implantation von Faeces oder lebenden Erregern in die freie Bauchhöhle, Simulation<br />
des klinischen Bildes einer Peritonitis<br />
3. Parenterale Applikation lebender Mikroorganismen, am häufigsten Escherichia coli<br />
4. CASP-Methode (Colon ascendens Stent-Peritonitis) oder CLP (cecal ligation an<br />
puncture)<br />
Im Rahmen dieser Arbeit wurden 5 mg/kgKG LPS gegeben. Die Auswirkungen der<br />
Endotoxinämie sind abhängig von der Dosierung des gegebenen LPS`. Eine Dosiserhöhung<br />
könnte deutlichere pathologische Werte hervorbringen und eventuell weitere Effekte der<br />
DHEA-Therapie signifikant werden lassen. Von weiterer Bedeutung ist, ob die<br />
Endotoxingabe bolusartig oder kontinuierlich erfolgt. Eine adäquate Volumentherapie hat in<br />
allen zu vergleichenden Gruppen zu erfolgen. Unter diesen Voraussetzungen liegt in der<br />
Vergleich-barkeit ein möglicher Vorteil der experimentellen Endotoxämie durch LPS. Ein<br />
weiterer Vorteil der LPS-Gabe ist, dass diese Methode zeitlich besser planbar ist als die<br />
CASP-Methode, bei der zwischen Chirurgie und Mikroskopie viele Stunden liegen müssen,
63<br />
um eine Peritonitis erzeugen zu können. Jedoch unterliegt auch das Endotoxin-Modell Einschränkungen:<br />
Bei LPS-Gabe wird lediglich ein Bakterienbestandteil appliziert und kein<br />
vollwertiges Bakterium, wobei hingegen im Rahmen des CASP-Modells die körpereigenen<br />
Bakterien des Versuchstieres zur Induktion der Sepsis dienen.<br />
Bei der CASP (Colon ascendens Stent-Peritonitis) oder CLP (cecal ligation and puncture)<br />
wird nach einer medianen Laparotomie ein Stent zwischen Darmlumen und Bauchhöhle<br />
gelegt und somit eine Peritonitis induziert. Dies mag einerseits das realistischere der beiden<br />
Verfahren sein und ähnelt somit stark dem klinischen Verlauf, da die Verletzung des Darmes<br />
eine entscheidende Rolle bei der Peritonitis spielt. Andererseits ist dieses Verfahren vom<br />
Operateur und dessen Fähigkeiten abhängig. Ein weiterer Nachteil stellt die schlechte<br />
Quantifizierbarkeit der genauen Dosis und Art sepsisauslösender Mikroorganismen dar.<br />
6.8.2 Applikationsweg und Dosierungen<br />
Die Applikation des hier verwendeten DHEA geschah in einer Dosierung von 28 mg/kgKG.<br />
Gelöst wurde das DHEA, welches in Pulverform vorlag, in 1 ml Flüssigkeit, bestehend aus<br />
0,7 ml Ethanol (da DHEA in NaCl ausfällt) und 0,3 ml NaCl, die Gabe erfolgte als<br />
Pretreatment intramuskulär, wobei die Tiere jeweils 0,1 ml in die Hinterläufe injiziert<br />
bekamen.<br />
Unter anderem Molinari et al. 48 konnten nachweisen, dass eine intravenöse<br />
Applikation von DHEA unmittelbare gefäßmodulierende Effekte aufweist. Daher entschieden<br />
wir uns in dieser Arbeit für die Gabe eines intramuskulären Depots, welches eine<br />
gleichmäßigere Freigabe des DHEA bewirkt und so vermag diese unmittelbaren Gefäßeffekte<br />
zu reduzieren. Jedoch könnte die gewählte Zeitspanne von 165 min für eine intramuskuläre<br />
Gabe relativ kurz sein, um eine maximale Freisetzung des DHEA und somit eine maximale<br />
systemische Wirkung zu erzielen.<br />
Auch Ethanol hat unmittelbare Eigenwirkungen: So führt es zur Vasodilatation von<br />
(Haut-) Gefäßen und kann somit zu einer Hypotension führen. In den 0,2 ml waren absolut<br />
0,14 g Ethanol enthalten. Auf das Gewicht einer Ratte (ca. 200 g) bezogen wären das<br />
demnach 0,7 g/kg und somit 49 g Ethanol auf einen 70 kg schweren Menschen über einen<br />
Zeitraum von 165 Minuten. Bei einem Ethanolabbau von ca. 1g/10kgKG/h würde ein 70 kg<br />
schwerer Mensch in etwa 7 Stunden benötigen, um die applizierte Ethanoldosis abzubauen.<br />
Auch wenn die Ethanoldosis in allen vier Gruppen identisch war, so ist zu vermuten, dass das<br />
Ethanol eine Eigenwirkung hatte. Weitere DHEA-Experimente mit und ohne Ethanol sollten
64<br />
folgen, um diese Eigenwirkung untersuchen zu können.<br />
6.8.3 Zeitablauf<br />
Der Versuchsablauf bei dieser Arbeit betrug 165 Minuten. Zu diskutieren sind die wichtigen<br />
Zeitpunkte im Rahmen dieser 165 Minuten:<br />
Die initiale Präparation (Intubation, Laparotomie) dauerte ca. 20 Minuten. Dieses<br />
Zeitfenster ist stark vom chirurgischen Geschick und der Erfahrung des Operateurs abhängig.<br />
Bereits die erste Blutentnahme erfolgte nach einem großen chirurgischen Trauma, welches<br />
einen Einfluss auf die gemessenen Parameter gehabt haben könnte. Die sich anschließende 90<br />
minütige Ruhephase war in allen vier Gruppen gleich und bietet ein standardisiertes<br />
Zeitfenster vor der Intravitalmikroskopie. Auch diese Ruhephase kann zeitlich variiert werden<br />
(z.B. verlängert) um die immunologischen und zellulären Akutfolgen des chirurgischen<br />
Traumas zu reduzieren.
65<br />
7 Zusammenfassung:<br />
Sepsis und der septische Schock sind trotz aller Fortschritte in der Intensivmedizin Haupttodesursachen<br />
auf nichtkardiologischen Intensivstationen in westlichen Ländern. Daher wird<br />
wissenschaftlich intensiv nach Möglichkeiten geforscht, um diese Letalität zu senken. In<br />
diesem Kontext wurden die Experimente zu dieser Arbeit durchgeführt.<br />
Diese Arbeit beschäftigt sich mit der Auswirkung von DHEA auf die intestinale Leukozytenaktivierung<br />
und Kapillarperfusion, die Zytokinfreisetzung sowie auf klinische Parameter von<br />
Ratten mit experimenteller Endotoxinämie 39 .<br />
Zu diesem Zweck wurden vier Gruppen gebildet (n = 40, 10 Tiere pro Gruppe): eine<br />
Kontrollgruppe, eine DHEA-Gruppe, eine LPS-Gruppe und eine DHEA+LPS-Gruppe. Das<br />
DHEA wurde als Pretreatment 2,5 Stunden vor der Intravitalmikroskopie i.m. verabreicht.<br />
Beobachtet wurde die Auswirkung der verabreichten Substanzen auf die Leukozytenadhäsion<br />
in Venolen 1. und 3. Grades und die Perfusion der longitudinalen und zirkulären Darmgefäße<br />
sowie die Perfusion der Mukosazotten. Zudem erfolgte zu den Zeitpunkten t = 0 min und t =<br />
165 min eine Bestimmung der Zytokine TNF-α, Interferon-γ, Interleukin-1 α, GM-CSF<br />
(Granolocyte macrophage colony-stimulating factor), Interleukin-4 sowie eine Bestimmung<br />
des Laktatwertes. Während des gesamten Versuchsablaufs erfolgte eine Dokumentation der<br />
Vitalparameter. Die DHEA-Dosis von 28 mg/kgKG wurde intramuskulär appliziert. Das<br />
Endotoxin (LPS von E.coli) wurde in einer Dosierung von 5 mg/kgKG intravenös verabreicht.<br />
Die Auswertung der Ergebnisse hat gezeigt, dass die Temperatur der DHEA+LPS-<br />
Gruppe sowie der DHEA-Gruppe zum Zeitpunkt t = 165 min (definierter Endpunkt)<br />
signifikant niedriger war, als die der LPS-Gruppe.<br />
Im Rahmen einer Endotoxinämie kommt es durch eine Freisetzung von Adhäsionsmolekülen<br />
zur Interaktion von Leukozyten mit dem Endothel und somit zur Adhärenz. Dieses<br />
Ergebnis zeigte sich sowohl in Venolen 1. Grades als auch in Venolen 3. Grades. Die<br />
Leukozytenadhärenz war in beiden Endotoxingruppen, in Venolen 1. Grades und in Venolen<br />
3. Grades, zur Kontrollgruppe signifikant erhöht. Die DHEA+LPS-Gruppe weist signifikant<br />
weniger adhärente Leukozyten in Venolen 3. Grades auf, als die LPS-Gruppe. Ähnliche<br />
Trends zeigen sich in den Venolen 1. Grades.<br />
Dem Gastrointestinaltrakt und vor allem dem Darm mit seiner Mukosa kommt in der<br />
Pathogenese der Sepsis eine herausragende Rolle zu. Im Rahmen einer Endotoxinämie kommt<br />
es zur Abnahme der funktionellen Kapillardichte. Die Ergebnisse dieser Arbeit zeigen, dass<br />
DHEA die funktionelle Kapillardichte verbessert. Sowohl in der Lamina muskularis<br />
longitudinalis als auch in der Lamina muskularis circularis weist die DHEA+LPS-Gruppe
66<br />
signifikant weniger dysfunktionelle und nonfunktionelle Kapillaren auf, als die Endotoxinämiegruppe.<br />
Zudem zeigt sich durch DHEA eine signifikante Reduktion der<br />
dysfunktionellen Kapillaren der Lamina mucosae.<br />
Die DHEA-Therapie ist bei experimenteller Endotoxinämie in der Lage, zu einer<br />
signifikanten Reduktion der Interleukin 1-α-Konzentration im Vergleich zur LPS-Gruppe zu<br />
führen. Ein ähnlicher Trend zeigt sich bei TNF-α.<br />
Eine weitere signifikante Reduzierung zeigt sich bei der Konzentration des Laktats<br />
zum Zeitpunkt der zweiten arteriellen Blutentnahme: DHEA reduziert die Laktatkonzentration<br />
auch in der DHEA+LPS-Kombinationsgruppe. Weitere experimentelle und klinische Studien<br />
sind notwendig, um die Bedeutung des DHEA in der Sepsis aufzuklären.
67<br />
8 Literaturverzeichnis<br />
1. Altman R, Motton DD, Kota RS, Rutledge JC; Inhibition of vascular inflammation by<br />
dehydroepiandrosterone sulfate in human aortic endothelial cells: roles of PPARalpha<br />
and NF-kappaB; Vascul Pharmacol 2008; 48:76-84<br />
2. Arango M, Parola S, Brignardello E, Mauro A, Tamagno E, Manti R, Danni O,<br />
Boccuzzi G; Dehydroepiandrosterone prevents oxidative injury induced by transient<br />
ischemia/reperfusion in the brain of diabetic rats; Diabetes 2000; 49:1924-31<br />
3. Ayhan S, Tugay C, Norton S, Areano B, Siemonow M; Dehydroepiandrosterone<br />
protects the microcirculation of muscle flaps from ischemia-reperfusion injury by<br />
reducing the expression of adhesion molecules; Plast Reconstr Surg 2003; 111:2286-<br />
94<br />
4. Barkhausen T, Hildebrand F, Krettek C, van Griensven M; DHEA-dependent and<br />
organ-specific regulation of TNF-alpha mRNA expression in a murine polymicrobial<br />
sepsis and trauma model; Crit Care Med 2009; 13:R114<br />
5. Barkhausen T, Westphal BM, Pütz C, Krettel C, v. Griensven M; Dehydroepiandrosterone<br />
administration modulates endothelial and neutrophil adhesion<br />
molecule expression in vitro; Crit Care Med 2006; 10:R109<br />
6. Bermejo A, Zarzuelo A, Duarte J; In vivo vascular effects of genistein on a rat model<br />
of septic shock induced by lipopolysaccharide; J Cardiovasc Pharmacol; 2003;<br />
42:329-38<br />
7. Birnbaum J, Lehmann Ch, Klotz E, Hein OV, Blume A, Jubin F, Polze N, Luther D,<br />
Spies CD; Effects of N-acetylcysteine and tirilazad mesylate on intestinal functional<br />
capillary density, leukocyte adherence, mesenteric plasma extravasation andcytokine<br />
levels in experimental endotoxemia in rats; Clin Hemorheol Microcirc 2008; 39:99-<br />
111<br />
8. Birnbaum J, Klotz E, Spies CD, Hein OV, Mallin K, Kawka R, Ziemer S, Lehmann C;<br />
The combinations C1 esterase inhibitor with coagulation factor XIII and N-<br />
acetylcysteine with tirilazad mesylate reduce the leukocyte adherence in an<br />
experimental endotoxemia in rats; Cin Hemorheol Microcirc 2008; 40:167-76<br />
9. Birnbaum J, Klotz E, Spies CD, Lorenz B, Stuebs P, Hein OV, Gründling M, Pavlovic<br />
D, Usischenko T, Wendt M, Kox WJ, Lehmann C; Effects of dopexamine on the<br />
intestinal microvascular blood flow and leukocyte activation in a sepsis model in rats;<br />
Crit Care Med 2006; 10:R117<br />
10. Birnbaum J, Hein OV, Lührs C, Rückbeil O, Spies C, Ziemer S, Gründling M,
68<br />
Usischenko T, Meissner K, Pavlovic D, Kox WJ, Lehmann C; Effects of coagulation<br />
factor XIII on intestinal functional capillary density, leukocyte adherence and<br />
mesenteric plasma extravasation in experimental endotoxemia; Crit Care Med 2006;<br />
10:R29<br />
11. Bone RC; Sir Isaak Newton, sepsis, SIRS, and CARS, Crit Care Med 1996; 24:1125-<br />
1128<br />
12. Bozinovski S, Jones J, Beavitt SJ, Cook AD, Hamilton JA, Anderson GP; Innate<br />
immune responses to LPS in mouse lung are suppressed an reversed by neutralization<br />
of GM-CSF via repression of TLR-4; Am J Physiol Lung Cell Mol Physiol 2004;<br />
286:L877-85<br />
13. Caetano LC, Brazao V, Filipin Mdel V, Santello FH, Toldo MP, Caldeira JC, do Prado<br />
JC Jr.; Corticosterone evaluation in Wistar rats infected with the Y strain of<br />
Trypanosoma cruzi during the chronic phase; Exp Parasitol 2011; 127:31-5<br />
14. Cain SM, Curtis SE; Systemic and regional oxygen uptake and lactate flux in<br />
endotoxic dogs resuscitated with dextran and dopexamine or dextran alone; Circ<br />
Shock 1992; 38:173-181<br />
15. Chang DM, Chu SJ, Chen HC, Kuo SY, Lai JH; Dehydroepiandrosterone suppresses<br />
Interleukin 10 synthesis in women with systemic lupus erythematosus; Ann Rheum<br />
Dis 2004; 63:1623-1626<br />
16. Charalampopoulos I, Dermitzaki E, Vardouli L, Tsatsanis C, Stournaras C, Margioris<br />
AN, Gravanis A; Dehydroepiandrosterone sulfate and allopregnanolone directly<br />
stmulate catecholamine production via induction of thyrosine hydroxylase and<br />
secretion by affecting actin polimerization; Endocrinology 2005; 146:3309-18<br />
17. Chiao CW, Lee SS, Wu CC, Su MJ; Thaliporphine increases survival rate and<br />
attenuates multiple organ injury in LPS-induced endotoxämia; Naunyn Schmiedebergs<br />
Arch Pharmacol 2005; 371:34-43<br />
18. Chieveley-Williams S, Hamilton-Davis C; The role of the gut in major surgical<br />
postoperative morbidity; Int Anesthesiol Clin 1999; 37:81-110<br />
19. Choi IS, Cui Y, Koh YA, Lee HC, Cho YB, Won YH; Effects of dehydroepiandrosterone<br />
on Th2 cytokine production in peripheral blood mononuclear cells<br />
from asthmatics; Korean J Intern Med 2008; 23:176–181<br />
20. Curtis SE, and Cain SM; Regional and systemic oxygen delivery/uptake relations and<br />
lactate flux in hyperdynamic, endotoxin-treated dogs; Am Rev Respir Dis 1992;<br />
145:348-354
69<br />
21. Danenberg HD, Ben-Yehuda A, Zakay-Rones Z, Gross DJ, Friedman G; Dehydroepiandrosterone<br />
treatment is not beneficial to the immune response to influenza in<br />
elderly subjects; J Clin Endocrinol Metab 1997; 82:2911-4<br />
22. Dellinger RP, Carlet JM, Masur H; Surviving sepsis Campaign guidelines for<br />
management of severe sepsis and septic shock; Crit Care Med 2008; 34:783-5<br />
23. Dinarello CA; Proinflammatory and anti-inflammatory cytokines as mediators in the<br />
pathogenesis of septic shock. Chest 1997; 112:321-29<br />
24. Engel C, Brunkhorst FM, Bone HG, Brunkhorst R, Gerlach H, Grond S, Gruendling<br />
M, Huhle G, Jaschinski U, John S, Mayer K, Oppert M, Olthoff D, Quintel M,<br />
Ragaller M, Rossaint R, Stuber F, Weiler N, Welte T, Bogatsch H, Hartog C,<br />
Loeffler M, and Reinhart K; Epidemiology of sepsis in Germany: results from a<br />
national prospective multicenter study; Intensive Care Med 2007; 33:606-618<br />
25. Essani NA, Fisher MA, Farhood A, Manning AM, Smith CW, Jaeschke H; Cytokineinduced<br />
upregulation of hepatic intercellular adhesion molecule-1 messenger RNA<br />
expression and its role in the pathophysiology of murine endotoxine shock and acute<br />
liver failure; Hepatology 1995; 21:1632-9<br />
26. Foitzik T, Kruschewski M, Kroesen AJ, Hotz HG, Eibl G, Buhr HJ; Does glutamine<br />
reduce bacterial translocation? A study in two animal models with impaires gut<br />
barrier; Int J Colorectal Dis 1999; 14:143-9<br />
27. Frey L, Kesel K; Significance of perfusion of the gastrointestinal tract in shock;<br />
Anaesthesist 2000; 49:446-50<br />
28. Galdo M, Gregonis J, Fiore CS, Compagnone NA; Dehydroepiandrosterone<br />
biosythesis, role and mechanism of action in the developing neural tube; Front<br />
Endocrinol 2012; 3:16<br />
29. Genazzani AR, Pluchino N; DHEA therapy in postmenopausal women: the need to<br />
move forward beyond the lack of evidence; Climacteric 2010; 13:314-316<br />
30. Hahner S, Allolio B; Deydroepiandrosterone to enhance physical performance: myth<br />
and reality; Endocrinol Merab Clin North Am 2010; 39:127-139<br />
31. Hazeldine J, Arlt W, Lord JM; Dehydroepiandrosterone as a regulator of immune cell<br />
function; Steroid Biochem Mol Biol 2010; 120:127-136<br />
32. Held TK, Weihua X, Yuan L, Kalvakolanu DV, and Cross AS; Gamma interferon<br />
augments macrophage activation by lipopolysaccharide by two distinct mechanisms,<br />
at the signal transduction level and via an autocrine mechanism involving tumor<br />
necrosis factor alpha and interleukin-1; Infect Immun 1999; 67: 206-212
70<br />
33. Hildebrand F, Pape HC, Harwood P, Wittwer T, Krettek C, van Griensven M; Are<br />
alterations of lymphocyte subpopulations in polymicrobial sepsis and DHEA treatment<br />
mediated by the tumor necrosis factor (TNF)-α receptor (TNF-RI)? A study in TNF-RI<br />
(TNF-RI -/- ) knock-out rodents; Clin Exp Immunol 2004; 138:221-229<br />
34. Hsu BG, Yang FL, Lee RP, Peng TC, Chen HI; Effects of post-treatment with lowdose<br />
propofol on inflammatory responses to lipopolysaccharide-induced schock in<br />
concious rats; Clin Exp Pharmacol Physiol 2005; 32:24-9<br />
35. Idkowiak J, Lavery GG, Dhir V; Premature adrenarche – novel lessons from early<br />
onset androgen excess; Eur J Endocrinol 2011; 165:189-207<br />
36. Kretz FJ, Schäffer J; Anästhesie, Intensivmedizin, Notfallmedizin, Schmerztherapie;<br />
5. Auflage; Springer Medizin Verlag Heidelberg; 2008:365<br />
37. Kuebler JF, Jarrar D, Toth B, Bland KI, Rue L, Wang P, Chaudry IH; Estradiol<br />
admission improves splanchnic perfusion following trauma-hemorrhage and sepsis;<br />
Arch Surg 2002; 137:74-9<br />
38. Lazaridis I, Charalampopoulos I, Alexaki VI; Neurosteroid Dehydroepiandrosterone<br />
interacts with Nerve Growth Factor (NFG) receptors, preventing neuronal apoptosis;<br />
PloS Biol 2011; 9(4):e1001051, Abstract<br />
39. Lehmann C; Tierexperimentelle Untersuchungen zur intestinalen Mikrozirkulation bei<br />
Endotoxinämie; Habilitationsschrift zu Erlangung der Lehrfähigkeit für das Fach<br />
Anästhesiologie; Berlin: Medizinische Fakultät Charité der Humboldt-Universität zu<br />
Berlin; 2000<br />
40. Liu, Dillon; Dehydrowpiandrosterone activates endothelial cell nitric-oxide synthase<br />
by a specific plasma membrane receptor coupled to alpha i2,3; J Biol Chem; 2002;<br />
277:211379-88<br />
41. Liu SF, and Malik AB; NF-kappa B activation as a pathological mechanism of septic<br />
shock and inflammation. Am J Physiol Lung Cell Mol Physiol 2006; 290:622-645<br />
42. Lo YC, Tsai PL, Huang YB, Shen KP, Tsai YH, Wu YC, Lai YH, Chen IJ; San-<br />
Huang-Xie-Xin-Tang reduces lipopolysaccharides-induced hypotension and<br />
inflammatory mediators; J Ethnopharmacol 2005; 96:99-106<br />
43. Lo YC, Wang CC, Shen KP, Wu BN, Yu KL, Chen IJ; Urgosedin inhibits<br />
hypotension, hypoglycämia, and proinflammatory mediators induced by<br />
lipopolysaccharide; J Cardiovasc Pharmacol 2004; 44:363-71<br />
44. Löffler G; Zellen und Organ – das endokrine System; In: Löffler Basiswissen<br />
Biochemie mit Pathobiochemie; 6. Auflage; Springerverlag Heidelberg; 2005:495-498
71<br />
45. Macphee IAM, Turner DR, Oliveira DBG; The role of endogenous steroid hormones<br />
in the generation of T helper 2-mediated autoimmunitiy in mercuric chloridetreated<br />
Brown-Norway rats; Immunology 2000; 99:141-146<br />
46. Mailman D., A role for abdominal vagal afferents in lipopolysaccharide-induced<br />
hypotension, Shock 2002; 18:177-81<br />
47. Mathias D.; Praxis für Laboratoriumsmedizin A-Z, Laborärztliche Arbeitsgemeinschaft<br />
für Diagnostik und Rationalisierung (LADR), 2005:331<br />
48. Molinari C, Battaglia A, Grossini E, Mary DA, Vassanelli C, Vacca G; The effect of<br />
dehydroepiandrosterone on regional blood flow in prepubertal anaesthetized pigs; J<br />
Physiol 2004; 557:307-19<br />
49. Moriguchi S, Yamamoto Y, Ikuno T; Sigma-1 receptor stimulation by dehydroepiandrosterone<br />
ameliorates cognitive impairment through activation of CaM kinase<br />
II, protein kinase C and extracellular signal-regulated kinase in olfactory bulbectomized<br />
mice; Neurochem 2011; 117:879-91<br />
50. Nadler EP, Ford HR; Regulation of bacterial translocation by nitric oxide; Pediatr<br />
Surg Int 2000; 16:165-8<br />
51. Nieto JE, MacDonald MH, Braim AE, Aleman M; Effect of lipopilysaccharide<br />
infusion on gene expression of inflammatory cytokines in normal horses in vivo;<br />
Equine Vet J 2009; 41:717-9<br />
52. Oberbeck R, Kobbe P; Dehydroepiandrosterone (DHEA): a steroid with multiple<br />
effects. Is there any possible option in th treatment of critical illness?; Curr Med Chem<br />
2010; 17:1039-1047<br />
53. O´Boyle CJ, Mac Fie J, Mitchell CJ, Johnstone D, Sagar PM, Sedman PC;<br />
Microbiology of bacterial translocation in humans; Gut 1998; 42:29-35<br />
54. Papanyiotou CM, Baliga R, Stdwill R, Taylor V, Singer M, Hobbs AJ; Resistance to<br />
endotoxic shock in mice lacking natriuretic peptide receptor-A; J Pharmacol 2010;<br />
160:2045-54<br />
55. Pavlovic D., Friehling H., Lauer KS., Bac VH. et al.; Thermostatic tissue platform for<br />
intrvital microscopy “the hanging drop model”, J Microsc.; 2006; 224:203-10<br />
56. Pavlovic D, Maskow J, Usischenko T,Wendt M; Dehydroepiandrosterone induces<br />
relaxation of human and rat bronchial smooth muscle and rat aorta; Eur Resp J, 2003;<br />
Vol. 22 Suppl-45:105s<br />
57. Reddy RC, Narala VR, Keshamouni VG, Milam JE, Newstead MW, Standiford TJ;<br />
Sepsis-induced inhibition of neutrophil chemotaxis is mediated by activation of
72<br />
peroxisome proliferator-activated receptor-gamma; Blood 2008; 112:4250-8<br />
58. Reinhart K, Brunkhorst FM, Bone HG, Bardutzky J, Dempfle CE, Forst H, Gastmeier<br />
P, Gerlach H, Gründling M, John S, Kern W, Kreymann G, Krüger W, Kujath P,<br />
Marggraf G, Martin J, Mayer K, Meier-Hellmann A, Oppert M, Putensen C, Quintel<br />
M, Ragaller M, Rossaint R, Seifert H, Spies C, Stüber F, Weiler N, Weimann A,<br />
Werdan K, Welte T; Prevention, diagnosis, treatment, and follow-up care of sepsis.<br />
First revision of the S2k Guidelines of the German Sepsis Society (DSG) and the<br />
German Interdisciplinary Association for Intensive and Emergency Care Medicine<br />
(DIVI); Anästhesist 2010; 59:347-70<br />
59. Richter J, Zhou J, Pavlovic D, Scheibe R, Bac VH, Blumenthal J, Hung O, Murphy<br />
MF, Whynot S, Lehmann C; Vancomycine and to lesser extent tobramycin have<br />
vasomodulatory effects in experimental endotoxemia in the rat; Clin Hemorheol<br />
Microcirc 2010; 46:37-49<br />
60. Rivera CA, Gaskin L, Singer G, Houghton J, Allman M; Western diet enhances<br />
hepatic inflammation in mice exposed to cecal ligation an puncture; BMC Physiol<br />
2010; 10:20<br />
61. Schmidt W, Schweppenhäuser W, Secchi A, Gebhard MM, Martin E, Schmidt H;<br />
Influence of epinephrine and norepinephrine on intestinal villous blood flow during<br />
endotoxemia. Crit Care Med 1999; 14:99-105<br />
62. Schmidt W, Tinelli M, Secchi A, Gebhard M, Martin E, Schmidt H; Influence of<br />
amrinone on intestinal villus blood flow during endotoxemia; Crit Care Med 2000;<br />
15:97-102<br />
63. Schmidt W, Tinelli M, Secchi A, Gebhard M, Martin E, Schmidt H; Milrinone<br />
improves intestinal villus blood flow during endotoxemia; Can J Anaesth 2000;<br />
47:673-9<br />
64. Schmidt M, Kreuz M, Löffler G, Schölmerich J, Straub RH; Conversion of<br />
dehydroepiandrosterone to downstream steroid hormones in macrophages; J<br />
Endocrinol 2000; 164:161-9<br />
65. Schmidt W, Tinelli M, Secchi A, Gebhard M, Martin E, Schmidt H; Enoximone<br />
maintains intestinal villus blood flow during endotoxemia; Int J Surg Investig 2001;<br />
2:359-67<br />
66. Shen KP, Lo YC, Yang RC, Liu HW, Chen IJ, Wu BN; Antioxidant eugenosedin-A<br />
protects against lipopolysaccharide-induced hypotension, hyperglycaemia and<br />
cytokine immunoreactivity in rats and mice; J Pharm Pharmacol 2005; 57:117-25
73<br />
67. Shufelt C, Bretsky P, Almeida CM; DHEA-S levels and cardiovascular disease<br />
mortality in postmenopausal women: results from the National Institutes of Health-<br />
National Heart, Lung, and Blood institutes (NHLNI)-sponsored Womens`s ischemia<br />
Evaluation; J Clin Endocrinol Metab 2010; 95:4985-92<br />
68. Schoenborn JR, Wilson CB; Regulation of interferon-gamma during innate and a-<br />
daptive immune responses; Immunol 2007; 96:41-101<br />
69. Schuster HP, Werdan K, Müller-Werdan U; Systematik der Therapie bei Sepsis und<br />
Multiorgandysfunktionssyndrom (MODS); In Sepsis und MODS; 4. Auflage; Springer<br />
Medizin Verlag Heidelberg, Berlin, New York; 2005:1-7<br />
70. Sebastiani G, Blais V, Sancho V, Vogel SN, Stevenson MM, Gros P, Lapointe JM,<br />
Rivest S, Malo D; Host immune response to Salmonella enterica serovar<br />
Typhimurium infection in mice derived from wild strains; Infect Immun 2002;<br />
70:1997-2009<br />
71. Sorwell KG, Urbanski HF; Dehydroepiandrosterone and age-related cognitive decline.<br />
Age 2010; 32:61-7<br />
72. Straub RH, Konecna L, Hrach S, Rothe G, Kreutz M, Schölmerich J, Falk W, Lang B;<br />
Serum dehydroepiandrosterone (DHEA) and DHEA sulfate are negatively correlated<br />
with serum interleukin-6 (IL-6) and DHEA inhibits IL-6 secretion from mononuclear<br />
cells in man in vitro: possible link between endocrinosenescence and immunosenescence;<br />
J Clin Endocrinol Metab 1998; 83:2012-7<br />
73. Swank GM, Deitch EA; Role of the gut in multiple organ failure: bacterial<br />
translocation and permeability changes; World J Surg 1996; 20:411-7<br />
74. von Bethmann AN, Brasch F, Nusing R, Vogt K, Volk HD, Muller KM, Wendel A,<br />
Uhlig S; Hyperventilation induces release of cytokines from perfused mouse lung; Am<br />
J Respir Crit Care Med 1998; 157:263-272<br />
75. Weigand MA, Bardenheuer HJ, Böttiger BW; Clinical management of patients with<br />
sepsis; Anästhesist 2003; 52:3-22<br />
76. Werdan K, Schuster HP, Müller-Werdan U; Abriß der Pathophysiologie als Grundlage<br />
der Therapie; In: Sepsis und MODS, 4. Auflage; Springer Medizin Verlag Heidelberg,<br />
Berlin, New York 2005:25-30<br />
77. Werdan K, Schuster HP, Müller-Werdan U; Abriß der Pathophysiologie als Grundlage<br />
der Therapie; In: Werdan Sepsis und MODS; 4. Auflage; Springer Medizin<br />
Verlag Heidelberg 2005:26-28<br />
78. Werdan K, Schuster HP, Müller-Werdan U; Abriß und Pathophysiologie als
74<br />
Grundlage der Therapie; In:Sepsis und MODS; 4. Auflage; Springer Medizin Verlag<br />
Heidelberg, Berlin, New York; 2005:44-46<br />
79. Wolkersdörfer GW, Lohmann T, Marx C, Schröder S, Pfeiffer R, Stahl HD, Scherbaum<br />
WA, Chrousos GP, Bornstein SR; Lymphocytes stimulate dehydroepiandrosterone<br />
production through direct cellular contact with adrenal zona reticularis cells:<br />
a novel mechanism of immune-endocrine interaction; J Clin Endocrinol Metab 1999;<br />
84:4220-7<br />
80. Yoshida S, Aihara K, Azuma H; Dehydroepiandrosterone sulfate is inversely<br />
associated with sex-dependent diverse carotid atherosclerosis regardless of endothelial<br />
function; Atherosclerosis 2010; 212:310-315
75<br />
9 Eidesstattliche Erklärung<br />
Hiermit erkläre ich, dass ich die vorliegende Dissertation selbständig verfasst und keine<br />
anderen als die angegebenen Hilfsmittel benutzt habe.<br />
Die Dissertation ist bisher keiner anderen Fakultät, keiner anderen wissenschaftlichen<br />
Einrichtung vorgelegt worden.<br />
Ich erkläre, dass ich bisher kein Promotionsverfahren erfolglos beendet habe und dass eine<br />
Aberkennung eines bereits erworbenen Doktorgrades nicht vorliegt.<br />
Datum<br />
Unterschrift