Folien
Folien
Folien
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
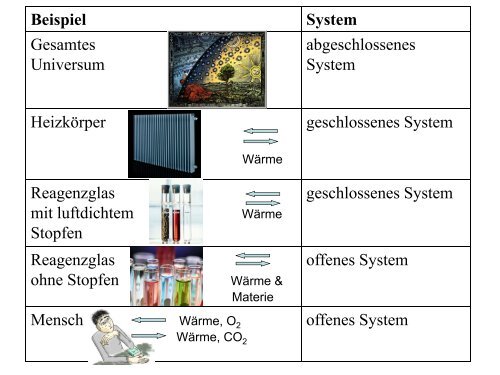
Beispiel<br />
Gesamtes<br />
Universum<br />
System<br />
abgeschlossenes<br />
System<br />
Heizkörper<br />
geschlossenes System<br />
Wärme<br />
Reagenzglas<br />
mit luftdichtem Wärme<br />
Stopfen<br />
Reagenzglas<br />
ohne Stopfen Wärme &<br />
Materie<br />
Mensch Wärme, O 2<br />
Wärme, CO 2<br />
geschlossenes System<br />
offenes System<br />
offenes System
Phasen und Phasengrenzflächen<br />
NaCl<br />
NaCl<br />
flüssiges Wasser,<br />
1 Phase, homogen<br />
flüssige<br />
Kochsalzlösung,<br />
1 Phase, homogen<br />
übersättigte<br />
Kochsalzlösung,<br />
2 Phasen, heterogen<br />
WINTER<br />
Eisschollen auf See !<br />
gasförmiges Wasser<br />
festes Wasser, Eis<br />
flüssiges Wasser<br />
3 Phasen,<br />
heterogen
Aggregatzustände<br />
Sublimieren<br />
Erstarren<br />
Sieden,<br />
Verdampfen<br />
Kondensieren<br />
Resublimieren
Aggregatzustände und Phasen<br />
Diamant<br />
Graphit
A B<br />
C<br />
A B<br />
C<br />
0. Hauptsatz<br />
& Kelvin-Skala<br />
Zeit<br />
Start: T 1 > T 2 > T 3 Ende: T 1 = T 2 = T 3<br />
p<br />
p 100<br />
p 0<br />
100<br />
-273.15<br />
0<br />
ϑ / °C<br />
0 273.15 T / K
Ideales Gas<br />
p<br />
T 1<br />
< T 2<br />
T 2<br />
Druck<br />
T 1<br />
Isothermen<br />
V<br />
V<br />
p 1<br />
p 1<br />
< p 2<br />
Temperatur<br />
Extrapolation<br />
p<br />
0<br />
p 2<br />
Isobaren<br />
T / K<br />
Volumen<br />
V 1<br />
V 1<br />
< V 2<br />
V 2<br />
Extrapolation<br />
0<br />
Isochoren<br />
T / K
Kompressionsfaktor Z<br />
E pot<br />
Z(p)-Isotherme von<br />
NH 3<br />
für T < T Boyle<br />
d<br />
d 0<br />
d<br />
ε<br />
Lennard-Jones Potential<br />
E<br />
=<br />
pot 4<br />
⎡⎛<br />
d<br />
ε⎢⎜<br />
⎢⎣<br />
⎝ d<br />
0<br />
⎞<br />
⎟<br />
⎠<br />
12<br />
⎛<br />
− ⎜<br />
⎝<br />
d<br />
d<br />
0<br />
6<br />
⎞<br />
⎟<br />
⎠<br />
⎤<br />
⎥<br />
⎥⎦<br />
Es kann (nicht muß) eine Temperatur<br />
geben bei der Z = 1. Bei dieser sog.<br />
Boyle-Temperatur T Boyle verhält sich<br />
ein reales Gas über einen größeren<br />
Druckbereich „ideal“. Für T > T Boyle<br />
gilt immer Z >1.
van-der-Waals<br />
Gleichung<br />
Isothermen des CO 2<br />
p<br />
=<br />
RT<br />
−<br />
V − b<br />
a<br />
2<br />
m<br />
V m<br />
= T k<br />
A<br />
Stoff N 2 H 2 CO 2 H 2 O<br />
T k / K 126.2 33.3 304.19 647.4<br />
p k / 10 5 Pa 33.94 12.97 73.87 221.19<br />
V m,k / 10 -6 m 3 mol -1 90.1 65.0 94.0 56.0<br />
B<br />
a / m 6 Pa mol -2 0.141 0.025 0.364 0.555<br />
b / 10 -5 m 3 mol -1 3.91 2.66 4.27 3.05<br />
Vorsicht Einheiten! Beispiel CO 2<br />
T k<br />
= 31.04 °C<br />
p k<br />
= 73.87 bar = 72.9 atm<br />
V m,k<br />
= 0.094 dm 3 mol -1<br />
a = 3.64 dm 6 bar mol -2<br />
b = 0.0427 dm 3 mol -1
Expansion gegen konstanten externen Druck<br />
F ex = p ex A<br />
p>p ex<br />
p=p ex<br />
p<br />
p
Irreversible und Reversible Expansion<br />
p ex = 1atm<br />
p ex = 1atm<br />
Stop<br />
Stop<br />
p = 2 atm<br />
p ex = 2 atm = 1atm + F/A<br />
Irreversible<br />
Expansion,<br />
wenn “Stops”<br />
entfernt werden<br />
p = 1 atm<br />
p<br />
ex<br />
= 1atm<br />
sehr kleine<br />
Gewichte<br />
p = F/A<br />
Reversible<br />
Kompression,<br />
Zufügen Gewichte<br />
p + dp<br />
p = 2 atm<br />
p -dp<br />
Reversible<br />
Expansion,<br />
Entfernen Gewichte<br />
p = 1 atm
Irreversible & Reversible Kompression<br />
p ex = 2 atm<br />
p ex = 2 atm<br />
p E<br />
Stop<br />
Stop<br />
p = nRT/V<br />
p A<br />
p = 1 atm<br />
Irreversible<br />
Kompression,<br />
wenn “Stops”<br />
entfernt werden<br />
p = 2 atm<br />
p<br />
= 1atm<br />
p ex = 2 atm = 1atm + F/A<br />
Reversible<br />
Kompression,<br />
Zufügen Gewichte<br />
p + dp<br />
sehr kleine<br />
Gewichte<br />
p = F/A<br />
V E<br />
p E<br />
V A<br />
p = 1 atm<br />
p -dp<br />
Reversible<br />
Expansion,<br />
Entfernen Gewichte<br />
p = 2 atm<br />
p A
ΔU<br />
Δh<br />
Weg 1: Start h A –direkt –Ende h E<br />
Weg 2: Start h A – Umwege – Ende h E<br />
Weg 1: Start U A - adiabatische Expansion<br />
→ q = 0, w ≠ 0 - Ende U E<br />
Weg 2: Start U A - isotherme Expansion<br />
→ q’ ≠ 0, w’ ≠ w ≠ 0 - Ende U E
Joulescher Expansionsversuch<br />
π Τ > 0 und Z < 1: reales Gas durch Anziehung leichter komprimierbar als ideales Gas<br />
π T < 0 und Z > 1: reales Gas durch Abstoßung schwerer komprimierbar als ideales Gas
Bombenkalorimeter<br />
V = konst.<br />
adiabatisch<br />
Verbrennungskalorimeter<br />
p = konst.<br />
adiabatisch<br />
„Bombe“<br />
Beide Kalorimeter sind ohne Isolierung gezeigt!
Bombenkalorimeter<br />
V = konst.<br />
adiabatisch<br />
Verbrennungskalorimeter<br />
p = konst.<br />
adiabatisch<br />
um 1920<br />
Luftisolierung<br />
Filzmantel<br />
http://de.wikipedia.org - Kalorimetrie<br />
http://www.sammlungen.hu-berlin.de/.../content.800.jpg
Heßscher Satz<br />
Weg A<br />
C(Graphit) + O 2 (g) CO 2 (g) Δ R H A = Δ B H θ (CO 2 ) = -393.51 kJ mol -1<br />
Weg A<br />
Zustand I<br />
Zustand II<br />
Weg B<br />
Zustand III<br />
Weg B<br />
Weg B<br />
C(Graphit) + ½ O 2 (g) CO(g) Δ R H B1 = Δ B H θ (CO) = -110.53 kJ mol -1<br />
CO (g) + ½ O 2 (g) CO 2 (g) Δ R H B2 = -282.98 kJ mol -1
Heßscher Satz<br />
Δ Β H θ<br />
Edukte<br />
Edukte<br />
Elemente<br />
Δ R H θ<br />
Δ Β H θ<br />
Produkte<br />
Produkte<br />
Δ Β H θ (Verbindung) = ?<br />
Verbindung<br />
(Produkt)<br />
Elemente<br />
Δ Verbr H θ (Verbindung)<br />
Δ Verbr H θ (Elemente) =<br />
Δ Β H θ (Verbrennungsprodukte)<br />
CO 2 , H 2 O
Kirchhoffscher Satz<br />
T 2<br />
Δ R Η (Τ 2 )<br />
Edukte A + B<br />
Weg I<br />
ΔΗ Edukte<br />
Weg I<br />
Δ R Η (Τ 1 )<br />
T 1 Edukte A + B<br />
Weg II<br />
Produkte C + D<br />
Weg II<br />
ΔΗ Produkte<br />
Produkte C + D<br />
Δ R H(T 2 ) = Δ R H(T 1 ) + ΔCp ΔT
Isothermen & Adiabaten<br />
p A<br />
p A<br />
p E<br />
p E<br />
Isothermengleichung<br />
p A<br />
V A<br />
= p E V E = konst.<br />
Adiabatengleichung<br />
p A<br />
V A γ = p E V E γ = konst.
Carnot Maschine<br />
q<br />
T w = konst.<br />
Gas<br />
q w<br />
T w > T k<br />
Arbeitsmedium<br />
= Gas<br />
w<br />
w<br />
q k<br />
T w<br />
q w<br />
qw<br />
T k = konst.<br />
q k<br />
Wirkungsgrad η = geleistete Arbeit w<br />
aufgenommene Wärme q w<br />
Kraftwärmemaschine<br />
Wärmekraftmaschine<br />
q k<br />
T k
Carnot Prozess<br />
4<br />
Isothermen<br />
A – B bei T w<br />
C – D bei T k<br />
q = -w<br />
Adiabaten<br />
B – C<br />
D – A<br />
q = 0<br />
1<br />
w<br />
4<br />
1<br />
1. Hauptsatz<br />
ΔU = 0 = q + w<br />
3<br />
2<br />
w 2 =<br />
η<br />
=<br />
− w<br />
q<br />
w<br />
=<br />
T<br />
w<br />
T<br />
−T<br />
w<br />
k<br />
3<br />
k
Carnot Wirkungsgrad<br />
Wirkungsgrad in %<br />
80<br />
70<br />
60<br />
50<br />
40<br />
30<br />
Carnot-Wirkungsgrad<br />
(unt. Tem. 20°C)<br />
moderner<br />
Dampfprozeß<br />
GuD-Prozesse<br />
Erdgasfeuerung<br />
Druck-Kohlevergasung<br />
Gasturbinenprozeß<br />
20 Dampfprozeß<br />
1900-1950<br />
10<br />
200 400 600 800 1000 1200<br />
Prozeßtemperatur in °C<br />
GuD-Prozesse: Gas und Dampfturbine
Richtung freiwilliger (= irreversibler) Prozesse<br />
T 2<br />
T 2<br />
> T<br />
(T 2 + T 1 ) / 2<br />
1<br />
(T<br />
T 2 + T 1 ) / 2<br />
1
Temperatur- und Druckabhängigkeit der Freien Enthalpie<br />
gasf.<br />
flüssig<br />
⎛<br />
⎜<br />
⎝<br />
∂G<br />
∂T<br />
⎞<br />
⎟<br />
⎠<br />
p<br />
= −S<br />
⎛<br />
⎜<br />
⎝<br />
∂G<br />
∂p<br />
⎞<br />
⎟<br />
⎠<br />
T<br />
= V<br />
fest<br />
G<br />
fest flüssig gasf.<br />
T 1 T 2<br />
T<br />
Beachte: Abbildung im Atkins ist falsch, da Kurven<br />
nicht gekrümmt, sondern Geraden sind; Kurven müssen<br />
gekrümmt sein, da S =f(T), d.h. dass sich die<br />
Steigung (= S)mitT ändern muss
Phasendiagramme reiner Stoffe<br />
Nickel, U., Lehrbuch der Thermodynamik, 2. Auflage<br />
PhysChem Verlag, Erlangen, 2011, S. 263
Phasendiagramme reiner Stoffe<br />
Hering, E., Martin, R., Stohrer, M., Physik für Ingenieure,<br />
Springer Verlag, Berlin, 2007 , S. 199
Phasendiagramme reiner Stoffe<br />
p / atm<br />
Feststoff<br />
(s = solid)<br />
Flüssigkeit<br />
(l = liquid)<br />
kritischer<br />
Punkt<br />
1 Phase<br />
F = 2<br />
2 Phasen<br />
F = 1<br />
Tripelpunkt,<br />
3 Phasen, F = 0<br />
Gas<br />
(g = gaseous)<br />
Gibbssche Phasenregel<br />
F = K – P + 2<br />
T / K<br />
F = Freiheitsgrade<br />
K = Anzahl Komponenten<br />
P = Anzahl Phasen<br />
Reiner Stoff<br />
K = 1, F = 3 – P
Phasendiagramme reiner Stoffe<br />
p / atm<br />
s<br />
l<br />
1<br />
g<br />
T 1 T 2<br />
T / K<br />
p / atm<br />
s<br />
l<br />
c<br />
b<br />
c<br />
g<br />
a<br />
b<br />
T / K<br />
a
Phasendiagramme reiner Stoffe<br />
73.0<br />
CO 2<br />
überkritisches<br />
Fluid<br />
p / atm<br />
Feststoff<br />
Flüssigkeit<br />
5.11<br />
1<br />
Tripelpunkt<br />
Gas<br />
-78.5 -56.4 31.1<br />
T / °C
Phasendiagramme reiner Stoffe<br />
p / atm<br />
H 2 O<br />
217.7<br />
Feststoff<br />
1<br />
6 10 -3<br />
Normalsiedepunkt<br />
p = 1 atm, T = 100°C<br />
Standardsiedepunkt<br />
p = 1 bar (10 5 Pa), T = 99.6°C<br />
Flüssigkeit<br />
Tripelpunkt<br />
0 0.0098 100 374.4<br />
T / °C<br />
Gas<br />
überkritisches<br />
Fluid<br />
kritischer<br />
Punkt<br />
Normalschmelzpunkt<br />
Normalsiedepunkt<br />
Normalschmelzpunkt<br />
p = 1 atm, T = 0°C<br />
Standardschmelzpunkt<br />
p = 1 bar (10 5 Pa), T ~ 0°<br />
Struktur von Eis<br />
ρ(Eis) < ρ(fl. Wasser)
Phasenübergänge reiner Stoffe<br />
Δ Trans V Δ Trans H Δ Trans S<br />
Temperatur T<br />
Bei Phasenübergängen 1. Ordnung<br />
ist die erste Ableitung des chemischen<br />
Potentials µ nach einer Zustandsgröße<br />
unstetig.<br />
⎛<br />
⎜<br />
⎝<br />
⎛<br />
⎜<br />
⎝<br />
∂Δ<br />
∂T<br />
Trans<br />
∂Δ<br />
∂p<br />
Trans<br />
μ<br />
⎞<br />
⎟<br />
⎠<br />
μ ⎞<br />
⎟<br />
⎠<br />
p<br />
T<br />
= −Δ<br />
= Δ<br />
Trans<br />
Trans<br />
V<br />
S<br />
m<br />
m<br />
= −<br />
≠ 0<br />
Δ<br />
T<br />
Trans<br />
H<br />
Trans<br />
m<br />
≠<br />
0
Phasenübergänge reiner Stoffe<br />
1. Ordnung<br />
V<br />
H µ<br />
S C p<br />
2. Ordnung<br />
V<br />
H<br />
µ<br />
S<br />
C p<br />
Temperatur T
Chemisches Potential – allgemeine Definition<br />
H 2 O<br />
Zuckerlösung<br />
p = konst., dp = 0<br />
T = konst., dT = 0<br />
c ≠ konst., dc ≠ 0<br />
spontaner, irreversibler<br />
Konzentrationsausgleich;<br />
ungenutzt<br />
spontaner, irreversibler<br />
Konzentrationsausgleich;<br />
genutzt, um Arbeit zu<br />
verrichten
Raoultsches Gesetz<br />
Gesamtdruck p total = p A + p B<br />
und die partiellen Dampfdrücke<br />
p A + p B der Komponenten einer<br />
idealen binären flüssigen Mischung<br />
p = x<br />
A<br />
p = x<br />
B<br />
l<br />
A<br />
l<br />
B<br />
p<br />
p<br />
*<br />
A<br />
*<br />
B<br />
x l + B<br />
l A x<br />
=1<br />
x l A<br />
1 Molenbruch von B, x l B 0<br />
VORSICHT!<br />
Nicht verwechseln mit Daltonschem<br />
Partialdruckgesetz, bei dem der Partialdruck<br />
eines Gases i proportional zum<br />
Stoffmengenanteil x g i des Gases in der<br />
Gasphase ist, d.h. es gilt generell<br />
Dalton Raoult<br />
p i = x g i p total = x l i p i *
Kolligative Eigenschaften<br />
µ<br />
gasf.<br />
flüssig<br />
fest<br />
fest flüssig gasf.<br />
T´1<br />
T 1 T 2 T´2 T<br />
Gefrierpunktserniedrigung<br />
Siedepunktserhöhung<br />
Beachte: Abbildung im Atkins ist falsch, da Kurven<br />
nicht gekrümmt, sondern Geraden sind; Kurven müssen<br />
gekrümmt sein, da S =f(T), d.h. dass sich die<br />
Steigung (= S)mitT ändern muss<br />
mit µ = Gm<br />
für Reinstoff folgt:<br />
⎛∂Gm ⎞ ⎛∂µ<br />
⎞<br />
⎜ ⎟ = ⎜ ⎟ =−S<br />
⎝ ∂T<br />
⎠ ⎝∂T<br />
⎠<br />
Phasenübergang, wenn gilt:<br />
μ<br />
fest<br />
=μ<br />
flüssig<br />
bzw. µ<br />
flüssig<br />
=μgasf.<br />
Zugabe von Komp. B führt zu:<br />
μ<br />
i<br />
p<br />
= μ<br />
i<br />
p<br />
* +RT ln x<br />
l<br />
i
Kolligative Eigenschaften<br />
Ursache aller kolligativen Eigenschaften<br />
Herabsenkung des chemischen Potentials<br />
des flüssigen Lösungsmittels A durch den gelöstenStoffB:Abnahmevonµ<br />
A *(l) auf µ A (l) =<br />
µ A *(l) + RT lnx A .Aufµ A *(g) und µ A *(s) hat der<br />
gelöste Stoff B keinen Einfluß (s. Definition<br />
Lösung).<br />
Ebullioskopie = Gleichgewicht zwischen Gas (rein) und Lösung<br />
Kryoskopie = Gleichgewicht zwischen Feststoff (rein) und Lösung<br />
Osmometrie = Gleichgewicht zwischen Flüssigkeit (rein) und Lösung
Freie Mischungsenthalpie<br />
IDEAL<br />
- unbegrenzt mischbar -<br />
Δ Misch H m = 0<br />
REAL<br />
- unbegrenzt mischbar -<br />
Δ Misch H m < 0<br />
REAL<br />
- unbegrenzt mischbar -<br />
Δ Misch H m > 0<br />
Δ Misch G m = Δ Misch H m - T Δ Misch S m
Ideale Dampfdruck- und Siedediagramme<br />
p<br />
p A<br />
*<br />
p 2<br />
p 1<br />
Flüssigkeit<br />
Dampf<br />
l(a‘)<br />
a‘<br />
a<br />
n(<br />
a')<br />
n(<br />
a'')<br />
l(a‘‘)<br />
l(<br />
a'')<br />
=<br />
l(<br />
a')<br />
Hebelgesetz<br />
a‘‘<br />
x l B<br />
x g B<br />
0 x B<br />
1<br />
p B<br />
*<br />
T A<br />
*<br />
Dampf<br />
Flüssigkeit<br />
Siedekurve<br />
x g B<br />
Kondensationskurve<br />
*<br />
T B<br />
x l B<br />
0 x B<br />
1
Freie Mischungsenthalpie<br />
REAL<br />
- begrenzt mischbar -<br />
Δ Misch H m > 0<br />
REAL<br />
- begrenzt mischbar -<br />
Δ Misch H m > 0<br />
REAL<br />
- nicht mischbar -<br />
Δ Misch H m > 0<br />
Δ Misch G m = Δ Misch H m - T Δ Misch S m
Freie Mischungsenthalpie<br />
Δ Misch<br />
G m<br />
Δ Misch<br />
G m<br />
0<br />
0.5 1.0<br />
0<br />
Phase α<br />
1.0<br />
Phase β<br />
Δ G Misch m<br />
T ><br />
T =<br />
T krit<br />
T<br />
krit<br />
T <<br />
T krit<br />
0<br />
x 1.0<br />
B<br />
x B
T,x-Phasendiagramme binärer flüssiger Mischungen<br />
T ok<br />
Hebelgesetz<br />
n(<br />
a')<br />
l(<br />
a'')<br />
=<br />
n(<br />
a'')<br />
l(<br />
a')<br />
T 2-1<br />
P = 1: vollständig mischbar<br />
a‘<br />
l(a‘)<br />
Konode für T =T ‘<br />
l(a‘‘)<br />
P = 2: Entmischung in<br />
Phase α und β der<br />
Zusammensetzung<br />
a‘ und a‘‘<br />
Molenbruch x B<br />
T ok = obere kritische Entmischungstemperatur
T, x-Phasendiagramme binärer flüssiger Mischungen<br />
Hexan Nitrobenzol<br />
T ok = 294 K<br />
T ok = 210 °C<br />
T uk = 61 °C<br />
T uk = 292 K<br />
T ok = obere kritische Entmischungstemperatur<br />
T uk = untere kritische Entmischungstemperatur
Das Chemische Gleichgewicht einer Reaktion<br />
Δ<br />
R<br />
G<br />
=<br />
⎛<br />
⎜<br />
⎝<br />
∂G<br />
∂ξ<br />
⎟<br />
⎠<br />
⎞<br />
p,T<br />
Δ<br />
R<br />
G<br />
<<br />
0<br />
exergonisch<br />
Δ<br />
R<br />
G<br />
=<br />
0<br />
Gleichgewicht<br />
Δ<br />
R<br />
G<br />
><br />
0<br />
endergonisch
ANHANG
van-der-Waals<br />
Gleichung<br />
Isothermen des CO 2<br />
p<br />
p<br />
=<br />
RT<br />
−<br />
V − b<br />
a<br />
2<br />
m<br />
V m<br />
= T k<br />
A<br />
l<br />
B<br />
p<br />
=<br />
RT<br />
V<br />
m<br />
a<br />
−<br />
V<br />
2<br />
m<br />
+<br />
V<br />
m<br />
g<br />
RTb<br />
( V − b)<br />
m<br />
T 1 > T k<br />
T = T k<br />
T 2 < T k<br />
V m
U<br />
U(V+ΔV)<br />
U(V+dV)<br />
U(V)<br />
U<br />
U(T+ΔT)<br />
U(T+dT)<br />
U(T)<br />
V<br />
V + ΔV<br />
V<br />
T<br />
T + ΔT<br />
T<br />
U ( V + ΔV<br />
) −U<br />
( V )<br />
( ΔV<br />
+ V ) −V<br />
=<br />
ΔU<br />
ΔV<br />
U( T + ΔT<br />
) −U( T<br />
( ΔT<br />
+ T ) − T<br />
)<br />
=<br />
ΔU<br />
ΔT<br />
U(V+dV) = U(V) + ⎟ ⎛ ∂U<br />
⎞<br />
⎟ dV ⎝ ∂ V ⎠<br />
T<br />
U(T+dT) = U(T) + ⎟ ⎛ ∂U<br />
⎞<br />
⎟ dT ⎝ ∂ T ⎠<br />
V
Änderung von V bei T = konst.<br />
Änderung von V und T<br />
Änderung von T bei V = konst.<br />
dV<br />
dT
Siedediagramme mit Azeotrop<br />
T (°C)<br />
T (°C)<br />
60<br />
Dampf<br />
50<br />
40<br />
Flüssigkeit<br />
46<br />
Siedepunkt<br />
CS 2<br />
0.2 0.6 1.0<br />
T (°C)<br />
63<br />
61<br />
59<br />
57<br />
Siedepunkt<br />
Aceton 55<br />
Flüssigkeit<br />
Dampf<br />
0.2 0.6 1.0<br />
T (°C)<br />
61<br />
Siedepunkt<br />
CHCl 3<br />
x CHCl3