Steigerung von Qualität und Ausbeute in der ... - DASGIP
Steigerung von Qualität und Ausbeute in der ... - DASGIP
Steigerung von Qualität und Ausbeute in der ... - DASGIP
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
Blitzlicht Biomanufactur<strong>in</strong>g<br />
<strong>Steigerung</strong> <strong>von</strong> <strong>Qualität</strong><br />
<strong>und</strong> <strong>Ausbeute</strong> <strong>in</strong> <strong>der</strong><br />
Wirkstoffproduktion<br />
Christian Kaiser, Stefan Krüß, Michael Küchler, Richter-Helm BioLogics, Hamburg<br />
Die Zahl <strong>der</strong> Multifermentersysteme im Litermaßstab hat <strong>in</strong> den vergangenen Jahren stetig<br />
zugenommen. Dabei ist sowohl die messtechnische Ausrüstung als auch die verfahrenstechnische<br />
Gestaltung <strong>der</strong> Bioreaktorsysteme vorangetrieben worden. Aufgr<strong>und</strong> <strong>der</strong> verbesserten<br />
Vergleichbarkeit zwischen den small-scale-Fermentern <strong>und</strong> Bioreaktoren im Labor-, Technikums-<br />
<strong>und</strong> Produktionsmaßstab werden diese heute für das Screen<strong>in</strong>g <strong>von</strong> Stämmen <strong>und</strong> Fermentationsparametern<br />
sowohl <strong>in</strong> <strong>der</strong> Prozessentwicklung als auch für Scale-down-Experimente<br />
e<strong>in</strong>gesetzt. Dabei erlauben erweiterte Monitor<strong>in</strong>goptionen die Identifizierung qualitätskritischer<br />
Attribute (CQA) <strong>und</strong> <strong>der</strong>en Zusammenhang mit Prozesskenngrößen im laufenden Prozess,<br />
e<strong>in</strong> wesentlicher Anspruch <strong>der</strong> PAT-Initiative <strong>der</strong> FDA. In parallelen Kultivierungen im kle<strong>in</strong>en<br />
Maßstab haben Forscher die Chance, mit ger<strong>in</strong>gem Zeit- <strong>und</strong> Kostenaufwand die kritischen<br />
Prozessparameter (CPP) zu erforschen. Methoden <strong>der</strong> statistischen Versuchsplanung (DoE – Design<br />
of Experiments) stellen dabei die effiziente Planung <strong>der</strong> durchzuführenden Versuche sicher<br />
<strong>und</strong> helfen, Wechselwirkungen zwischen den e<strong>in</strong>zelnen Faktoren zu identifizieren. Durch e<strong>in</strong>en<br />
geeigneten Grad an Prozessautomatisierung können die Prozesse <strong>in</strong>nerhalb <strong>der</strong> vorgegebenen<br />
Grenzen geführt <strong>und</strong> damit die Reproduzierbarkeit <strong>der</strong> Bioreaktionsprozesse erhöht werden.<br />
Wie die verbesserten technischen Rahmenbed<strong>in</strong>gungen zu e<strong>in</strong>er effizienteren Prozessentwicklung<br />
beitragen, zeigt das folgende Beispiel e<strong>in</strong>es zu entwickelnden Upstream-Prozesses für die<br />
Wirkstoffproduktion mit dem Bakterium Escherichia coli.<br />
Herstellungsprozesse rekomb<strong>in</strong>anter Produkte<br />
<strong>in</strong> Bioreaktoren basieren im Wesentlichen auf<br />
den zellbiologischen Produktionsorganismen<br />
Bakterien, Hefen sowie tierischen bzw. Humanzelll<strong>in</strong>ien.<br />
Die Expression rekomb<strong>in</strong>anter<br />
(therapeutischer) Prote<strong>in</strong>e wird ungeachtet<br />
aufkommen<strong>der</strong> eukaryotischer Expressionssysteme<br />
wie etwa CHO-Zellen, Pichia pastoris,<br />
Saccharomyces cerevisiae sowie Hansenula<br />
polymorpha immer noch am häufigsten mit<br />
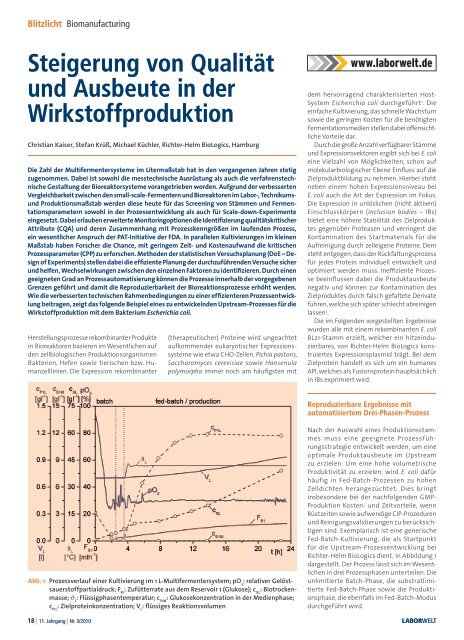
Abb. 1: Prozessverlauf e<strong>in</strong>er Kultivierung im 1 L-Multifermentersystem; pO 2 : relativer Gelöstsauerstoffpartialdruck;<br />
F R1 : Zufütterrate aus dem Reservoir 1 (Glukose); c XL : Biotrockenmasse;<br />
J L : Flüssigphasentemperatur; c S1M : Glukosekonzentration <strong>in</strong> <strong>der</strong> Medienphase;<br />
c P1L : Zielprote<strong>in</strong>konzentration; V L : flüssiges Reaktionsvolumen<br />
www.laborwelt.de<br />
dem hervorragend charakterisierten Host-<br />
System Escherichia coli durchgeführt 1 . Die<br />
e<strong>in</strong>fache Kultivierung, das schnelle Wachstum<br />
sowie die ger<strong>in</strong>gen Kosten für die benötigten<br />
Fermentationsmedien stellen dabei offensichtliche<br />
Vorteile dar.<br />
Durch die große Anzahl verfügbarer Stämme<br />
<strong>und</strong> Expressionsvektoren ergibt sich bei E. coli<br />
e<strong>in</strong>e Vielzahl <strong>von</strong> Möglichkeiten, schon auf<br />
molekularbiologischer Ebene E<strong>in</strong>fluss auf die<br />
Zielproduktbildung zu nehmen. Hierbei steht<br />
neben e<strong>in</strong>em hohen Expressionsniveau bei<br />
E. coli auch die Art <strong>der</strong> Expression im Fokus.<br />
Die Expression <strong>in</strong> unlöslichen (nicht aktiven)<br />
E<strong>in</strong>schlusskörpern (Inclusion bodies – IBs)<br />
bietet e<strong>in</strong>e höhere Stabilität des Zielproduktes<br />
gegenüber Proteasen <strong>und</strong> verr<strong>in</strong>gert die<br />
Kontam<strong>in</strong>ation des Startmaterials für die<br />
Aufre<strong>in</strong>igung durch zelleigene Prote<strong>in</strong>e. Dem<br />
steht entgegen, dass <strong>der</strong> Rückfaltungsprozess<br />
für jedes Prote<strong>in</strong> <strong>in</strong>dividuell entwickelt <strong>und</strong><br />
optimiert werden muss. Ineffiziente Prozesse<br />
bee<strong>in</strong>flussen dabei die Produktausbeute<br />
negativ <strong>und</strong> können zur Kontam<strong>in</strong>ation des<br />
Zielproduktes durch falsch gefaltete Derivate<br />
führen, welche sich später schlecht abre<strong>in</strong>igen<br />
lassen 2 .<br />
Die im Folgenden vorgestellten Ergebnisse<br />
wurden alle mit e<strong>in</strong>em rekomb<strong>in</strong>anten E. coli<br />
BL21-Stamm erzielt, welcher e<strong>in</strong> hitze<strong>in</strong>duzierbares,<br />
<strong>von</strong> Richter-Helm BioLogics konstruiertes<br />
Expressionsplasmid trägt. Bei dem<br />
Zielprote<strong>in</strong> handelt es sich um e<strong>in</strong> humanes<br />
API, welches als Fusionsprote<strong>in</strong> hauptsächlich<br />
<strong>in</strong> IBs exprimiert wird.<br />
Reproduzierbare Ergebnisse mit<br />
automatisiertem Drei-Phasen-Prozess<br />
Nach <strong>der</strong> Auswahl e<strong>in</strong>es Produktionsstammes<br />
muss e<strong>in</strong>e geeignete Prozessführungsstrategie<br />
entwickelt werden, um e<strong>in</strong>e<br />
optimale Produkt ausbeute im Upstream<br />
zu erzielen. Um e<strong>in</strong>e hohe volumetrische<br />
Produktivität zu erzielen, wird E. coli dafür<br />
häufig <strong>in</strong> Fed-Batch-Prozessen zu hohen<br />
Zelldichten herangezüchtet. Dies br<strong>in</strong>gt<br />
<strong>in</strong>sbeson<strong>der</strong>e bei <strong>der</strong> nachfolgenden GMP-<br />
Produktion Kosten- <strong>und</strong> Zeitvorteile, wenn<br />
Rüstzeiten sowie aufwendige CIP-Prozeduren<br />
<strong>und</strong> Re<strong>in</strong>igungsvalidierungen zu berücksichtigen<br />
s<strong>in</strong>d. Exemplarisch ist e<strong>in</strong>e generische<br />
Fed-Batch-Kultivierung, die als Startpunkt<br />
für die Upstream-Prozessentwicklung bei<br />
Richter-Helm BioLogics dient, <strong>in</strong> Abbildung 1<br />
dargestellt. Der Prozess lässt sich im Wesentlichen<br />
<strong>in</strong> drei Prozessphasen unterteilen. Die<br />
unlimitierte Batch-Phase, die substratlimitierte<br />
Fed-Batch-Phase sowie die Produktionsphase,<br />
die ebenfalls im Fed-Batch-Modus<br />
durchgeführt wird.<br />
18 | 11. Jahrgang | Nr. 3/2010 LABORWELT
Tab 1: Wichtige die Zielprote<strong>in</strong>expression bee<strong>in</strong>flussende Parameter 3-6<br />
Parameter Variationen Parameter Variationen<br />
Medium M<strong>in</strong>eralmedium Induktion Induktionstemperatur<br />
Semi-def<strong>in</strong>iertes Medium Zeitpunkt <strong>der</strong> Induktion<br />
Komplexmedium Induktorkonzentration<br />
Spurenelemente Induktorzugabe<br />
Am<strong>in</strong>osäuren pH Sollwert<br />
Vitam<strong>in</strong>e pH-Profil<br />
Zufütterung L<strong>in</strong>eares Profil Temperatur Sollwert<br />
Exponentielles Profil Temperaturprofil<br />
Komb<strong>in</strong>ation aus exp. <strong>und</strong> l<strong>in</strong>. Profil pO 2 Sollwert<br />
Zur Verbesserung <strong>der</strong> Reproduzierbarkeit <strong>und</strong><br />
Vergleichbarkeit <strong>von</strong> Ergebnissen steht e<strong>in</strong>e<br />
Reihe <strong>von</strong> Automatisierungsmöglichkeiten<br />
zur Verfügung. Das verwendete Multifermentersystem<br />
<strong>der</strong> Firma <strong>DASGIP</strong>®, Jülich,<br />
bietet hierfür e<strong>in</strong>e sehr geeignete Auswahl<br />
an Regelungs- <strong>und</strong> Steuerungsmöglichkeiten<br />
<strong>in</strong> <strong>der</strong> systemzugehörigen Software<br />
<strong>DASGIP</strong>®-Control 4.0. Je<strong>der</strong> zur Verfügung<br />
stehende Regler (pH, pO 2 , Temperatur, Zufütterpumpen,<br />
Begasungsraten) kann über alle<br />
vorhandenen Prozessgrößen <strong>und</strong> Schaltzeiten<br />
getriggert <strong>und</strong> damit an-, aus- o<strong>der</strong> mehrfach<br />
geschaltet werden. Zusätzlich können Filter-<br />
<strong>und</strong> Verzögerungszeiten e<strong>in</strong>gesetzt werden,<br />
um e<strong>in</strong>e fehlerhafte Initiation <strong>der</strong> Regler zu<br />
vermeiden <strong>und</strong> serielle Steuerungen zu realisieren.<br />
Für die e<strong>in</strong>zelnen Regler besteht die<br />
Möglichkeit, konstante Sollwerte vorzugeben<br />
sowie zeitlich o<strong>der</strong> an an<strong>der</strong>e Prozessgrößen<br />
gekoppelte Profile <strong>in</strong> Form <strong>von</strong> Tabellen o<strong>der</strong><br />
Funktionen vorzugeben. Für die pO 2 -Regelung<br />
steht zusätzlich e<strong>in</strong>e Kaskade zur Verfügung,<br />
um über die Drehzahl, die Begasungsrate<br />
<strong>und</strong> die Gasmischung <strong>von</strong> Luft <strong>und</strong> O 2 e<strong>in</strong>e<br />
ausreichende Sauerstoffversorgung <strong>der</strong><br />
Zellen über den gesamten Prozessverlauf<br />
sicherzustellen.<br />
In dem <strong>in</strong> Abbildung 1 dargestellten<br />
Prozessverlauf stellt die Initialisierung <strong>der</strong><br />
pO 2 -Drehzahlregelung die erste Automatisierungsaufgabe<br />
dar. Sobald <strong>der</strong> pO 2 -Wert für<br />
mehr als 30 Sek<strong>und</strong>en unter den Sollwert <strong>von</strong><br />
30% fällt, wird diese gestartet.<br />
Anschließend muss <strong>der</strong> vollständige Verbrauch<br />
<strong>der</strong> vorgelegten Glukose detektiert<br />
werden, um die Glukosezufütterung <strong>und</strong><br />
damit die Fed-Batch-Phase zu <strong>in</strong>itialisieren.<br />
Als Trigger kann hierbei <strong>der</strong> pO 2 -Wert genutzt<br />
werden. Überschreitet dieser e<strong>in</strong>en Wert <strong>von</strong><br />
45% für mehr als 30 Sek<strong>und</strong>en, wird e<strong>in</strong> vorgegebenes<br />
Zufütterprofil gestartet. Für die<br />
Glukosezufütterung stehen dabei – genau wie<br />
für die Korrekturmittel Säure, Lauge <strong>und</strong> Antischaummittel<br />
– kont<strong>in</strong>uierlich ansteuerbare<br />
Präzisionsschlauchpumpen zur Verfügung.<br />
Abb. 2: Prote<strong>in</strong>bildungsk<strong>in</strong>etik bei unterschiedlichen Induktionstemperaturen; c XL := Biotrockenmasse;<br />
c P1L := Zielprote<strong>in</strong>konzentration; J Ind := Induktionstemperatur<br />
Blitzlicht Biomanufactur<strong>in</strong>g<br />
Die Pumpenkalibrierung erfolgt automatisiert<br />
<strong>und</strong> simultan prä-experimentell über<br />
die <strong>DASGIP</strong>®-Control-Software mit Hilfe <strong>von</strong><br />
Differenzwägungen <strong>der</strong> entsprechenden<br />
Medien. Die Umrechnung <strong>der</strong> relativen <strong>in</strong> die<br />
absoluten Zufütterraten erfolgt system<strong>in</strong>tern.<br />
Über die E<strong>in</strong>gabe des Startvolumens zu<br />
Kultivierungsbeg<strong>in</strong>n sowie die E<strong>in</strong>gabe <strong>der</strong><br />
e<strong>in</strong>zelnen Probenahmeraten steht je<strong>der</strong>zeit<br />
das gesamte aktuelle Fermentationsvolumen<br />
während des Prozesses zur Verfügung.<br />
Die letzte Automatisierungsaufgabe stellt<br />
dann die Induktion <strong>der</strong> Kultur für die Initialisierung<br />
<strong>der</strong> Produktionsphase dar. Bei<br />
Temperatur-<strong>in</strong>duzierbaren Systemen erfolgt<br />
dies über e<strong>in</strong>e Erhöhung <strong>der</strong> Kultivierungstemperatur,<br />
bei chemisch <strong>in</strong>duzierbaren System<br />
durch Zugabe e<strong>in</strong>es Induktors. Die Induktion<br />
kann dabei entwe<strong>der</strong> zeitlich an e<strong>in</strong> Ereignis<br />
geb<strong>und</strong>en (z.B. 1 St<strong>und</strong>e nach Start <strong>der</strong> Zufütterung)<br />
o<strong>der</strong> aber an die aktuelle Zelldichte<br />
gekoppelt werden. Diese kann onl<strong>in</strong>e sowohl<br />
über e<strong>in</strong>e Trübungsmessung als auch über<br />
die Abgasmessung berechnet werden (Daten<br />
nicht dargestellt).<br />
<strong>Qualität</strong>skritische Parameter<br />
<strong>und</strong> Prozessoptimierung<br />
Das systematische Screen<strong>in</strong>g nach optimalen<br />
Parametern während <strong>der</strong> Prozessentwicklung<br />
ist nicht nur <strong>von</strong> entscheiden<strong>der</strong> Bedeutung,<br />
um maximale Produktausbeuten zu<br />
erreichen, son<strong>der</strong>n liefert auch zusätzlich<br />
wichtige Informationen, um die Robustheit<br />
des Upstream-Prozesses zu beurteilen. Diese<br />
können im Folgenden e<strong>in</strong>gesetzt werden, um<br />
Spezifikationen <strong>und</strong> Grenzen für den Produktionsprozess<br />
zu def<strong>in</strong>ieren, <strong>und</strong> geben erste<br />
entscheidende H<strong>in</strong>weise für die <strong>in</strong> den kl<strong>in</strong>ischen<br />
Phasen anstehende Prozessvalidierung.<br />
Je mehr Informationen während <strong>der</strong> Phase <strong>der</strong><br />
Prozessentwicklung generiert werden, desto<br />
ger<strong>in</strong>ger fällt oft <strong>der</strong> Arbeits- <strong>und</strong> Zeitaufwand<br />
für diese entscheidende <strong>und</strong> kosten<strong>in</strong>tensive<br />
Phase auf dem Weg zur Marktzulassung aus.<br />
E<strong>in</strong>en Überblick über wichtige, die Zielprote<strong>in</strong>expression<br />
bee<strong>in</strong>flussende Parameter gibt<br />
die Tabelle 1. Da e<strong>in</strong> komplettes Screen<strong>in</strong>g aller<br />
Parameter schon alle<strong>in</strong> aus Kosten- <strong>und</strong> Zeitgründen<br />
nicht realistisch ist, muss zunächst<br />
e<strong>in</strong>e geeignete Auswahl getroffen werden.<br />
Hierfür muss die Art <strong>der</strong> Expression (löslich<br />
vs. IBs; zytoplasmatisch vs. sekretiert) sowie<br />
die verwendete Komb<strong>in</strong>ation Vektor-Stamm-<br />
Produkt berücksichtigt werden. Auf Gr<strong>und</strong>lage<br />
<strong>von</strong> <strong>in</strong> <strong>der</strong> Literatur beschriebenen Prozessen<br />
sowie den vorliegenden Erfahrungen konnte<br />
entschieden werden, welche Parameter <strong>in</strong><br />
welchem Wertebereich untersucht werden<br />
sollten.<br />
Es wurden <strong>in</strong>sgesamt 26 Kultivierungen im<br />
1 L-Maßstab durchgeführt, wobei die <strong>in</strong> Tabelle<br />
1 farblich h<strong>in</strong>terlegten Parameter untersucht<br />
wurden. Im ersten Ansatz wurde <strong>der</strong> E<strong>in</strong>fluss<br />
LABORWELT 11. Jahrgang | Nr. 3/2010 | 21
Blitzlicht Biomanufactur<strong>in</strong>g<br />
Abb. 3: E<strong>in</strong>fluss <strong>der</strong> Induktionstemperatur (TInd) sowie <strong>der</strong> optischen Dichte zu Induktionsbeg<strong>in</strong>n<br />
(ODInd) auf das IB/sol-Verhältnis sowie die Zielprote<strong>in</strong>konzentration<br />
verschiedener Medien h<strong>in</strong>sichtlich <strong>der</strong> Prote<strong>in</strong>expression<br />
analysiert. Dabei zeigte sich, dass<br />
e<strong>in</strong> semi-def<strong>in</strong>iertes Glukosemedium unter<br />
Zusatz <strong>von</strong> pflanzlichem Pepton zur besten<br />
Expressionsleistung führt. Der Produkttiter<br />
<strong>von</strong> 1,2 g/L (Abb. 1) liegt dabei deutlich höher<br />
als auf semi-def<strong>in</strong>ierten Glycer<strong>in</strong>medien (ca.<br />
320 mg/L) <strong>und</strong> glukosehaltigem M<strong>in</strong>eralmedium<br />
(ca. 900 mg/L). Zusätzlich ergab sich das<br />
beste IB/sol-Verhältnis (Verhältnis Inclusion<br />
bodies zu löslichem Prote<strong>in</strong>) <strong>von</strong> etwa 90%<br />
zu 10% bei E<strong>in</strong>satz des semi-def<strong>in</strong>ierten Glukosemediums.<br />
Wie aus Abbildung 1 ersichtlich, zeigt <strong>der</strong><br />
verwendete Stamm e<strong>in</strong>e sehr gute Prote<strong>in</strong>expression<br />
während <strong>der</strong> ersten vier bis<br />
sechs St<strong>und</strong>en nach Induktion. Anschließend<br />
ist ke<strong>in</strong>e nennenswerte Zielprote<strong>in</strong>bildung<br />
mehr zu verzeichnen. Als mögliche Ursachen<br />
wurden im ersten Ansatz e<strong>in</strong>e zu ger<strong>in</strong>ge<br />
Wachstumsrate – bed<strong>in</strong>gt durch das l<strong>in</strong>eare<br />
Zufütterprofil –, genetische Instabilität o<strong>der</strong><br />
fehlende Medienzusätze <strong>in</strong> Betracht gezogen.<br />
Mit Hilfe <strong>der</strong> folgenden Versuche konnte die<br />
genetische Instabilität ausgeschlossen werden.<br />
Die Produktausbeuten wurden durch den<br />
Zusatz <strong>von</strong> Pepton im Feedmedium sowie e<strong>in</strong>e<br />
exponentielle Zufütterung mit e<strong>in</strong>er Wachstumsrate<br />
<strong>von</strong> µ w = 0,2 h –1 zwar leicht auf ca. 1,5<br />
g/L verbessert, die Prote<strong>in</strong>expression erfolgte<br />
jedoch auch hier nur während <strong>der</strong> ersten St<strong>und</strong>en<br />
nach Induktion.<br />
Um den Zellstress durch die hohe Induktionstemperatur<br />
sowie die hohe Expressionsleistung<br />
zu reduzieren, wurden im nächsten<br />
Ansatz unterschiedliche Expressionstemperaturen<br />
untersucht. Zusätzlich wurden Experimente<br />
durchgeführt, bei denen die Kulturen<br />
bei höheren Zelldichten <strong>in</strong>duziert wurden, um<br />
e<strong>in</strong>en höheren, Zellmasse-geb<strong>und</strong>enen Produkttiter<br />
zu erreichen. Die Planung <strong>der</strong> Experimente<br />
erfolgte dabei nach den Methoden <strong>der</strong><br />
statistischen Versuchsplanung. Die E<strong>in</strong>gangsgrößen<br />
waren dabei die Induktionstemperatur<br />
sowie die optische Dichte zu Induktionsbeg<strong>in</strong>n.<br />
Als Zielgrößen wurden die Produktausbeute<br />
sowie das IB/sol-Verhältnis def<strong>in</strong>iert.<br />
Die Ergebnisse e<strong>in</strong>es Ansatzes im Multifermentersystem<br />
s<strong>in</strong>d <strong>in</strong> Abbildung 2 dargestellt.<br />
Dabei wurden dieselben Medien <strong>und</strong> Zufütterprofile<br />
für alle vier Fermenter verwendet,<br />
was <strong>der</strong> synchrone Verlauf <strong>der</strong> Biomassebildung<br />
(c XL ) wi<strong>der</strong>spiegelt. Es ist offensichtlich,<br />
dass bereits bei e<strong>in</strong>er Induktionstemperatur<br />
<strong>von</strong> 40°C im Vergleich zu 42°C die Phase <strong>der</strong><br />
Produktbildung leicht verlängert werden<br />
konnte. Bei e<strong>in</strong>er weiteren Herabsetzung <strong>der</strong><br />
Induktionstemperatur auf 38°C konnte bei<br />
gleichbleibend starker Expressionsleistung<br />
die Zielprote<strong>in</strong>bildung über den gesamten<br />
Prozess aufrechterhalten <strong>und</strong> damit <strong>der</strong> Produkttiter<br />
mit 4.5 g/L entscheidend verbessert<br />
werden.<br />
Durch e<strong>in</strong>e spätere Induktion <strong>der</strong> Kulturen<br />
(5 h nach Feedstart) <strong>in</strong> Komb<strong>in</strong>ation mit e<strong>in</strong>er<br />
Induktionstemperatur <strong>von</strong> 38°C konnte die<br />
Endkonzentration des Zielprote<strong>in</strong>s weiter<br />
auf 7,5 g/L gesteigert werden (Daten nicht<br />
dargestellt).<br />
Der E<strong>in</strong>fluss <strong>der</strong> betrachteten Faktoren<br />
unter Verwendung <strong>der</strong> statistischen Versuchsplanung<br />
ist <strong>in</strong> Abbildung 3 dargestellt.<br />
Daraus wird ersichtlich, dass e<strong>in</strong>e niedrige<br />
Induktionstemperatur <strong>in</strong> Verb<strong>in</strong>dung mit<br />
e<strong>in</strong>er hohen Zelldichte zu Induktionsstart zu<br />
den besten Produkttitern führt. E<strong>in</strong> Nachteil<br />
<strong>der</strong> ger<strong>in</strong>geren Induktionstemperatur ist dabei<br />
das schlechtere IB/sol-Verhältnis (70% zu<br />
30%) im Vergleich zur Induktion bei höheren<br />
Temperaturen. Durch die wesentlich höhere<br />
Produktbildung bei niedrigen Temperaturen<br />
kann <strong>der</strong> Verlust an IBs jedoch vernachlässigt<br />
werden.<br />
Im weiteren Verlauf des Projektes konnte<br />
die Produktkonzentration durch die Variation<br />
des verwendeten pflanzlichen Peptons <strong>und</strong><br />
e<strong>in</strong>e verlängerte Expressionsphase bis auf 11<br />
g/L erhöht werden. Anschließend wurde <strong>der</strong><br />
Prozess erfolgreich <strong>in</strong> den 10 L-Maßstab skaliert<br />
<strong>und</strong> – bed<strong>in</strong>gt durch den besseren Sauerstoffe<strong>in</strong>trag<br />
<strong>und</strong> die damit verb<strong>und</strong>ene längere<br />
Expressionsphase – e<strong>in</strong>e Produktkonzentration<br />
<strong>von</strong> mehr als 20 g/L erzielt werden.<br />
22 | 11. Jahrgang | Nr. 3/2010 LABORWELT<br />
Fazit<br />
In dem hier vorgestellten Projekt wurden <strong>in</strong><br />
e<strong>in</strong>em Multifermentersystem im Labormaßstab<br />
26 Kultivierungen für die Upstream-<br />
Prozessentwicklung durchgeführt. Durch die<br />
parallele Prozessführung werden dabei identische<br />
Startbed<strong>in</strong>gungen durch den E<strong>in</strong>satz<br />
<strong>der</strong> gleichen Vorkulturen sichergestellt <strong>und</strong> e<strong>in</strong><br />
schnelles <strong>und</strong> effizientes Parameterscreen<strong>in</strong>g<br />
ermöglicht. Durch e<strong>in</strong>e e<strong>in</strong>fache Automatisierung<br />
<strong>der</strong> Fermentationsprozesse wurde die<br />
Vergleichbarkeit <strong>und</strong> Reproduzierbarkeit <strong>der</strong><br />
Kultivierungen gewährleistet.<br />
Es wurden <strong>der</strong> E<strong>in</strong>fluss <strong>der</strong> verwendeten<br />
Medien <strong>und</strong> Medienzusätze, die Zufütterprofile<br />
für die Fed-Batch-Phase sowie die<br />
Induktionstemperatur <strong>und</strong> <strong>der</strong> Induktionszeitpunkt<br />
näher untersucht. Dabei wurden auch<br />
Verfahren <strong>der</strong> statistischen Versuchsplanung<br />
(DoE) e<strong>in</strong>gesetzt. Durch die Absenkung <strong>der</strong><br />
Induktionstemperatur konnte die Expressionsphase<br />
entscheidend verlängert <strong>und</strong> damit<br />
die Produktkonzentration deutlich gesteigert<br />
werden. Die Produktausbeute konnte dadurch<br />
um 1 L-Maßstab <strong>von</strong> 1,2 g/L auf 11 g/L nahezu<br />
verzehnfacht werden.<br />
Literatur<br />
[1] An<strong>der</strong>son, D.C., and Krummen, L., Curr. Op<strong>in</strong>. Biotechnol. 13<br />
(2002), 117-123<br />
[2] Sørensen, H.P., Mortensen, K.K., Microb. Cell. Fact. 4 (2005)<br />
[3] Mark A. Eiteman, Elliot Altman. (2006) Trends <strong>in</strong> Biotechnology,<br />
24 (11), 530-536<br />
[4] Delia M. Ramirez and William E. Bentley. (1995) Biotechnology<br />
and Bioeng<strong>in</strong>eer<strong>in</strong>g, 47, 596-608<br />
[5] Lars Strandberg and Sven-Olaf Enfors. (1991) Applied and<br />
Environmental Microbiology, 57 (6), 1669-167<br />
[6] Jong H. Choi, Ki. C. Keum, Sang Y. Lee. (2006) Chemical<br />
Eng<strong>in</strong>eer<strong>in</strong>g Science, 61, 876-885<br />
Korrespondenzadresse<br />
Dr. Christian Kaiser<br />
Richter-Helm BioLogics, Hamburg<br />
Habichthorst 30, 22459 Hamburg<br />
C.Kaiser@richter-helm-biologics.eu