Steigerung von Qualität und Ausbeute in der ... - DASGIP
Steigerung von Qualität und Ausbeute in der ... - DASGIP
Steigerung von Qualität und Ausbeute in der ... - DASGIP
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
Blitzlicht Biomanufactur<strong>in</strong>g<br />
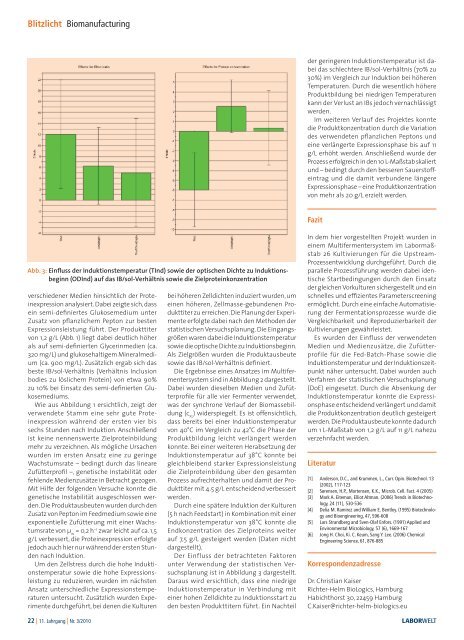
Abb. 3: E<strong>in</strong>fluss <strong>der</strong> Induktionstemperatur (TInd) sowie <strong>der</strong> optischen Dichte zu Induktionsbeg<strong>in</strong>n<br />
(ODInd) auf das IB/sol-Verhältnis sowie die Zielprote<strong>in</strong>konzentration<br />
verschiedener Medien h<strong>in</strong>sichtlich <strong>der</strong> Prote<strong>in</strong>expression<br />
analysiert. Dabei zeigte sich, dass<br />
e<strong>in</strong> semi-def<strong>in</strong>iertes Glukosemedium unter<br />
Zusatz <strong>von</strong> pflanzlichem Pepton zur besten<br />
Expressionsleistung führt. Der Produkttiter<br />
<strong>von</strong> 1,2 g/L (Abb. 1) liegt dabei deutlich höher<br />
als auf semi-def<strong>in</strong>ierten Glycer<strong>in</strong>medien (ca.<br />
320 mg/L) <strong>und</strong> glukosehaltigem M<strong>in</strong>eralmedium<br />
(ca. 900 mg/L). Zusätzlich ergab sich das<br />
beste IB/sol-Verhältnis (Verhältnis Inclusion<br />
bodies zu löslichem Prote<strong>in</strong>) <strong>von</strong> etwa 90%<br />
zu 10% bei E<strong>in</strong>satz des semi-def<strong>in</strong>ierten Glukosemediums.<br />
Wie aus Abbildung 1 ersichtlich, zeigt <strong>der</strong><br />
verwendete Stamm e<strong>in</strong>e sehr gute Prote<strong>in</strong>expression<br />
während <strong>der</strong> ersten vier bis<br />
sechs St<strong>und</strong>en nach Induktion. Anschließend<br />
ist ke<strong>in</strong>e nennenswerte Zielprote<strong>in</strong>bildung<br />
mehr zu verzeichnen. Als mögliche Ursachen<br />
wurden im ersten Ansatz e<strong>in</strong>e zu ger<strong>in</strong>ge<br />
Wachstumsrate – bed<strong>in</strong>gt durch das l<strong>in</strong>eare<br />
Zufütterprofil –, genetische Instabilität o<strong>der</strong><br />
fehlende Medienzusätze <strong>in</strong> Betracht gezogen.<br />
Mit Hilfe <strong>der</strong> folgenden Versuche konnte die<br />
genetische Instabilität ausgeschlossen werden.<br />
Die Produktausbeuten wurden durch den<br />
Zusatz <strong>von</strong> Pepton im Feedmedium sowie e<strong>in</strong>e<br />
exponentielle Zufütterung mit e<strong>in</strong>er Wachstumsrate<br />
<strong>von</strong> µ w = 0,2 h –1 zwar leicht auf ca. 1,5<br />
g/L verbessert, die Prote<strong>in</strong>expression erfolgte<br />
jedoch auch hier nur während <strong>der</strong> ersten St<strong>und</strong>en<br />
nach Induktion.<br />
Um den Zellstress durch die hohe Induktionstemperatur<br />
sowie die hohe Expressionsleistung<br />
zu reduzieren, wurden im nächsten<br />
Ansatz unterschiedliche Expressionstemperaturen<br />
untersucht. Zusätzlich wurden Experimente<br />
durchgeführt, bei denen die Kulturen<br />
bei höheren Zelldichten <strong>in</strong>duziert wurden, um<br />
e<strong>in</strong>en höheren, Zellmasse-geb<strong>und</strong>enen Produkttiter<br />
zu erreichen. Die Planung <strong>der</strong> Experimente<br />
erfolgte dabei nach den Methoden <strong>der</strong><br />
statistischen Versuchsplanung. Die E<strong>in</strong>gangsgrößen<br />
waren dabei die Induktionstemperatur<br />
sowie die optische Dichte zu Induktionsbeg<strong>in</strong>n.<br />
Als Zielgrößen wurden die Produktausbeute<br />
sowie das IB/sol-Verhältnis def<strong>in</strong>iert.<br />
Die Ergebnisse e<strong>in</strong>es Ansatzes im Multifermentersystem<br />
s<strong>in</strong>d <strong>in</strong> Abbildung 2 dargestellt.<br />
Dabei wurden dieselben Medien <strong>und</strong> Zufütterprofile<br />
für alle vier Fermenter verwendet,<br />
was <strong>der</strong> synchrone Verlauf <strong>der</strong> Biomassebildung<br />
(c XL ) wi<strong>der</strong>spiegelt. Es ist offensichtlich,<br />
dass bereits bei e<strong>in</strong>er Induktionstemperatur<br />
<strong>von</strong> 40°C im Vergleich zu 42°C die Phase <strong>der</strong><br />
Produktbildung leicht verlängert werden<br />
konnte. Bei e<strong>in</strong>er weiteren Herabsetzung <strong>der</strong><br />
Induktionstemperatur auf 38°C konnte bei<br />
gleichbleibend starker Expressionsleistung<br />
die Zielprote<strong>in</strong>bildung über den gesamten<br />
Prozess aufrechterhalten <strong>und</strong> damit <strong>der</strong> Produkttiter<br />
mit 4.5 g/L entscheidend verbessert<br />
werden.<br />
Durch e<strong>in</strong>e spätere Induktion <strong>der</strong> Kulturen<br />
(5 h nach Feedstart) <strong>in</strong> Komb<strong>in</strong>ation mit e<strong>in</strong>er<br />
Induktionstemperatur <strong>von</strong> 38°C konnte die<br />
Endkonzentration des Zielprote<strong>in</strong>s weiter<br />
auf 7,5 g/L gesteigert werden (Daten nicht<br />
dargestellt).<br />
Der E<strong>in</strong>fluss <strong>der</strong> betrachteten Faktoren<br />
unter Verwendung <strong>der</strong> statistischen Versuchsplanung<br />
ist <strong>in</strong> Abbildung 3 dargestellt.<br />
Daraus wird ersichtlich, dass e<strong>in</strong>e niedrige<br />
Induktionstemperatur <strong>in</strong> Verb<strong>in</strong>dung mit<br />
e<strong>in</strong>er hohen Zelldichte zu Induktionsstart zu<br />
den besten Produkttitern führt. E<strong>in</strong> Nachteil<br />
<strong>der</strong> ger<strong>in</strong>geren Induktionstemperatur ist dabei<br />
das schlechtere IB/sol-Verhältnis (70% zu<br />
30%) im Vergleich zur Induktion bei höheren<br />
Temperaturen. Durch die wesentlich höhere<br />
Produktbildung bei niedrigen Temperaturen<br />
kann <strong>der</strong> Verlust an IBs jedoch vernachlässigt<br />
werden.<br />
Im weiteren Verlauf des Projektes konnte<br />
die Produktkonzentration durch die Variation<br />
des verwendeten pflanzlichen Peptons <strong>und</strong><br />
e<strong>in</strong>e verlängerte Expressionsphase bis auf 11<br />
g/L erhöht werden. Anschließend wurde <strong>der</strong><br />
Prozess erfolgreich <strong>in</strong> den 10 L-Maßstab skaliert<br />
<strong>und</strong> – bed<strong>in</strong>gt durch den besseren Sauerstoffe<strong>in</strong>trag<br />
<strong>und</strong> die damit verb<strong>und</strong>ene längere<br />
Expressionsphase – e<strong>in</strong>e Produktkonzentration<br />
<strong>von</strong> mehr als 20 g/L erzielt werden.<br />
22 | 11. Jahrgang | Nr. 3/2010 LABORWELT<br />
Fazit<br />
In dem hier vorgestellten Projekt wurden <strong>in</strong><br />
e<strong>in</strong>em Multifermentersystem im Labormaßstab<br />
26 Kultivierungen für die Upstream-<br />
Prozessentwicklung durchgeführt. Durch die<br />
parallele Prozessführung werden dabei identische<br />
Startbed<strong>in</strong>gungen durch den E<strong>in</strong>satz<br />
<strong>der</strong> gleichen Vorkulturen sichergestellt <strong>und</strong> e<strong>in</strong><br />
schnelles <strong>und</strong> effizientes Parameterscreen<strong>in</strong>g<br />
ermöglicht. Durch e<strong>in</strong>e e<strong>in</strong>fache Automatisierung<br />
<strong>der</strong> Fermentationsprozesse wurde die<br />
Vergleichbarkeit <strong>und</strong> Reproduzierbarkeit <strong>der</strong><br />
Kultivierungen gewährleistet.<br />
Es wurden <strong>der</strong> E<strong>in</strong>fluss <strong>der</strong> verwendeten<br />
Medien <strong>und</strong> Medienzusätze, die Zufütterprofile<br />
für die Fed-Batch-Phase sowie die<br />
Induktionstemperatur <strong>und</strong> <strong>der</strong> Induktionszeitpunkt<br />
näher untersucht. Dabei wurden auch<br />
Verfahren <strong>der</strong> statistischen Versuchsplanung<br />
(DoE) e<strong>in</strong>gesetzt. Durch die Absenkung <strong>der</strong><br />
Induktionstemperatur konnte die Expressionsphase<br />
entscheidend verlängert <strong>und</strong> damit<br />
die Produktkonzentration deutlich gesteigert<br />
werden. Die Produktausbeute konnte dadurch<br />
um 1 L-Maßstab <strong>von</strong> 1,2 g/L auf 11 g/L nahezu<br />
verzehnfacht werden.<br />
Literatur<br />
[1] An<strong>der</strong>son, D.C., and Krummen, L., Curr. Op<strong>in</strong>. Biotechnol. 13<br />
(2002), 117-123<br />
[2] Sørensen, H.P., Mortensen, K.K., Microb. Cell. Fact. 4 (2005)<br />
[3] Mark A. Eiteman, Elliot Altman. (2006) Trends <strong>in</strong> Biotechnology,<br />
24 (11), 530-536<br />
[4] Delia M. Ramirez and William E. Bentley. (1995) Biotechnology<br />
and Bioeng<strong>in</strong>eer<strong>in</strong>g, 47, 596-608<br />
[5] Lars Strandberg and Sven-Olaf Enfors. (1991) Applied and<br />
Environmental Microbiology, 57 (6), 1669-167<br />
[6] Jong H. Choi, Ki. C. Keum, Sang Y. Lee. (2006) Chemical<br />
Eng<strong>in</strong>eer<strong>in</strong>g Science, 61, 876-885<br />
Korrespondenzadresse<br />
Dr. Christian Kaiser<br />
Richter-Helm BioLogics, Hamburg<br />
Habichthorst 30, 22459 Hamburg<br />
C.Kaiser@richter-helm-biologics.eu