Carbonat, Hydrogencarbonat und Kohlensäure
Carbonat, Hydrogencarbonat und Kohlensäure
Carbonat, Hydrogencarbonat und Kohlensäure
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
Auswertung <strong>und</strong> Diskussion<br />
Teil a.)<br />
- durch Zugabe von Trockeneis zum entionisiertem Wasser löst sich das CO 2 physikalisch im Wasser<br />
- dabei entsteht auch zum Teil <strong>Kohlensäure</strong>, die über <strong>Hydrogencarbonat</strong>ionen weiter zu <strong>Carbonat</strong>ionen reagieren<br />
CO 2 + H 2 O ⇀↽ H 2 CO 3 (1)<br />
H 2 CO 3 + H 2 O ⇀↽ HCO − 3 + H 3O + (2)<br />
HCO − 3 + H 2O ⇀↽ CO 2−<br />
3 + H 3 O + (3)<br />
- somit entstehen auch Hydroniumionen, die für den niedrigen pH-Wert verantwortlich sind<br />
- in der Ausgangslösung lassen sich aufgr<strong>und</strong> der obigen Reaktionen auch <strong>Carbonat</strong>ionen als Bariumcarbonat<br />
nachweisen (Ba 2+ + CO 2−<br />
3 → BaCO 3 ↑)<br />
- durch Kochen der Lsg. entweichen die physikalisch gelösten CO 2 -Moleküle <strong>und</strong> somit sind danach auch keine<br />
<strong>Carbonat</strong>ionen nachweisbar (das Gleichgewicht (1) liegt völlig auf der linken Seite)<br />
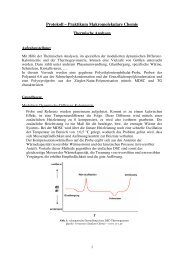
Teil b.)<br />
- das Soda liegt im Wasser dissoziert vor (Na 2 CO 3 → 2Na + + CO 2−<br />
3 )<br />
- die <strong>Carbonat</strong>ionen reagieren mit Wasser <strong>und</strong> es entsteht folgendes Gleichgewicht:<br />
CO 2−<br />
3 + H 2 O ⇀↽ HCO − 3 + OH− (4)<br />
- beim Ansäuern reagieren die <strong>Carbonat</strong>ionen zu <strong>Hydrogencarbonat</strong>ionen (siehe GGW (3)) <strong>und</strong> es wird der<br />
erste Äquivalenzpunkt erreicht (pH = 8)<br />
- durch weiteres Ansäuern reagieren die <strong>Hydrogencarbonat</strong>ionen zu <strong>Kohlensäure</strong> (siehe GGW (2))<br />
- ab pH = 7 zersetzt sich die <strong>Kohlensäure</strong> in Wasser <strong>und</strong> Kohlenstoffdioxid, welches aus der Lsg. entweicht<br />
(Reaktion(1))<br />
- der zweite Äquivalenzpunkt wird bei pH = 4 erreicht<br />
pH-Wert<br />
13<br />
12<br />
11<br />
10<br />
9<br />
8<br />
7<br />
6<br />
5<br />
4<br />
3<br />
2<br />
1<br />
×<br />
×<br />
×<br />
×<br />
0<br />
0 20 40 60 80 100 120 140 160 180 200<br />
Zugabe von HCl in Tropfen<br />
×<br />
×<br />
×<br />
×<br />
×<br />
×<br />
×<br />
Entsorgung bzw. Weiterverwendung der Edukte <strong>und</strong> Produkte<br />
Die Lösungen von Teil a.) werden gesammelt, die von Teil b.) verworfen. Fällung der Ba 2+ -Ionen mit Soda<br />
ergibt leicht abtrennbares BaCO 3 , das zu Ba(NO 3 ) 2 aufgearbeitet wird.