Download des Faltblattes - Ulrich Helmich
Download des Faltblattes - Ulrich Helmich
Download des Faltblattes - Ulrich Helmich
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
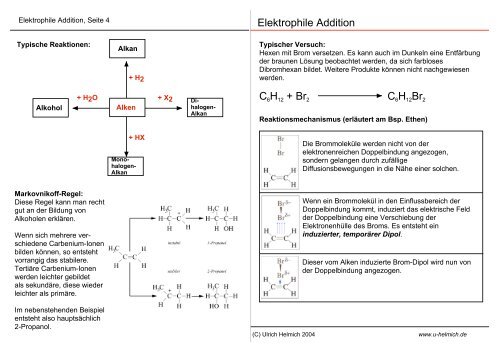
Elektrophile Addition, Seite 4<br />
Typische Reaktionen:<br />
Alkan<br />
+ H2<br />
Elektrophile Addition<br />
Typischer Versuch:<br />
Hexen mit Brom versetzen. Es kann auch im Dunkeln eine Entfärbung<br />
der braunen Lösung beobachtet werden, da sich farbloses<br />
Dibromhexan bildet. Weitere Produkte können nicht nachgewiesen<br />
werden.<br />
Alkohol<br />
+ H2O<br />
Alken<br />
+ X2<br />
Di-<br />
halogen-<br />
Alkan<br />
C 6 H 12 + Br 2 C 6 H 12 Br 2<br />
Reaktionsmechanismus (erläutert am Bsp. Ethen)<br />
+ HX<br />
Mono-<br />
halogen-<br />
Alkan<br />
Die Brommoleküle werden nicht von der<br />
elektronenreichen Doppelbindung angezogen,<br />
sondern gelangen durch zufällige<br />
Diffusionsbewegungen in die Nähe einer solchen.<br />
Markovnikoff-Regel:<br />
Diese Regel kann man recht<br />
gut an der Bildung von<br />
Alkoholen erklären.<br />
Wenn sich mehrere verschiedene<br />
Carbenium-Ionen<br />
bilden können, so entsteht<br />
vorrangig das stabilere.<br />
Tertiäre Carbenium-Ionen<br />
werden leichter gebildet<br />
als sekundäre, diese wieder<br />
leichter als primäre.<br />
Im nebenstehenden Beispiel<br />
entsteht also hauptsächlich<br />
2-Propanol.<br />
Wenn ein Brommolekül in den Einflussbereich der<br />
Doppelbindung kommt, induziert das elektrische Feld<br />
der Doppelbindung eine Verschiebung der<br />
Elektronenhülle <strong>des</strong> Broms. Es entsteht ein<br />
induzierter, temporärer Dipol.<br />
Dieser vom Alken induzierte Brom-Dipol wird nun von<br />
der Doppelbindung angezogen.<br />
(C) <strong>Ulrich</strong> <strong>Helmich</strong> 2004 www.u-helmich.de
Elektrophile Addition, Seite 2<br />
Seite 3<br />
Das Brom-Kation dringt in die<br />
Doppelbindung ein, es bildet sich als<br />
Zwischenprodukt das Bromonium-<br />
Ion. Die positive Ladung verteilt sich<br />
auf die beiden C-Atome und das Br-<br />
Atom.<br />
Belege für diesen Reaktionsmechanismus:<br />
Eines der in der Lösung vorhandenen Bromidionen<br />
wird nun von dem Bromonium-Ion angezogen.<br />
Dieser nucleophile Angriff erfolgt von der Rückseite<br />
<strong>des</strong> Bromonium-Ions aus. Experimente belegen<br />
diesen Mechanismus (siehe S. 3).<br />
Das Bromonium-Ion kann sich nun umlagern, so dass<br />
ein Carbenium-Ion entsteht (siehe MARKOWNIKOFF-<br />
Regel). Das Bromid-Anion lagert sich dann an das<br />
postive geladene C-Atom an.<br />
Wenn man Cyclohexen bromiert, tritt nur ein einziges von zwei<br />
möglichen 1,2-Dibrom-Cyclohexanen auf, nämlich das trans-Produkt.<br />
Das cis-Produkt wird nicht gebildet. Diese Tatsache bestätigt die<br />
Theorie vom RÜckseiten-Angriff.<br />
Führt man die Bromierung in einem wässrigen Lösemittel durch, so<br />
bildet sich ein zweites Reaktionsprodukt, nämlich das trans-1-Brom-<br />
2-Hydroxy-Cyclohexan. Dies bestätigt, dass ein positives Ion als<br />
Zwischenprodukt auftritt.<br />
Außerdem verläuft die Bromierung in einem polaren Lösemittel<br />
schneller als in einem unpolaren. Das zeigt, dass das Brommolekül<br />
polarisiert und dann heterolytisch gespalten wird. Es kann sich also<br />
um keinen Radikalmechanismus handeln.