Leseprobe Themenblock 3 herunterladen
Leseprobe Themenblock 3 herunterladen
Leseprobe Themenblock 3 herunterladen
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
11<br />
Arterielle Blutgasanalyse (BGA)<br />
53<br />
Indikation<br />
Eine arterielle Blutgasanalyse (BGA) dient u.a. zur Überprüfung der Gasaustauschfunktion der Lunge und wird vor allem bei<br />
respiratorisch insuffizienten und generell bei beatmeten Patienten durchgeführt, um die Beatmungsparameter richtig einzustellen<br />
bzw. dem aktuellen Bedarf anzupassen. Dafür werden die Partialdrücke von Sauerstoff (pO 2 ), von Kohlendioxid (pCO 2 )<br />
und der Sauerstoffsättigung (sO 2 ) bestimmt.<br />
Zusätzlich kann der Säure-Base-Haushalt mit Hilfe des pH-Wertes, der Konzentration des Standardbikarbonats (HCO 3<br />
- ) und<br />
des Basenüberschusses (Base, BE) auf eine eventuelle Entgleisung überprüft werden. Die meisten Messgeräte liefern<br />
außerdem die Konzentration der Elektrolyte Natrium (Na + ), Kalium (K + ), Calcium (Ca ++ ) und Chlorid (Cl - ) gleich mit. Die<br />
Referenzbereiche für die wichtigsten BGA-Parameter sind in der Tab. 53.1 aufgelistet (vgl. S. 115/120), variieren allerdings von<br />
Labor zu Labor.<br />
Vorbereitung<br />
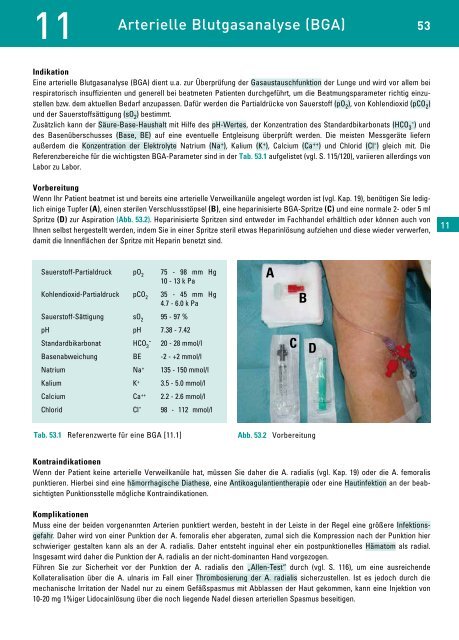
Wenn Ihr Patient beatmet ist und bereits eine arterielle Verweilkanüle angelegt worden ist (vgl. Kap. 19), benötigen Sie lediglich<br />
einige Tupfer (A), einen sterilen Verschlussstöpsel (B), eine heparinisierte BGA-Spritze (C) und eine normale 2- oder 5 ml<br />
Spritze (D) zur Aspiration (Abb. 53.2). Heparinisierte Spritzen sind entweder im Fachhandel erhältlich oder können auch von<br />
Ihnen selbst hergestellt werden, indem Sie in einer Spritze steril etwas Heparinlösung aufziehen und diese wieder verwerfen,<br />
damit die Innenflächen der Spritze mit Heparin benetzt sind.<br />
11<br />
Sauerstoff-Partialdruck pO 2<br />
75 - 98 mm Hg<br />
10 - 13 k Pa<br />
Kohlendioxid-Partialdruck pCO 2<br />
35 - 45 mm Hg<br />
4.7 - 6.0 k Pa<br />
Sauerstoff-Sättigung sO 2<br />
95 - 97 %<br />
pH pH 7.38 - 7.42<br />
Standardbikarbonat HCO 3<br />
- 20 - 28 mmol/l<br />
Basenabweichung BE -2 - +2 mmol/l<br />
Natrium Na + 135 - 150 mmol/l<br />
Kalium K + 3.5 - 5.0 mmol/l<br />
Calcium Ca ++ 2.2 - 2.6 mmol/l<br />
Chlorid Cl - 98 - 112 mmol/l<br />
A<br />
C<br />
B<br />
D<br />
Tab. 53.1 Referenzwerte für eine BGA [11.1]<br />
Abb. 53.2 Vorbereitung<br />
Kontraindikationen<br />
Wenn der Patient keine arterielle Verweilkanüle hat, müssen Sie daher die A. radialis (vgl. Kap. 19) oder die A. femoralis<br />
punktieren. Hierbei sind eine hämorrhagische Diathese, eine Antikoagulantientherapie oder eine Hautinfektion an der beabsichtigten<br />
Punktionsstelle mögliche Kontraindikationen.<br />
Komplikationen<br />
Muss eine der beiden vorgenannten Arterien punktiert werden, besteht in der Leiste in der Regel eine größere Infektionsgefahr.<br />
Daher wird von einer Punktion der A. femoralis eher abgeraten, zumal sich die Kompression nach der Punktion hier<br />
schwieriger gestalten kann als an der A. radialis. Daher entsteht inguinal eher ein postpunktionelles Hämatom als radial.<br />
Insgesamt wird daher die Punktion der A. radialis an der nicht-dominanten Hand vorgezogen.<br />
Führen Sie zur Sicherheit vor der Punktion der A. radialis den „Allen-Test“ durch (vgl. S. 116), um eine ausreichende<br />
Kollateralisation über die A. ulnaris im Fall einer Thrombosierung der A. radialis sicherzustellen. Ist es jedoch durch die<br />
mechanische Irritation der Nadel nur zu einem Gefäßspasmus mit Abblassen der Haut gekommen, kann eine Injektion von<br />
10-20 mg 1%iger Lidocainlösung über die noch liegende Nadel diesen arteriellen Spasmus beseitigen.
72<br />
Venenverweilkanülen (Arm)<br />
14<br />
Nun öffnen Sie den Stauschlauch ( ) langsam – nicht schnappen lassen (Abb. 72.1) und legen einen Tupfer zwischen<br />
Haut und Kanülenöffnung. Wenn Sie die innere Stahlkanüle hinausziehen ( ), fixieren Sie dabei die Verweilkanüle wieder<br />
( in Abb. 72.2) und drücken die Vene am proximalen, tastbaren Ende des Schlauches ab ( ), damit kein Blut zurückläuft<br />
(Abb. 72.3). Werfen Sie die Stahlkanüle sicher in einer bereitstehenden Abwurfbox ab!<br />
Abb. 72.1 Staubinde lösen Abb. 72.2 Stahlkanüle herausziehen Abb. 72.3 Vene abdrücken<br />
14<br />
Abb. 72.4 Probeinjektion Abb. 72.5 freier Abfluss? Abb. 72.6 oder Paravasat?<br />
Dann drehen Sie die bereit liegende Spritze mit isotoner NaCl-Lösung im Uhrzeigersinn auf und führen eine schnelle<br />
Testinjektion ( ) von 2 - 5 ml durch (Abb. 72.4): Achten Sie darauf, dass die Flüssigkeit sofort frei abfließen kann und sich in<br />
der Nachbarschaft der Punktionsstelle ( ) kein Paravasat bildet (Abb. 72.5). Die Abb. 72.6 zeigt eine solche „Beulenbildung“<br />
( ) bei Kanülenfehllage.<br />
Dann erfolgt die Fixierung der Verweilkanüle an der Haut mit Pflasterstreifen beliebiger Art (Abb. 72.7) und einem sterilen<br />
Verband, der im Idealfall transparent ist (Abb. 72.8), um spätere Rötungen an der Einstichstelle auch ohne Verbandswechsel<br />
schneller erkennen zu können (Abb. 72.9a) als bei nicht-transparenten Verbandsets (Abb. 72.9b).<br />
Abb. 72.7 Pflasterfixierung Abb. 72.8 transparentes Pflaster Abb. 72.9 Schutzverband<br />
a<br />
b
84<br />
Intramuskuläre (i.m.) Injektion<br />
15<br />
Nun halten Sie mit der linken Hand einen Tupfer bereit ( ) und ziehen die Spritze mit Kanüle heraus ( in Abb. 84.1).<br />
Anschließend drücken Sie den Tupfer fest auf die Einstichstelle und können auch das Medikament mit kreisenden<br />
Bewegungen ( ) dabei etwas verteilen (Abb. 84.2). Abschließend schützen Sie die Punktionsstelle durch ein Pflaster<br />
(Abb. 84.3).<br />
Abb. 84.1 Spritze + Nadel entf. Abb. 84.2 Kompression Abb. 84.3 Pflasterschutz<br />
15<br />
Alternative Punktionsstellen<br />
Besonders für Impfungen und für die Injektion kleinerer Volumina unter 2 ml eignet sich alternativ die Regio deltoidea an<br />
der Schulter bzw. am proximalen Oberarm (Abb. 84.4). Achten Sie darauf, dass der Patient im Sitzen den Arm locker hängen<br />
lassen kann (Abb. 84.5) und ertasten Sie die dickste Ausdehnung des M. deltoideus ( ), die Sie z.B. mit dem Fingernagel<br />
markieren können (Abb. 84.6). Nach einer sorgfältigen Sprühdesinfektion (Abb. 84.7) können Sie den Muskel mit der linken<br />
Hand etwas komprimieren ( ) und dann in den „dickeren“ Muskelbauch besser einstechen ( in Abb. 84.8). Stechen<br />
Sie hier nicht zu tief ein (Abb. 84.9) und denken Sie an eine Aspiration ( in Abb. 84.10), bevor Sie das Medikament injizieren<br />
( in Abb. 84.11). Dabei gelten dieselben Vorsichtsmaßnahmen wie auf S. 82.<br />
Abb. 84.4 Regio deltoidea Abb. 84.5 Abb. 84.6 Markierung Abb. 84.7 Desinfektion<br />
Armhaltung locker<br />
Abb. 84.8<br />
leichte<br />
Kompression<br />
Abb. 84.9<br />
Einstich<br />
(nicht zu tief)<br />
Abb. 84.10 Aspiration<br />
Abb. 84.11 Injektion