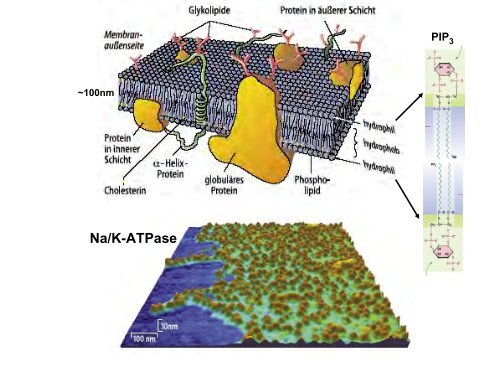
Membran, Nerv (Skript)
Membran, Nerv (Skript)
Membran, Nerv (Skript)
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
~100nm<br />
Na/K-ATPase<br />
PIP 3
1. Fick´sches Diffusionsgesetz<br />
F<br />
V = D (C 1 - C2)<br />
Diffusion<br />
V Diffusion = Diffusionsstrom, z.B. Gasstrom<br />
~<br />
Löslichkeit<br />
Mol.gew.<br />
F = Diffusionsfläche<br />
d = Diffusionsstrecke<br />
(C 1 - C2 C2 )<br />
= Konzentrationsdifferenz, z.B. Partialdruckdifferenz<br />
zwischen Alveole und Blut<br />
Diffusion braucht 53 Tage für 10 cm<br />
12,75 h für 1 cm<br />
7,5 min für 1 mm<br />
0,46 ms für 1 micrometer<br />
4,6 �s für 0,1 �m = 100nm (<strong>Membran</strong>dicke)<br />
d
Äquivalentmasse =<br />
mol / Wertigkeit<br />
Einheit: val<br />
(engl.: eq)<br />
□ val und mol sind<br />
für 1-wertige Ionen<br />
gleich<br />
□ für 2-wertige<br />
Ionen gilt:<br />
1 val Ca++ =<br />
1 mol Ca++ / 2<br />
→<br />
1 mol Ca++ =<br />
2 val Ca++<br />
Zucker, Glycogen<br />
Aminosäuren<br />
Fettsäuren, Fette<br />
etc.
Ursachen des <strong>Membran</strong>potentials<br />
1. Diffusionspotential 90%<br />
2. Donnan-Potential 2%<br />
3. Elektrogene<br />
z.B. Na/K-ATPase (3 + /2 - )<br />
Ionenpumpen 8%
Zu 1.<br />
Poren = Kanäle<br />
<strong>Membran</strong> insbesondere durchlässig für K + , weniger für Na +<br />
und Cl -
In einen 1000x tieferen Würfel (als oben) werden von intranach extrazellulär<br />
nur ca. 6000<br />
K + -Ionen<br />
= 1 nm<br />
(0,006%) verschoben, um K + -Gleich-<br />
gewichtspotential zu erreichen!<br />
Zum Vergleich:<br />
1 µm3 der intrazellulären Flüssigkeit enthält 108 K + -Ionen (100 000 000 K + )
Spannungsunabhängige<br />
K + -Kanäle (z.B.KCNK)<br />
= Leckkanäle<br />
- +
* *<br />
*<br />
*unspezifische Kationenkanäle<br />
TWIC<br />
TREK1-3<br />
*<br />
*<br />
TRAAK<br />
TASK1-3 Am Ruhemembranpotential (RMP) beteiligt
Nernst-<br />
Gleichung<br />
Gleichgewichtspotential =<br />
E Ion<br />
E = equilibrium<br />
R = allgemeine Gaskonstante (Teilchenzahl)<br />
F = Faradaykonstante (Ladung der Teilchen)<br />
T = absolute Temperatur (°K)<br />
z = Wertigkeit des betreffenden Ions<br />
für Säugetier und<br />
Körpertemperatur<br />
E Ion<br />
=<br />
R . T [Ion] außen<br />
z .<br />
ln<br />
F [Ion] innen<br />
-61 mV [Ion] innen<br />
log<br />
z [Ion] außen
Gleichgewichtspotential Kalium<br />
E Kalium =<br />
=<br />
-61 mV [K + ] innen<br />
z [K + log<br />
] außen<br />
-61 mV 145 mM<br />
log<br />
1 4,5 mM<br />
=<br />
-91 mV
Gleichgewichtspotential Natrium<br />
E Natrium =<br />
-61 mV [Na + ] innen<br />
z [Na + log<br />
] außen<br />
-61 mV 12 mM<br />
log<br />
1 145 mM<br />
=<br />
+ 66 mV
Fettzelle<br />
Neuron<br />
Muskel<br />
Diese Abweichung ist ein Hinweis auf eine gewisse Ruheleitfähigkeit<br />
für Na + , die umso mehr zum Tragen kommt je weiter sich das <strong>Membran</strong>potential<br />
vom Na-Gleichgewichtspotential entfernt !<br />
3
Gleichgewichtspotential Calcium<br />
E Calcium =<br />
-61 mV [Ca ++ ] innen<br />
z [Ca ++ log<br />
] außen<br />
-61 mV 0,00013 mM<br />
log<br />
2 1,3 mM<br />
=<br />
+ 120 mV
Na + -K + -ATPase transportiert<br />
3 Na + nach außen u. 2 K + nach innen unter 1 ATP-Verbrauch<br />
Pumprate ↑ wenn ↑ [Na + ] intrazellulär ( bzw. ↑ [K + ] extrazellulär )
Goldman-Gleichung:<br />
P Permeabilitätskoeffizienten<br />
der <strong>Membran</strong><br />
In<br />
P K<br />
Ruhe:<br />
: P Na<br />
: P Cl<br />
= 1 : 0,04 : 0,45<br />
d.h. die Permeabilität ist für K + -Ionen<br />
25mal so groß<br />
wie für Na + -Ionen<br />
µ . R<br />
Permeabilität P=<br />
. T<br />
d . F<br />
µ= Ionenbeweglichkeit<br />
d=Dicke der <strong>Membran</strong><br />
E M<br />
�<br />
R<br />
.T<br />
F<br />
� � �<br />
PNa [ Na ] � o PK [ K ] � o PCl [ Cl ] i<br />
ln<br />
� � �<br />
P [ Na ] � P [ K ] � P [ Cl ]<br />
Na i K i Cl o
1/R =<br />
*Ohm`sches Gesetz R = U / I<br />
g = Leitfähigkeit [pS]<br />
I = U / R<br />
I = U .<br />
Die Größe des Ionenstroms über die <strong>Membran</strong> wird bestimmt<br />
durch die treibende Kraft : U = EM -EIon *<br />
zu Deutsch:<br />
Georg Simon Ohm, 1789-1854,<br />
aus Erlangen<br />
IIon= (EM ( Differenz zwischen aktuellem <strong>Membran</strong>-<br />
speziellem Gleichgewichtspotential )<br />
g<br />
-EIon) . gIon und<br />
mal Leitfähigkeit des Ions ergibt die Ionenstromstärke
GHK-Gleichung (Goldman – Hodgkin – Katz)<br />
„constant<br />
oder<br />
field<br />
equation“<br />
(weil sie, streng genommen, nur für konstante elektrische Felder gilt)<br />
E <strong>Membran</strong><br />
E M =<br />
=<br />
g K<br />
g M<br />
gKEK + gNaENa g K<br />
+ g Na<br />
E K + g Na<br />
g M<br />
E Na<br />
+ gCaECa + g Ca<br />
+ gClECl + gCl = gges. = gM + g Ca<br />
g M<br />
E Ca<br />
+ g Cl<br />
g M<br />
E Cl<br />
oder<br />
-91 mV +66 mV +120 mV zwischen -25 mV<br />
und -90 mV, je nach<br />
Zelltyp<br />
.<br />
. . . . .
Ein<br />
Gleichgewichtspotential<br />
E Chlorid =<br />
von Chlorid<br />
-61 mV [Cl- ] innen<br />
z [Cl- log<br />
] außen<br />
-61 mV 4 mM<br />
log<br />
-1 120 mM<br />
=<br />
-90 mV
2<br />
Na-K-2Cl-<br />
Transport<br />
(blockiert durch<br />
Furosemid<br />
= Lasix R )<br />
K-Cl-Cotransporter
NKCC1<br />
Gleichgewichtspotential Chlorid in sensorischen<br />
Neuronen (ggl. spinalia, trigem., nodosum, jugulare)<br />
innen<br />
KCC2<br />
E Chlorid =<br />
-61 mV [Cl- ] innen<br />
z [Cl- log<br />
] außen<br />
-61 mV 45 mM<br />
log<br />
-1 120 mM<br />
_~<br />
-<br />
26<br />
mV
Präsynaptische Hemmung (durch Depolarisation!)<br />
(Interneuron)<br />
GABA A<br />
GABA<br />
Cl<br />
Glu.<br />
-<br />
AMPA-<br />
(sensorisch)
“Umkehrpotential”<br />
am Beispiel von Cl -<br />
in (postsynaptischen) Neuronen<br />
stark<br />
depolarisiert<br />
schwach<br />
depolarisiert<br />
MP bei völliger<br />
Ruhe ~ E Cl<br />
hyperpolarisiert<br />
g Cl<br />
Glycin<br />
GABA<br />
g Cl<br />
Umkehrpotential<br />
g Cl<br />
Cl -<br />
1 chemischer Gradient<br />
2 elektrischer Gradient<br />
3 Differenz (Nettogradient)
Schwellenpotential<br />
(= Schwelle)<br />
normal ca. 20 mV<br />
über Ruhepotential<br />
Strompulse<br />
elektr.Reize<br />
„Lokale Antwort“<br />
= unterschwellige Antwort<br />
→ nicht fortgeleiteter<br />
Erregungszustand
ei “Vergiftung<br />
Vergiftung” der K + -Kan Kanäle le<br />
durch 4-Aminopyridin 4 Aminopyridin +<br />
Tetraethylammonium<br />
Ursachen der Nachhyperpolarisation:<br />
► gK ist noch nach Erreichen des ursprünglichen Ruhepotentials erhöht<br />
► auch eine erhöht Pumprate der Na + -K + -ATPase kann dazu beitragen<br />
(nur nach Salven von Aktionspotentialen)
Evolution der <strong>Nerv</strong>enfasern verbessert deren Ökonomie
Nachhyperpolarisation<br />
Nachdepolarisation
Aktionspotential<br />
<strong>Nerv</strong> :
�<br />
�<br />
Differenzverstärker<br />
nur bei unterbrochener<br />
Leitung von E1 nach E2<br />
oder bei fern liegender<br />
E2 (pseudounipolare<br />
Ableitung)
einwärts auswärts<br />
Na + K +<br />
Ort der<br />
Ableitung<br />
Ausbreitungsrichtung des AP<br />
sind die “elektrotonische” Grundlage<br />
der Weiterleitung des Aktionspotentials
Strömchentheorie<br />
(nach Hermann)<br />
Dipol<br />
Dipol weist (außen) von<br />
– nach +<br />
(erregt) (nicht erregt)<br />
↓
Kontinuierliche AP-Leitung<br />
im Beispiel:<br />
Fortpflanzungsgeschwindigkeit des AP = 1 m/s
Ranvierscher<br />
Schnürring<br />
Immuncytochemische<br />
Färbungen<br />
(Fehlfarben)<br />
rot: versch. Na + -Kanäle<br />
blau/grün: versch. K + -Kanäle
Schwann-Zellen
Saltatorische<br />
Erregungsweiterleitung
Zeitkonstante �<br />
R i<br />
= R <strong>Membran</strong><br />
.<br />
C <strong>Membran</strong>
Längskonstante<br />
�<br />
~<br />
R <strong>Membran</strong><br />
R innen<br />
:
Wovon hängt die Leitungsgeschwindigkeit der Erregung (AP) ab ?<br />
Einflüsse auf die Leitungsgeschwindigkeit<br />
► Größe<br />
► Abstand<br />
► Temperatur<br />
des Na + -Einstroms<br />
Ruhepotential<br />
→<br />
je<br />
–<br />
→<br />
je<br />
Schwelle<br />
höher, desto<br />
(LG):<br />
größer, desto<br />
→<br />
größer<br />
je<br />
größer<br />
kleiner, desto<br />
LG ( Q 10 ~ 1,8 -<br />
► Faserdurchmesser� je dicker, desto größer LG<br />
-wegen elektrotonischer<br />
Zeitkonstante �→<br />
�<br />
= R M<br />
·C M<br />
(R M<br />
je kleiner �,<br />
LG (Alter )<br />
größer<br />
2 )<br />
Ausbreitung der Potentialänderung<br />
desto größer LG<br />
<strong>Membran</strong>widerstand, C M<br />
R M ändert sich nicht mit Axondurchmesser<br />
C M<br />
wächst zwar mit der<br />
Oberfläche (C M<br />
~ 2r<br />
<strong>Membran</strong>kapazität)<br />
.<br />
����<br />
:<br />
LG<br />
sinkt aber mit Dicke<br />
und Zahl der Myelinschichten (1/Cges=1/C1+1/C2+…1/Cn) Cave : Wenn das Ruhepotential durch Depolarisation in Schwellennähe rückt,<br />
kommt es zur Inaktivierung der Na-Kanäle und ... letztlich zur Verlangsamung<br />
der NLG (z.B. diabetische Polyneuropathie ).
ff. Leitungsgeschwindigkeit<br />
-sie steigt mit der<br />
-<br />
-<br />
Längskonstante<br />
�<br />
~<br />
�der elektrotonischen Ausbreitung� :<br />
R <strong>Membran</strong><br />
R innen<br />
steigt mit dem <strong>Membran</strong>widerstand,<br />
d.h. mit dem Grad der Myelinisation<br />
(RM ges=R1+R2+…Rn<br />
AP könnte mehrere Schnürringe überspringen<br />
(“Sicherheitsfaktor”),<br />
tut’s aber im gesunden <strong>Nerv</strong>en nicht. Warum?<br />
)<br />
steigt mit dem Axonkaliber (sinkendem<br />
Innenwiderstand) Ri ~ 1/r2 . �
Afferenzen Erlanger-<br />
Gasser Efferenzen<br />
Haut<br />
A� Mechanozeption<br />
A� Thermozeption (kalt),<br />
Nozizeption<br />
C Thermozeption (warm),<br />
Nozizeption<br />
Lloyd-<br />
Hunt<br />
Peripherer <strong>Nerv</strong><br />
Muskel<br />
C Vasokonstriktoren,<br />
Sudomotoren, Piloarrektoren<br />
Ia Intrafusale Spindelafferenzen �� -Motoneurone<br />
Ib Sehnenorgane<br />
A�<br />
II sekund. Spindelafferenzen<br />
III Mechanorezeption,<br />
A� II ��-Motoneurone<br />
Nozizeption<br />
A�<br />
IV Mechanorezeption,<br />
Nozizeption<br />
C IV Vasokonstriktoren
TTX<br />
www.dr-bernhard-peter.de/Apotheke/Gifte/Tetrodotoxin.htm
Funktionelle Anatomie des Kugelfisches;<br />
die besonders giftigen Organe sind rot unterlegt
Mammalian voltage-gated sodium channel<br />
� subunits<br />
Type<br />
NaV1.1 NaV1.2 NaV1.3 NaV1.4 NaV1.5 NaV1.6 NaV1.7 NaV1.8 Na V<br />
Gene<br />
Symbol<br />
SCN1a<br />
SCN2a<br />
SCN3a<br />
SCN4a<br />
SCN5a<br />
Name<br />
type I<br />
type II<br />
type III<br />
SkM1 (�1)<br />
SkM2 (�1)<br />
Primary<br />
Tissue<br />
CNS, heart<br />
CNS<br />
fetal brain<br />
skeletal muscle<br />
heart<br />
Present<br />
in DRG<br />
+<br />
+<br />
+ --<br />
Function<br />
in vitro<br />
+<br />
+<br />
+<br />
+<br />
+<br />
+<br />
SCN8a<br />
SCN9a<br />
NaCh6<br />
PN1<br />
CNS, glial cells<br />
SCG, CNS<br />
+<br />
+ +<br />
1.9<br />
SCN10a<br />
SCN11a<br />
SCN7a<br />
SNS (PN3)<br />
NaN (SNS2)<br />
PNS<br />
PNS<br />
+<br />
+<br />
+<br />
+<br />
+<br />
TTX<br />
sensitivity<br />
Na X - ( )<br />
courtesy John N. Wood<br />
+<br />
+<br />
+<br />
+<br />
-<br />
+<br />
+<br />
-<br />
-<br />
NaG sciatic nerve, lung +
3-dimensionale<br />
Ansicht
TTX<br />
α-UE ~260kDa<br />
Ionenkanal, ein Tetramer aus<br />
4 Proteinen, je 6 Transmembrandomänen<br />
V-VI poreform. unit<br />
IV-voltage sensor<br />
Selektivitätsfilter<br />
Inaktivierungschleife<br />
TTX, Phosphorylierung<br />
(e.g.lidocain)<br />
β-UE~33kDa<br />
Verankerung<br />
Modulation<br />
Verteilung -> Funktionalität
Selektivitätsfilter
“steady state”- Inaktivierung und Aktivierung<br />
sind potentialabhängig<br />
50%<br />
inaktiviert<br />
100%<br />
50%<br />
0%<br />
Aktivierung
Nav1.7 is a critical switch at nerve terminals<br />
Sensitisation<br />
amplification<br />
Sensory Transduction Spike<br />
Action Potential<br />
prim.depolarisation trigger inactivation resist.<br />
Nav1.9 Nav1.7 Nav1.8<br />
Peter W. Reeh<br />
Dept. Physiology<br />
courtesy John N. Wood<br />
TRPs<br />
ASICs<br />
P2Xs<br />
GPCRs<br />
etc<br />
Em (mV)<br />
3.5<br />
-130 100<br />
-4<br />
current<br />
(nA)<br />
(Nav<br />
1.1<br />
etc.)<br />
University of<br />
Erlangen-Nuremberg<br />
Erlangen Nuremberg<br />
Germany
�����<br />
Human mutations in<br />
Gain of function<br />
Nav1.7 α-subunits subunits<br />
mod. from Dib-Hajj et al. 2009 (Brain Res. Rev.)<br />
on chrom.2<br />
�����<br />
Loss of function
Sensitisation<br />
amplification<br />
Nav1.9 Nav1.7 Nav1.8<br />
courtesy John N. Wood<br />
Nav1.8<br />
Sensory Transduction Spike<br />
Action Potential<br />
prim.depolarisation trigger inactivation resist.<br />
TRPs<br />
ASICs<br />
P2Xs<br />
GPCRs<br />
etc<br />
resists inactivation<br />
Em (mV)<br />
3.5<br />
-130 100<br />
-4<br />
current<br />
(nA)<br />
(Nav<br />
1.1<br />
etc.)
Fraction of Current<br />
Slow steady-state steady state inactivation of Na V1.8<br />
1.8<br />
but not Na V1.7<br />
1.7 currents is cold resistant<br />
in transfected HEK293 cells<br />
g Nav1.7 h Nav1.8<br />
i<br />
1<br />
.8<br />
.6<br />
.4<br />
.2<br />
0<br />
-120 -100 -80 -60 -40 -20<br />
prepulse potential, mV<br />
Fraction of Current<br />
1<br />
.8<br />
.6<br />
.4<br />
.2<br />
0<br />
-120 -100 -80 -60 -40 -20<br />
prepulse potential, mV<br />
Normalized Current<br />
n.s.<br />
current at 30 °C<br />
*<br />
-120<br />
mV -80<br />
mV<br />
20°C<br />
*<br />
Nav1.8<br />
Nav1.7<br />
*<br />
-120<br />
mV -80<br />
mV<br />
V h<br />
10°C Temp.<br />
Andreas Leffler in :<br />
Zimmermann et al. (2007) Nature
Painless freezing Na V1.8<br />
1.8 knockout<br />
Photo<br />
C. Forster<br />
Cold Plate<br />
**<br />
(0°C) (0 C)<br />
WT NaV1.8-/- Cruz M. Cendan in :<br />
Zimmermann et al. (2007) Nature
1. Reiz 2. Reiz<br />
Refraktärzeit<br />
chwelle
It -<br />
Kurve<br />
Rheobase: minimale Reizstärke, die bei „unendlicher“ Reizdauer eben noch eine<br />
Erregung auslösen kann (eine Reizdauer von 8 - 10 ms ist bereits ∞ lang)<br />
Chronaxie: Reizdauer bei doppelter Rheobase = geringster Aufwand an Reiz -<br />
energie (I x t = minimal)
Akkommodation
Wechselstromreizung von <strong>Nerv</strong>en
Ca ++ /H + -<br />
Abhängigkeit der Erregbarkeit<br />
und/oder [H + ]<br />
respiratorische Alkalose,<br />
z.B. Hyperventilation� Tetanie<br />
und/oder [H + ] : metabolische<br />
Azidose,<br />
z.B. Coma diabeticum