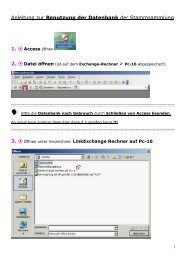
Western Blot
Western Blot
Western Blot
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
<strong>Western</strong> <strong>Blot</strong>ting<br />
Nach der Auftrennung der Proteinextrakte über Polyacrylamidgele in SDS<br />
PAGE-Puffer, erfolgt die Übertragung der aufgetrennten Proteine auf eine<br />
Nitrocellulosemembran.<br />
Als Membran entweder:<br />
• Westran Clear Signal, Schleicher & Schuell<br />
(Membran zuerst in Methanol ca. 10 Sekunden befeuchten, dann<br />
mindestens 10 Minuten in Anoden-Lösung I inkubieren)<br />
• Whatman Protran Nitrocellulose Transfer Membran<br />
(Membran ca. 10 Sekunden in ddH 2 O befeuchten, dann mindestens 10<br />
Minuten in Anoden-Lösung I inkubieren)<br />
Als blotting Papier:<br />
• Whatman 3MM-Chromatographie Papier<br />
1. Inkubiere 6 Lagen Papier je <strong>Blot</strong> in Kathodenlösung<br />
2. Inkubiere 3 Lagen Papier je <strong>Blot</strong> in Anodenlösung I<br />
3. Inkubiere 6 Lagen Papier je <strong>Blot</strong> in Anodenlösung II<br />
• Für mindestens 10 Minuten<br />
Größe für die Membran und das 3MM-Papier: 5.5 x 9 cm<br />
Die Graphit-Elektroden (Anode, Kathode) mindestens eine Stunde vor der<br />
Benutzung in deionisiertem Wasser wässern (in einer Plastikwanne mit Wasser<br />
überschichten). Vor dem Gebrauch, Elektroden abtrocknen (mit<br />
Zellstofftüchern).
Aufbau der <strong>Blot</strong>s nach folgendem Schema<br />
Den elektrophoretischen Transfer 1. 30 Stunden bei 100 mA/<strong>Blot</strong> durchführen.<br />
• Nach elektrophoretischem Transfer, Membran mindestens 1 Stunde bei<br />
RT (oder auch über Nacht bei 4°C) in Blockierungspuffer (6 %<br />
Magermilchpulver in TBS/Tween, soweit nicht anders verordnet)<br />
inkubieren<br />
• Membran mit dem primären Antikörper verdünnt im Blockierungspuffer<br />
inkubieren (ca 10 ml pro <strong>Blot</strong>). Mindestens 1 Stunde bei RT, oder über<br />
Nacht bei 4 °C inkubieren<br />
• Membran anschließend 3 x 5 Minuten mit TBS/Tween (ca 50 ml/<strong>Blot</strong>)<br />
waschen<br />
• Inkubation mit sekundären Antikörper (meist 1 : 10.000) in<br />
Blockierungspuffer für 1 Stunde bei RT (darauf achten, den richtigen<br />
Antikörper zu verwenden, z.B. anti RAT, RABBIT, MOUSE usw. IgG,<br />
Peroxidase oder Alkalische Phosphatase-Konjugat)<br />
• Membran anschließend 3 x 5 Minuten mit TBS/Tween (ca 50 ml/<strong>Blot</strong>)<br />
waschen<br />
• Entwicklung des <strong>Blot</strong>s mittels enhanced chemiluminescence (ECL)
1. Membran mit 200 µl/<strong>Blot</strong> frisch angesetzter ECL-Lösung (Super Signal<br />
West Dura Kit) für 5 Minuten inkubieren ( ECL-Lösung mit einem Spatel<br />
vorsichtig, ohne die Membran zu verletzen gleichmäßig über die Membran<br />
verteilen)<br />
ODER<br />
2. Membran in 20 ml “ Homemade” ECL-Lösung für 2 Minuten inkubieren<br />
Nach der Inkubation, ECL-Lösung von der Membran abtropfen lassen, <strong>Blot</strong> in<br />
Folie legen, in der Dunkelkammer auf Röntgenfilm exponieren, Film entwickeln,<br />
und das herrliche Resultat genießen.
Lösungen und Puffer:<br />
Kathodenlösung<br />
40 mM 6-Aminohexansäure<br />
20 % (v/v) Methanol<br />
Anodenlösung I<br />
0,3 M Tris/HCl pH 10,4<br />
20 % (v/v) Methanol<br />
Anodenlösung II<br />
25 mM Tris/HCl pH 10,4<br />
20 % (v/v) Methanol<br />
TBS (Tris-Buffered Saline, 25 mM Tris)<br />
8 g NaCl<br />
0,2 g KCl<br />
3 g Tris<br />
in 800 ml H2O lösen, pH auf 7,4 einstellen, mit H2O auf 1 l auffüllen<br />
(20x konzentriert herstellen)<br />
TBS/Tween<br />
0,1 % (v/v) Tween 20 in TBS<br />
Blockierungslösung<br />
6 % (w/v) Magermilchpulver in TBS Tween<br />
ECL<br />
Super Signal® West Dura Trial Kit (Pierce) (Komponente 1 : 1 mischen)<br />
Homemade ECL<br />
p-Coumarsäure (90 mM in DMSO)<br />
3-aminophtalhydrazide (Luminol) (250 mM in DMSO)<br />
1 M Tris/HCL ph 8,5<br />
30 % H 2 O 2<br />
• 5 ml Tris/HCL pH 8,5<br />
• 45 ml ddH 2 O<br />
• 110 µl Coumarsäure<br />
• 250 µl Luminol<br />
Ca 2-3 Wochen im Kühlschrank<br />
haltbar. (im dunkeln lagern)<br />
• 30 µl H 2 O 2 je 10 ml Mix hinzugeben. (H 2 O 2 erst zugeben, wenn man die Reaktion<br />
starten möchte)