Jens Christoffers - Organische Chemie - Christoffers
Jens Christoffers - Organische Chemie - Christoffers
Jens Christoffers - Organische Chemie - Christoffers
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
<strong>Jens</strong> <strong>Christoffers</strong> Grundlagen der <strong>Organische</strong>n <strong>Chemie</strong> 26.10.2010<br />
Grundlagen der <strong>Organische</strong>n <strong>Chemie</strong><br />
Vorlesung im WS 2010/2011<br />
1. Einführung 1<br />
1.1 Die wunderbare Welt der <strong>Organische</strong>n <strong>Chemie</strong><br />
1.2 Kohlenstoff – ein ganz besonderes Element 4<br />
2. Die kovalente Bindung 5<br />
2.1 Atomorbitale<br />
2.2 Die Einfachbindung 9<br />
2.2.1 Das Wasserstoffmolekül<br />
2.2.2 Das Fluormolekül 11<br />
2.2.3 Das Fluorwasserstoffmolekül<br />
2.2.4 Das Methanmolekül und die sp 3 -Hybridisierung 12<br />
2.2.5 Das Ethanmolekül 14<br />
2.3 Die Mehrfachbindung 17<br />
2.3.1 Die sp 2 -Hybridisierung<br />
2.3.2 Das Ethenmolekül 18<br />
2.3.3 Das Formaldehydmolekül 21<br />
2.3.4 Die sp-Hybridisierung 23<br />
2.3.5 Das Ethinmolekül 24<br />
3. Alkane und Cycloalkane 26<br />
3.1 Nomenklatur und Isomerie<br />
3.1.1 Homologe Reihe<br />
3.1.2 Konstitutionsisomere 28<br />
3.1.3 Nomenklatur 29<br />
3.1.4 Cycloalkane 31<br />
3.1.5 Konformationsisomere 33<br />
3.2 Gewinnung und Darstellung 35<br />
3.2.1 Erdöl, Erdgas und Kohle<br />
3.2.2 Katalytische Hydrierung 37<br />
3.2.3 Hydrolyse von Grignard-Verbindungen 38<br />
3.2.4 Kolbe-Elektrolyse 39<br />
3.3 Reaktionen von Alkanen 40<br />
3.3.1 Verbrennung<br />
3.3.2 Radikale und ihre Instabilität 41<br />
3.3.3 Radikalische Halogenierung 43<br />
3.3.4 Autoxidation zu Hydroperoxiden 48<br />
1
<strong>Jens</strong> <strong>Christoffers</strong> Grundlagen der <strong>Organische</strong>n <strong>Chemie</strong> 26.10.2010<br />
4. Alkene 49<br />
4.1 Nomenklatur<br />
4.2 Konfigurationsisomere 51<br />
4.3 Reaktionen von Alkenen 53<br />
4.3.1 Katalytische Hydrierung<br />
4.3.2 Konformationen des Cyclohexans 54<br />
4.3.3 Hydrohalogenierung von Alkenen 57<br />
4.3.4 Die Elektrophile Addition 59<br />
3.3.5 Halogenierung von Alkenen 59<br />
3.3.6 Radikalische Hydrohalogenierung 61<br />
3.3.7 Saure Hydratisierung 63<br />
3.3.8 Hydroborierung 63<br />
3.3.9 Dihydroxylierung 66<br />
3.3.10 Epoxidierung 67<br />
3.3.11 Polymerisation 69<br />
3.3.12 Ozonolyse 71<br />
4.4 Darstellung von Alkenen 72<br />
4.4.1 Petrochemie 72<br />
4.4.2 Alkinhydrierung 73<br />
4.4.3 Dehydratisierung von Alkoholen 74<br />
4.4.4 Eliminierung erster Ordnung 75<br />
4.4.5 Dehydrohalogienierung 77<br />
4.4.6 Eliminierung zweiter Ordnung 78<br />
4.4.7 Thermische syn-Eliminierungen 80<br />
4.4.8 Dehalogenierung von 1,2-Dihalogenalkanen 81<br />
5. Alkine 82<br />
5.1 Nomenklatur 82<br />
5.2 Darstellung 82<br />
5.2.1 Acetylen 82<br />
5.2.2 Zweifache Dehydrohalogenierung 83<br />
5.3 Reaktionen von Alkinen 84<br />
5.3.1 syn-Dihydrierung 84<br />
5.3.2 anti-Dihydrierung 84<br />
5.3.3 Hydrohalogenierung 85<br />
5.3.4 Hydratisierung 85<br />
5.3.5 Acidität und Alkylierung 86<br />
6. Aromaten 87<br />
6.1 Aromatizität 87<br />
6.2 Nomenklatur 93<br />
6.3 Darstellung 96<br />
6.4 Elektrophile Substitution am Aromaten 97<br />
6.4.1 Halogenierung 97<br />
6.4.2 Mechanismus der elektrophilen Substitution am Aromaten 100<br />
6.4.3 Nitrierung 101<br />
6.4.4 Sulfonierung 102<br />
2
<strong>Jens</strong> <strong>Christoffers</strong> Grundlagen der <strong>Organische</strong>n <strong>Chemie</strong> 26.10.2010<br />
6.4.5 Friedel-Crafts-Alkylierung 102<br />
6.4.6 Friedel-Crafts-Acylierung 104<br />
6.4.7 Vilsmeier-Haack-Formylierung 105<br />
6.4.8 Die Regiochemie der Zweitsubstitution 107<br />
6.5 Nucleophile Substitution am Aromaten 112<br />
6.5.1 Direkte Substitution 112<br />
6.5.2 Über Arin-Zwischenstufen 113<br />
6.5.3 Über Diazonium-Ion-Zwischenstufen 114<br />
6.5.4 Birch-Reduktion 116<br />
7. Halogenverbindungen 117<br />
7.1 Stereochemie 117<br />
7.2 Nomenklatur von Konfigurationsisomeren 121<br />
7.3 Darstellung von Halogenalkanen 123<br />
7.3.1 Radikalische Substitution 123<br />
7.3.2 Elektrophile Addition 124<br />
7.3.3 Darstellung aus Alkoholen 124<br />
7.4 Nucleophile Substitution 124<br />
7.4.1 Monomolekularer Mechanismus 125<br />
7.4.2 Bimolekularer Mechanismus 126<br />
7.4.3 Stereochemie der S N 1- und S N 2-Reaktion 127<br />
7.4.4 Beispiele für S N -Reaktionen 129<br />
7.5 Relevante Halogenverbindungen 131<br />
7.5.1 Lösemittel 131<br />
7.5.2 Monomere 131<br />
7.5.3 Narkosemittel 131<br />
7.5.4 Kältemittel 132<br />
7.5.5 Feuerlöschmittel 133<br />
7.5.6 Insektizide und Herbizide 134<br />
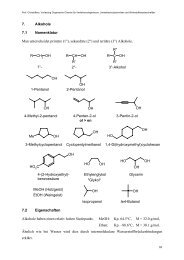
8. Alkohole 135<br />
8.1 Nomenklatur und physikalische Eigenschaften 135<br />
8.2 Darstellung von Alkoholen 137<br />
8.2.1 Technische Synthesen 137<br />
8.2.2 Elektrophile Addition und Nucleophile Substitution 138<br />
8.2.3 Nucleophile Addition 138<br />
8.3 Reaktionen von Alkoholen 141<br />
8.3.1 Acidität 141<br />
8.3.2 Nucleophile Substitution und Eliminierung 142<br />
8.3.3 Oxidationsreaktionen 142<br />
8.3.4 Veresterung 143<br />
8.3.5 Ester anorganischer Säuren 145<br />
9 Ether 148<br />
9.1 Übersicht 148<br />
9.2 Darstellung 148<br />
9.3 Reaktionen 149<br />
3
<strong>Jens</strong> <strong>Christoffers</strong> Grundlagen der <strong>Organische</strong>n <strong>Chemie</strong> 26.10.2010<br />
10. Carbonsäuren und ihre Derivate 152<br />
10.1 Übersicht 152<br />
10.2 Darstellung von Carbonsäuren 154<br />
10.3 Darstellung und Reaktionen von Carbonsäurederivaten 155<br />
10.3.1 Die S N t-Reaktion 155<br />
10.3.2 Darstellung Carbonsäurechloriden 156<br />
10.3.3 Reaktionen von Carbonsäurechloriden 157<br />
10.3.4 Reaktionen von Carbonsäureanhydriden 158<br />
10.3.5 Darstellung von Carbonsäureestern 159<br />
10.3.6 Darstellung von Carbonsäureamiden 161<br />
10.4 Reaktionen von Carbonsäureestern 163<br />
10.4.1 Verseifung 163<br />
10.4.2 Acidität von Carbonylverbindungen 164<br />
10.4.3 α-Alkylierung 165<br />
10.4.4 Claisen-Kondensation 167<br />
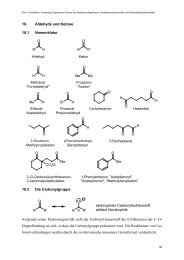
11. Aldehyde und Ketone 169<br />
11.1 Nomenklatur 169<br />
11.2 Darstellung 171<br />
11.2.1 Elektrophile Substitution 171<br />
11.2.2 Hydrolyse 171<br />
11.2.3 Reduktion und nucleophile Addition 172<br />
11.2.4 Oxidation und elektrophile Addition 174<br />
11.3 Reaktionen als Elektrophil 175<br />
11.3.1 Nucleophile Addition 175<br />
11.3.2 Hydrate und Acetale 176<br />
11.3.3 Kohlenhydrate 180<br />
11.3.4 Aminale und Imine 183<br />
11.3.5 Umlagerungen 186<br />
11.3.6 Die Wittig-Reaktion 189<br />
11.4 Reaktionen als Nucleophil 191<br />
11.4.1 Alkylierung 191<br />
11.4.2 Aldol-Reaktion 192<br />
11.5 Konjugierte Additionen 195<br />
11.5.1 Vinylogie Prinzip 195<br />
11.5.2 Cuprat-Addition 196<br />
11.5.3 Michael-Reaktion 197<br />
11.5.4 Robinson-Anellierung 199<br />
11.5.5 Decarboxylierung 200<br />
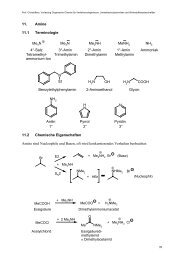
12. Amine 202<br />
12.1 Übersicht 202<br />
12.2 Darstellung 203<br />
12.2.1 Alkylierungsreaktionen 203<br />
12.2.2 Reduktion 204<br />
12.2.3 Reduktive Aminierung 205<br />
12.2.4 Strecker-Synthese 206<br />
12.2.5 Umlagerungen 207<br />
4
<strong>Jens</strong> <strong>Christoffers</strong> Grundlagen der <strong>Organische</strong>n <strong>Chemie</strong> 26.10.2010<br />
12.3 Reaktionen 208<br />
12.3.1 Basizität 208<br />
12.3.2 Diazoverbindungen 209<br />
12.3.3 Enamine 213<br />
12.3.4 Mannich-Reaktion 215<br />
12.4 Beispiele und biologische Aktivität, Alkaloide 217<br />
5