Lise-Meitner-Gymnasium Böblingen Schulcurriculum G8 Chemie 1 ...
Lise-Meitner-Gymnasium Böblingen Schulcurriculum G8 Chemie 1 ...
Lise-Meitner-Gymnasium Böblingen Schulcurriculum G8 Chemie 1 ...
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
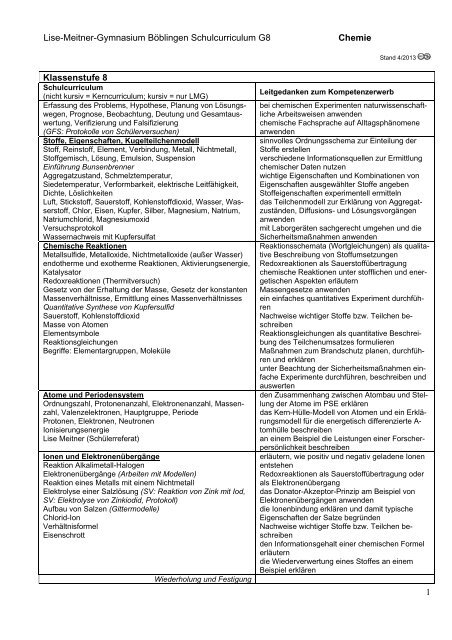
<strong>Lise</strong>-<strong>Meitner</strong>-<strong>Gymnasium</strong> <strong>Böblingen</strong> <strong>Schulcurriculum</strong> <strong>G8</strong><strong>Chemie</strong>Stand 4/2013Klassenstufe 8<strong>Schulcurriculum</strong>(nicht kursiv = Kerncurriculum; kursiv = nur LMG)Erfassung des Problems, Hypothese, Planung von Lösungswegen,Prognose, Beobachtung, Deutung und Gesamtauswertung,Verifizierung und Falsifizierung(GFS: Protokolle von Schülerversuchen)Stoffe, Eigenschaften, KugelteilchenmodellStoff, Reinstoff, Element, Verbindung, Metall, Nichtmetall,Stoffgemisch, Lösung, Emulsion, SuspensionEinführung BunsenbrennerAggregatzustand, Schmelztemperatur,Siedetemperatur, Verformbarkeit, elektrische Leitfähigkeit,Dichte, LöslichkeitenLuft, Stickstoff, Sauerstoff, Kohlenstoffdioxid, Wasser, Wasserstoff,Chlor, Eisen, Kupfer, Silber, Magnesium, Natrium,Natriumchlorid, MagnesiumoxidVersuchsprotokollWassernachweis mit KupfersulfatChemische ReaktionenMetallsulfide, Metalloxide, Nichtmetalloxide (außer Wasser)endotherme und exotherme Reaktionen, Aktivierungsenergie,KatalysatorRedoxreaktionen (Thermitversuch)Gesetz von der Erhaltung der Masse, Gesetz der konstantenMassenverhältnisse, Ermittlung eines MassenverhältnissesQuantitative Synthese von KupfersulfidSauerstoff, KohlenstoffdioxidMasse von AtomenElementsymboleReaktionsgleichungenBegriffe: Elementargruppen, MoleküleAtome und PeriodensystemOrdnungszahl, Protonenanzahl, Elektronenanzahl, Massenzahl,Valenzelektronen, Hauptgruppe, PeriodeProtonen, Elektronen, NeutronenIonisierungsenergie<strong>Lise</strong> <strong>Meitner</strong> (Schülerreferat)Ionen und ElektronenübergängeReaktion Alkalimetall-HalogenElektronenübergänge (Arbeiten mit Modellen)Reaktion eines Metalls mit einem NichtmetallElektrolyse einer Salzlösung (SV: Reaktion von Zink mit Iod,SV: Elektrolyse von Zinkiodid, Protokoll)Aufbau von Salzen (Gittermodelle)Chlorid-IonVerhältnisformelEisenschrottWiederholung und FestigungLeitgedanken zum Kompetenzerwerbbei chemischen Experimenten naturwissenschaftlicheArbeitsweisen anwendenchemische Fachsprache auf Alltagsphänomeneanwendensinnvolles Ordnungsschema zur Einteilung derStoffe erstellenverschiedene Informationsquellen zur Ermittlungchemischer Daten nutzenwichtige Eigenschaften und Kombinationen vonEigenschaften ausgewählter Stoffe angebenStoffeigenschaften experimentell ermittelndas Teilchenmodell zur Erklärung von Aggregatzuständen,Diffusions- und Lösungsvorgängenanwendenmit Laborgeräten sachgerecht umgehen und dieSicherheitsmaßnahmen anwendenReaktionsschemata (Wortgleichungen) als qualitativeBeschreibung von StoffumsetzungenRedoxreaktionen als Sauerstoffübertragungchemische Reaktionen unter stofflichen und energetischenAspekten erläuternMassengesetze anwendenein einfaches quantitatives Experiment durchführenNachweise wichtiger Stoffe bzw. Teilchen beschreibenReaktionsgleichungen als quantitative Beschreibungdes Teilchenumsatzes formulierenMaßnahmen zum Brandschutz planen, durchführenund erklärenunter Beachtung der Sicherheitsmaßnahmen einfacheExperimente durchführen, beschreiben undauswertenden Zusammenhang zwischen Atombau und Stellungder Atome im PSE erklärendas Kern-Hülle-Modell von Atomen und ein Erklärungsmodellfür die energetisch differenzierte A-tomhülle beschreibenan einem Beispiel die Leistungen einer Forscherpersönlichkeitbeschreibenerläutern, wie positiv und negativ geladene IonenentstehenRedoxreaktionen als Sauerstoffübertragung oderals Elektronenübergangdas Donator-Akzeptor-Prinzip am Beispiel vonElektronenübergängen anwendendie Ionenbindung erklären und damit typischeEigenschaften der Salze begründenNachweise wichtiger Stoffe bzw. Teilchen beschreibenden Informationsgehalt einer chemischen Formelerläuterndie Wiederverwertung eines Stoffes an einemBeispiel erklären1
<strong>Lise</strong>-<strong>Meitner</strong>-<strong>Gymnasium</strong> <strong>Böblingen</strong> <strong>Schulcurriculum</strong> <strong>G8</strong><strong>Chemie</strong>Stand 4/2013Klassenstufe 9MoleküleWasserReaktion von Magnesium mit Wasser, ProtokollWasserstoffMolekülformeln (CH 4 , H 2 O, NH 3 , HCl)bindende und nichtbindende Elektronenpaareräumlicher Bau der Moleküle(z. B. Arbeiten mi Kugel-Stab-Modell, Kalotten-Modell)ElektronegativitätWasserstoffbrückenVAN-DER-WAALS-WechselwirkungenDipol-Dipol-WechselwirkungenWasser als Lösungsmittel (Ion-Dipol-Wechselwirkungen)(SV: Wasser als Lösungsmittel, Protokoll)Große Wiederholung und Vernetzung:Atom, Molekül, Ion, Elektronenpaarbindung, IonenbindungSaure und alkalische Lösungen und ProtonenübertragungsreaktionenReaktion von Chlorwasserstoff mit Wasser(Springbrunnenversuch, Protokoll)Oxonium-Ionen, Hydroxid-Ionen, NatriumhydroxidSaure, neutrale, alkalische Lösungen, IndikatorenBetrachtung verschiedener Säuren und ihrer SalzeNatronlauge, Ammoniaklösung, Salzsäure, Kohlensäure(Bildung von Ammoniumchlorid, Protokoll)den Informationsgehalt einer chemischen Formelerläuterndie Bedeutung des Wasserstoffs als EnergieträgererläuternNachweise wichtiger Stoffe bzw. Teilchen beschreibendie Molekülbildung durch Elektronenpaarbindungunter Anwendung der Edelgasregel erläuternden räumlichen Bau von Molekülen mithilfe einesgeeigneten Modells erklärenMolekülstrukturen mit Sachmodellen darstellenpolare und unpolare Elektronenpaarbindungenunterscheidenden Zusammenhang zwischen Molekülstrukturund Dipol-Eigenschaft herstellendie besonderen Eigenschaften von Wasser erklärenden Aufbau ausgewählter Stoffe darstellen undTeilchenarten zuordnenVerbindungen nach dem Bindungstyp ordnenzwischenmolekulare Wechselwirkungen nennenund erklärendas Donator-Akzeptor-Prinzip am Beispiel vonElektronen- und Protonenübergängen anwendendie typischen Teilchen in sauren und alkalischenLösungen nennenReaktionen von Säuren mit Wasser als Protonenübergangerkennen und erläuternbei wässrigen Lösungen die Fachausdrücke "sauer","alkalisch", "neutral" der pH-Skala zuordnenBeispiele für alkalische und saure Lösungen angebendie Bedeutung saurer, alkalischer und neutralerLösungen für Lebewesen erörternNachweise wichtiger Stoffe bzw. Teilchen beschreiben2
<strong>Lise</strong>-<strong>Meitner</strong>-<strong>Gymnasium</strong> <strong>Böblingen</strong> <strong>Schulcurriculum</strong> <strong>G8</strong><strong>Chemie</strong>Stand 4/2013Anorganische KohlenstoffverbindungenCarbonate, Kohlenstoffdioxid-Zucker-KreislaufTreibhauseffekt<strong>Chemie</strong> - Segen oder Fluch?Aktuelles BeispielKunststoffe, ErdölStoffe in Alltag oder Technik erläuterndas Aufbauprinzip von Makromolekülen aneinem Beispiel erläuterneinfache Experimente mit organischen Verbindungendurchführenausgewählte organische Reaktionstypen nennenund erkennendas Aufbauprinzip von Makromolekülen aneinem Beispiel erläuterndie Wiederverwertung eines Stoffes an einemBeispiel erklärendie chemischen Grundlagen für einen Kohlenstoffkreislaufin der belebten oder unbelebtenNatur darstellen und die Rolle der nachwachsendenRohstoffe erläuternan einem ausgewählten Stoff schädliche Wirkungenauf Luft, Gewässer oder Boden beurteilenund Gegenmaßnahmen aufzeigenam Beispiel eines Stoffes, der Gegenstand deraktuellen gesellschaftlichen Diskussion ist, dieBedeutung der Wissenschaft <strong>Chemie</strong> und derchemischen Industrie für eine nachhaltigeEntwicklung darstellendie Wiederverwertung eines Stoffes an einemBeispiel erklärendie Verwendung ausgewählter organischerStoffe in Alltag oder Technik erläuterndie chemischen Grundlagen für einen Kohlenstoffkreislaufin der belebten oder unbelebtenNatur darstellen und die Rolle der nachwachsendenRohstoffe erläuternan einem ausgewählten Stoff schädliche Wirkungenauf Luft, Gewässer oder Boden beurteilenund Gegenmaßnahmen aufzeigenam Beispiel eines Stoffes, der Gegenstand deraktuellen gesellschaftlichen Diskussion ist, dieBedeutung der Wissenschaft <strong>Chemie</strong> und derchemischen Industrie für eine nachhaltigeEntwicklung darstellendie Wiederverwertung eines Stoffes an einemBeispiel erklärendie Verwendung ausgewählter organischerStoffe in Alltag oder Technik erläutern4