Kleinturbellarien aus dem Litoral der Binnengewässer Schleswig ...
Kleinturbellarien aus dem Litoral der Binnengewässer Schleswig ...
Kleinturbellarien aus dem Litoral der Binnengewässer Schleswig ...
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
,<br />
t<br />
Arch. Hydrobiol. 464-51:lS Stuttgart, Mai 1961<br />
Aus <strong>dem</strong> Zoologischen Institut <strong>der</strong> Universität Kiel<br />
<strong>Kleinturbellarien</strong><br />
<strong>aus</strong> <strong>dem</strong> <strong>Litoral</strong> <strong>der</strong> <strong>Binnengewässer</strong><br />
<strong>Schleswig</strong>-Holsteins*)<br />
VonJENS-UWE RIXEN, Kiel<br />
Mit 54 Abbildungen sowie 8 Tabellen im Text und auf 4 Beilagen<br />
*) Dissertation bei <strong>der</strong> Philosophischen Fakultät <strong>der</strong> Universität Kiel (Anregung<br />
und Anleitung Dozent Dr. P. Ax).
<strong>Kleinturbellarien</strong> <strong>aus</strong> <strong>dem</strong> <strong>Litoral</strong> <strong>der</strong> <strong>Binnengewässer</strong> <strong>Schleswig</strong>-Holsteins 465<br />
Familie Koinocystidae<br />
Familie Placorhynchidae<br />
IV. Vergleichend-ökologischer Teil .<br />
A. Quellbiotope<br />
B. Flußsande .<br />
C. Stehende perennierende Gewässer .<br />
1. Phytalregion<br />
2. Schlammbiotope<br />
3. Psammal<br />
4. Küstengrundwasser<br />
D. Moorbiotope<br />
1. Braunwasserseen<br />
2. Torflöcher und Sphagnumrasen .<br />
E. Kleingewässer .<br />
1. Waldtfunpel<br />
2. Waldgräben und -bäche.<br />
3. Kleingewässer in <strong>der</strong> offenen Landschaft .<br />
F. Gewässer mit aberrantem Chemismus.<br />
1. Organische Abwässer<br />
2. Der schwefelsaure Tonteich bei Reinbek .<br />
3. Die Oldesloer Salzstellen<br />
G. Ökologische Schlußbetrachtungen .<br />
H. Notizen über Nahrung, Feinde und Parasiten<br />
1. Jahreszeitliche Verteilung <strong>der</strong> Gesamtfauna<br />
Zusammenfassung<br />
Abkürzungen in den Abbildungen<br />
Literaturverzeichnis .<br />
J. Einleitung<br />
Seite<br />
507<br />
508<br />
509<br />
510<br />
510<br />
511<br />
512<br />
513<br />
514<br />
515<br />
516<br />
516<br />
516<br />
517<br />
517<br />
518<br />
519<br />
519<br />
519<br />
519<br />
520<br />
522<br />
526<br />
527<br />
528<br />
Die biologische Untersuchung <strong>der</strong> <strong>Binnengewässer</strong> <strong>Schleswig</strong>-Holsteins<br />
gehört seit mehreren Jahrzehnten zum Arbeitsprogramm <strong>der</strong> Hydrobiologischen<br />
Anstalt in Plön. In einer Fülle systematischer und ökologischer<br />
Arbeiten wurden die Grundzüge <strong>der</strong> Zusammensetzung und Verteilung<br />
<strong>der</strong> limnischen Tierwelt in den verschiedenartigen Gewässertypen des Landes<br />
aufgezeigt. Dennoch ist <strong>der</strong> Artenbestand unserer heimischen Süßwasserfauna<br />
keineswegs vollständig erfaßt.<br />
Aus <strong>der</strong> Klasse <strong>der</strong> Turbellarien sind die großen Süßwasser-Trikladen<br />
in vielen Arbeiten von THIENEMANN behandelt worden, insbeson<strong>der</strong>e die<br />
rheophilen Arten Crenobia alpina (DANA) und Polycelis felina (= cornuta)<br />
DALYELL als Charakterarten <strong>der</strong> schleswig-holsteinischen Quellfauna. Auch<br />
über die Verbreitung <strong>der</strong> terrikolen Triklade Rhyncho<strong>dem</strong>us (01tho<strong>dem</strong>us)<br />
terrestris O. F. MÜLLER, sowie des in Gewächshäusern gefundenen Placocephalus<br />
(Bipalium) kewensis Mos. in <strong>Schleswig</strong>-Holstein liegen neuere Zusammenfassungen<br />
vor (JAECKEL 1955, 1957). Das Gros <strong>der</strong> sogenannten<br />
Archiv f. Hydrobiologie, Bd. 57<br />
30<br />
531<br />
531
466 Jens-Uwe Rixen<br />
<strong>Kleinturbellarien</strong> ist dagegen - abgesehen von wenigen verstreuten Einzelbefunden<br />
- bisher unbekannt geblieben.<br />
Diese Lücke in <strong>der</strong> Kenntnis <strong>der</strong> Turbellarienfauna existiert nicht nur<br />
innerhalb <strong>der</strong> Grenzen von <strong>Schleswig</strong>-Holstein. Wenn A. LUTHER (1955,<br />
p. 84) schreibt: "Selbst in einem sonst so gründlich durchforschten Lande<br />
wie Deutschland es ist, wurde den unscheinbaren Dalyelliiden wenig Aufmerksamkeit<br />
geschenkt", so gilt dieser Satz in gleicher Weise für die ge<br />
samte <strong>Kleinturbellarien</strong>fauna <strong>der</strong> deutschen <strong>Binnengewässer</strong>. Während die<br />
Turbellarien vieler europäischer Län<strong>der</strong> eingehen<strong>der</strong> untersucht wurden,<br />
so etwa von v. HOFSTEN und LUTHER in Skandinavien, von GIEYSZTOR in<br />
Polen, REISINGER und STEINBÖCK in Österreich, durch FUHRMANN und v. HOF<br />
STEN in <strong>der</strong> Schweiz o<strong>der</strong> auch von PAPI neuerdings in Italien, liegen <strong>aus</strong><br />
Deutschland nur zwei zusammenfassende Darstellungen vor, die in vieler<br />
Hinsicht nicht voll befriedigen können. Einer älteren Studie über die Tur<br />
bellarien Ostpreußens von DORNER (1902) schließt WEISE (1942/43) eine<br />
Untersuchung über die Alloeocoelen und Rhabdocoelen <strong>der</strong> Kurmark an.<br />
Aus diesem Grunde haben wir uns die Aufgabe gestellt, den Bestand<br />
<strong>der</strong> schleswig-holsteinischen <strong>Kleinturbellarien</strong> möglichst vollständig zu er<br />
fassen, die Autökologie <strong>der</strong> einzelnen Arten zu untersuchen und die Vertei<br />
lung und biozönotische Glie<strong>der</strong>ung in den verschiedenen Lebensräumen<br />
des Landes zu erarbeiten. Das Untersuchungsgebiet umfaßt dabei alle Typen<br />
<strong>der</strong> <strong>Binnengewässer</strong> <strong>Schleswig</strong>-Holsteins einschließlich <strong>der</strong> Binnensalz<br />
stellen bei Bad Oldesloe. Die Mündungsgebiete <strong>der</strong> Flüsse wurden nur bis<br />
an die Grenze zum Oligohalinikum (Salzgehalt 0,5 tJ/f}) aufgenommen und<br />
ebenso die brackigen Strandseen <strong>aus</strong>geschlossen, da diese Regionen im Rah<br />
men vergleichen<strong>der</strong> Untersuchungen über marine Turbellarien von P. Ax<br />
bearbeitet werden.<br />
Die vorliegende Untersuchung wurde vom Frühjahr 1956 bis zum Sommer<br />
1958 im Zoologischen Institut <strong>der</strong> Christian-Albrechts-Universität in Kiel durchgeführt.<br />
Meinem hochverehrten Lehrer, Herrn Professor Dr. A. REMANE, danke ich für<br />
die Überlassung eines Arbeitsplatzes, sowie für die mir stets gewährte Beratung<br />
und Unterstützung. Herr Dozent Dr. P. Ax hat die Anregung zu dieser Arbeit gegeben,<br />
mich in die Methodik eingeführt und mir immer mit Rat und Tat zur<br />
Seite gestanden. Hierfür möchte ich an dieser Stelle ganz beson<strong>der</strong>s danken.<br />
Auch von <strong>aus</strong>wärts wurde mir Hilfe zuteil. Die Herren Professoren A. THIENE<br />
MANN und Dr. H. SIOLI ermöglichten mir einen dreiwöchentlichen Arbeitsaufenthalt<br />
in <strong>der</strong> Hydrobiologischen Anstalt <strong>der</strong> Max-Pland
<strong>Kleinturbellarien</strong> <strong>aus</strong> <strong>dem</strong> <strong>Litoral</strong> <strong>der</strong> <strong>Binnengewässer</strong> <strong>Schleswig</strong>-Holsteins 467<br />
11. Untersuchungsmethodik<br />
In <strong>der</strong> Untersuchung des eingangs umschriebenen Gebietes wurden zwei verschiedene<br />
Wege beschritten.<br />
Auf <strong>der</strong> einen Seite wurde eine vollständige Erfassung <strong>der</strong> verschiedenartigen<br />
"Lebensräume angestrebt. Der Schwerpunkt <strong>der</strong> Untersuchungen lag dabei naturgemäß<br />
in <strong>der</strong> näheren Umgebung Kiels, während <strong>der</strong> schleswigsche Raum, Südholstein<br />
und das Herzogtum Lauenburg nur auf wenigen größeren Exkursionen<br />
aufgesucht werden konnten. Auf <strong>der</strong> an<strong>der</strong>en Seite wurden einzelne geeignete<br />
Lebensräume in regelmäßigen Zeitabständen bearbeitet, um den jahreszeitlichen<br />
Wechsel <strong>der</strong> Turbellarienfauna zu erfassen. Dieses Studium <strong>der</strong> Aspektfolge wurde<br />
in drei verschiedenen Biotopen durchgeführt, am Sandstrand des Suhrer Sees, im<br />
Phytal des unteren Teiches im Kieler Botanischen Garten und an zwei Buchenwaldtümpeln<br />
im Vieburger Gehölz und bei Schrevenbom.<br />
Die Untersuchungen beschränken sich im wesentlichen auf die Regionen des<br />
Eulitorals. Das Material wurde vom Ufer o<strong>der</strong> vom Boot <strong>aus</strong> bis in eine Tiefe von<br />
rund 50 cm auf folgende Weise entnommen:<br />
Ben t haI pro ben: Abheben <strong>der</strong> Oberflächenschicht des Substrats mit<br />
einem Handkäscher. Anschließend Konzentrierung eines Teils des Materials durch<br />
Auswaschen, Einfüllen <strong>der</strong> Materialen in einen Eimer, nach Zusatz von Wasser<br />
aufrühren, die Schwebstoffe mit den Kleinorganismen von den rasch absinkenden<br />
Substratteilchen abgießen und durch die Gaze des Käschers auffangen.<br />
P h y tal pro ben: Entwe<strong>der</strong> in ähnlicher Weise <strong>aus</strong>waschen o<strong>der</strong> über<br />
<strong>dem</strong> Käscher <strong>aus</strong>spülen. Einen Teil <strong>der</strong> groben Bestandteile (Blätter, Stenge!) mit<br />
<strong>dem</strong> konzentrierten Kleinmaterial in die Probegläser einfüllen.<br />
K ü s t eng run d was se r : Grabung im Sandstrand 1-2 m oberhalb <strong>der</strong><br />
Wasserlinie bis zum Niveau des Grundwasserspiegels. Die mit <strong>dem</strong> Grundwasser<br />
in die Grube einströmenden Organismen direkt <strong>aus</strong> <strong>dem</strong> Wasser <strong>aus</strong>käschern o<strong>der</strong><br />
durch das geschil<strong>der</strong>te Auswaschen des Sandes konzentrieren.<br />
Die Proben wurden im Labor bei Temperaturen von 15--17° C aufbewahrt<br />
und gewöhnlich iImerhalb von 24 Stunden nach <strong>dem</strong> Fang bearbeitet. Bei <strong>der</strong><br />
überwiegenden Mehrzahl <strong>der</strong> behandelten Arbeiten war durch sorgfältige Lebendbeobachtungen<br />
an Hand von Quetschpräparaten eine einwandfreie Determination<br />
möglich. Nur bei einigen Typhloplaniden und zur Beschreibung von RhynChoscolex<br />
remanei nov. spec. wurden Schnittserien untersucht. Die Fixierung erfolgte in<br />
diesen Fällen mit Sublimat-Eisessig-Formol.<br />
111. Systematisch-autökologischer Teil<br />
Literaturübersicllt<br />
Die ersten Mitteilungen über <strong>Kleinturbellarien</strong> <strong>aus</strong> Sch1eswig-Holstein<br />
liefert ZACHARIAS (1887-1903). Neben kleineren taxonomischen Studien<br />
an Vertretern <strong>der</strong> Catenuliden und Microstomiden handelt es sich hierbei<br />
im wesentlichen um faunistische Untersuchungen am Großen Plöner See<br />
und in einigen Moorbiotopen. Aus dieser Periode liegt ferner eine Untersuchung<br />
über Turbellarien von Helgoland vor (ATTEMs 1897), in welcher<br />
auch die Süßwasserart Stenostomum unicolor gemeldet wird, sowie einige<br />
Angaben in <strong>der</strong> Arbeit von KRÄPELIN (1901) über die Fauna <strong>der</strong> Umgebung<br />
Hamburgs.
468<br />
Jens-Uwe Rixen<br />
Nach<strong>dem</strong> THIENEMANN (1921) in einer selbständigen Notiz über Bothrioplana<br />
semperi <strong>aus</strong> <strong>Schleswig</strong>-Holstein publiziert hat, finden sich in <strong>der</strong><br />
Folgezeit nur noch verstreute Einzelbefunde über <strong>Kleinturbellarien</strong> in verschiedenen<br />
faunistischen und ökologischen Untersuchungen, so für die Binnensalzstellen<br />
von Bad Oldesloe bei THIENEMANN (1925/26), für die Bodenfauna<br />
norddeutscher Seen bei LUNDBECK (1926), neue Angaben für Helgoland<br />
bei ARNDT (1940) und CASPERS (1942), <strong>aus</strong> <strong>der</strong> Seerosenzone und <strong>aus</strong><br />
<strong>der</strong> Potamogeton-Zone ostholsteinischer Seen bei v. BÜLow (1951) und<br />
MÜLLER-LIEBENAU (1956). Schließlich hat Ax (1957a) bei einer Bearbeitung<br />
<strong>der</strong> limnischen Flußsande in <strong>der</strong> EIbe eine Reihe von <strong>Kleinturbellarien</strong> limnischer<br />
und mariner Herkunft nachgewiesen.<br />
Verzeichnis <strong>der</strong> Arten 1)<br />
In den <strong>Binnengewässer</strong>n <strong>Schleswig</strong>-Holsteins sind bisher 69 <strong>Kleinturbellarien</strong>arten<br />
beobachtet worden, die in <strong>der</strong> folgenden übersicht aufgeführt<br />
werden. 63 Arten stammen <strong>aus</strong> rein limnischen Lebensräumen, sie<br />
umfassen jedoch neben <strong>dem</strong> Gros typischer Süßwasserturbeliarien vier spezifische<br />
Brackwasserarten als Immigranten <strong>aus</strong> <strong>dem</strong> marinen Milieu (Macrostomum<br />
curvituba, Coelogynopora spec., Vejdovskya ignava und Coronhelmis<br />
multispinosus). Sechs Arten sind bisher nur <strong>aus</strong> den Binnensalzstellen<br />
von Bad Oldesloe bekannt geworden.<br />
Im Verlaufe <strong>der</strong> eigenen Untersuchungen wurden insgesamt 61 <strong>Kleinturbellarien</strong>arten<br />
beobachtet. 44 Arten - also fast 65 % des Gesarritbestandes<br />
- sind neu für <strong>Schleswig</strong>-Holstein, 15 Arten (ca. 25 %) außer<strong>dem</strong><br />
neu für Deutschland. Zwei für die Wissenschaft neue Arten werden beschrieben<br />
(Rhynchoscolex remanei und Macrostomum subterraneum), eine<br />
weitere neue Alt war infolge ungenügenden Materials noch nicht einwandfrei<br />
zu charakterisieren (Provorticidorum spec.).<br />
Folgende Arten und Varietäten sind bisher <strong>aus</strong> <strong>Schleswig</strong>-Holstein<br />
bekannt geworden:<br />
Catenulida<br />
Macrostomida<br />
1. Catenula lemnae ANT. DUCES 1832<br />
2. Suomina turgida (ZACHARIAS 1902)<br />
3. Stenostomum leucops (ANT. DUCES 1828)<br />
4. Stenostomum unicolor O. SCHMIDT 1848<br />
5. RhynChoscolex simplex LEIDY 1851<br />
++ 6. RhynChoscolex remanei nov. spec.<br />
++ S 7. Macrostomum hystricinum BEKLEMIscHEv 1951<br />
++ 8. Macrostomum 1'Ostratum PAPI 1951<br />
++ 9. Macrostomum distinguendum PAPI 1951<br />
1) Zur Orientierung werden in <strong>der</strong>Tabel}e folgende Zeichen verwendet: + =<br />
neu für <strong>Binnengewässer</strong> <strong>Schleswig</strong> Holsteins, ++ = neu für <strong>Binnengewässer</strong><br />
Deutschlands, M = marine Immigranten (Brackwasserarten) im Süßwasser,<br />
S = nur in den Binnensalzstellen von Bad Oldesloe.
470 Jens-Uwe Rixen<br />
60. Typhloplana viridata (ABILDGAARD 1789)<br />
+ 61. Mesostoma lingua (ABILDGAARD 1789)<br />
62. Mesostoma ehrenbergi (FOCKE 1836)<br />
63. Mesostoma tetragonum (0. F. MÜLLER 1774)<br />
64. Bothromesostoma personatum (0. SCHMIDT 1848)<br />
65. Bothromesostoma essenii M. BRAUN 1885<br />
66. Gyratrix hermaphroditus EHRENBERG 1831<br />
+ 67. Opisthocystis goettei (BRESSLAU 1906)<br />
++ 68. Koinocystis neocomensis (FUHRMANN 1904)<br />
++ S 69. Placorhynchus octaculeatus dimorphis KARLING<br />
1947<br />
Ordnung Catenulida<br />
Familie Catenulidae<br />
1. Catenula lemnae ANT. DUCES 1832<br />
Bekannte Verbreitung: Europa, Sibirien, Japan, USA, Brasilien.<br />
Sdlleswig-HoIstein: Kaltenhofer Moor 7.10. 1957 (1 Ex.) - Hasenrnoor bei Brandshek<br />
18. 10. 1957 (sehr häufig) - Moor in Kiel-Kroog 22. 10. 1957 (sehr häufig)<br />
- Kiel-Elmsdlenhagen, Moor, im Sphagnum 22. 10. 1957 (25 Ex.) <br />
Lebra<strong>der</strong> Moor 5. 11. 1957 (wenige Ex.) - von v. BÜLOW (1951) in <strong>der</strong> Seerosenzone<br />
von Seen nachgewiesen.<br />
Die schleswig-holsteinischen Exemplare dieser Art erreichten eine Kör<br />
perlänge von 0,8 mm. Es wurden keine geschlechtsreifen Tiere festgestellt.<br />
Die Ketten bestanden <strong>aus</strong> höchstens vier Zooiden.<br />
Die Art ist in <strong>Schleswig</strong>-Holstein weitgehend auf Moore beschränkt.<br />
Sie ist jedoch nicht spezifisch an diesen Lebensraum gebunden, son<strong>der</strong>n<br />
wurde in an<strong>der</strong>en Gebieten <strong>aus</strong> stark differierenden Biotopen, wie stehenden<br />
Süßwassertümpeln, Seen und Warmh<strong>aus</strong>bassins, gemeldet. C. lemnae<br />
wurde von mir nur im Spätherbst beobachtet.<br />
2. Suomina turgida (ZACHARIAS 1902)<br />
Bekannte Verbreitung: <strong>Schleswig</strong>-HoIstein, Alpenrand, Böhmen, Polen, Brasilien.<br />
<strong>Schleswig</strong>-Holstein: Holstsdles Hei<strong>dem</strong>oor bei Plön (ZACHARIAS 1902 c).<br />
Die Art wurde nicht wie<strong>der</strong>gefunden. Der Originalfund ZACHARIAS'<br />
ist kultiviert worden, so daß hier eine Nachsuche nicht möglich war.<br />
Gattung Stenostomum O. SCHMIDT 1848<br />
Eine einwandfreie Identifizierung <strong>der</strong> vielen <strong>aus</strong> Europa beschriebenen<br />
Stenostomum-Arten ist sehr schwierig. Mit Sicherheit habe ich zunächst<br />
nur St. leucops nachweisen können, es ist jedoch leicht möglich, daß weitere<br />
Vertreter dieses Genus in <strong>Schleswig</strong>-Holstein vorkommen, aber übersehen<br />
wurden. Nach MARCUS (1949) ist die Art St. leuGops in <strong>der</strong> Fassung<br />
v. GRAFFS (1913) nicht homogen.
<strong>Kleinturbellarien</strong> <strong>aus</strong> <strong>dem</strong> <strong>Litoral</strong> <strong>der</strong> <strong>Binnengewässer</strong> <strong>Schleswig</strong>-Holsteins 471<br />
3. Stenostomum leucops (ANT. DUGES 1828)<br />
Bekannte Verbreitung: Ganz Europa (auch Brackwasser), Sibirien, Ostasien,<br />
USA, Brasilien, Ost- und Südafrika.<br />
<strong>Schleswig</strong>-Holstein: Neben Gyratrix hermaphroditus häufigstes Kleinturbellar. Von<br />
April bis November in fast allen Proben <strong>aus</strong> den verschiedenartigsten Biotopen:<br />
Phytal <strong>der</strong> Seen und Teiche, Moore, ephemere Tümpel und Bäche,<br />
Sandbäden, Küstengrundwasser, sogar im schwefelsauren Tonteich bei Reinbek<br />
(pH = 3,4). Von ZACHARIAS (1893, 1894) bereits im Großen Plöner See,<br />
von v. BÜLow (1951) in <strong>der</strong> Seerosenzone holsteinischer Gewässer beobachtet<br />
und von Ax (1957 a) <strong>aus</strong> <strong>der</strong> EIbe gemeldet.<br />
Die Tiere dieser Art variieren im Habitus sehr stark, so treten neben<br />
Exemplaren mit deutlich abgesetztem Schwanzanhang Tiere mit gerundetem<br />
Hinterende auf. Ferner ist auch die Form des Kopflappens sehr<br />
verschieden. Alle Tiere aber zeigen die zwei für die Art charakteristischen<br />
schüsselförmigen lichtbrechenden Organe.<br />
4. Stenostomum unicolor O. SCHMIDT 1848<br />
Bekannte Verbreitung: Europa, Japan, Sumatra.<br />
<strong>Schleswig</strong>-Holstein: Großer Plöner See (ZACHARIAS 1893, 1894) - Helgoland, Brunnen<br />
einer Bierbrauerei auf <strong>dem</strong> Unterland (ATTEMs 1897).<br />
Nicht wie<strong>der</strong>gefunden.<br />
Gattung Rhynchoscolex LEIDY 1851<br />
Die Gattung Rhyndwscolex umfaßte bisher sechs Arten und eine<br />
Unterart <strong>aus</strong> Europa, Ostasien, Nord- und Südamerika. Neben <strong>der</strong> weitverbreiteten<br />
Art R. simplex wurde im Küstengrundwasser <strong>Schleswig</strong>-Holsteins<br />
eine neue Art gefunden, R. remanei nov. spec. Der von MARCUS (1945 b)<br />
entworfene Bestimmungsschlüssel <strong>der</strong> Gattung wird im folgenden um diese<br />
neue Art erweitert.<br />
1. Statozyste vorhanden.<br />
Statozyste fehlt .<br />
2. Ein Statolith .<br />
Zwei o<strong>der</strong> drei Statolithen<br />
3. Geschlossene Statozyste hinter <strong>dem</strong> Gehirn<br />
Offene Statozyste vor <strong>dem</strong> Gehirn<br />
2<br />
6<br />
3<br />
4<br />
R. platypus MARCUS 1945<br />
Luthersche Larve von R. simplex LEIDY 1851<br />
4. Zwei miteinan<strong>der</strong> verwachsene Statolithen, Länge des reifen Tieres 0,3 bis<br />
0,4 mrn . R. evelinae MARCUS 1945<br />
Zwei o<strong>der</strong> drei freie Statolithen, Länge mehr als 0,4 mm . 5<br />
5. Zwei durch Bän<strong>der</strong> in ihrer Stellung fixierte Statolithen, Länge des reifen<br />
Tieres 1-1,5 mm . R. diplolithicus REISINGER 1924<br />
- Zwei o<strong>der</strong> drei gegeneinan<strong>der</strong> frei bewegliche Statolithen, Länge des <strong>aus</strong>gewachsenen<br />
Tieres 4--6 mm. . R. remanei nov. spec.<br />
6. Länge des stark muskulösen Pharynx gleich <strong>der</strong> des Rüssels o<strong>der</strong> größer.<br />
R. pusillus MARCUS 1945<br />
Länge des wenig muskulösen Pharynx geringer als die des Rüssels 7
472<br />
Jens-Uwe Rixen<br />
7. Rüssel konisch, allmählich sich verengend, von sehr variabler Form beim sich<br />
bewegenden Tier. Vor<strong>der</strong>rand des Gehirns ohne Furche.<br />
R. nanus MARcus 1945<br />
Rüssel an <strong>der</strong> Basis sich verengend, von hier nach vorne zylindrisch, beim sich<br />
bewegenden Tier von konstanter Form. Gehirn mit medianer Furche am Vor<strong>der</strong>rande<br />
. 8<br />
8. Exkretophoren vorhanden . R. simplex LEIDY 1851<br />
- Exkretophoren fehlen R. simplex plotnikovi BEKLEMISCHEV 1924<br />
5. Rhynchoscolex simplex LEIDY 1851<br />
Bekannte Verbreitung: Europa, Japan, USA, Brasilien.<br />
<strong>Schleswig</strong>-Holstein: Rosenfel<strong>der</strong> See, laubhaltiger Uferschlamm 7. 10. 19'56 (20 Ex.)<br />
- Großer Plöner See, bei Ascheberg, Küstengrundwasser 6. 8. 1957 (sehr<br />
häufig) - Großer Plöner See, Küstengrundwasser am Prinzenbad in Plön<br />
13. 5. 1958 (10 Ex.) - Schluensee, Grobsand 6. 8. 1957 (1 Ex.) - Flußsande<br />
<strong>der</strong> EIbe (Ax 1957 a).<br />
Die schleswig-holsteinischen Exemplare werden bis zu 6 mm lang. Die<br />
bevorzugten Lebensräume dieser Art sind schlammige und sandige Biotope.<br />
6. Rhynchoscolex remanei nov. spec.<br />
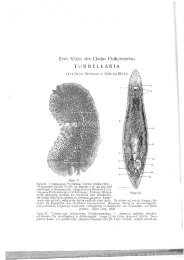
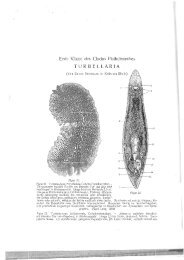
(Abb. 1-4)<br />
<strong>Schleswig</strong>-Holstein: Selenter See, bei Bellin, Küstengrundwasser 16. 10. 1953 (nach<br />
Mitteilung von Dr. Ax), 30. 5. 1956 (2 Ex.), 16. 6. 1956 (1 Ex.), 3. 9. 1957<br />
(3 Ex.) - Selenter See, bei Fargau, Küstengrundwasser mit viel eingespülter<br />
organischer Substanz 11. "9. 1956 (5 Ex.), 30. 6. 1957 (1 Ex.), 28. 9. 1958 (sehr<br />
häufig).<br />
Die neue Art, die ich meinem hochverehrten Lehrer, Herrn Professor<br />
Dr. A. REMANE, in Dankbarkeit widme, wurde 1953 von Dr. Ax im Küstengrundwasser<br />
des Selenter Sees erstmalig beobachtet. Reicheres Material<br />
ermöglicht folgende Beschreibung.<br />
Habitus und Bewegung: Das Tier wird bis 6 mm lang und etwa<br />
0,15 mm breit, die Färbung ist milchig-trübe weiß (Abb. 1). Das lang <strong>aus</strong>gestreckte<br />
Tier gleitet auf rauhem Substrat ruhig und gleichmäßig dahin. Auf<br />
glattem Untergrund ist die normale Bewegung offensichtlich gestört. Das<br />
Tier rollt sich, auf einer Körperseite liegend, zu einer Spirale zusammen.<br />
Die Ventralfläche weist nach außen, das Hinterende liegt im Zentrum <strong>der</strong><br />
Spirale. Mit <strong>dem</strong> erhobenen Vor<strong>der</strong>ende führt es schlängelnde Bewegungen<br />
im freien Wasser <strong>aus</strong>. Das ganze Tier zeigt außer<strong>dem</strong> das von REISINGER<br />
(1924) für R. simplex als "Kreisen" beschriebene Verhalten. Sind mehrere<br />
Exemplare in einem engen Gefäß beisammen, so verknäulen sie sich. In<br />
diesen Merkmalen unterscheidet sich R. remanei nicht von R. simplex.<br />
U nt er s u c h u n gen am Q u e t s c h prä par at (Abb. 3): Der<br />
ca. 75 !-" lange Pharynx simplex ist auffällig stark bewimpert. Im Bereich<br />
des Rüssels sind die beiden nebeneinan<strong>der</strong> verlaufenden Äste des Exkretionshauptstammes<br />
deutlich wahrnehmbar, ebenso im ganzen Körper die
474 Jens-Uwe Rixen<br />
regelmäßig angeordneten Exkretophoren. Der vor<strong>der</strong>e Rüsselabschnitt ist<br />
durch zarte Bindegewebssepten quer und längs geglie<strong>der</strong>t. REISINGER (1924)<br />
beschreibt bei R. simplex dieses System von prall mit periviszeraler Flüssigkeit<br />
gefüllten Glie<strong>der</strong>n und betrachtet es als ein Stützgewebe für den beim<br />
Durchwühlen <strong>der</strong> Sand- und Schlarnmböden beson<strong>der</strong>s beanspruchten Rüssel.<br />
Offenbar ist dieses Stützgewebe aber kein Derivat des Darmkanals und<br />
deshalb nur funktionell mit <strong>dem</strong> bei psammobionten Proseriaten entwickelten<br />
"chordoiden Stützorgan" des Ento<strong>der</strong>ms (Ax 1957 b) vergleichbar.<br />
Im Gegensatz zu R. simplex besitzt R. remanei eine Statozyste (Abb.<br />
2). Sie ist durchschnittlich 17 X 14 'IJ- groß und enthält zwei, in ca. 20 % <strong>der</strong><br />
Tiere drei Statolithen. Diese werden etwa 7 X 5,5 !1 groß. Sie sind frei gegeneinan<strong>der</strong><br />
beweglich.<br />
S c h n i t t s er i e nun t er s u c h u n g (Abb. 4)2): Das Deckepithel<br />
ist am gesamten Körper dorsal höher als ventral. Die Höhe beträgt bei<br />
R. remanei dorsal ca. 10 t.t und ventral ca. 7 IJ-. Die Zellwände sind sehr<br />
zart. Die Kerne des Epithels stehen im Gegensatz zu R. simplex senkrecht<br />
zur Längsachse des Tieres.<br />
Die Zilien liegen am fixierten Tier <strong>der</strong> Körperoberfläche mehr o<strong>der</strong><br />
min<strong>der</strong> an. So ist ihre Länge nicht exakt zu erfassen. Sie sind aber offenbar<br />
länger als die des Mundes und des Pharynx.<br />
Das große Gehirn liegt an <strong>der</strong> Rüsselbasis, die Statozyste schließt<br />
kaudalwärts an. Statolithen sind in den Sclmittserien nicht nachweisbar.<br />
Dem Gehirn schließen vorn die charakteristischen, <strong>aus</strong> zahlreichen Ganglienzellen<br />
aufgebauten Sinnesplatten an.<br />
In <strong>der</strong> Region des Mundes geht <strong>der</strong> Hautmuskelschlauch in die Pharynxmuskulatur<br />
über. An dieser Stelle (X) än<strong>der</strong>t sich auch die Struktur <strong>der</strong><br />
Bewimperung. Die Zilien des Mundes, wie auch die des Körpers färben sich<br />
mit Eisenhämatoxylin-Erythrosin hellgelbbraun an. Das kurze Wimperkleid<br />
des Pharynx (Höhe 2,5 IJ-) ist dagegen hellbräunlichrot gefärbt.<br />
Der Darm ist mit hohen Zellen <strong>aus</strong>gekleidet, zwischen denen die Zellgrenzen<br />
deutlich erkennbar sind. R. simplex besitzt im Gegensatz hierzu<br />
nach REISINGER (1924) einen weitgehend syncytialen Darm. Zwischen Darm<br />
und Hautmuskelschlauch liegt im vor<strong>der</strong>en Darmabschnitt eine schmale<br />
Schicht lockeren Parenchyms.<br />
Weibliche Gonaden fanden sich bei Tieren, die im September gefangen<br />
wurden. Sie liegen seitlich vom Darm in <strong>der</strong> Region hinter <strong>dem</strong> Pharynx.<br />
Dis ku s s ion: Innerhalb <strong>der</strong> Gattung RhynChoscolex stellt R. remanei<br />
ohne Zweifel den nächsten Verwandten von R. simplex. Durch den<br />
2) Da die Untersuchung vorwiegend faunistisch-ökologischen Charakter trägt,<br />
mußte auf eine intensive histologische Bearbeitung verzichtet werden. Die Angaben<br />
über R. remanei beschränken sich daher auf einige wenige zur Artdiagnose<br />
wichtige Details.
<strong>Kleinturbellarien</strong> <strong>aus</strong> <strong>dem</strong> <strong>Litoral</strong> <strong>der</strong> <strong>Binnengewässer</strong> <strong>Schleswig</strong>-Holsteins 475<br />
Besitz einer Statozyste mit zwei bis drei Statolithen sowie den mehr zellulären<br />
Bau des Darms sind jedoch zwei einwandfreie Unterscheidungsmerkmale<br />
gegeben. Zwar besitzt die Luthersche Larve von R. simplex gleichfalls<br />
eine Statozyste, doch ist die Struktur des Schweresinnesorgans von <strong>der</strong> des<br />
R. remanei völlig verschieden. Bei <strong>der</strong> Lutherschen Larve stellt sie eine<br />
dorsal offene Epi<strong>der</strong>miseinstülpung mit einem Statolithen dar, sie liegt hier<br />
außer<strong>dem</strong> vor <strong>dem</strong> Gehirn, während sie bei R. remanei kaudalwärts an das<br />
Gehirn anschließt und völlig abgeschlossen ist.<br />
Die zweite europäische Form mit einer Statozyste ist R. diplolithicus.<br />
Sie unterscheidet sich von R. remanei zunächst in <strong>der</strong> Größe (max. 1 bis<br />
1,5 mm lang) und im Habitus durch einen schärfer abgesetzten Rüssel und<br />
einen fadenförmigen Schwanzanhang. Außer<strong>dem</strong> ist auch <strong>der</strong> Bau <strong>der</strong><br />
Statozyste unterschiedlich. Sie ist bei R. diplolithicus mit 34 fL erheblich<br />
größer, die Statolithen berühren sich nicht, son<strong>der</strong>n werden durch Bän<strong>der</strong><br />
voneinan<strong>der</strong> entfernt gehalten, so daß sie auch nicht gegeneinan<strong>der</strong> verschiebbar<br />
sind. R. remanei dagegen besitzt zwei bis drei frei bewegliche<br />
Statolithen.<br />
Schließlich sind <strong>aus</strong> Brasilien zwei Statozysten tragende Rhyndwscolex<br />
Arten bekannt. Von diesen besitzt R. platypus nur einen, R. evelinae zwei<br />
miteinan<strong>der</strong> verwachsene Statolithen. Letztere Art wird zu<strong>dem</strong> nur 0,3 bis<br />
0,4 mm lang.<br />
Ordnung Macrostomida<br />
Familie Macrostomidae<br />
Gattung Macrostomum O. SCHMIDT 1848<br />
In einer Bearbeitung <strong>der</strong> Macrostomum-Arten <strong>der</strong> Sowjetunion unter<br />
teilt BEKLEMISCHEV (1951) die Gattung auf Grund <strong>der</strong> differierenden<br />
Str,uktur des Kutikularorgans in dreiVerwandtschaftsgruppen. Von den neun<br />
in <strong>Schleswig</strong>-Holsteins <strong>Binnengewässer</strong>n nachgewiesenen Arten gehören<br />
vier zur Macrostomum hystricinum-Gruppe und zwei in die Macrostomum<br />
orthostylum-Gruppe, drei Arten werden <strong>der</strong> Macrostomum tuba-Gruppe<br />
zugeordnet.<br />
M acrostomum hystricinum-Gruppe<br />
Neue taxonomische Untersuchungen von LUTHER, BEKLEMISCHEV, Ax<br />
und PAPI haben gezeigt, daß die bis vor kurzem unter <strong>der</strong> Bezeichnung<br />
M. hystrix OERSTED o<strong>der</strong> M. appendiculatum (FABRICIUS) geführten Macrostomum-Arten<br />
<strong>aus</strong> <strong>dem</strong> Süßwasser, Brackwasser und <strong>dem</strong> marinen Milieu<br />
Eurasiens in eine Vielzahl gut unterscheidbarer Arten aufgeteilt werden<br />
müssen. We<strong>der</strong> M. hystrix noch M. appendiculatum sind nach den Original<br />
arbeiten von OERSTED (1844) und F ABRICIUS (1826) zu identifizieren. Sie<br />
werden als Namen ohne Inhalt von BEKLEMISCHEV (1951) und Ax (1959)<br />
eingezogen.
Ardtiv f. Hydrobiologie. Bd. 57. Zu S. 476.<br />
Abb. 5-7. Macrostomum hystricinum BEKL. 1951, Stilette<br />
verschiedener Individuen.<br />
56," 68<br />
Abb. 8--13. Macrostomum rostratum PArI 1951, Stilette<br />
verschiedenen Individuen.
<strong>Kleinturbellarien</strong> <strong>aus</strong> <strong>dem</strong> <strong>Litoral</strong> <strong>der</strong> <strong>Binnengewässer</strong> <strong>Schleswig</strong>-Holsteins 477<br />
Sd1leswig-Holstein: An vielen Stellen im Phytal von Seen, Teichen und Gräben<br />
von April bis Oktober, am 6. 8. 1957 im Küstengrundwasser des Großen<br />
Plöner Sees bei Ascheberg. Häufigste Macrostomum-Art.<br />
Die Körperlänge wurde mit 0,9-1,2 mm festgestellt. Die UntersuChungen<br />
des Stiletts decken sich absolut mit <strong>der</strong> Originalbeschreibung<br />
von PAPI. Die Länge beträgt 56-77 l-l. Die Abbildungen 9-12 zeigen<br />
die Variationsbreite <strong>der</strong> Stilettform in schwach gequetschtem Zustande. Die<br />
hier im allgemeinen nicht sichtbare distale Öffnung liegt an <strong>der</strong> Innenseite<br />
des Hakens, die Stelle ist durch einen kleinen treppenförmigen Absatz markiert.<br />
Erst am stark deformierten Stilett tritt diese Öffnung deutlich hervor<br />
(Abb. 13). Das Wachstum des Stiletts beginnt bei allen Macrostomum<br />
Arten bekanntlich am distalen Ende. Bei jüngeren Tieren ist <strong>dem</strong>entsprechend<br />
<strong>der</strong> distale Haken bereits voll entwickelt, während <strong>der</strong> proximale<br />
Anteil noch im Wachstum begriffen ist (Abb. 8).<br />
Vorliegende Art wurde von PAPI (1951) als Unterart rostrata von<br />
M. finnlandense abgetrennt. Nach unserer Auffassung handelt es sich um<br />
zwei selbständige Arten. Infolge <strong>der</strong> völlig an<strong>der</strong>sartigen Lage <strong>der</strong> distalen<br />
Öffnung ordnen wir M. rostratum in die M. hystricinum-Gruppe ein, während<br />
M. finnlandense nach BEKLEMISCHEV (1951) zur orthostylum-Gruppe<br />
gehört.<br />
Bereits nach den wenigen sicheren Fundorten ist M. rostratum sehr<br />
weit verbreitet. Ohne Zweifel wird ein großer Teil <strong>der</strong> früher unter <strong>der</strong><br />
Bezeichnung M. appendiculatum geführten Funde <strong>aus</strong> <strong>dem</strong> Süßwasser<br />
Europas hier einzureihen sein.<br />
9. Macrostomum distinguendum PAPI 1951<br />
(Abb. 14-16)<br />
M. appendiculatum: BEKLEMISCHEV 1915, 1921 a, 1921 b.<br />
M. hystrix: v. GRAFF 1882 (t. 4, f. 9).<br />
M. appendiculatum ssp. distinguenda PAPI 1951.<br />
M. rossicum BEKLEMISCHEV 1951.<br />
M. distinguendum PAPI 1953. FERGUSON 1954.<br />
M. hystricinum BEKL. CHODOROWSKI 1959 5 ).<br />
Bekannte sichere Verbreitung: Italien, bei Pisa - Finnisch-Lappland, bei Kittilä<br />
Masuren, Harsz-See - Sowjet-Union, bei Leningrad, Kaluga und in Ostrußland.<br />
Schieswig-Hoistein: Suhrer See, Hydropsammal 17. 6. 1957 (5 Ex.), 17. 8. 1958<br />
(2 Ex.) - Schulensee, Hydropsammal 6. 8. 1957 (1 Ex.) - Großer Plöner<br />
See, Küstengrundwasser bei Ascheberg 22. 6. 1957 (1 Ex.), 6. 8. 1957 (2 Ex.) <br />
Buchenwaldtümpel bei Schrevenborn 17. 4. 1957 (40 Ex.), 26. 4. 1957 (20 Ex.)<br />
- Waldgraben bei Trensahl 29. 5. 1957 (6 Ex.) - Kirchsee, Phytalregion<br />
18. 8. 1957 (5 Ex.) ...<br />
5) Vgl. Fußnote S. 476.
<strong>Kleinturbellarien</strong> <strong>aus</strong> <strong>dem</strong> <strong>Litoral</strong> <strong>der</strong> <strong>Binnengewässer</strong> <strong>Schleswig</strong>-Holsteins 479<br />
meinen Untersuchungen an Süßwasser-Macrostomiden ist sie mit keiner<br />
<strong>der</strong> <strong>aus</strong> <strong>Schleswig</strong>-Holstein bekannten Macrostomum-Arten identisch. Vorerst<br />
ist eine Einordnung in eine bekannte Art nicht möglich.<br />
SS-A<br />
l<br />
ph<br />
te<br />
vif<br />
ge<br />
wo'<br />
kop<br />
Abb. 18-21. Macrostomum finnlandense FERGUSON 1940.<br />
Abb. 18. Habitusskizze.<br />
Abb. 19-21. Stilette verschiedener Individuen.<br />
Macrostomum orthostylum-Gruppe<br />
11. Macrostomum finnlandense FERGUSON 1940<br />
(Abb. 18-21)<br />
M. viride: LUTHER 1905, PAPI 1951.<br />
M. ruebushi var. finnlandensis FERGUSON 1939/40.<br />
M. appendiculatum ssp. finnlandensis: LUTHER 1947, FERGUSON 1954.
480 Jens-Uwe Rixen<br />
Bekannte sichere Verbreitung: Finnland, Italien. Die übrigen in <strong>der</strong> Literatur unter<br />
<strong>dem</strong> Namen M. viride verzeichneten Funde erscheinen unsicher, da den betreffenden<br />
Arbeiten keine Stilettskizzen beigefügt sind.<br />
<strong>Schleswig</strong>-Holstein: .Großer Plöner See, Hydropsammal bei Plön (leg. Dr. Ax)<br />
13.5. 1949 - Großer Plöner See, Küstengrundwasser bei Ascheberg 6. 8. 1957<br />
(1 Ex.) - Schulensee, Ufer-Grobsand 6. 8. 1957 (1 Ex.) - Kiel, Oberer<br />
Teich im Botanischen Garten, zwischen Hippuris 13. 5. 1957 (3 Ex.).<br />
1870 wurde von VAN BENEDEN eine Macrostomide unter <strong>dem</strong> Namen<br />
M. viride beschrieben. Lange Zeit wurde die heute M. [innlandense genannte<br />
Art mit <strong>der</strong> vAN BENEDENS identifiziert, doch ist diese Gleichsetzung<br />
nach <strong>der</strong> Originalbeschreibung nicht akzetabel, so daß wir im Einklang mit<br />
LUTHER und PAPI den von FERGUSON 1940 vorgeschlagenen Namen be<br />
nutzen.<br />
Die Länge beträgt 1,0-1,3 mm. Die Färbung ist gelblich grau. Das<br />
Vor<strong>der</strong>ende ist mit Tastborsten besetzt. Rhabditen treten am Hinterende<br />
gehäuft auf. Sie sind zu je 4-5 gebündelt. Am Hinterende befinden sich<br />
eine AnzaW dünne, stäbchenförmige Haftpapillen. Form und Länge des<br />
Stiletts variieren auch innerhalb dieser Art erheblich. Die Länge beträgt<br />
nach LUTHER, 1905 (<strong>aus</strong> <strong>der</strong> Abb. 9 gemessen) 57 fL, nach den Angaben desselben<br />
Autors von 1947 (p. 12) sogar 135fL, während <strong>aus</strong> <strong>der</strong> Zeichnung<br />
PAPIS (1951. p. 312) ein Wert von 80 fL hervorgeht. Meine Messungen liegen<br />
in <strong>der</strong> Größenordnung 55-66 fL.<br />
Die Art wurde an zwei Stellen mit an<strong>der</strong>en Macrostomum-Arten ver<br />
gesellschaftet gefunden, so im Küstengrundwasser bei Ascheberg zusammen<br />
mit M. rostratum und distinguendum und im Schluensee zusammen mit<br />
M. distinguendum.<br />
12. Macrostomum tenuicauda LUTHER 1947<br />
(Abb. 22-24)<br />
Bekannte Verbreitung: Finnland, Umgebung von Tvärminne und Hangö.<br />
<strong>Schleswig</strong>-Holstein: Salzwasser bei Bad Oldesloe, Stelle VI f 11. 8. 1958 (8 Ex.) <br />
im Rasen einer kleinen mit Juncus gerardi, Glaux maritima, Aster tripolium,<br />
Agrostis alba, Spergularia und Puccinellia bestandenen Salzwiese, umgeben<br />
von salzigen Tümpeln. Salzgehalt 13%°' Die Tiere fanden sich in <strong>der</strong> obersten,<br />
ca. 3 cm hohen Bodenschicht (leg. M. Bilio).<br />
Länge <strong>der</strong> Tiere 0,55 mm. Wie die <strong>der</strong> Originalbeschreibung zugrunde<br />
liegenden Tiere sind auch die Oldesloer Exemplare am Hinterende mit<br />
beson<strong>der</strong>s vielen und dichten Rhabditenbündeln besetzt. Stilettlänge 65<br />
bis 75 fL. Das Stilett zeigt am distalen Ende eine leichte Anschwellung <strong>der</strong><br />
Wände. Somit kann M. tenuicauda als eine Übergangsform von <strong>der</strong> M. orthostylum-<br />
zur M. tuba-Gruppe angesehen werden.<br />
Verbreitungsökologisch ist dieser Fund von beson<strong>der</strong>em Interesse. Die<br />
Art ist bisher nur <strong>aus</strong> <strong>dem</strong> Finnischen Meerbusen gemeldet worden, und<br />
1
482 Jens-Uwe Rixen<br />
Verbreitung etwa auf 49° N. Einmal wurde M. tuba jedoch auf 57° N bei<br />
Bologoje (Rußland) von PLOTNIKOV (1905) nachgewiesen. Über diese Grenze<br />
hin<strong>aus</strong> ist M. tuba verschiedentlich in temperier,ten, durch den Menschen<br />
geschaffenen Wasserbecken (in Warmhäusern und Aquarien) beobachtet<br />
worden. Auch unser Fund ist hier einzureihen.<br />
15. Macrostomum subterraneum nov. spec.<br />
(Abb. 25-27)<br />
<strong>Schleswig</strong>-Holstein: Küstengrundwasser des Selenter Sees, bei Bellin 1950.<br />
Diese von Dr. Ax im Jahre 1950 entdeckte Art wurde trotz mehrfacher<br />
Probenentnahme am Originalfundort nicht wie<strong>der</strong>gefunden. Die folgende<br />
Beschreibung gründet sich auf Aufzeichnungen von Dr. Ax, die mir freundlicherweise<br />
zur Verfügung gestellt wurden.<br />
Länge knapp I mm, das Vor<strong>der</strong>ende ist abgerundet, das Hinterende<br />
läuft in eine rundliche, sich etwas verbreiternde Schwanzplatte <strong>aus</strong>. Das<br />
kaudale Ende ist sehr stark mit Haftpapillen besetzt. Tastborsten stehen<br />
am ganzen Körper, gehäuft an Vor<strong>der</strong>- und Hinterende. Große Rhabditenbündel<br />
durchsetzen am ganzen Körper das Epithel, beson<strong>der</strong>s stark am<br />
Hinterende. Die Stäbchen sind zu 5-10 Stück gebündelt, etwa 10-12 J.t<br />
lang. Die Augen sind sehr schwach entwickelt, bei oberflächlicher Beobachtung<br />
erscheint das Tier sogar völlig augenlos. Die Pigmentbecher setzen<br />
sich <strong>aus</strong> sehr wenigen (3-7) schwach rötlichen Pigmentkörnchen zusammen.<br />
Die geringe Entwicklung des Augenpigments ist offenbar eine Reduktionserscheinung<br />
im Zusammenhang mit <strong>der</strong> Besiedlung des lichtabgeschlossenen<br />
Küstengrundwassers.<br />
Das Stilett ist eine insgesamt 115 J.t lange Röhre, die in einem Winkel<br />
von etwa 90° abgebogen ist. Der kürzeste Abstand zwischen den beiden<br />
Enden beträgt 90 J.t. Das Rohr wird distalwärts enger, die Wandungen bilden<br />
am distalen Ende eine kugelförmige Anschwellung <strong>aus</strong>. Der Durchmesser<br />
des Stiletts ist etwa auf <strong>der</strong> Hälfte <strong>der</strong> Länge zwischen <strong>der</strong> Krümmung<br />
und <strong>dem</strong> proximalen Ende 10 J.t, nahe <strong>dem</strong> distalen Ende kurz vor<br />
<strong>der</strong> Wandverdickung 5 J.t.<br />
Dis k u s s ion: Innerhalb <strong>der</strong> M. tuba-Gruppe sind meines Erachtens<br />
nur M. tuba v. GRAFF 1882, M. rhabdophorum BEKLEMISCHEV 1927 und<br />
M. pseudoobtusum BEKL. 1927 zu einem näheren Vergleich heranzuziehen.<br />
Mit M. tuba teilt M. subterraneum die charakteristische Anschwellung des<br />
Distalendes des Stiletts. Das Kutikularorgan ist bei M. tuba aber bekanntlich<br />
fast gerade, außer<strong>dem</strong> ist die Art erheblich größer (z. B. nach WEISE<br />
[1942] 2,4-3 mm). Bei den beiden an<strong>der</strong>en Arten ist das Stilett gleichfalls<br />
gekrümmt, aber in <strong>der</strong> speziellen Form doch klar unterschieden. Bei M.<br />
pseudoobtusum liegt ein scharfer Knick im oberen Drittel des Rohres, bei<br />
M. rhabdophorum ist nur das distale Ende schwach abgewinkelt.
Ardrlv f. Hydrobiologie. Bd. 57. Zu S. 482.<br />
ph<br />
te<br />
Abb. 25-27. Macrostomum subte1Taneum nov. spec.<br />
Abb. 25. Habitusskizze.<br />
Abb. 26. Stilett.<br />
Abb. 27. Kopulationsorgan.
<strong>Kleinturbellarien</strong> <strong>aus</strong> <strong>dem</strong> <strong>Litoral</strong> <strong>der</strong> <strong>Binnengewässer</strong> <strong>Schleswig</strong>-Holsteins 483<br />
Familie Microstomidae<br />
16. Microstomum lineare (0. F. MUELLER 1774)<br />
(Abb. 28-29)<br />
Bekannte Verbreitung: Europa, Sibirien, Ostasien, Sunda-Inseln, USA.<br />
<strong>Schleswig</strong>-Holstein: In den meisten Proben <strong>aus</strong> <strong>der</strong> Phytalregion <strong>der</strong> Seen und<br />
Teiche von Juni bis Oktober reichlich vertreten, vereinzelt auch in detritusreichem<br />
Sand. Durch ZACHARIAS (1893, 1894) bereits <strong>aus</strong> <strong>dem</strong> großen Plöner<br />
See bekannt, auch in <strong>der</strong> Form M. giganteum. Von Ax (1957 a) im <strong>Litoral</strong> <strong>der</strong><br />
EIbe nachgewiesen. Von ZACHARIAS (1894) <strong>aus</strong> <strong>dem</strong> Großen Plöner See infolge<br />
des Fehlens von Nematozysten irrtümlich als M. inerme neu beschrieben.<br />
Abb. 28-29: Microstomum lineare (0. F. MÜLL. 1774), Stilette verschiedener<br />
Individuen.<br />
Neben <strong>dem</strong> über<strong>aus</strong> häufigen Normaltyp wurden in drei Proben große<br />
Exemplare beobachtet, welche nach <strong>der</strong> synoptischen Darstellung von<br />
v. GRAFF (1913) als M. giganteum HALLEZ zu identifizieren sind. STEINBÖCK<br />
(1951) äußert jedoch den Verdacht, daß diese Form noch innerhalb <strong>der</strong><br />
Variationsbreite liegt, eine Vermutung, die durch meine Untersuchungen<br />
bestätigt werden kann.<br />
Die Form M. giganteum trat stets zusammen mit M. lineare auf, in<br />
allen Fällen aber nur in wenigen Exemplaren neben einer großen Anzahl<br />
von M. lineare. Ähnliche Verhältnisse ergeben sich <strong>aus</strong> <strong>der</strong> Arbeit von<br />
DORNER (1902) und <strong>aus</strong> den Fundortlisten von WEISE. Gute übereinstimmungen<br />
sind in <strong>der</strong> Form des Stiletts vom M. lineare-Typus (Abb. 28)<br />
29
<strong>Kleinturbellarien</strong> <strong>aus</strong> <strong>dem</strong> <strong>Litoral</strong> <strong>der</strong> <strong>Binnengewässer</strong> <strong>Schleswig</strong>-Holsteins 485<br />
19. Geocentrophora baltica (KENNEL 1883)<br />
(Abb. 30)<br />
Bekannte Verbreitung: Europa, USA, Afrika, in Kärnten auch im Edaphon beobachtet.<br />
<strong>Schleswig</strong>-Holstein: Lebra<strong>der</strong> Moor, in Sphagnum-Bulten 14. 10. 1957 (1 Ex.),<br />
5. 11. 1957 (6 Ex.).<br />
Länge des Tieres 6 mm, maximale Stilettlänge 45 "".<br />
30 31<br />
Abb. 30. Geocentrophora baltica (KENNEL 1883), Stilett.<br />
Abb. 31: Geocentrophora sphyrocephala DE MAN 1876, Stilett.<br />
20. Geocentrophora sphyrocephala DE MAN 1876<br />
(Abb. 31)<br />
Bekannte Verbreitung: Europa, Japan. In Kärnten auch im Edaphon nachgewiesen.<br />
<strong>Schleswig</strong>-Holstein: Marutendorf, Quellrinnsal am Westensee (Fund von Prof. RE<br />
MANE 1936) - Lebra<strong>der</strong> Moor, in Sphagnum-Bulten 14. 10. 1957 (20 Ex.),<br />
5. 11. 1957 (10 Ex.).<br />
Körperlänge bis 1,3 mm, Länge des Stiletts 42 "". Während in <strong>der</strong><br />
Körpergröße und <strong>dem</strong> Habitus klare, äußerlich erkennbare Unterscheidungsmerkmale<br />
zwischen G. baltica und G. sphyrocephala vorliegen, sind die<br />
Stilettapparaturen (Abb. 30-31) auffallend ähnlich und nicht voneinan<strong>der</strong><br />
zu unterscheiden. Es handelt sich möglicherweise nur um zwei Entwicklungsstadien<br />
einer Art.<br />
Die beiden Geocentrophora-Arten sind spezifische Besiedler von<br />
Sphagnumpolstem in Moorbiotopen. Unsere Habitate in <strong>Schleswig</strong>-Holstein<br />
decken sich absolut mit den Angaben von STEINBÖCK (1927). Daneben<br />
dringen beide Arten auch in edaphische Lebensräume ein. Sie wurden von<br />
REISINGER (1954) in Kärnten beobachtet, und REMANE (1938) fand G. sphyrocephala<br />
zusammen mit <strong>dem</strong> Anneliden Parergodrilus hei<strong>der</strong>i REIS. im<br />
feuchten Laub eines Quellrinnsals am Westensee.
486<br />
Jens-Uwe Rixen<br />
Ordnung Prolecithophora<br />
Unterordnung Separata<br />
Familie Plagiostomidae<br />
21. Plagiostomum lemani (DU PLESSIS 1874)<br />
Bekannte Verbreitung: Europa, auch Brackwasser bis zu 7 %0 Salzgehalt, Kaspisches<br />
Meer, Japan, USA.<br />
<strong>Schleswig</strong>-Holstein: Selenter See, bei Giekau, in angespülten Pflanzemesten<br />
3.9. 1957 (1 Ex.) - Suhrer See, mit Characeen bewachsener Sand 27. 9. 1957<br />
(3 Ex.), 5. 11. 1957 (1 Ex) - Schulensee, Bodenschlamm in 1-2 m Tiefe (md!.<br />
Mitteilung von Prof. REMANE) - Großer Plöner See, in tieferen Zonen regelmäßig<br />
(mdl. Mitteilung von Prof. THIENEMANN) - von ZACHARIAS (1893, 1894)<br />
unter <strong>dem</strong> Synonym P. quadrioculatum <strong>aus</strong> <strong>dem</strong> Großen Plöner See gemeldet.<br />
KRÄPELIN (1901) gibt die Art für Gräben bei Hamburg an.<br />
In <strong>Schleswig</strong>-Hoistein gehört Pl. lemani nicht zur typischen Fauna des<br />
oberen Eulitorals, sie tritt dagegen nach den mündlichen Angaben von<br />
Herrn Prof. THIENEMANN und Herrn Prof. REMANE in Tiefen ab 1-2 m<br />
regelmäßiger auf. Die wenigen Exemplare, die von mir an zwei Stellen<br />
gefunden wurden, sind ohne Zweifel sekundär <strong>aus</strong> tieferen Schichten eingedrungen<br />
o<strong>der</strong> passiv in die Uferzone eingespült worden.<br />
Ordnung Seriata<br />
Unterordnung Proseriata<br />
Familie Monocelididae<br />
Unterfamilie Coelogynoporinae<br />
22. Coelogynopora spec.<br />
<strong>Schleswig</strong>-Holstein, Süßwasser: Küstengrundwasser <strong>der</strong> EIbe bei Hamburg (Ax<br />
1957 a).<br />
Nicht wie<strong>der</strong>gefunden.<br />
Familie Otomesostomatidae<br />
23. Otomesostoma auditivum (DU PLESSIS 1874)<br />
Bekannte Verbreitung: Nord-Europa, Riesengebirge, Alpengebiet, Grönland, USA.<br />
<strong>Schleswig</strong>-Holstein: Suhrer See, Sand mit Characeenbewuchs 2. 11. 1956 (3 Ex.),<br />
19. 11. 1957 (24 Ex.), 27. 9. 1957 (8 Ex,), 14. 10. 1957 (6 Ex.), 5. 11. 1957<br />
(6 Ex.), 5. 5. 1958 (2 juv. Ex.), 17. 8. 1958 (8 Ex.) - Selenter See, bei Bellin<br />
(mdl. Mitteilung von Dr. Ax) - LUNDBECK (1926) <strong>aus</strong> <strong>der</strong>Tiefe folgen<strong>der</strong> Seen<br />
nachgewiesen (mit Tiefenangaben): Großer Plöner See 8--19 m, Trammer See<br />
9-19 m, Schöhsee 10-15,5 m, Dieksee 13 m, Plußsee 3,5-7 m, Ihlsee 12 bis<br />
14 m, Plötschersee 3,5 m, Schaalsee 8 m.<br />
Nach den Untersuchungen von LUNDBECK (1926) ist Otomesostoma<br />
auditivum in den norddeutschen Seen auf das Sublitoral und das obere<br />
Profundal beschränkt. Zwei Faktoren, die Temperatur und <strong>der</strong> Sauerstoffgehalt,<br />
werden als Primärfaktoren für die vertikale Verbreitung <strong>der</strong> Art
<strong>Kleinturbellarien</strong> <strong>aus</strong> <strong>dem</strong> <strong>Litoral</strong> <strong>der</strong> <strong>Binnengewässer</strong> <strong>Schleswig</strong>-Holsteins 487<br />
angesprochen. Auf <strong>der</strong> einen Seite soll eine gewisse Kaltstenothermie die<br />
Besiedlung <strong>der</strong> oberen Wasserschichten verhin<strong>der</strong>n. Die höchste Wassertemperatur,<br />
bei <strong>der</strong> LUNDBECK die Art beobachtet hat, beträgt 15,9° C.<br />
Auf <strong>der</strong> an<strong>der</strong>en Seite verursacht das im Profundal herrschende Sauerstoffdefizit,<br />
insbeson<strong>der</strong>e in den stark eutrophen baltischen Seen, eine basale<br />
Besiedlungsgrenze, so daß damit O. auditivum an <strong>der</strong> Grenze Profundal<br />
Sublitoral das Existenzoptimum finden soll.<br />
STEINBÖCK (1932) faßt seine Untersuchungen über die ökologischen<br />
Ansprüche von Otomesostoma folgen<strong>der</strong>maßen zusammen: "Auf Grund <strong>der</strong><br />
aufgezählten Tatsachen scheint mir ein Zweifel nicht mehr möglich, daß<br />
Otomesostoma im Sinne ZSCHOKKES zu jenen "Trümmern <strong>der</strong> glazialen<br />
Mischfauna" gehört, die zur Eiszeit am Ufer unserer mitteleuropäischen<br />
Gewässer lebten und sich vor <strong>der</strong> zunehmenden Erwärmung einerseits in<br />
die kalte Tiefe <strong>der</strong> großen Seen, an<strong>der</strong>erseits ins Hochgebirge zurückgezogen,<br />
wo sie auch am Ufer auftreten. In <strong>der</strong> kalten Tiefe oberflächenwarmer<br />
Seen ist es also auch als echtes Glazialrelikt im Sinne v. HOFSTENS und<br />
EKMANS zu bezeichnen".<br />
Weitere Untersuchungen, die STEINBÖCK auf Grönland und Island<br />
durchführte, ergaben dann aber, daß O. auditivum dort ein eurythermer<br />
Tümpel- und Seebewohner ist. STEINBÖCK (1942, 1943) erldärt dieses unterschiedliche<br />
Verhalten in arktischen Gebieten und in Mitteleuropa mit existenzökologischen<br />
Gründen. Das Tier steht in den relativartenarmen arktischen<br />
Gebieten einer geringeren Zahl von Konkurrenten gegenüber als auf<br />
<strong>dem</strong> mitteleuropäischen Festland und wird deshalb hier in tiefere Zonen<br />
gedrängt.<br />
Schließlich äußert STEINBÖCK (1951) auch die Vermutung, "daß das<br />
in <strong>der</strong> Glazialzeit noch eurytherme Otomesostoma heute in <strong>der</strong> Tiefe <strong>der</strong><br />
europäischen Seen eine oligotherme physiologische Rasse darstellt".<br />
Nach den eigenen Beobachtungen siedelt O. auditivum regelmäßig<br />
und in größerer Individuenzahl im Limnopsammal des Suhrer Sees in einer<br />
Tiefe von 30-50 cm (Mai bis November). Dr. Ax fand die Art im Küstengrundwasser<br />
des Selenter Sees, sie ist hier jedoch vermutlich <strong>aus</strong> den ufernahen<br />
Sanden eingespült worden.<br />
Diese Befunde einer regelmäßigen Besiedlung des <strong>Litoral</strong>s finden wir<br />
bei einer genauen Durchsicht <strong>der</strong> Literatur für den borealen wie auch für<br />
den alpinen Bereich von vielen an<strong>der</strong>en Stellen bestätigt. MARTIN (1907)<br />
fand Otomesostoma in den schottischen Lochs auch an flachen Stellen. Nach<br />
BRINKMANN (1905) kommt es im dänischen Furesee nur an seichten Uferstellen<br />
vor. v· HOFsTEN (1911a) weist die Art für Schweden in einem bis<br />
1,5 m tiefen Gewässer des Moorgebietes Mästermyr auf Gotland und in<br />
einem kleinen Teich bei Abisko (Schwedisch-Lappland) nach. Im finnischen<br />
Lojosee ist nach LUTHER (1902) O. auditivum nur im flachen Wasser ver-
488 Jens-Uwe Rixen<br />
treten. Auch PLOTNIKOWS Funde von Bologoje (1905) entstammen <strong>der</strong> sandigen<br />
Uferregion. BRAUN (1885) erbeutete die Art im Peipus-See mit einem<br />
Schleppnetz. Es erscheint unwahrscheinlich, daß dort auf diese Weise größere<br />
Tiefen erreicht wurden. Schließlich fand DORNER (1902) unsere Art<br />
im Oberteich in Königsberg. Der Fund muß, wie schon die Bezeichnung<br />
Teich besagt, <strong>aus</strong> geringerer Tiefe stammen. Diesen nordeuropäischen Nachweisen<br />
folgen noch einige <strong>aus</strong> <strong>dem</strong> Alpenraum: FUHRMANN (1900) gibt Otomesostoma<br />
für den Genfer See an (Schilfgürtel bei La Belotte), v. HOFSTEN<br />
(1911 a) ebenfalls für den Genfer See (Tiefe 1,3-2 m), FINDENEGG und<br />
TURNOWSKY (1935) erbeuteten die Art in zwei verhältnismäßig warmen Seen<br />
auf <strong>der</strong> Turracher Höhe (Kärnten) und endlich wies REISINGER (1955)<br />
O. auditivum für Schlammbiotope des Gurksees (Kärnten) in 0,1-2 m Tiefe<br />
nach. An <strong>der</strong> letztgenannten Fundstelle trat sie allerdings nur im Winter auf.<br />
Otomesostoma auditivum besiedelt also fast im gesamten Verbreitungsgebiet<br />
neben <strong>der</strong> Tiefenregion auch die Uferzonen. Die Annahme einer<br />
generellen Kaltstenothermie dieser viel diskutierten Art muß damit endgültig<br />
fallengelassen werden.<br />
Der von STEINBÖCK (1942, 1943) her<strong>aus</strong>gearbeitete Gegensatz zwischen<br />
<strong>dem</strong> arktischen und <strong>dem</strong> alpinen Vorkommen scheint nach neueren Unter<br />
suchungen von REISINGER (1955) und STEINBÖCK (1958) nicht mehr in dieser<br />
scharfen Form zu bestehen, vielmehr besitzt die Art offenbar in den ihr<br />
gemäßen Lebensräumen überall eine gleiche ökologische Valenz.<br />
Mit diesen Feststellungen ist allerdings die Frage, weshalb dieses Turbellar<br />
in einigen Gewässern vorkommt, in an<strong>der</strong>en chemisch und typologisch<br />
gleichartigen dagegen fehlt, noch nicht geklärt. REISINGER (1955) kommt<br />
auf Grund von Laborversuchen zu <strong>dem</strong> interessanten Schluß, daß "nicht<br />
Temperatur, Sauerstoffgehalt und pH bestimmen, ob Otomesostoma in<br />
einem Hochgebirgstümpel leben kann o<strong>der</strong> nicht, es sind chemische Stoffe,<br />
die, von den Mitbewohnern <strong>der</strong> Tiere abgeschieden, diese vergiften und<br />
nicht aufkommen lassen" (zit.). Inwieweit diese Laborversuche Schlüsse<br />
auf die natürlichen Bedingungen zulassen, können erst eingehende Freilandbeobachtungen<br />
<strong>der</strong> Gesamtfauna in den jeweiligen Standorten ergeben.<br />
STEINBÖCK (1958) steht diesen Angaben REISINGERS vorerst noch skeptisch<br />
gegenüber, sieht aber auch existenzökologische Faktoren als die bestimmenden<br />
an.<br />
Familie Bothrioplanidae<br />
24. Bothrioplana semperi BRAUN 1881<br />
Bekannte Verbreitung: Europa nördlich <strong>der</strong> Alpen, Japan, Sumatra, Grönland,<br />
USA, Brasilien, Südafrika, meist in periodischen Kleingewässern und Quellbiotopen<br />
(DARM 1951), mitunter edaphisch (REISINGER 1954).<br />
<strong>Schleswig</strong>-Holstein: Kiel-Hasseldieksdamm, Buchenwaldtümpel 5. 3. und 11. 3.<br />
1957 (je 1 Ex.) - Küchensee, Quelle (TRIENEMANN 1921).
<strong>Kleinturbellarien</strong> <strong>aus</strong> <strong>dem</strong> <strong>Litoral</strong>' <strong>der</strong> <strong>Binnengewässer</strong> <strong>Schleswig</strong>-Holsteins 489<br />
Nach v. HOFsTEN (1912) besiedelt Bothrioplana in <strong>der</strong> Schweiz fast<br />
nur konstante Kleingewässer und tritt nur selten an Seeufern auf. Auch<br />
DAHM (1951) stellt flache Tümpel und Quellen als die bevorzugten Biotope<br />
her<strong>aus</strong>, daneben ist die Art <strong>aus</strong> seichteren Stellen an See- und Flußufern<br />
S'owie <strong>aus</strong> Gräben bekannt.<br />
THIENEMANN (1921) sieht in Bothrioplana einen Stygobionten. Obwohl<br />
die Art verschiedentlich in Grundwassersammlungen und Quellen angetroffen<br />
wurde, läßt sich nach den vielen neueren Befunden diese Ansicht nicht<br />
halten. Nach REISINGER (1925b) ist B. semperi in erster Linie Schlammbewohner<br />
oberirdischer Gewässer, Grundwasserbefunde sind durch sekundäre<br />
Einwan<strong>der</strong>ung zu erklären.<br />
Ordnung Neorhabdocoela<br />
Unterordnung Dalyellioida<br />
Familie Provorticidae<br />
25. Veidovskya ignava Ax 1951<br />
Bekannte Verbreitung: Finnischer Meerbusen, Kieler Bucht, Schlei, Amrum, Etangs<br />
an <strong>der</strong> französischen Mittelmeerküste (Ax 1951, 1954, 1956, GERLACH 1954).<br />
<strong>Schleswig</strong>-Holstein, Süßwasser: Hydro- und Hygropsammal <strong>der</strong> EIbe bei Hamburg<br />
(Ax 1957 a).<br />
Veidovskya ignava ist ein spezifisches Faunenelement <strong>der</strong> mesohalinen<br />
Brackwassergebiete an den europäischen Küsten. Die Besiedlung <strong>der</strong> limnischen<br />
Ufersande <strong>der</strong> EIbe stellt einen lokalen Vorstoß <strong>aus</strong> diesem Lebensraum<br />
dar.<br />
Nicht wie<strong>der</strong>gefunden.<br />
26. Provorticidorum spec.<br />
(Abb. 32-34)<br />
Sch1eswig-Holstein: Großer Plöner See, Hydropsammall3. 5. 1949 (leg. Dr. Ax) <br />
Großer Plöner See, am Koppelsberg, zwischen Phragmites-Wurzeln 30. 4.<br />
1958 (4 Ex., davon 3 juv.) - Großer Plöner See, Küstengrundwasser an <strong>der</strong><br />
Spitze <strong>der</strong> Prinzeninsel 13. 5. 1958 (3 juv. Ex.).<br />
GegenüberVeidovskya ignava ist die zweite Provorticide <strong>der</strong> schleswigholsteinischen<br />
<strong>Binnengewässer</strong> eine echte Süßwasserart. Die spärlichen Beobachtungen<br />
an wenigen Exemplaren gestatten zunächst nur eine oberflächliche<br />
Charakterisierung. Eine detaillierte Beschreibung dieser offenbarneuen<br />
Form muß künftigen Untersuchungen vorbehalten bleiben.<br />
Die Körperlänge beträgt 0,4-0,6 mm. Die Testes liegen lateral etwas<br />
hinter <strong>dem</strong> Pharynx. Die Vitellarien bilden zwei lange, laterale Schläuche,<br />
die in Höhe <strong>der</strong> Geschlechtsöffnung aufeinan<strong>der</strong> zulaufen. Die paarigen<br />
Germarien liegen seitlich im Hinterende des Körpers (Abb. 32). Das Kopulationsorgan<br />
(Abb. 33) setzt sich <strong>aus</strong> einem sackförmigen Muskelbulbus und
490<br />
Jens-Uwe Rixen<br />
einem kutikularen Stilett zusammen. Der Muskelbulbus ist im kugelförmig<br />
angeschwollenen Proximalteil mit Sperma erfüllt, <strong>der</strong> distale Schlauch enthält<br />
Kornsekret. Das Kutikularorgan setzt am distalen Ende etwa im rechten<br />
Winkel an. Es ist ein kurzes, leicht sichelförmig gebogenes Gebilde (Abb. 34).<br />
Abb. 32---34. Provorticidorumspec.<br />
Abb. 32. Habitusskizze. Abb. 33. Kopulationsorgan.<br />
Abb. 34. Kutikularstilett.<br />
Dis k u s s ion: In den genannten Merkmalen unterscheidet sich vorliegende<br />
Art sehr deutlich von allen bisher <strong>aus</strong> <strong>dem</strong> limnischen Bereich bekannten<br />
Vertretern <strong>der</strong> Provorticidae. Pilgramilla sphagnorum SEKERA 1906<br />
setzt sich im Habitus durch das verbreiterte Vor<strong>der</strong>ende einwandfrei ab,<br />
das Kopulationsorgan dieser Art ist möglicherweise reduziert, jedenfalls ist<br />
es bisher nicht beobachtet worden. Der terrikole ArChivortex silvestris REI<br />
SINGER 1924 ist nur 0,2 mm lang, er besitzt ein unpaares Germovitellar,<br />
Hoden und Kopulationsorgan sind sehr klein. Der Ductus ejaculatorius ist<br />
eine lange, s-förmig gebogene Röhre. Haplovortex bryophilus REIS. 1925,<br />
ein Bewohner nasser Moosrasen, besitzt ein rudimentäres Kopulationsorgan<br />
ohne Kutikularbewehrung. Schließlich ist <strong>aus</strong> <strong>der</strong> Neuen Welt noch Haplovortex<br />
virginianus RUEBUSH und HAYES 1939 zu nennen. Diese Art, die in<br />
einem Teich in Virginia (USA) gefunden wurde, unterscheidet sich von <strong>der</strong><br />
Form <strong>aus</strong> <strong>dem</strong> Großen Plöner See im Habitus (RuEBusH 1935, Hg. 1) und<br />
in <strong>der</strong> Form des Kutikularorgans (1. c. Hg. 2), welches hier ein tütenförmiges,<br />
gerades Gebilde darstellt.
<strong>Kleinturbellarien</strong> <strong>aus</strong> <strong>dem</strong> <strong>Litoral</strong> <strong>der</strong> <strong>Binnengewässer</strong> <strong>Schleswig</strong>-Holsteins 491<br />
Familie Graffillidae<br />
27. Bresslauilla relicta REISINGER 1929<br />
Bekannte Verbreitung: a) im marinen Bereich: Finnischer Meerbusen, Umgebung<br />
von Tvärminne, 15° C (KARLING 1930) - Kieler Bucht: an mehreren Stellen<br />
von ca. 10-15 %0 Salzgehalt im mehr o<strong>der</strong> weniger detritusreichen Sand<br />
und in Algenwatten-Selker Noor (fast abgeschlossener Nebenarm <strong>der</strong> Schlei)<br />
bei 2,5 % 0 (Ax 1951) - <strong>Schleswig</strong>-holsteinische Nordseeküste, auf Amrum und<br />
am Westerhever-Sand im Feinsand und Sandwatt bei ca. 30 0 / 00 Salzgehalt<br />
(Ax 1952) - Etangs an <strong>der</strong> französischen Mittelmeerküste, 6-15 %0 Salzgehalt<br />
(Ax 1956) - Schwarzes Meer, Süßwassereinfluß bei $ile (Türkei) im<br />
Feinsand bei 3-15 0 / 00 (Ax 1959).<br />
b) im Süßwasser: Wörthersee, 15--40 m Tiefe, 6,8-4,5° C, im Schlamm und<br />
zwischen Chara-Wurzeln (REISINGER und STEINBÖCK 1925) - Lago Maggiore,<br />
8-18 m Tiefe (STEINBÖCK 1951) - In einigen Steiermärker Seen (nach brieflicher<br />
Mitteilung von Prof. REISINGER an Dr. Ax) - Weiher im Botanischen<br />
Garten in Köln, in <strong>der</strong> kalten Jahreszeit (REISINGER 1929) - EIbe bei Hamburg,<br />
Mittel- bis Grobsand nahe <strong>der</strong> Spülzone (Ax 1957 a) - Stichkanal<br />
Spandau, nahe <strong>dem</strong> Teufelsee 11. 10. 1933 (Mitteilung von Dr. WEISE).<br />
<strong>Schleswig</strong>-Holstein: Bad Oldesloe, 22. 6. 1958, Salzstelle III a, 11 %0 Salzgehalt,<br />
13° C (sehr häuBg) - ebendort, 11. 8. 1958, Stelle I b, 19 0 / 00 , 24° C, (2 Ex.)<br />
- ebendort, 11. 8. 1958, Stelle VI d, 13 0 / 00 , 20° C (5 Ex.).<br />
Bresslauilla relicta siedelt in zwei völlig verschiedenen Lebensräumen.<br />
Sie wurde zuerst <strong>aus</strong> <strong>dem</strong> Süßwasser beschrieben, dann jedoch im Meere<br />
vom vollmarinen Bereich bis in das oligohaline Brackwasser nachgewiesen.<br />
Damit gehört die Art ähnlich wie Gyratrix hermaphroditus zu den wenigen<br />
holeuryhalinen Turbellarien (Ax 1952, 1956, 1957 a, REMANE 1958).<br />
Im marinen Bereich bevorzugt Bresslauilla relicta nach den bisher vorliegenden<br />
Beobachtungen küstennahe Regionen mit niedrigen Salzkonzentrationen.<br />
Die Neufunde in Oldesloe liefern den ersten Nachweis für die<br />
Besiedlung von Binnensalzstellen. Im Salzwasser ist die Art sehr eurytherm.<br />
Für das Süßwasser liegen die meisten Angaben <strong>aus</strong> den Alpenrandseen<br />
vor (REISINGER, STEINBÖCK). Die Art ist hier auf größere Tiefen mit<br />
niedrigen Temperaturen beschränkt. Für eine gewisse Kaltstenothermie im<br />
limnischen Bereich sprechen außer<strong>dem</strong> die Funde von REISINGER (1929)<br />
im Botanischen Garten Köln und von WEISE (1942) im Stichkanal Spandau.<br />
Die Art trat hier nur in <strong>der</strong> kalten Jahreszeit auf. In den Ufersanden <strong>der</strong><br />
EIbe besiedelt Bresslauilla eine Region mit stark strömen<strong>dem</strong> Wasser.<br />
Diese deutliche Bevorzugung kalter Tiefenregionen o<strong>der</strong> strömungsreicher<br />
Stellen im Süßwasser entspricht <strong>der</strong> bekannten Tatsache, daß "limnische<br />
Pflanzen und Tiere, die mit marinen Arten nahe verwandt sind, im<br />
Süßwasser viel mehr strömendes Wasser bevorzugen als im Meer o<strong>der</strong> im<br />
Süßwasser stärker kaltstenotherm sind als im Meer" (REMANE 1958, p. 55).<br />
Diese Aussage gilt nicht nur für getrennte Arten, son<strong>der</strong>n im vorliegenden<br />
Fall auch für verschiedene Populationen einer Spezies.
<strong>Kleinturbellarien</strong> <strong>aus</strong> <strong>dem</strong> <strong>Litoral</strong> <strong>der</strong> <strong>Binnengewässer</strong> <strong>Schleswig</strong>-Holsteins 493<br />
lieh, lediglich für den Fundort in <strong>der</strong> EIbe ist eine aktive Einwan<strong>der</strong>ung<br />
<strong>aus</strong> <strong>dem</strong> brackigen EIbeästuar wahrscheinlich.<br />
Familie Dalyelliidae<br />
28. Microdalyellia armigera (0. SCHMIDT 1861)<br />
(Abb. 35)<br />
Bekannte Verbreitung: Europa, Sibirien, Japan (?), USA.<br />
<strong>Schleswig</strong>-Holstein: Moore, Quelltümpel, Frühjahrstümpel, Waldgräben von April<br />
bis Juni, August, Oktober - Küstengrundwasser des Großen Plöner Sees bei<br />
Ascheberg 22. 6. (3 Ex.) und 6. 8. 1957 (6 Ex.).<br />
Körperlänge 0,8-1,4 mm. Länge des Kutikularapparats 84-130 fl <br />
<strong>der</strong> Abstand vom Ansatz <strong>der</strong> Seitenäste bis zum distalen Ende <strong>der</strong> Rinne<br />
beträgt 45-60 fl.<br />
Die Art ist sehr euryök.<br />
29. Microdalyellia armigera var. vinculosa (SZYNAL 1933)<br />
(Abb. 36)<br />
Bekannte Verbreitung: Polen.<br />
<strong>Schleswig</strong>-Holstein: Bach im Dodauer Forst 1. 5. 1958 (1 Ex.).<br />
Von <strong>der</strong> Hauptart trennt SZYNAL (1933) eine Unterart vinculosa ab,<br />
die sich im wesentlichen durch die Drehung <strong>der</strong> Rinne des Kutikularorgans<br />
unterscheidet.<br />
Die Länge des Kutikularapparats betrug bei <strong>dem</strong> schleswig-holsteinisehen<br />
Exemplar nur 100 fl gegenüber 215fl in <strong>der</strong> Angabe von SZYNAL.<br />
Der Unterschied geht im wesentlichen auf die sehr kurzen Stiele zurück, die<br />
bei <strong>dem</strong> mir vorliegenden Exemplar oHenbar noch nicht voll <strong>aus</strong>gewachsen<br />
waren. Nehmen wir als Maß den Abstand vom Ansatz <strong>der</strong> Seitenäste bis<br />
zur Spitze <strong>der</strong> Rinne - diese Länge beträgt nach SZYNAL ca. 85 fl gegenüber<br />
75 fl bei <strong>dem</strong> schleswig-holsteinischen Tier - so ist eine gute übereinstimmung<br />
vorhanden. Der rechte Seitenast des Kutikularorgans trägt 7 Stacheln<br />
gegenüber 8-10 in SZYNALS Beschreibung.<br />
30. Microdalyellia kupelwieseri (MEIXNER 1915)<br />
(Abb. 37)<br />
Bekannte Verbreitung: Fennoskandien, Nordrußland, Österreich, Schweiz, Italien.<br />
<strong>Schleswig</strong>-Holstein: Kiel-Hasseldieksdamm, Buchenwaldgraben 16. 4. 1958 (1 Ex.)<br />
- Bach im Dodauer Forst 1. 5. 1958 (8 Ex.) - Ladelun<strong>der</strong> Moor 1. 6. 19-58<br />
(1 Ex.) - Lebra<strong>der</strong> Moor 14. 10. (sehr häufig) und 5. 11. 1957 (sehr häufig) <br />
Kiel-Elmschenhagen, Moor 22. 10. 1957 (2 Ex.).<br />
Körperlänge 0,9-1 mm. Ein Teil <strong>der</strong> am 14. 10. 1957 im Lebra<strong>der</strong><br />
Moor gefundenen Tiere war, wohl durch den Darrninhalt bedingt, grün<br />
gefärbt. Der HO fl lange Kutikularapparat trägt am linken Seitenast einen<br />
und am rechten drei Stacheln.
494<br />
Jens-Uwe Rixen<br />
Die Art bewohnt humusreiche Kleingewässer. Sie wurde in Schleswl f<br />
Rolstein <strong>aus</strong>schließlich im Frühjahr und im Rerbst beobachtet, besitzt 11111"<br />
möglicherweise ein gewisses Kältebedürfnis. Die bisher bekannten FUlJlh<br />
weisen auf eine boreoalpine Disjunktion in <strong>der</strong> Verbreitung hin (STEINnl (<br />
1932; REISINGER 1955).<br />
31. Microdalyellia schmidtii (v. GRAFF 1882)<br />
(Abb. 38)<br />
Bekannte Verbreitung: Großbritannien, Fennoskandien, Nordrußland, Kaukasllii,<br />
Deutschland, Österreich, Schweiz.<br />
<strong>Schleswig</strong>-Holstein: Erlenbruchwaldtümpel am Westensee 22. 5. 1957 (1 Ex.) .<br />
Bach im Dodauer Forst 1. 5. 1958 (1 Ex) - Lebra<strong>der</strong> Moor 14. 10. 195"/<br />
(1 Ex.).<br />
Körperlänge 0,7-0,9 mm. Länge des Kutikularorgans 100 "".<br />
Die vier vorstehenden Formen M. armigera, M. armigera var. vin··<br />
culosa, M. kupelwieseri und M. schmidtii sind sehr nahe miteinan<strong>der</strong> verwandt.<br />
An verschiedenen Fundstellen traten mehrere zusammen in <strong>der</strong>selben<br />
Probe auf: Lebra<strong>der</strong> Moor, 14. 10. 1957: M. kupelwieseri und 1 Ex.<br />
M. schmidtii - Kiel-Elmschenhagen, Moor, 22. 10. 1957: Viele M. armigera<br />
und 4 Ex. M. kupelwieseri - Dodauer Forst, Waldbach 1. 5. 1958: 1 Ex.<br />
M. armiL ta, 1 Ex. M. armigera vinculosa, 8 M. kupelwieseri und 1 M.<br />
schmidtii - Ladelun<strong>der</strong> Moor 1. 6. 1958: 1 M. armigera und 1 M. kupelwieseri.<br />
Es bleibt dabei auffällig, daß die einzelnen Variationen an den<br />
verschiedenen Fundstellen ihres Gesamtareals in sehr identischer Ausprägung<br />
auftreten.<br />
32. Microdalyellia fusca (FUHRMANN 1894)<br />
(Abb. 39)<br />
Bekannte Verbreitung: a) Süßwasser: Spanien, Frankreich, Schweiz, Italien, Österreich,<br />
Deutschland, Sowjet-Union, Sibirien, Japan (?).<br />
b) Brackwasser: Finnischer Meerbusen (Salzgehalt bis 6,5 0 / 00 ), schwedische<br />
Ostseeküste.<br />
<strong>Schleswig</strong>-Holstein: Binnensalzstellen bei Bad Oldesloe 11. 8. 1958: Stelle Vb<br />
(19 0 C, 5 Ex.) und VI d (20 0 C, 2 Ex.).<br />
Die Art ist im Süßwasser Mittel- und Südeurasiens verbreitet. In<br />
Fennoskandien besiedelt sie dagegen nur das Brackwasser und wird<br />
deshalb von REMANE (1958) als regionale Brackwasserart bezeichnet. In den<br />
<strong>Binnengewässer</strong>n <strong>Schleswig</strong>-Holsteins wurde sie gleichfalls nur im Brack<br />
wasser <strong>der</strong> Binnensalzstellen von Oldesloe gefunden.<br />
LUTHER (1955) weist darauf hin, daß das Fehlen <strong>der</strong> Art im Süßwasser<br />
Fennoskandiens möglicherweise durch das mehr o<strong>der</strong> weniger saure, elek<br />
trolytenarme Wasser <strong>der</strong> fennoskandischen Urgesteinsgebiete bedingt ist.<br />
Während M. fusca im Brackwasser eine eurytherme Art ist, bevorzugt sie
Archiv f. Hydrobiologie. Bd. 57.<br />
Abb. 35. Microdalyellia armigera<br />
(0. SCHM. 1861), Kutikularapparat.<br />
Abb. 37. MicrodalyeUia kupelwieseri<br />
(MEIXNER 1915), Kutikularapparat.<br />
Zu S. 494.<br />
Abb. 36. Microdalyellia armigera var.<br />
vinculosa (SZYNAL 1933), Kutikularapparat.<br />
Abb. 38. Microdalyellia scnmidtii<br />
(V. GRAFF 1882), Kutikularapparat.
<strong>Kleinturbellarien</strong> <strong>aus</strong> <strong>dem</strong> <strong>Litoral</strong> <strong>der</strong> <strong>Binnengewässer</strong> <strong>Schleswig</strong>-Holsteins 495<br />
im Süßwasser, soweit dieser Faktor in den Literaturangaben berücksichtigt<br />
ist, kälteres Wasser.<br />
Danach ist M. fusca in ihren Ansprüchen an die chemische Zusammensetzung<br />
und die Temperatur <strong>der</strong> Gewässer in Parallele zu Bresslauilla relicta<br />
zu setzen.<br />
33. Microdalyellia fairchildi (v. GRAFF 1911)<br />
Bekannte Verbreitung: Frankreich, Fennoskandien, Polen, Rußland, Sibirien, Japan,<br />
USA.<br />
<strong>Schleswig</strong>-Holstein: Kieler Botanischer Garten, unterer Teich 20. 6. (6 Ex.), 19. 7.<br />
(20 Ex.), 16. 9. (sehr häufig), 4. 10. 1957 (2 Ex.), 20. 5. 1958 (1 Ex.) <br />
Kieler Botanischer Garten, oberer Teich 8. 5. (1 Ex.), 12. 5. (2 Ex.), 20. 6. 1957<br />
(1 Ex.) - Rosemel<strong>der</strong> See, Phytal 9. 7. (1 Ex.), 16. 8. 1957 (4 Ex.) - Bad<br />
Oldesloe, Teich im Kurpark 22. 6. 1958 (1 Ex.) - Marschgraben bei Neukirchen<br />
(Krs. Südton<strong>dem</strong>) 6. 9. 1957 (6 Ex.).<br />
Körperlänge 0,7-0,9 mm. Länge des Kutikularapparats bis zu 87 ll,<br />
davon bis 55,"", auf die Stiele entfallend.<br />
Die Art bevorzugt pflanzenreiche Kleingewässer.<br />
34. Microdalyellia brevimana (BEKLEMISCHEV 1921)<br />
(Abb. 40)<br />
Bekannte Verbreitung: Italien, Nord- und Osteuropa, Deutschland (Kurmark), Ostpreußen,<br />
Polen, Sibirien, Japan, USA.<br />
<strong>Schleswig</strong>-HoIstein: Selenter See, bei Giekau, zwischen angeschwemmten Pflanzenteilen<br />
3. 9. (8 Ex.) und 8. 9. 1957 (4 Ex.).<br />
Körperlänge 1,2 mm. Der Kutikularapparat <strong>der</strong> von mir untersuchten<br />
Tiere zeigt konstant eine an <strong>der</strong> Spitze in Zacken endigende Rinne. Auf<br />
dieses Merkmal gründet WEISE (1942) eine selbständige var. tectispinosa.<br />
Im Gegensatz zur Auffassung LUTHERs (1955) betrachte ich diese Bildung<br />
als eine natürliche Struktur und führe sie nicht auf Deformation zurück.<br />
Die Art besiedelt vorzugsweise die submerse Phytalregion größerer<br />
Seen.<br />
35. Microdalyellia picta (0. SCHMIDT 1848)<br />
(Abb. 41)<br />
Bekannte Verbreitung: Nord- und Osteuropa, Polen, Deutschland (Kurmark).<br />
<strong>Schleswig</strong>-Holstein: Kiel-Elmschenhagen, Moor 22. 10. 1957 (2 Ex.) - Kieler Botanischer<br />
Garten, unterer Teich 6.5. (8 Ex.) und 24. 6. 1957 (3 Ex.).<br />
Microdalyellia picta lebt vorzugsweise in moorigen und pflanzenreichen<br />
Kleingewässem.<br />
36. Microdalyellia rossi (v. GRAFF 1911)<br />
(Abb. 42)<br />
Bekannte Verbreitung: Nord- und Osteuropa, Polen, Deutschland (Kurmark), USA,<br />
Westgränland.
I.<br />
496 Jens-Uwe Rixen<br />
<strong>Schleswig</strong>-Holstein: Vieburger Gehölz in Kiel, Buchenwaldtümpel 12. 4. (30 Ex.),<br />
23. 4. 1957 (18 Ex.), 19. 5. 1958 (1 Ex.) - Teich im Tannenberger Gehölz in<br />
Kiel 29. 5. 1958 (5 Ex.) - Rosemel<strong>der</strong> See, Phytalregion 16. 8. 1957 (5 Ex.),<br />
9. 7. 1958 (sehr häufig) - Wellsee, Binsengürtel 24. 7. 1957 (15 Ex.) <br />
Lebra<strong>der</strong> Teich 12. 6. (1 Ex.), 31. 7. 1958 (3 Ex.) - Schulensee, Phytal 15. 5.<br />
1957 (1 Ex.), 23. 7. 1958 (3 Ex.).<br />
LUTHER (1955) hebt hervor, daß M. rossi an vielen Stellen Europas ein<br />
typisches Mitglied <strong>der</strong> Frühlingsfauna ist. Auch in .<strong>der</strong> Kurmark wurde die<br />
Art von WEISE nur im April und Mai beobachtet (unveröffentlichte Fundortlisten).<br />
In <strong>Schleswig</strong>-Holstein konnte M. rossi zwar auch regelmäßig in<br />
temporären Frühlingsgewässern gefunden werden, daneben trat sie aber<br />
auch im Sommer, bis in den August hinein, in <strong>der</strong> Phytalregion auf.<br />
37. Dalyellia viridis (G. SHAW 1791)<br />
Bekannte Verbreitung: Großbritannien, Nie<strong>der</strong>lande, Frankreich, Italien, Schweiz,<br />
Deutschland, Böhmen, Polen, Ost- und Südosteuropa, USA. In Nordeuropa<br />
wird D. viridis von D. penicilla (M. BRAUN) vertreten.<br />
<strong>Schleswig</strong>-Holstein: Buchenwaldtürnpel bei Schrevenbom 13. 3. (wenige juv. Ex.),<br />
17. 4. (sehr häufig), 13. 11. 1957 (sehr viele juv.), 21. 4. (sehr häufig), 8. 6. 1958<br />
(5 Ex.) - Graben am Koppelsberg bei Plön 2. 5. 1958 (6 Ex.) - Wiesentümpel<br />
in Kiel-Hasseldieksdamm 31. 5. 1956 (15 Ex.) - Wiesengraben zwischen Leck<br />
und Klixbüll (Krs. Südton<strong>dem</strong>) 22. 9. 1957 (5 Ex.).<br />
Die Mehrzahl <strong>der</strong> in <strong>Schleswig</strong>-Holstein beobachteten Exemplare von<br />
Dalyellia viridis ist durch den Besitz von Zoochlorellen <strong>aus</strong>gezeichnet, jedoch<br />
treten gelegentlich farblose Tiere auf. So waren in <strong>der</strong> Probe von<br />
Schrevenborn vom 21. 4. 1958 5 % und in <strong>dem</strong> Graben am Koppelsberg<br />
am 2. 5. 1958 ca. 30 % fast völlig weiß. Es handelt sich in beiden Fällen<br />
<strong>aus</strong>schließlich um adulte Tiere. Wie. v. HAFFNER (1925) feststellte, erfolgt<br />
die Infektion mit <strong>dem</strong> Symbionten Chlorella vulgaris bei Dalyellia viridis<br />
nicht, wie etwa bei Chlorohydra viridissima, im Eistadium, son<strong>der</strong>n erst als<br />
halberwachsenes Tier über den Darm. Unter diesen Umständen erscheint<br />
es eigenartig, daß sich einige Tiere nicht infizieren, obwohl die betreffenden<br />
Biotope die kleinen Grünalgen sicherlich in großer Fülle enthalten.<br />
Es wurden in den Tieren 25---36 Eier gezählt.<br />
Bekanntlich ist D. viridis überwiegend eine Frühjahrsform, sie tritt<br />
gelegentlich jedoch auch im Sommer auf. DORNER (1902) fand die Art am<br />
16. 8. im ostpreußischen Löwentinsee. Ich konnte am 22. 9. 1957 in einem<br />
Wiesengraben einige Exemplare feststellen. Mein Fund ist auf die sehr<br />
nie<strong>der</strong>schlagsreichen Sommermonate des Jahres 1957 zurückzuführen, in<br />
denen die sonst trockenliegenden Wiesengräben Lebensmöglichkeiten für<br />
diese Art boten. D. viridis ist also nicht absolut auf das Frühjahr beschränkt.<br />
Die jungen Tiere schlüpfen in <strong>der</strong> Regel bereits im Spätherbst. Sie<br />
überleben den Winter in <strong>der</strong> Schlammschicht <strong>der</strong> Tümpel. Im Frühjahr setzt
498 Jens-Uwe Rixen<br />
In <strong>der</strong> Kurmark von WEISE von Juli bis Oktober gefunden. Die Art<br />
lebt im Sommer und Herbst im Phytal von Seen, wahrscheinlich nur im<br />
Sublitoral.<br />
43<br />
I22ß<br />
l<br />
Abb. 43. Gieysztoria virgulifera (PLOTNIKOV 1906), Kutikularapparat.<br />
Abb. 44. Gieysztoria triquetra (FUHRMANN 1894), Kutikularapparat.<br />
43. Gieysztoria triquetra (FUHRMANN 1894)<br />
(Abb. 44)<br />
Bekannte Verbreitung: Mitteleuropa.<br />
<strong>Schleswig</strong>-Holstein: Einfel<strong>der</strong> See, Phytalregion 26. 8. 1957 (7 Ex.).<br />
Körperlänge 1,1-1,3 mm. Höhe des Kutikularapparates 125 f1. Das<br />
dunkelbraune Ei mißt ca. 165 X 115 f1.<br />
44. Castrella truncata (ABILDGAARD 1789)<br />
Bekannte Verbreitung: Europa, Zentralasien, Grönland, Ägypten.<br />
<strong>Schleswig</strong>-Holstein: Von Mai bis Oktober regelmäßig im Phytal von Seen, Teichen<br />
und Tümpel. Von v. BüLOw (1951) in <strong>der</strong> Seerosenzone ostholsteinischer Seen<br />
nachgewiesen.<br />
Unterordnung Typhloplanoida<br />
Familie Trigonostomidae<br />
45. Coronhelmis multispinosus LUTHER 1948<br />
Bekannte Verbreitung: Brackwässer <strong>der</strong>Ostsee in Finnland und<strong>Schleswig</strong>-Holstein.<br />
<strong>Schleswig</strong>-Holstein: EIbe, bei Hamburg, Hydro- und Hygropsammal (Ax 1957 a).<br />
Diese Brackwasserform, <strong>der</strong>en lokale Einwan<strong>der</strong>ungstendenz Ax (1957a)<br />
nachwies, wurde nicht wie<strong>der</strong> beobachtet.<br />
Familie Typhloplanidae<br />
Unterfamilie Protoplanellinae<br />
46. Castradella granea (M. BRAUN 1885)<br />
Bekannte Verbreitung: Livland, Nordrußland, Polen, Kurmark.
<strong>Kleinturbellarien</strong> <strong>aus</strong> <strong>dem</strong> <strong>Litoral</strong> <strong>der</strong> <strong>Binnengewässer</strong> <strong>Schleswig</strong>-Holsteins 499<br />
<strong>Schleswig</strong>-Holstein: Trensahl, mooriger Waldgraben 29. 5. 1957 (4 Ex.) - Schrevenborn,<br />
Buchenwaldtümpel 17. 4. (30 Ex.), 26. 4. 1957 (2 Ex.), 1. 5. 1957<br />
(3 Ex.) - Vieburger Gehölz in Kiel, Buchenwaldtümpel 23. 4. 1957 (sehr<br />
häufig).<br />
Die 0,9-1,2 mm langen Exemplare dieser Art sind auffallend dunkel<br />
gefärbt. Die Farbe ist ein ins Violett spielende Grau. Bekanntlich lebt<br />
C. granea vorzugsweise als Einmieter im Brutraum von Asellus aquaticus.<br />
Von mir wurden die Tiere stets frei im Substrat beobachtet. Sie entstammen<br />
jedoch Fundstellen, in denen die Assel in großer Anzahl vorkommt. Vermutlich<br />
haben die Tiere die Wirte also sekundär, nach <strong>der</strong>en Absterben in den<br />
Probengläsern, verlassen.<br />
Soweit bisher bekannt, hat die Art eine recht enge Verbreitung. Diese<br />
deckt sich etwa mit <strong>dem</strong> Baltischen Höhenrücken, <strong>der</strong> im Süden, Osten<br />
und Westen die Ostsee begrenzt. Bevorzugte Biotope sind temporäre Waldgewässer.<br />
Unterfamilie Olisthanellini<br />
47. Olisthanella obtusa (M. SCHULTZE 1851)<br />
Bekannte Verbreitung: Ganz Europa außer Skandinavien und <strong>dem</strong> Süden.<br />
<strong>Schleswig</strong>-Holstein: Botanischer Garten Kiel, unterer Teich 16. 9. 1957 (3 Ex.) <br />
Rosenfel<strong>der</strong> See, zwischen angeschwemmten PRanzenresten 9. 7. 1958 (7 Ex.)<br />
- Bad Oldesloe, Teich im Kurpark (nach THIENEMANN 1925/26 Salzstelle VII,<br />
jetzt völlig <strong>aus</strong>gesüßt), zwischen faulen<strong>dem</strong> Laub 22. 6. 1958 (15 Ex.).<br />
Die Art ist sehr euryök.<br />
Unterfamilie Ascophorini<br />
48. Dochmiotrema limicola v. HOFSTEN 1907<br />
Bekannte Verbreitung: Schweiz, Schlamm eines Baches am Thuner See - Finnland,<br />
Tümpel bei Lappvik, Hydropsammal - Rußland, Ladogasee, im <strong>Litoral</strong><br />
zwischen WasserpRanzen - Rußland, See Perejeslawskoje, im seichten Wasser<br />
zwischen Heleocharias - Polen, Wigrysee, im Hygropsammal.<br />
<strong>Schleswig</strong>-Holstein: Großer Plöner See, Küstengrundwasser am Prinzenbad in Plön<br />
13. 5. 1958 (3 Ex.) - Nach mündlichen Mitteilungen von Prof. REMANE und<br />
Dr. Ax im Großen Plöner See früher regelmäßig beobachtet - Selenter See,<br />
bei Bellin, Küstengrundwasser 16. 6. 1956 (sehr häufig) - EIbe, bei Hamburg,<br />
Hydropsammal (Ax 1957 a).<br />
In <strong>Schleswig</strong>-Holstein ist D. limicola auf das Psammal und Küstengrundwasser<br />
beschränkt. Auch GIEYSZTOR (1938) fand die Art in Polen nur<br />
im Psammal, in Finnland wurde sie ebenfalls nur im Psammal beobachtet<br />
(LUTHER, 1946). Dagegen liegen die Fundstellen von v. HOFsTEN (1907)<br />
in <strong>der</strong> Schweiz, von NASONOV (1917) im Ladogasee und von CORDE (1923)<br />
im See Perejeslawskoje in Schlammbiotopen. GIEYSZTOR (1938) vermutet<br />
allerdings, daß auch diese Befunde von Sandböden stammen, die sekundär<br />
mit Schlamm überlagert sind. Jedenfalls erscheint D. limicola auch nach<br />
unseren Befunden als ein sehr typischer Psammobiont.
500 Jens-Uwe Rixen<br />
Unterfamilie Phaenocorini<br />
49. Phaenocora unipunctata (OERSTED 1843)<br />
(Abb. 45)<br />
Bekannte Verbreitung: Europa, Zentralasien, Sumatra.<br />
<strong>Schleswig</strong>-Holstein: Vieburger Gehölz in Kiel, Buchenwaldtümpel 12. 4. 1958<br />
(1 Ex). - Buchenwaldtümpel bei Schrevenbom 19. 4. 1956 (25 Ex.) <br />
Hohner See 18. 5. 1956 (1 Ex.) - Hasseldieksdammer Gehölz in Kiel, Buchenwaldtümpel<br />
5. 3. 1957 (5 Ex.), 11. 3. 1957 (1 Ex.) - Teich im Tannenberger<br />
Gehölz in Kiel 2. 4. 1957 (6 Ex.) - Rosenfel<strong>der</strong> See, auf schlammigem Sandgrund<br />
9. 7. 1957 (1 Ex.) - Selent, Abflußgraben <strong>der</strong> Meierei 3. 6. 1957<br />
(10 Ex.).<br />
Abb. 45. Phaenocora unipunctata (OERSTED 1843), Kopulationsorgan.<br />
Maximallänge 3,5 mm, größte Breite 1,5 mm. Die gesamte Population<br />
<strong>aus</strong> <strong>dem</strong> Meiereiabfluß in Selent besaß ein stumpf abgerundetes Hinterende,<br />
wie es auch WEISE (1942) beschrieben hat (var. acaudata). In <strong>der</strong><br />
inneren Organisation ist aber kein Unterschied zur Nominatform festzustellen.<br />
Abb. 45 zeigt das Kopulationsorgan eines Exemplares <strong>aus</strong> Selent.<br />
50. Phaenocora typhlops (VEJDOVSKY 1880)<br />
Bekannte Verbreitung: Mittel-, Nordost- und Osteuropa.<br />
<strong>Schleswig</strong>-Holstein: Teich im Tannenberger Gehölz, zwischen Wasserpflanzen<br />
26. 4. 1956 (10 Ex.), 29. 5. 1958 (1 Ex.) - Schulensee, im ufernahen Phytal<br />
23. 7. 1958 (1 Ex.) - Brahmsee, bei Eisendorl, Hydropsammal 27. 3. 1957<br />
(6 Ex.) - Hohner See 18. 5. 1956 (5 Ex.).<br />
Länge etwa 1,75 mm. Bei einem Exemplar war <strong>der</strong> Darm durch Nahrungspartikel<br />
grün gefärbt.<br />
Die beiden Phaenocora-Arten sind in <strong>Schleswig</strong>-Holstein im wesent-
<strong>Kleinturbellarien</strong> <strong>aus</strong> <strong>dem</strong> <strong>Litoral</strong> <strong>der</strong> <strong>Binnengewässer</strong> <strong>Schleswig</strong>-Holsteins 501<br />
lichen auf Kleingewässer beschränkt und treten vorzugsweise im Frühjahr<br />
auf.<br />
Unterfamilie Opistominae<br />
51. Opistomum pallidum O. SCHMIDT 1848<br />
Bekannte Verbreitung: Europa, USA.<br />
<strong>Schleswig</strong>-Holstein: Vieburger Gehölz in Kiel, Buchenwaldtümpel 12. 4. (8. Ex.),<br />
23. 4. 1957 (8 Ex), 15. 4. (sehr häufig), 19. 5. 1958 (13 Ex.) - Buchenwaldtümpel<br />
bei Schrevenbom 13. 3. (1 Ex.), 17. 4. (2 Ex.), 13. 11. 1957 (sehr<br />
viele juv. Ex.) - Kiel-Hasseldieksdamm, Buchenwaldtümpel 5. 3. (42 Ex.),<br />
11. 3. (sehr häufig), 24. 10. 1957 (7 juv. Ex.), 16. 4. 1958 (sehr häufig) <br />
Lebra<strong>der</strong> Moor 14. 10. 1957 (3 Ex.).<br />
Opistomum pallidum lebt in <strong>Schleswig</strong>-Holstein vorzugsweise in temporären<br />
Waldtümpeln. Große geschlechtsreife Exemplare (Größe ca. 4 mm)<br />
treten <strong>aus</strong>schließlich im Frühjahr auf, jedoch wurden an den gleichen Fundstellen<br />
im Spätherbst zweimal junge Tiere beobachtet (Länge ca. 1 mm).<br />
Interessanterweise kann die Anlage <strong>der</strong> Geschlechtsorgane bereits im Spätherbst<br />
erfolgen; so wurden zu diesem Zeitpunkt in Einzelfällen sehr kleine<br />
Tiere mit schon voll entwickeltem Kopulationsorgan gefunden. Im Winter<br />
scheint das Wachstum zu ruhen, so daß die Tiere erst im zeitigen Frühjahr<br />
ihre volle Körperlänge erreichen. Einmal wurden voll <strong>aus</strong>gewachsene Exemplare<br />
unter einer noch bestehenden Eisdecke gefunden (12. 4. 1957). Ende<br />
Mai ist die Entwicklung in unseren Kleingewässern abgeschlossen, Opistomum<br />
pallidum verschwindet, auch wenn <strong>der</strong> Lebensraum noch Wasser<br />
führt. Im ökologischen Verhalten ergeben sich gewisse Übereinstimmungen<br />
mit Dalyellia viridis, allerdings ist letztgenannte Form für Wiesentümpel<br />
charakteristisch, während O. pallidum fast <strong>aus</strong>schließlich Waldtümpel<br />
besiedelt. Die beiden Arten wurden nur einmal in einem am Waldrand<br />
gelegenen, gut durchlichteten Tümpel vergesellschaftet angetroffen (Schrevenborn).<br />
52. Opistomum fuscum WEISE 1942<br />
(Abb. 46-47)<br />
Bekannte Verbreitung: Kurmark, Lappland<br />
<strong>Schleswig</strong>-Holstein: Suhrer See, Hydropsammal mit Characeenbewuchs, 10 bis<br />
40 cm tief, 17. 6. 1957.<br />
Nur in einem Exemplar wurde ein weiterer Vertreter <strong>der</strong> Gattung<br />
Opistomum beobachtet. Das Tier ist 0,75 mm lang, farblos, ohne Augen.<br />
Das Kopulationsorgan (Abb. 47) zeigt im Ruhezustand einen stark aufgeknäulten<br />
Ductus ejaculatorius. Im voll <strong>aus</strong>gestülpten Zustand (Abb. 46)<br />
ist dieser 250 fL lang (entlang <strong>der</strong> Krümmung gemessen). Das Organ ist in<br />
ganzer Länge mit kurzen Stacheln besetzt, nur proximal ist eine kleine<br />
Zone stachelfrei.<br />
Dis k u s s ion: Gegenüber O. pallidum ist vorliegende Form durch<br />
geringere Körpergröße <strong>aus</strong>gezeichnet. Es fehlt ferner die kutikularisierte
502 Jens-Uwe Rixen<br />
Mündung <strong>der</strong> Penisscheide sowie <strong>der</strong> Hakenbesatz <strong>der</strong> Penisspitze. O. arsenii<br />
NASONOV 1917 besitzt Augen, auch ist <strong>der</strong> Ductus ejaculatorius bedeutend<br />
kürzer. O. dimitrii NASONOV 1919 wird 3 mm lang, außer<strong>dem</strong> ist <strong>der</strong><br />
Ductus ejaculatorius bei dieser Art, wie auch bei O. tundrae NASONOV 1923<br />
erheblich kürzer und im Ruhezustand sehr viel weniger aufgewunden als bei<br />
<strong>der</strong> uns vorliegenden Art. Von O. fuscum WEISE 1942 weicht die vorliegende<br />
Form in zwei Punkten ab. Einmal besitzt die Art <strong>aus</strong> <strong>der</strong> Kurmark<br />
braune Pigmentflecken. Dieser Unterschied zu unseren Tieren <strong>aus</strong> <strong>dem</strong><br />
Suhrer See kann auf individueller Variation beruhen. Zum an<strong>der</strong>en zeigt<br />
sich ein Unterschied in <strong>der</strong> Bestachelung des sonst gleich gebauten Ductus<br />
ejaculatorius. Nach <strong>der</strong> Beschreibung von WEISE besitzt das Organ lediglich<br />
einen Stachelkranz an <strong>der</strong> Basis, während es bei unserer Art bis auf einen<br />
kleinen proximalen Teil voll bestachelt ist. Es ist sehr wahrscheinlich, daß<br />
hier ein Beobachtungsfehler WEISES vorliegt. Jedenfalls haben LUTHER,<br />
KARLING und PAPI (nach briefl. Mitt. PAPI) in Lappland eine Opistomum<br />
Art gefunden, die unserer Form völlig gleicht und identifizieren sie mit<br />
Vorbehalt als O. fuscum. Dieser Auffassung schließen wir uns für die<br />
schleswig-holsteinische Form an.<br />
Abb. 46-47. Opistomum fuscum WEISE 1942.<br />
Abb. 46. Ausgestülpter Ductus ejaculatorius.<br />
Abb. 47. Kopulationsorgan im Ruhezustand.<br />
Unterfamilie Rhynchomesostominae<br />
53. RhynChomesostoma rostratum (0. F. MÜLLER 1774)<br />
Bekannte Verbreitung: Europa, Sibirien, Ceylon (?), Formosa, Japan, USA.<br />
<strong>Schleswig</strong>-Holstein: In fast allen Proben <strong>aus</strong> moorigen Biotopen, außer<strong>dem</strong> in<br />
einem Graben, <strong>der</strong> sehr intensiv bewirtschaftete, stark gedüngte Schrebergärten<br />
entwässert. Von April bis Mai und Oktober bis November.<br />
R. rostratum lebt in <strong>Schleswig</strong>-Holstein <strong>aus</strong>schließlich in den kühleren<br />
Jahreszeiten. Sie wurde in den Sommermonaten von Juni bis September
<strong>Kleinturbellarien</strong> <strong>aus</strong> <strong>dem</strong> <strong>Litoral</strong> <strong>der</strong> <strong>Binnengewässer</strong> <strong>Schleswig</strong>-Holsteins 505<br />
förmige, nach innen gerichtete Nebenstacheln an. Dieser Typus ist auch von<br />
WEISE (1942) festgestellt worden (Abb. 48).<br />
59. Castrada neocomensis VOLZ 1898<br />
(Abb. 49).<br />
Bekannte Verbreitung: Fennoskandien, Osteuropa, Alpengebiet.<br />
<strong>Schleswig</strong>-Holstein: Garrensee 12. 7. 1957, unter Nuphar-Blättem (1 Ex.).<br />
Länge 0,7 mm. Bis auf einen kleinen Bezirk am Vor<strong>der</strong>ende ist das<br />
Tier völlig mit Zoochlorellen erfüllt.<br />
60. Typhloplana viridata (ABILDGAARD 1789)<br />
Bekannte Verbreitung: Ganz Europa außer <strong>dem</strong> Süden, Japan, Neuseeland (?),<br />
USA.<br />
<strong>Schleswig</strong>-HoIstein: Von Mai bis September sehr zahlreich im Phytal vieler Seen,<br />
Teiche und Gräben. Von ZACHARIAS (1893, 1894) im Großen Plöner See beobachtet.<br />
Möglicherweise liegt hier eine Verwechslung mit Castrada viridis vor.<br />
v. BüLOw (1951) wies die Art in Holstein nach.<br />
In <strong>Schleswig</strong>-Holstein wurde T. viridata sehr häufig beobachtet, dagegen<br />
nicht die vielfach angezweifelte, nahe verwandte Art T. minima<br />
(FUHRMANN 1894). Diese soll auf das zeitige Frühjahr beschränkt sein<br />
(MAHAN, 1956). Ich habe Vertreter <strong>der</strong> Gattung nur ab Ende Mai gefunden.<br />
Alle in sorgfältigen Untersuchungen bearbeiteten Tiere erwiesen sich<br />
einheitlich als T. viridata.<br />
Unterfamilie Mesostominae<br />
61. Mesostoma lingua (ABILDGAARD 1789)<br />
Bekannte Verbreitung: Europa, Zentralasien, Japan, Mrika.<br />
<strong>Schleswig</strong>-Holstein: Vieburger Gehölz in Kiel, Buchenwaldtümpel 12. 4., 15. 4.,<br />
23. 4., 19. 5., 12. B. 1957 (meistens in sehr großer Anzahl) - Suhrer See,<br />
Hydropsammal mit Characeenbewuchs 5. 5. (4 Ex.), 17. 8. 1958 (2 Ex.) <br />
Großer Plöner See, Küstengrundwasser an <strong>der</strong> Spitze <strong>der</strong> Prinzeninsel 8. 7.<br />
1956 (1 Ex.) - Lebra<strong>der</strong> Teich, Phytalregion 17. 6., 1. 7. 1958 (sehr häufig).<br />
62. Mesostoma ehrenbergi (FOCKE 1836)<br />
Bekannte Verbreitung: Europa, Zentralasien, Kamtschatka, USA, Trinidad, Brasilien,<br />
Titicacasee, Neuseeland.<br />
<strong>Schleswig</strong>-Holstein: Suhrer See, Hydropsammal mit Characeenbewuchs 27. 9. 1957<br />
(1 Ex.) - Einfel<strong>der</strong> See, Phytal 26. 8. 1957 (1 Ex.) - von v. BÜLOW (1951)<br />
im Bossee beobachtet.<br />
63. Mesostoma tetragonum (0. F. MÜLLER 1774)<br />
Bekannte Verbreitung: Ganz Europa außer <strong>dem</strong> Süden.<br />
Schieswig-Hoistein: Phytal des Lebra<strong>der</strong> Teiches 17. 6. 1958 (sehr häufig) - von<br />
ZACHARIAS (1887) im Kellersee, von MÜLLER-LIEBENAU (1956) in <strong>der</strong> Potamogeton-Zone<br />
ostholsteinischer Seen gefunden.
506<br />
Jens-Uwe Rixen<br />
An <strong>dem</strong> Fundort trat M. tetragonum zusammen mit M. lingua auf. Die<br />
Jungtiere <strong>der</strong> ersteren Art zeigen noch nicht die seitlichen Lamellen, so daß<br />
eine Verwechslung mit M. lingua auf diesem Entwicklungsstadium leicht<br />
möglich ist.<br />
64. Bothromesostoma personatum (0. SCHMIDT 1848)<br />
Bekannte Verbreitung: Ganz Europa, Sibirien, Tienschan-Gebirge, Iran, Japan,<br />
USA.<br />
<strong>Schleswig</strong>-Holstein: Bossee, unter Nuphar-Blättern 16. 7. 1957 (1 Ex.) - Einfel<strong>der</strong><br />
See, Phytal 26. 8. 1957 (1 Ex.) - Lütichauer See, unter Nuphar-Blättern 2. 9.<br />
1956 (1 Ex.) - Lebra<strong>der</strong> Teich, Phytal 17.6. (2 Ex.), 1. 7. (7 Ex.), 31. 7. 1958<br />
(7 Ex.) - Schmalstede, Mühlenteich, zwischen Fadenalgen 18. 8. 1957 (5 Ex.)<br />
- Wiesengraben bei Leck (Krs. Südton<strong>der</strong>n) 22. 9. 1957 (sehr häufig) - Billwer<strong>der</strong><br />
bei Hamburg, alter Torfstich mit Potamogeton 22. 6. Hi58 (20 Ex.) <br />
von ZACHARIAS (1887) im Großen Eutiner und Ratzeburger See, nach handschriftlicher<br />
Ergänzung zu ZACHARIAS 1894 auch im Großen Plöner See beobachtet.<br />
65. Bothromesostoma essenii M. BRAUN 1885<br />
Bekannte Verbreitung: Fennoskandien, Dänemark, Norddeutschland, Ostpreußen,<br />
Rußland, Österreich, Tienschan-Gebirge.<br />
Schieswig-Hoistein: Bossee, unter Nuphar-Blättern 16. 7. 1957 (20 Ex.), 20. 7. 1958<br />
(2 Ex.) - Schulensee, Phytalregion 25. 6. 1957 (3 Ex.), 23. 7. 1958 (20 Ex.) <br />
Brahmsee, bei Eisendorf, Phytal 16. 7. 1957 (1 Ex.) - Drüsensee, Phytal<br />
12. 7. 1957 (3 Ex.) - Lütichauer See, Phytal 2. 9. 1956 (1 Ex.) - von<br />
ZACHARIAS (1887) in zahlreichen schleswig-holsteinischen Seen gefunden.<br />
Beide Bothromesostoma-Arten sind typische Phytalbewohner. Sei treten<br />
normalerweise jedoch nicht zusammen auf (Konkurrenz?), nur in einem<br />
Fall wurde neben zahlreichen Exemplaren von B. essenii auch ein Exemplar<br />
von B. personatum festgestellt.<br />
Unterordnung Kalyptorhynchia<br />
Familie Polycystididae<br />
66. Gyratrix hermaphroditus EHRENBERG 1831<br />
Bekannte Verbreitung: Europa, Asien, Amerika, vom limnischen Bereich bis ins<br />
Hyperhalinikum (bis 43 0 /00 Salzgehalt), vom Grundwasser bis ins Phytal.<br />
Auch in Gewässern mit aberrantem Chemismus (WEISE 1943: gipshaltiges<br />
Wasser).<br />
<strong>Schleswig</strong>-Holstein: Von März bis Oktober in etwa 95 % aller Gewässer. Von<br />
ZACHARIAS (1883, 1894) im Großen Plöner See nachgewiesen, Ax (1957 a) fand<br />
die Art im <strong>Litoral</strong> <strong>der</strong> EIbe bei Hamburg. v. BÜLow (1951) beobachtete<br />
G. hermaphroditus in <strong>der</strong> Seerosenzone osthoisteinischer Gewässer.<br />
67. Opisthocystis goettei (BRESSLAU 1906)<br />
(Abb. 50-51)<br />
Bekannte Verbreitung: Ganz Europa, Japan, USA.
508 Jens-Uwe Rixen<br />
psammal des Bodensees bei Langenargen, August 1949, sehr häufig (mündliche<br />
Mitteilung von Prof. REMANE).<br />
<strong>Schleswig</strong>-Holstein: Suhrer See, Hydropsammal mit Characeenbewuchs 2. 11.<br />
(5 Ex.), 19. 11. 1956 (2 Ex.), 17. 6. (6 Ex.), 14. 10. 1957 (2 Ex.).<br />
Körperlänge 0,9 mm. Länge des gesamten Kopulationsorgans 315 f.L<br />
(Abb. 52). Im Ruhezustand liegen die zwölf Stacheln eng aneinan<strong>der</strong>, beim<br />
Vorstülpen werden sie abgespreizt, offensichtlich ein Mechanismus zur Verankerung<br />
des Kopulationsorgans im Geschlechtspartner. Die Vorstülpung<br />
tritt auch bei starkem Quetschen des lebenden Tieres ein (Abb. 53).<br />
Koinocystis neocomensis war bisher nur <strong>aus</strong> <strong>dem</strong> Alpenraum bekannt.<br />
Durch den Nachweis im <strong>Litoral</strong> schleswig-holsteinischer <strong>Binnengewässer</strong><br />
wird unsere Kenntnis über das Verbreitungsareal dieser Art beträchtlich<br />
erweitert. Die Mehrzahl <strong>der</strong> <strong>aus</strong> <strong>dem</strong> Alpengebiet bekannten Funde stammen<br />
<strong>aus</strong> größeren Tiefen, jedoch hat MEIXNER (1915) die Art einmal auch<br />
in <strong>der</strong> Uferzone des Lunzer Sees und Prof. REMANE neuerdings im <strong>Litoral</strong><br />
des Bodensees gefunden.<br />
Die Art wurde von mir regelmäßig zu verschiedenen Zeiten in <strong>der</strong><br />
Uferzone des Suhrer Sees beobachtet. Ähnlich wie für Otomesostoma auditivum<br />
ist damit die ältere Auffassung (EKMAN, 1917), daß K. neocomensis<br />
ein spezifischer Bewohner des Profundals ist, hinfällig geworden. Ebensowenig<br />
ist auch die von STEINBÖCK (1932) vollzogene Charakterisierung als<br />
ein stenothermal alpines Kältetier haltbar. Koinocystis neocomensis erscheint<br />
vielmehr als ein eurythermer Süßwasserbewohner, <strong>der</strong> in seiner Verbreitung<br />
aber offenbar an wenig verschmutzte Gewässer gebunden ist. Die schleswig-holsteinischen<br />
Funde entstammen <strong>aus</strong>schließlich <strong>dem</strong> Suhrer See, <strong>der</strong><br />
einen recht ursprünglichen, wenig durch menschliche Kulturmaßnahmen<br />
beeinflußten Charakter behalten hat (v. S. 514).<br />
Die Frage, ob mit <strong>dem</strong> Nachweis in NorddeutschIamI eine boreoalpine<br />
Disjunktion vermutet werden kann, ist vorläufig nicht zu entscheiden. Auf<br />
fällig ist jedenfalls, daß bei den gründlichen Untersuchungen im skandi<br />
navischen Raum diese Art bisher nicht gemeldet worden ist.<br />
Nach MEIXNER (1925) sind die limnischen Vertreter <strong>der</strong> Kalyptorhyn<br />
chierfamilie Koinocystidae präglaziale Einwan<strong>der</strong>er <strong>aus</strong> <strong>dem</strong> pontokaspi<br />
schen Raum. Mit <strong>dem</strong> Nachweis mehrerer mariner Koinocystiden an medi<br />
terranen, nordeuropäischen und südamerikanischen Küsten (MARCUS, 1949;<br />
KARLING, 1954; Ax, 1959) ist diese Hypothese hinfällig geworden.<br />
Familie Placorhynchidae<br />
69. Placorhynchus octaculeatus dimorphis KARLING 1947<br />
Bekannte Verbreitung <strong>der</strong> ssp. dimorphis: Finnischer Meerbusen (KARLING 1947),<br />
Kieler Bucht (mündl. Angaben von Dr. Ax), Schwarzes Meer, Süßwassereinfluß<br />
bei $ile (Türkei) (Ax 1959).
510 Jens-Uwe Rixen<br />
Die in den Artenlisten <strong>der</strong> verschiedenen Biotoptypen in Klammern beigefügten<br />
Zahlenwerte geben die Anzahl <strong>der</strong> Einzelbiotope an, in denen die<br />
betreffende Art gefunden wurde.<br />
A. Q u e 11 bio top e<br />
In den ostholsteinischen Quellen hat THIENEMANN (1922 a, b, 1925,<br />
1949) die Trikladenfauna eingehend bearbeitet. Über <strong>Kleinturbellarien</strong> liegen<br />
dagegen bisher keine Beobachtungen vor. In Tabelle 1 sind die bei<br />
vorliegenden Untersuchungen in Quellen gefundenen Arten zusammengestellt.<br />
Tab. 1. Quellbiotope (Numerierung <strong>der</strong> ostholsteinischen Quellen<br />
nach THIENEMANN 1922 a).<br />
Kellersee Dieksee Botani-<br />
K. VIII<br />
Rheokrene<br />
17.8.1958<br />
K. IX K. XI<br />
Holo- Limnokrene<br />
kiene<br />
17.8.1958 17.8.1958<br />
D.VI<br />
Limnokl'ene<br />
7.5.1958 17.8.1958<br />
scher<br />
Garten<br />
Kiel<br />
Rheo-<br />
krene<br />
8.5.1958<br />
Opisthocystis goettei<br />
Gyratrix hermaphroditus<br />
Castrella truncata I<br />
• •<br />
•<br />
I<br />
I<br />
0<br />
•<br />
Microdalyellia armigera<br />
Microstomum spec.<br />
Stenostomum leucops<br />
I<br />
•<br />
+<br />
• •<br />
Die in <strong>der</strong> sechsten Spalte angeführte Quelle im Botanischen Garten Kiel ist<br />
eine künstliche, durch Leitungswasser gespeiste Rheokrene.<br />
Insgesamt erscheint die Quellfauna recht arm, es kann zu<strong>dem</strong> keine<br />
<strong>der</strong> gefundenen <strong>Kleinturbellarien</strong>arten als spezifischer Quellbewohner an<br />
gesprochen werden, während unter den Trikladen bekanntlich in Polycelis<br />
felina und Crenobia alpina zwei sehr typische Krenobionten existieren.<br />
Lediglich Opisthocystis goettei wurde in SchIeswig-Holstein <strong>aus</strong>schließlich<br />
in Quellen gefunden, so daß zum mindesten für unseren Raum eine gewisse<br />
Krenophilie <strong>der</strong> Art konstatiert werden kann.<br />
Unsere Beobachtungen decken sich mit den Untersuchungen von<br />
PAGAST und FROESE (1933) über die Quellfauna Lettlands. Auch hier wer<br />
den die Quellen vorwiegend durch <strong>Kleinturbellarien</strong> großer ökologischer<br />
Valenz besiedelt.<br />
B. F 1u ß san d e<br />
Die Mehrzahl <strong>der</strong> Fließgewässer <strong>Schleswig</strong>-Holsteins besitzt ein recht<br />
geringes Gefälle und hat in den Sommermonaten nur schwache Strömung.<br />
Sie zeichnen sich <strong>dem</strong>entsprechend in <strong>der</strong> Regel durch eine stärkere Ver<br />
krautung und sehr schlammigen Untergrund <strong>aus</strong>. Die in diesen Regionen
512 Jens-Uwe Rixen<br />
1925). Bei Teichen und Weihern zeichnet sich dagegen keine Profundalregion<br />
ab, infolge ihrer geringen Tiefe reicht die Zone <strong>der</strong> submersen Was<br />
serpflanzen überall bis auf den Grund. Da bei vorliegenden Untersuchun<br />
gen nur die Fauna des <strong>Litoral</strong>s berücksichtigt wurde, können wir den Unterschied<br />
vernachlässigen und die Turbellarien <strong>der</strong> Seen und Teiche gemeinsam<br />
besprechen. Dagegen müssen die Tümpel, die in <strong>der</strong> Regel nur<br />
während eines Teils des Jahres Wasser führen, geson<strong>der</strong>t behandelt werden.<br />
1. Phytalregion<br />
Die reichste Besiedlung finden wir in <strong>der</strong> Phytalregion <strong>der</strong> Seen und<br />
Teiche. Hier wurden 30 Arten festgestellt, die in <strong>der</strong> folgenden Aufstellung<br />
nach ihrer Präsenz geordnet werden. Die Anzahl <strong>der</strong> verschiedenen Fundorte<br />
wird in Klammern beigefügt.<br />
Gyratrix hermaphroditus (19)<br />
Stenostomum leucops (13)<br />
Macrostomum rostratum (13)<br />
Castrella tmncata (10)<br />
Typhloplana viridata (9)<br />
Microstomum lineare (7)<br />
Bothromesostoma personatum (6)<br />
Bothromesostoma essenii (5)<br />
Microstomum spec. (5)<br />
Microdalyellia rossi (5)<br />
Strongylostoma radiatum (5)<br />
Microdalyellia fairchildi (3)<br />
Gieysztoria cuspidata (3)<br />
Olisthanella obtusa (3)<br />
Phaenocora typhlops (3)<br />
Castrada armata (3)<br />
Castrada intermedia (2)<br />
Macrostomum distinguendum (1)<br />
Macrostomum finnlandense (1)<br />
Microdalyellia brevimana (1)<br />
Microdalyellia picta (1)<br />
Gieysztoria expedita (1)<br />
Gieysztoria virgulifera (1)<br />
Gieysztoria triquetra (1)<br />
Castrada neocomensis (1)<br />
Mesostoma lingua (1)<br />
Mesostoma ehrenbergi (1)<br />
Mesostoma tetragonum (1)<br />
Pr01'hynchus stagnalis (1)<br />
Plagiostomum lemani (1)<br />
Somit können als regelmäßige Phytalbewohner Gyratrix hermaphroditus,<br />
Stenostomum leucops, Macrostomum rostratum, Castrella truncata,<br />
Typhloplana viridata, Microstomum lineare, die beiden Bothromesostoma<br />
Arten, Microstomum spec., Microdalyellia rossi und Strongylostoma radiatum<br />
angesprochen werden. Allerdings sind Gyratrix und Stenostomum Ubi<br />
quisten, die in gleicher Häufigkeit auch an<strong>der</strong>e Biotope, wie Tümpel und<br />
Sandböden besiedeln, während die in obiger Aufzählung genannten Arten<br />
von Macrostomum rostratum bis Strongylostoma radiatum die Kerngruppe<br />
<strong>der</strong> typischen Phytalbewohner bilden. Auch Gieysztoria cuspidata, Castrada<br />
armata, Castrada intermedia, Microdalyellia brevimana, Gieysztoria expedita,<br />
G. virgulifera, G. triquetra, Castrada neocomensis, Mesostoma ehrenbergi<br />
und M. tetragonum müssen wir zu den typischen Phytalbewohnern<br />
rechnen, wenn sie auch in <strong>Schleswig</strong>-Holstein, jedenfalls im oberen <strong>Litoral</strong>,<br />
nur in geringer Präsenz vorkommen. Dabei ist hervorzuheben, daß Microstomum<br />
lineare, Microdalyellia rossi, Gieysztoria cuspidata und Bothromeso-
516 Jens-Uwe Rixen<br />
Sandbiotopen ein o<strong>der</strong> werden passiv ins Küstengrundwasser eingespült.<br />
Das gleiche gilt für Otomesostoma auditivum. Irrgäste in diesem Lebensraum<br />
sind neben <strong>der</strong> letztgenannten Art mit Sicherheit Macrostomttm rost1'Otum<br />
und Microdalyellia armigera. Sie sind zusammen mit zersetztem Pflanzenmaterial<br />
in das Küstengrundwasser eingeschwemmt worden.<br />
D. M 0 0 r bio top e<br />
Die Mehrzahl <strong>der</strong> schleswig-holsteinischen Moore ist durch die Anlage<br />
von Entwässerungsgräben und durch Torfstiche mehr o<strong>der</strong> weniger kultiviert<br />
worden. Untersucht wurden im wesentlichen Torfstichlächer, daneben<br />
Sphagnumpolster und ein Braunwassersee.<br />
1. Braunwasserseen<br />
Der Hohner See liegt inmitten des <strong>aus</strong>gedehnten Moorgebietes, das<br />
sich zwischen Ei<strong>der</strong> und Treene beinahe von Rendsburg bis Friedrichsstadt<br />
erstreckt. Hier wurden lediglich die recht euryöken Arten Phaenocora typhlops<br />
und P. unipunctata beobachtet.<br />
2. Torflächer und Sphagnumrasen<br />
Sehr viel reicher ist dagegen die Turbellarienfauna von Torfstichen, die<br />
in verschiedenen Moorgebieten, wie <strong>dem</strong> Kaltenhofer Moor, Meimersdorfer<br />
Moor, Schlüsbeker Moor (Umgebung von Kiel) und <strong>dem</strong> Salemer Moor (bei<br />
Ratzeburg) untersucht wurde. Folgende 10 Arten wurden in diesem Lebensraum<br />
beobachtet:<br />
Castrada sphagnetorum (1)<br />
Catenula lemnae (4)<br />
Rhynchomesostoma rostratum (3)<br />
Microdalyellia kupelwieseri (2)<br />
Microdalyellia armigem (3)<br />
Microdalyellia picta (1)<br />
Castrella truncata (1)<br />
Prorhynchus stagnalis (1)<br />
Stenostomum leucops (6)<br />
Gyratrix hermaphroditus (3)<br />
Während die Fauna dieser Torfstiche zweifellos durch Kulturmaßnahmen<br />
stark beeinflußt ist, geben die Sphagnumrasen des Lebra<strong>der</strong> Moores<br />
mit wohl <strong>aus</strong>gebildeten Bulten und Schlenken vermutlich ein besseres Bild<br />
über die ursprünglichen Verhältnisse in ungestörten Hochmooren. In diesem<br />
Biotop des Lebra<strong>der</strong> Moores wurden die folgenden Arten nachgewiesen:<br />
Geocentrophom sphyrocephal.a<br />
Geocentrophora baltica<br />
Catenula lemnae<br />
Rhynchomesostoma rostratum<br />
M iC1'Odalyellia kupelwieseri<br />
Prorhynchus stagnalis<br />
Stenostomum leucops<br />
Gyratrix hermaphroditus<br />
Opistomum pallidum<br />
Von diesen in Torflächern und Sphagnumpolstern nachgewiesenen<br />
<strong>Kleinturbellarien</strong> ist zunächst Castrada sphagnetorum ein ganz spezifischer<br />
Sphagnobiont (HARNISCH 1926). Alle bisherigen Funde stammen <strong>aus</strong> Moor-
<strong>Kleinturbellarien</strong> <strong>aus</strong> <strong>dem</strong> <strong>Litoral</strong> <strong>der</strong> <strong>Binnengewässer</strong> <strong>Schleswig</strong>-Holsteins 517<br />
biotopen, und auch bei vorliegenden Untersuchungen wurde die Art <strong>aus</strong>schließlich<br />
in diesem Lebensraum gefunden. Auch die beiden Geocentrophora-Arten<br />
können als Moorturbellarien im weiteren Sinne angesprochen<br />
"Yerden. Sie sind insbeson<strong>der</strong>e charakteristische Bewohner <strong>der</strong> gut durchlüf<br />
teten Spalträume zwischen den Sphagnumblättchen, wie es auch STEINBÖCK<br />
(1927) in <strong>der</strong> Monographie <strong>der</strong> Prorhynchiden feststellt. Beide Arten dringen<br />
daneben aber auch in edaphische Biotope ein (S. 485). Ebenso liegt <strong>der</strong> Ver<br />
breitungsschwerpunkt von Rhyndwmesostoma rostratum eindeutig in Moor<br />
biotopen, auch wenn diese Art in verwandte humusreiche Lebensräume<br />
regelmäßig eindringt. Catenula lemnae wurde in <strong>Schleswig</strong>-Holstein fast<br />
<strong>aus</strong>schließlich in Mooren festgestellt, sie ist in unserem Areal den typischen<br />
Moorturbellarien anzuschließen. Die drei Microdalyellia-Arten M. armigera,<br />
M. kupelwieseri und M. picta sind Formen, die Kleingewässer aller Art<br />
besiedeln, während die an<strong>der</strong>en Arten Ubiquisten sind. Sehr ungewöhnlich<br />
ist allerdings das Auftreten von Opistomum pallidum, das im übrigen als<br />
streng an periodische Waldtümpel gebunden erscheint.<br />
E. K 1ein g e w ä s s e r<br />
Unter diesem Begriff fassen wir Waldtümpel, \iValdgräben und -bäche<br />
sowie Kleingewässer in <strong>der</strong> offenen Landschaft zusammen.<br />
1. Vialdtümpel<br />
Die in <strong>Schleswig</strong>-Holstein im allgemeinen vom Spätherbst bis in das<br />
Frühjahr hinein Wasser führenden Waldtümpel ergaben die folgende recht<br />
reiche Ausbeute an <strong>Kleinturbellarien</strong>:<br />
Opistomwn pallidum (3)<br />
Gieysztoria mbra (2)<br />
Castradella gmnea (2)<br />
Microdalyellia rossi (1)<br />
Bothrioplana semperi (1)<br />
Microdalyellia armigem (2)<br />
Microdalyellia schmidtii (1)<br />
Phaenocora unipunctata (1)<br />
Mesostoma lingua (1)<br />
Microstomum spec. (1)<br />
Mi-erostomum distinguendum (1)<br />
Dalyellia viridis (1)<br />
Prorhynchus stagnalis (2)<br />
Stenostomum leucops (2)<br />
Gyratrix hermaphroditus (4)<br />
Als spezifische Vertreter dieser Fauna sind in erster Linie Opistomum<br />
pallidum und Gieysztoria rubra zu nennen. Ferner bevorzugen Castradella<br />
granea, Microdalyellia rossi und Bothrioplana diesen Lebensraum. Die übrigen<br />
Vertreter dieser Fauna sind untypisch für Waldtümpel, insbeson<strong>der</strong>e<br />
gilt dies für Macrostomum distinguendum und Dalyellia viridis, sie wurden<br />
beide nur in einem am Waldrand gelegenen, gut durchlichteten Tümpel<br />
bei Schrevenborn angetroffen.<br />
Eine übersicht über die jahreszeitliche Verteilung wird im folgenden<br />
für zwei Waldtümpel gegeben (Tab. 5 und 6):
I<br />
<strong>Kleinturbellarien</strong> <strong>aus</strong> <strong>dem</strong> <strong>Litoral</strong> <strong>der</strong> <strong>Binnengewässer</strong> <strong>Schleswig</strong>-Holsteins 519<br />
An dieser Stelle können die Beobachtungen von REMANE (1938) <strong>aus</strong><br />
einem Buchenwaldrinnsal am Westensee (Marutendorf) angeschlossen werden.<br />
Dort kam in <strong>der</strong> feuchten Laubschicht neben <strong>dem</strong> Anneliden Parergodrilus<br />
hei<strong>der</strong>i die Prorhynchide Geocentrophora sphyrocephala vor (vgl.<br />
S. 485).<br />
3. Kleingewässer in <strong>der</strong> offenen Landschaft<br />
Unter diesem Sammelbegriff fasse ich Wiesentümpel, Wiesengräben,<br />
Tümpel auf Äckern und Überschwemmungspfützen <strong>der</strong> Bäche sowie Bombentrichter<br />
zusammen. Die Tatsache, daß einige dieser Kleingewässer das<br />
ganze Jahr hindurch Wasser führen, an<strong>der</strong>e dagegen im Sommer regelmäßig<br />
<strong>aus</strong>trocknen, läßt keinen grundlegenden Einfluß auf die Zusammensetzung<br />
<strong>der</strong> Fauna erkennen.<br />
Dalyellia viridis (3)<br />
Typhloplana viridata (2)<br />
Macrostomum rostratum (1)<br />
Castrella truncata (3)<br />
Microdalyellia fairdÜldi (1)<br />
Microdalyellia armigem (2)<br />
RhynChomesostoma rostratum (2)<br />
Stenostomum leucops (3)<br />
Gyratrix hermaphroditus (2)<br />
Bothromesostoma personatum (1)<br />
Als sehr spezifische Art dieser Kleingewässer können wir Dalyellia viridis<br />
her<strong>aus</strong>stellen. Bemerkenswert ist, daß diese Art nicht nur in den <strong>aus</strong>trocknenden<br />
Gewässern, in denen die natürlichen Umweltsbedingungen<br />
einen Abschluß <strong>der</strong> Entwicklung im Sommer erfor<strong>der</strong>n, zu diesem Zeitpunkt<br />
verschwindet, son<strong>der</strong>n daß sie auch in perennierenden Kleingewässem<br />
in <strong>der</strong> Regel im Juni ihre Entwicklung abgeschlossen hat und später<br />
nur noch in Ausnahmefällen zu beobachten ist (vgl. S. 496). Ein Wiesengraben<br />
als Fundort von Bothromesostoma personatum erscheint im Vergleich<br />
mit <strong>dem</strong> Verbreitungsschwerpunkt in <strong>der</strong> Seerosenzone von Seen sehr<br />
untypisch.<br />
F. Ge w ä s s e r mit a b e r r an t em ehe m i s mus<br />
1. Organische Abwässer<br />
Die Untersuchungen von Gewässern, in welche organische Abwässer<br />
eingeleitet werden, ergaben in den meisten Fällen negative Resultate. In<br />
einem Bach, <strong>der</strong> die Abwässer <strong>der</strong> Meierei in Selent aufnimmt und in den<br />
Selenter See leitet, konnte jedoch Phaenocora unipunctata in ungewöhnlich<br />
großer Individuenzahl beobachtet werden. Mit Längenwerten von 3,3 mm<br />
waren diese Exemplare bedeutend größer als die sonst in Sch1eswig-Holstein<br />
nur 1,5 rnrn erreichenden Tiere.<br />
2. Der schwefelsaure Tonteich bei Reinbek<br />
Der schwefelsaure Tonteich bei Reinbek zeichnet sich durch einen ungewöhnlich<br />
hohen Gehalt an freier Schwefelsäure <strong>aus</strong>, die durch Oxydation<br />
des freiliegenden Schwefeleisens entsteht (OHLE, 1936). Bereits OHLE konnte
I<br />
<strong>Kleinturbellarien</strong> <strong>aus</strong> <strong>dem</strong> <strong>Litoral</strong> <strong>der</strong> <strong>Binnengewässer</strong> <strong>Schleswig</strong>-Holsteins 521<br />
a) Quelle, Sandboden, 9° C, 7 0 / 00 , - b) Graben mit Phragmites, 19° C, 16 0 / 00 , <br />
c) Graben mit VaUdlel'ia und Purpurbakterien, 10° C, 9 0 / 00 , - VI. Salzgebiet am<br />
linken Traveufer bei Alt-Freseburg: a) Alter Torfstich, 16° C, 4 0 / 00 , _ b) Kleiner<br />
Entwässerungsgraben, 9° C, 7 0 / 00 , - c) Großer Sammelgraben, 13° C, 11 0/ 00 , <br />
d)"QuelIrinnsal mit Salicornia, 20° C, 13 0 / 00 , - e) Torfstich mit Eisenocker, HO C,<br />
16 0 / 00 , - f) Salzrasen mit Aster, Glaux, Spergularia, Puccinellia, Agrostis alba,<br />
funcus gerardi, obere, ca. 3 cm hohe Schicht, 18° C, 13 0 / 00 ,<br />
Die vom Meerwasser abweichende chemische Zusammensetzung des Oldesloer<br />
Salzwasser ist durch THIENEMANN (1925/26) bereits bekannt. Trotz einer dadurch<br />
bedingten Fehlerquelle geben die mit einem auf Seewasser geeichten Aräometer<br />
gemessenen Salzgehalte einen <strong>aus</strong>reichend genauen \Vert des Gesamtsalzgehaltes<br />
<strong>der</strong> untersuchten Stellen.<br />
Die <strong>Kleinturbellarien</strong> <strong>der</strong> Oldesloer Salzstellen zeigen eine bemerkenswerte<br />
Zusammensetzung <strong>aus</strong> Iimnogenen und thalassogenen Elementen.<br />
Typische Süßwasser-Bewohner sind wohl nur die beiden nicht näher bestimmten<br />
Castrada-Arten. Sie wurden nur bei <strong>dem</strong> geringen Salzgehalt<br />
von 4 0 / 00 beobachtet. Von den sieben sicher bestimmten Arten ist nur <strong>der</strong><br />
holeuryhaline Ubiquist Gyratrix hermaphroditus auch in süßen <strong>Binnengewässer</strong>n<br />
<strong>Schleswig</strong>-Holsteins nachgewiesen worden. Macrostomum hystricinum<br />
und M. tenuicauda sind als spezifische Brackwasserorganismen anzusprechen.<br />
Während diese Aussage für M. hystricinum durch eine Vielzahl<br />
von Brackwasserfunden an den europäischen Küsten (S. 476) belegt ist, stellen<br />
die Funde von M. tenuicauda den ersten Nachweis außerhalb <strong>der</strong> Originalhabitate<br />
im Finnischen Meerbusen dar. Dennoch erscheint für diese<br />
Art auf Grund <strong>der</strong> hohen Übereinstimmung <strong>der</strong> Lebensräume die Charakterisierung<br />
als ein an Salzwiesen gebundener Brackwasserbewohner gesichert<br />
(S. 480). Auch Placorhyndws octaculeatus dimorphis ist ein typischer<br />
mariner Immigrant, <strong>der</strong> in diesen Untersuchungen erstmalig für Binnensalzstellen<br />
nachgewiesen werden konnte. Die Art ist jedoch stärker euryhaHn.<br />
Bresslauilla relicta ist eine holeuryhaline Art. Die mutmaßlichen<br />
Gründe für die Besiedlung unterschiedlicher Biotope im Meer- und Süßwasser<br />
\vurden bereits eingehend diskutiert (S. 491 f.). Die im Oldesloer<br />
Salzgebiet gefundenen Exemplare von Gieysztoria 01'nata gehören vermutlich<br />
zur ssp. maritima, die bisher nur im Brackwasser des Finnischen Meerbusens<br />
beobachtet wurde.<br />
Ein Vergleich <strong>der</strong> Salzgehaltsbereiche, in denen die einzelnen Arten<br />
vorkommen, führte zu folgenden Aussagen: Mac1'ostomum hystricinum und<br />
Gyratrix hermaphroditus treten in relativ weiten Grenzen vom oIigohaIinen<br />
bis zum pleiohalinen Bereich auf. Bresslauilla relicta und Microdalyellia<br />
fusca wurden nur im Pleiohalinikum beobachtet. Die Funde von Placorhynchus<br />
und M. tenuicauda liegen im meiomesohalinen Wasser, während<br />
Gieysztoria ornata und die beiden Castraden <strong>aus</strong>schließlich im oligohalinen<br />
Wasser nachgewiesen wurden (Nomenklatur <strong>der</strong> Salzwasserbereiche nach<br />
REMANE 1958).
522 Jens-U we Rixen<br />
Insgesamt ist für die Oldesloer Salzstellen eine rasche Verarmung <strong>der</strong><br />
limnogenen Turbellarienfauna mit zunehmen<strong>dem</strong> Salzgehalt zu konstatieren.<br />
Die salzreicheren Regionen werden dafür von einer Reihe spezifischer<br />
Brackwasserarten und euryhaliner Meeresbewohner besiedelt.<br />
G. Öko log i s c h e S chI u ß b e t r ach tun gen<br />
Die vergleichende Untersuchung <strong>der</strong> Turbellarienfauna in den Süßgewässern<br />
<strong>Schleswig</strong>-Holsteins hat eine charakteristische Zusammensetzung<br />
des Artenbestandes in den verschiedenartigen Biotopen ergeben. Aus dieser<br />
Verteilung und unter Berücksichtigung <strong>der</strong> Literatur läßt sich die folgende<br />
Übersicht über das ökologische Verhalten <strong>der</strong> Einzelarten und die<br />
assoziative Zusammensetzung in bestimmten Lebensräumen aufstellen<br />
(Tab. 8). Dabei blieben die marinen Immigranten in <strong>der</strong> EIbe sowie die<br />
lediglich im Oldesloer Salzgebiet beobachteten Arten unberücksichtigt.<br />
Zwei Arten, Gyratrix hermaphroditus und Stenostomum leucops<br />
(Gruppe A) sind absolute Ubiquisten. Sie besiedeln die verschiedenen limnischen<br />
Lebensräume einschließlich recht extremer Biotope, wie stark schwefelsaure<br />
Gewässer (Stenostomum) mit einem pR von 3,4 o<strong>der</strong> gipshaltige<br />
Tümpel (Gyratrix). Daneben dringen beide Arten ins Salzwasser vor, Gyratrix<br />
sogar bis in das Hyperhalinikum.<br />
Die zweite Gruppe (B) umfaßt fünf sehr euryöke Arten. Für Microdalyellia<br />
armigera läßt sich noch eine geringe Bevorzugung von verschiedenartigen<br />
Kleingewässem feststellen, Castrella truncata siedelt in größter Individuenzahl<br />
in <strong>der</strong> Phytalregion, erreicht aber daneben viele an<strong>der</strong>sartige<br />
Lebensräume. Für die Arten Mesostoma lingua, Prorhynchus stagnalis und<br />
Phaenocora unipunctata läßt sich kein bevorzugter Biotop her<strong>aus</strong>stellen.<br />
Eine einzige Form ist nach den bisherigen Untersuchungen in <strong>Schleswig</strong>-Holstein<br />
auf Quellgebiete beschränkt, Opisthocystis goettei (Spalte C).<br />
Da die Art aber an den außerhalb unseres Landes gelegenen Fundorten<br />
keine spezielle Bindung an diesen Biotop erkennen läßt, kann sie nicht allgemein<br />
als Krenobiont bezeichnet werden.<br />
Der Lebensraum des Küstengrundwassers (Gruppe D), <strong>der</strong> in früheren<br />
Untersuchungen über limnische <strong>Kleinturbellarien</strong> unberücksichtigt blieb,<br />
wies zwei neue Arten auf, Rhynchoscolex remanei und Macrostomum subterraneum.<br />
Mit Sicherheit sindbeide Formen für diesen Lebensraum spezi<br />
fisch.<br />
In <strong>der</strong> Gruppe E sind die im <strong>Litoral</strong> schleswig-holsteinischer Seen <strong>aus</strong>gesprochen<br />
psammobionten Arten Castrada viridis, Dochmiotrema limicola,<br />
Koinocystis neocomensis, Otomesostoma auditivum, Opistomum fuscum<br />
sowie die neue, noch nicht endgültig definierte Art Provorticidorum spec. zusammengefaßt.<br />
Die überwiegende Mehrzahl lebt im Mesopsammal, lediglich<br />
Otomesostoma erscheint auf Grund ihrer Körpergröße nicht an das<br />
Lückensystem gebunden, sie ist entwe<strong>der</strong> als Sandwühler aufzufassen (vgl.
<strong>Kleinturbellarien</strong> <strong>aus</strong> <strong>dem</strong> <strong>Litoral</strong> <strong>der</strong> <strong>Binnengewässer</strong> <strong>Schleswig</strong>-Holsteins 523<br />
REMANE, 1952) o<strong>der</strong> aber gehört <strong>der</strong> Epifauna an. Die Mehrzahl dieser<br />
psammobionten Arten dringt auch in das Küstengrundwasser vor.<br />
Als psammophile Arten können die beiden Macrostomiden M. finnlandense<br />
und M. distinguendum (Gruppe F) angeschlossen werden. Sie sind<br />
nicht <strong>aus</strong>schließlich Sandbewohner, jedoch liegt ihr Verbreitungsschwerpunkt<br />
eindeutig in diesem Lebensraum, während sie in an<strong>der</strong>sartigen Biotopen<br />
nur in geringer Häufigkeit auftreten.<br />
Rhynchoscolex simplex (Spalte G) ist im Psammal, im Küstengrundwasser<br />
und in Schlammböden gleichermaßen vertreten. Er schiebt im Gefügesystem<br />
die Partikel beiseite und ist in dieser Hinsicht als Übergangsform<br />
von <strong>der</strong> Mesofauna zur Endofauna anzusprechen.<br />
Die folgenden zwölf Arten (Gruppe H) haben ihren Verbreitungsschwerpunkt<br />
im Phytal. Sie sind jedoch keine stenöken Bewohner des Phytals,<br />
son<strong>der</strong>n treten in unterschiedlichem Umfang auch in an<strong>der</strong>en Lebensräumen<br />
auf.<br />
Die Kerngruppe <strong>der</strong> typischen Phytalbewohner umfaßt die zehn Arten<br />
von Microdalyellia brevimana bis Bothromesostoma essenii (Gruppe I). Für<br />
eine Reihe von <strong>Kleinturbellarien</strong>, wie Gieysztoria cuspidata, Castrada armata<br />
und Bothromesostoma essenii ist diese Aussage durch viele Funde<br />
gesichert. Microdalyellia brevimana, Gieysztoria expedita, G. virgulifera,<br />
G. triquetra und Castrada neocomensis konnten in <strong>Schleswig</strong>-Holstein nur<br />
jeweils einmal im Phytal beobachtet werden. Möglicherweise sind einige<br />
dieser Formen im sublitoralen Phytal stärker vertreten. Da die Mehrzahl <strong>der</strong><br />
Literaturangaben für eine präzise ökologische Auswertung zu allgemein gehalten<br />
ist, kann für diese Arten die Bindung an den Lebensraum des Phytals<br />
nur mit Vorbehalt konstatiert werden.<br />
Plagiostomum lemani (Spalte K) ist im <strong>Litoral</strong> <strong>der</strong> schleswig-holsteinischen<br />
<strong>Binnengewässer</strong> nur im PsammaI und in <strong>der</strong> Phytalregion nachgewiesen<br />
worden. Wie <strong>aus</strong> an<strong>der</strong>en Beobachtungen hervorgeht, ist jedoch <strong>der</strong><br />
bevorzugte Siedlungsraum dieser Art schlammiges Substrat im Sublitoral<br />
und Profundal.<br />
Für Frühjahrstümpel in <strong>der</strong> freien Landschaft ist allein Dalyellia viridis<br />
sehr typisch (Spalte L).<br />
In ephemeren Waldgewässern (Gruppe M) dagegen ist regelmäßig eine<br />
größere Anzahl von spezifischen Frühjahrsformen anzutreffen. Hier sind in<br />
erster Linie Opistomum pallidum, Gieysztoria rubra und Castradella granea<br />
zu nennen. Sehr regelmäßig treten in diesem Lebensraum daneben Microdalyellia<br />
rossi, die außer<strong>dem</strong> in <strong>der</strong> Phytalregion <strong>der</strong> Seen vorkommt, und<br />
die euryöke Art Phaenocora unipunctata in großer Individuenzahl auf.<br />
Als wenig spezifisch für einen bestimmten Biotop, aber generell an<br />
Kleingewässer gebunden erscheirren Rhynchomesostoma rostratum, Microdalyellia<br />
schmidtii und M. kupelwieseri (Gruppe N).
526 Jens-Uwe Rixen<br />
In <strong>Schleswig</strong>-Holstein konnte Catenula lemnae (Spalte 0) nur in Moorbiotopen<br />
nachgewiesen werden, nach an<strong>der</strong>en Autoren ist sie aber weiter<br />
verbreitet und somit nicht als spezifischer Moorbewohner anzusehen.<br />
Ein typischer Sphagnobiont ist dagegen Castrada sphagnetorum (Spalte<br />
P). Die Art wurde zwar nur an einem Fundort beobachtet, aber im Vergleich<br />
mit <strong>der</strong> Literatur erscheint mir dieser Habitat in <strong>Schleswig</strong>-Holstein<br />
- nasses Sphagnum an <strong>der</strong> Oberfläche von Torfstichen - kennzeichnend<br />
für C. sphagnetorum.<br />
Allein in feuchten Sphagnumbulten wurden die beiden Prorhynchiden<br />
Geocentrophora sphyrocephala und G. baltica gefunden (Gruppe Q). Für<br />
G. sphyrocephala liegt außer<strong>dem</strong> <strong>aus</strong> <strong>Schleswig</strong>-Holstein noch ein edaphischer<br />
Fund vor, auch G. baltica ist im Alpenraum ein Vertreter <strong>der</strong> limnischen<br />
Komponente <strong>der</strong> edaphischen Kleinfauna. Danach scheint für diese<br />
beiden Arten eine Bindung an phytogene Lückenräume mit sehr feuchtem<br />
Kleinklima zu bestehen.<br />
H. Not i zen Übe r Nah run g, F ein d e und Par a s i t e n<br />
Bei den Untersuchungen wurden wie<strong>der</strong>holt Beobachtungen über Ernährung,<br />
Feinde und Parasiten <strong>der</strong> <strong>Kleinturbellarien</strong> gemacht, die jedoch<br />
in keiner Weise Anspruch auf Vollständigkeit erheben können. Es werden<br />
hier im wesentlichen solche Beuteobjekte erwähnt, die sich durch unverdauliche<br />
Skelettelemente zu erkennen geben.<br />
Folgende Nahrungsobjekte konnten im Darm <strong>der</strong> aufgezählten Turbellarienarten<br />
nachgewiesen werden:<br />
Chlorophyceen: Macrostomum distinguendum, Geocentrophora sphyrocephala.<br />
Diatomeen: Geocentrophora sphyrocephala, Provorticidorum spec.,<br />
Gieysztoria rubra, Castrada viridis.<br />
Thecamoeben: Macrostomum distinguendum, Microstomum spec.<br />
Rotatorien: Microstomum spec., Geocentrophora sphyrocephala, Castrella<br />
truncata, Olisthanella obtusa.<br />
Nematoden: Mesostoma ehrenbergi.<br />
Cladoceren: Geocentrophora sphyrocephala.<br />
Bevorzugte Beuteobjekte <strong>der</strong> gesamten <strong>Kleinturbellarien</strong> scheinen Rotatorien<br />
und Diatomeen zu sein. Phytobionte Arten ernähren sich offenbar<br />
in erster Linie von den in diesem Lebensraum beson<strong>der</strong>s häufigen Rotatoria<br />
Bdelloidea, psammobionte Formen sind wohl zur Hauptsache auf<br />
Diatomeen angewiesen, nehmen daneben jedoch regelmäßig auch tierische<br />
Nahrung auf. Inwieweit Cyanophyceen, Chlorophyceen, Ciliaten und Bakterien<br />
<strong>der</strong> Ernährung dienen, läßt sich in den meisten Fällen am Quetschpräparat<br />
nicht feststellen, es scheint aber wahrscheinlich, daß diese Organis-
.<br />
528 Jens-Uwe Rixen<br />
das unterschiedliche ökologische Verhalten bestimmter Artengruppen bedingt,<br />
die wir wie folgt klassifizieren können:<br />
Gruppe A: indifferente Basisgruppe. Arten, die das ganze Jahr hindurdl<br />
vorkommen (z. B. Stenostomum leucops, Rhynchoscolex simplex, Macrostomum<br />
rostratum, Prorhynchus stagnalis, Otomesostoma auditivum, Microdalyellia<br />
faird'lildi, Castrada viridis, Gyratrix hermaphroditus).<br />
Gruppe B: Arten mit zwei Entwicklungsmaxima, im Frühjahr und<br />
Herbst (etwa Microdalyellia kupelwieseri und Rhynchomesostoma rostratum).<br />
Gruppe C: Spezifische Frühjahrsformen. Die hierhergehörigen Arten<br />
sind beson<strong>der</strong>s zahlreich. Sie bedingen das Mai-Maximum. (Bothrioplana<br />
semperi, Gieysztoria 1'ubra, Dalyellia viridis, Castradella granea, Opistomum<br />
pallidum).<br />
Gruppe D: Reine Sommerformen, die insbeson<strong>der</strong>e im Phytal leben<br />
und erst auftreten, wenn ihre bevorzugten Habitate, die großen Schwimmblätter<br />
<strong>der</strong> Seerosen und die Potamogeton-Blätter entwickelt sind. (Microstomum-Arten,<br />
Gieysztoria cuspidata, Castrella truncata, Strongylostoma<br />
radiatum, Bothromesostoma personatum und B. essenÜ sowie fast alle<br />
großen Mesostoma-Arten). Die hier genannten Formen sind für das zweite<br />
Maximum im August verantwortlich.<br />
Die für <strong>Schleswig</strong>-Holstein vorliegenden Verhältnisse decken sich ungefähr<br />
mit den Beobachtungen von SCHMIDT (1848) in <strong>der</strong> Provinz Sachsen,<br />
von BRAUN (1885) in Livland und <strong>der</strong> allgemeinen Übersicht, die v. GRAFF<br />
1882 bereits zu dieser Frage gegeben hat. Dagegen haben DORNER (1902)<br />
in Ostpreußen und LUTHER (1904) in Finnland ein absolutes Artenmaximum<br />
in den Monaten Juli und August beobachtet. Das Friihjahrsmaximum kann<br />
sich in diesen borealen Festlandsklimaten sicherlich nicht <strong>aus</strong>bilden. Die von<br />
DORN ER (1902) angegebenen Werte für die Sommermonate (Abb. 54, gestrichelte<br />
Linie) sind wohl im wesentlichen durch die Vielzahl <strong>der</strong> von ihm<br />
beobachteten Mesostoma-Arten bedingt.<br />
Derartige Vergleiche mit <strong>der</strong> jahreszeitlichen Verteilung <strong>der</strong> Gesamtfauna<br />
in an<strong>der</strong>en Regionen können, wie auch BRINKMANN (1905) hervorgehoben<br />
hat, nur mit großer Vorsicht <strong>aus</strong>gewertet werden. Ein Unsicher<br />
heitsfaktor liegt darin, daß die einzelnen Autoren Kleingewässer, die ja<br />
insbeson<strong>der</strong>e die Frühjahrsfauna beherbergen, und Seen in unterschiedlichem<br />
Verhältnis beriicksichtigt haben. Insbeson<strong>der</strong>e die geographischen<br />
Gegebenheiten <strong>der</strong> untersuchten Regionen beeinflussen in bedeuten<strong>dem</strong><br />
Maße die jahreszeitliche Verteilung <strong>der</strong> Gesamtfauna.<br />
Zusammenfassung<br />
1. Die vorliegende Arbeit behandelt die bisher fast unbekannte <strong>Kleinturbellarien</strong>fauna<br />
<strong>Schleswig</strong>-Holsteins. Um eine vollständige Übersicht über
I<br />
<strong>Kleinturbellarien</strong> <strong>aus</strong> <strong>dem</strong> <strong>Litoral</strong> <strong>der</strong> <strong>Binnengewässer</strong> <strong>Schleswig</strong>-Holsteins 529<br />
den Gegenstand <strong>der</strong> Untersuchungen zu erzielen, wurden alle frÜher publizierten<br />
<strong>Kleinturbellarien</strong>funde <strong>aus</strong> <strong>dem</strong> Gebiet mit aufgenommen.<br />
2. Von den 69 gefundenen Arten (S. 468 f.) sind 44 neu für <strong>Schleswig</strong><br />
Hol,stein und 15 gleichzeitig neu für Deutschland. Davon sind zwei Arten<br />
neu fÜr die Wissenschaft (Rhynchoscolex remanei und Macrostomum subterraneum),<br />
eine dritte Form (Provorticidorum spec.) konnte infolge Materialmangels<br />
nur provisorisch gekennzeichnet werden.<br />
3. Im systematisch-autökologischen Teil werden die Fundumstände <strong>der</strong><br />
einzelnen Arten zusammengestellt sowie nach Möglichkeit ihre ökologischen<br />
AnsprÜche analysiert und tiergeographische Fragen behandelt. Soweit erfor<strong>der</strong>lich,<br />
werden taxonomische Angaben gemacht.<br />
4. Der hohe Prozentsatz fÜr <strong>Schleswig</strong>-Holstein und Deutschland neuer<br />
Arten zeigt die Lückenhaftigkeit in <strong>der</strong> Kenntnis <strong>der</strong> Verbreitung unserer<br />
<strong>Kleinturbellarien</strong>fauna. Gegenüber <strong>der</strong> bisherigen tiergeographischen Charakterisierung<br />
mancher Arten erscheint daher Zurückhaltung geboten (insbeson<strong>der</strong>e<br />
bei Otomesostoma auditivum, Castrada sphagnetorum, Castrada<br />
viridis und Koinocystis neocomensis).<br />
5. Im vergleichend-ökologischen Teil wird die schleswig-holsteinische<br />
<strong>Kleinturbellarien</strong>fauna in ihrer Verteilung auf die verschiedenartigen Lebensräume<br />
abgehandelt. Die untersuchten Biotope sind Quellgebiete, Flußsande,<br />
stehende perennierende Gewässer (aufgeglie<strong>der</strong>t in Phytal, Schlammbiotope,<br />
Psammal, Küstengrundwasser), Moorbiotope, Wald- und WiesentÜmpel<br />
sowie einige Gewässer mit aberrantem Chemismus. Unter letzteren<br />
erfahren die Oldesloer Binnensalzstellen beson<strong>der</strong>e BerÜcksichtigung.<br />
6. Neben zwei <strong>aus</strong>gesprochenen Ubiquisten (Gyratrix hermaphroditus<br />
und Stenostomum leucops), erweisen sich einige weitere Arten (Tab. 8,<br />
Gruppe B) als recht eurytop. Im übrigen läßt sich eine gewisse Zuordnung<br />
bestimmter Artengruppen zu bevorzugten Lebensräumen, wie Küstengrundwasser,<br />
Psammal, Phytal, Frühlingstümpeln und Moorbiotopen durchfüh<br />
ren (Tab. 8, Gruppe C bis Q). An den Oldesloer Salzstellen wurden einige<br />
thalassogene Formen erstmalig für Binnensalzbiotope nachgewiesen (Macrostomum<br />
hystricinum, Macrostomum tenuicauda, Placorhynchus octaculeatus<br />
dimorphis, Bresslauilla relicta).<br />
7. Als Nahrungsobjekte werden bei vielen bodenlebenden Formen<br />
Diatomeen nachgewiesen. Die Bewohner <strong>der</strong> Phytalregion ernähren sich<br />
in hohem Maße vonbdelloiden Rotatorien.<br />
Zu den bisher bekannten Parasiten bei Turbellarien ist eine Cestoden<br />
Art <strong>der</strong> Gattung Hymenolepis hinzuzufügen. Ihr Wirt ist Microstomum<br />
lineare.<br />
8. Die Untersuchung <strong>der</strong> jahreszeitlichen Verteilung <strong>der</strong> <strong>Kleinturbellarien</strong>fauna<br />
ergab eine Kurve mit zwei Maxima im FrÜhjahr und Hochsommer<br />
(Abb. 54). Das erste Maximum ist durch die vielen Arten <strong>der</strong> ephemeren<br />
Archiv f. Hydrobiologie, Bd. 57<br />
.f<br />
I J<br />
I
530 Jens-Uwe Rixen<br />
Frühlingstümpel bedingt, das zweite im August resultiert <strong>aus</strong> <strong>der</strong> großen<br />
Zahl <strong>der</strong> sich zu dieser Zeit entwickelnden Phytalbewohner.<br />
Summary<br />
1. The present study deals with previously nearly unknown microturbellaria<br />
of <strong>Schleswig</strong>-Holstein. In or<strong>der</strong> to obtain a complete survey of<br />
the object of this treatise, all findings of microturbellaria in our country<br />
published hitherto are summarised.<br />
2. Forty-four of the 69 obtained species (p. 468 f.) have not yet been<br />
found in Sch1eswig-Holstein, 15 are new to Germany as a whole. Two of<br />
them are new to science (Rhynchoscolex remanei and Macrostomum subterraneum),<br />
a third species (Provorticidorum spec.) is only described pro<br />
visionally due to lack of material.<br />
3. In the systematic-autecological part of this paper the circumstances<br />
of the findings of the individual species are listed. Whenever possible,<br />
their ecological <strong>dem</strong>ands have been analysed, and zoogeographical problems<br />
treated. When necessary taxonomical facts have been added.<br />
4. The high percentage of new species found for <strong>Schleswig</strong>-Holstein<br />
and Germany <strong>dem</strong>onstrates the deficiency in our knowledge of the distri<br />
bution of microturbellaria. Therefore one must excercise caution in the use<br />
of hitherto published zoogeographical characterisations of some species<br />
(especially according to Otomesostoma auditivum, Castrada sphagnetorum,<br />
Castrada viridis, Koinocystis neocomensis).<br />
5. The comparative-ecological part deals with the distribution of the<br />
<strong>Schleswig</strong>-Ho1stein microturbellaria fauna within the different biotopes.<br />
The studied biotopes are springs, sandy banks of rivers, standing waters<br />
(divided in phytal, muddy biotopes, psammal, subterranean interstitia1<br />
system), moor biotopes, wood and meadow ponds, and some waters of<br />
an aberrant chemism. From the latter group the Oldesloe salt marshes<br />
have been consi<strong>der</strong>ed especially.<br />
6. Two species are real ubiquists (Gyratrix hermaphroditus and Stenostomum<br />
leucops), some others (tab. 8, group B) properly eurotopic. With regard<br />
to still other species, one is ab1e to arrange certain groups to preferred<br />
biotopes, as subterranean interstitia1 system, psammal, phyta1, verna1 ponds,<br />
and moor biotopes (tab. 8, groups C-Q). In the Oldesloe salt ponds some<br />
thalassogene species have been found for the first time inland, far from<br />
the sea in salt water (Macrostomum hystricinum, Macrostomum tenuicauda,<br />
Placorhynchus octaculeatus dimorphis, Bresslauilla relicta).<br />
7. Diatoms have been <strong>dem</strong>onstrated to be an important food of many<br />
bottomliving species. The animals of the phytal feed on Rotatoria bdelloidea<br />
to a high degree.
<strong>Kleinturbellarien</strong> <strong>aus</strong> <strong>dem</strong> <strong>Litoral</strong> <strong>der</strong> <strong>Binnengewässer</strong> <strong>Schleswig</strong>-Holsteins 531<br />
A species of Cestoda of the genus Hymenolepis has been added to the<br />
number of known parasites of turbellaria. Its host is Microstomum lineare.<br />
8. The research of the seasonal distribution of the microturbellaria<br />
fa)..ma yields a curve with two maxima (spring and midsummer) (fig. 54).<br />
The first maximum, in may, depends on the rich fauna of the ephemer<br />
vernal ponds, the second, in august, results from the great number of the<br />
phytal inhabitants developing in this month.<br />
Abkürzungen in den Abbildungen<br />
ag = Atrium genitale ph = Pharynx<br />
dep = Dorsales Epithel phm = Pharynxmuskulatur<br />
di = Ductus intervesicularis qsp = Quersepten<br />
ex = Exkretionshauptstamm sp = Sperma<br />
exph = Exkretophor spl = Sinnesplatten<br />
fs = Falsche Samenblase st = Stilett<br />
g = Gehirn stz = Statozyste<br />
ge = Germarium te = Testis<br />
S?gk = Weib1. Genitalkanal vep = Ventrales Epithel<br />
kd = Körnerdrüsen vit = Vitellarium<br />
kop = Kopulationsorgan vg = Vesicula granulorum<br />
ksekr = Kornsekret vs = Vesicula seminis<br />
lsp = Längsseptum wö = ·Weib1. Geschlechtsöffnung<br />
ms = Hautmuskelschlauch x = Ausgezeichnete Stelle, im<br />
pe = Penis Text erläutert<br />
Literaturverzeichnis<br />
ARNDT, W. (1921): Reste <strong>der</strong> Eiszeitfauna in Gewässern <strong>der</strong> Mark Brandenburg.<br />
Zugleich eine Bemerkung zur Terminologie des Glazialreliktbegriffs.<br />
S. B. Ces. naturforsch. Fr. Berlin, Nr. 8-10: 125--181.<br />
(1940): Notiz zur Kenntnis <strong>der</strong> Süßwasserfauna Helgolands. - Ibid.: 64<br />
-67.<br />
ATTEMs, C. GRAF (1897): Beitrag zur Kenntnis <strong>der</strong> rhabdocoelen Turbellarien<br />
Helgolands. - Wiss. Meeresunters., Kommiss. Unters. d. Meere. Kiel u.<br />
Bio1. Anst. Helgoland 11/1 (Kiel und Leipzig): 219-232.<br />
Ax, P. (1951): Die Turbellarien des Eulitorals <strong>der</strong> Kieler Bucht. - Zoo1. Jb. Abt.<br />
Syst. 80: 277-378.<br />
(1952): Bresslauilla relicta REISINGER, ein holeuryhalines Turbellar des<br />
Meer- und Süßwassers. - Faun. Mitt. Norddeutsch1. 1: 18.<br />
(1954): Die Turbellarienfauna des Küstengrundwassers am Finnischen Meerbusen.<br />
- Acta Zoo1. Fenn. 81 (Helsingfors): 1-54.<br />
(1956): Les turbellaries des etangs cötiers du littoral mediterraneen de la<br />
France meridionale. - Vie et Milieu, Supp1. No. 5 (Paris): 1-215.<br />
(1957 a): Die Einwan<strong>der</strong>ung mariner Elemente <strong>der</strong> Mikrofauna in das limnische<br />
Mesopsammal <strong>der</strong> EIbe. - Verh. Dt. Zoo1. Ges. Hamburg 1956:<br />
428-435.<br />
(1957 b): Ein chordoides Stützorgan des Ento<strong>der</strong>ms bei Turbellarien. <br />
Z. Morph. u. Öko1. Tiere, 46: 389-396.<br />
(J 0.50): Zur Systematik, Ökologie und Tiergeographie <strong>der</strong> Turbellarienfauna
532 Jens-Uwe Rixen<br />
in den ponto-kaspischen Brackwassermeeren. - Zoo1. Jb. Abt. Syst. 87:<br />
43-184.<br />
BEKLEMISCHEV, W. (1915): Über die Turbellarienfauna des Kaspischen Meeres. <br />
Trav. soe. imp. nat. de 'Petrograd 46: 106 ff. [russ.].<br />
(1921 a) Materiaux eoneernant la systematique et la faunistique des Turbellaria<br />
de la Russie de l'Est. - Bull. Aead. Sei. Russie, Ser. 6, 15: 631-656<br />
[russ.].<br />
(1921 b): "Turbellaria" in Fauna Petropolitanea Catalogus. - 2, NT. 6,<br />
1-9 (Petrograd) [russ.].<br />
(1922): Nouvelles contributions a la faune du lae Aral. - Russ. Hydrobiol.<br />
Z. 1: 276-289 [ross.].<br />
(1924): Sur quelques formes de Rhabdocoeles nouveaux ou peu connues.<br />
Bull. Inst. Recherch. Bio1. Univ. Perm, 2: 295---302 [ross.].<br />
(1927): Über die Turbellarienfauna des Aralsees. - Zoo1. Jb. Abt. Syst. 54:<br />
87-138 [russ.].<br />
BEKLEMISCHEV, N. V. (1951): The Species belonging to the Genus Macrostomum<br />
(Turbellaria Rhabdocoela) of the Soviet Union. - Bull. Soc. Nat. Moskau<br />
(Bio1.) 56, 4: 31--40 [ross.].<br />
BENEDEN, E. VAN (1870): Etude zoologique et anatomique du genre Macrostomum<br />
et description de deux especes nouvelles. - Bul1. Acad. Roy. sciences,<br />
lettres et beaux-arts Belg. 30: 116-133.<br />
BRAUN, M. (1885): Die rhabdocoeliden Turbellarien Livlands. - Arch. f. Naturkde.<br />
Liv-, Esth- und Kurlands Sero II, X: 1-125.<br />
- (1892): Notizen über mecklenburgische Turbellarien. - Arch. Freunde<br />
Naturg. Mecklenburg. 45., 11. Abt.: 151-154.<br />
BRESSLAU, E. (1906): Eine neue Art <strong>der</strong> marinen Turbellariengattung Polycystis<br />
(Macrorhynchus) <strong>aus</strong> <strong>dem</strong> Süßwasser. - Zoo1. Anz. 30: 415--422.<br />
- (1933): Turbellaria in Kükenthai und Krumbaeh, Handb. Zoo1. 2 (1): 52<br />
- 304.<br />
BRINKMANN, A. (1905): Studier over Danmarks rhabdoeoele og aeoele Turbellarier.<br />
- Vidensk. Meddel. naturhist. Foren. K0benhavn 1906: 1-159.<br />
BüLOw. T. VON (1951): Die Seerosenzone als Lebensraum. - Diss. Kiel.<br />
CARTER, 1. S. (1928): Note upon the Occurrence of Otomesostoma auditivurn<br />
(PLESS.) in the United States. - Science 68: 568.<br />
CASPERS, H. (1942): Die Landfauna <strong>der</strong> Insel Helgoland. - Zoogeogr. 4: 127-186.<br />
CHODOROWSKI, A. (1959): Ecological differentiation of turbellaIia in Harsz-Lake. <br />
Polsk. Arch. Hydrobiol. VI: 33-73.<br />
CORDE, W. J. (1923): Recherche sur la faune du gouvernement Ivanovo-Voznesensk.<br />
6. La faune des Turbellaria de la region des recherehes. - Trav. Instit.<br />
Polytech. I.-V. 7 (3): 41--49 [ross.].<br />
DAHM, A. G. (1951): Bothrioplana semperi M. BRAUN. - Ark. Zool., Ser. 2, 1:<br />
503-510.<br />
DORNER, C. (1902): Darstellung <strong>der</strong> Turbellarienfauna <strong>der</strong> <strong>Binnengewässer</strong> Oslpreußens.<br />
- Sehr. Phys.-ökon. Ces. Königsberg, 43: 1-58.<br />
EKMAN, S. (1915): Vorschläge und Erörterung zur Reliktenfrage in <strong>der</strong> Hydrobiologie.<br />
- Ark. Zool. 9: 1--35.<br />
- (1917): Allgemeine Bemerkungen über die Tiefenfauna <strong>der</strong> Binnenseen. <br />
Int. Rev. ges. Hydrobiol. 8 (2): 113-124.<br />
F ABRICIUS, O. (1826): Fortsaettelse af Nye Zoologiske Bidrag (1820). _ Kgl.<br />
Vidensk. Selsk. Naturvid. Math. Afhandl. 2.: 13--35.
536 Jens-Uwe Rixen<br />
REISINGER, F. (1923): Turbellaria in P. SCHULZE, Biologie <strong>der</strong> Tiere Deutschlands.<br />
6: 1-64.<br />
(1924 a): Die Gattung Rhyndwscolex. - Z. Morph. u. Öko1. Tiere I: 1-37.<br />
(1924 b): Die terricolen Rhabdocoelen Steiermarks. - ZooI. Anz. 59:<br />
33-48,72--86,128-143.<br />
(1925 a): Zur Turbellarienfauna <strong>der</strong> Ostalpen. - Zoo1. Jb. Abt. Syst. 49:<br />
229-298.<br />
(1925 b): Untersuchungen am Nervensystem <strong>der</strong> Bothrioplana semperi. <br />
Z. Morph. u. Öko1. Tiere 5: 119-149.<br />
1929): Zum Ductus genito-intestinalis-Problem. - 1. Über primäre Geschlechtstrakt-Darmverbindung<br />
bei rhabdocoelen Turbellarien. - Z. Morph.<br />
und Ökol. Tiere. 16: 49-73.<br />
(1954): Edaphische <strong>Kleinturbellarien</strong> als bodenkundliehe Leitformen. <br />
Carinthia II, 64: 105-123.<br />
(1955): Kärntens Hochgebirgsturbellarien. - Carinthia II, 65: 112-150.<br />
REISINGER, E., und STEINBÖCK, O. (1925): Zur Turbellarienfauna des Wörthersees.<br />
- Carinthia II, 114-115: 109-114.<br />
REMANE, A. (1938): Parergodrilus hei<strong>der</strong>i REISINGER in <strong>Schleswig</strong>-Holstein. <br />
Sehr. Naturwiss. Ver. Schl.-Holst. 22: 514.<br />
(1952): Die Besiedlung des Sandbodens <strong>der</strong> Meere und die Bedeutung <strong>der</strong><br />
Lebensformtypen für die Ökologie. - Verh. Dt. Zool. Ges. Wilhelmshaven<br />
1951: 327-359.<br />
(1957): Zur Verwandtschaft und Ableitung <strong>der</strong> nie<strong>der</strong>en Metazoen. - Verh.<br />
Dt. Zool. Ges. Graz 1957: 179-196.<br />
REMANE, A., und SCHLIEPER, C. (1958): Die Biologie des Brackwassers. - Die<br />
<strong>Binnengewässer</strong>, 22 (Stuttgart): 1-348.<br />
RUEBUSH, T. K. (1935): The Occurrence of Provortex affinis JENSEN in the United<br />
States. - Zool. Anz. 111: 305-308.<br />
RUEBUSH, T. K., und HAYES, W. J. jun. (1939): The Genus Dalyellia in America n.<br />
- Zoo1. Anz. 128: 136--152.<br />
RUHL, L (1927): Regenerationserscheinungen an Rhabdocoelen. - Zool. Anz. 72:<br />
160-175.<br />
RUTTNER, F. (1952): Grundriß <strong>der</strong> Limnologie. 2. Aufl.. (Berlin) : 1-232.<br />
RUTTNER-KoLISKO, A. (1956): Psammonstudien In. Das Psammon des Lago<br />
Maggiore in Oberitalien. - Memor. Ist. Idrobiol. 9: 365-402.<br />
SCHMIDT, E. O. (1848): Die rhabdocoelen Strudelwürmer (Turbellaria rhabdocoela)<br />
des süßen Wassers (Jena): 1-65.<br />
SCHULTZE, M. S. (1851): Beiträge zur Naturgeschichte <strong>der</strong> Turbellarien (Greifswald)<br />
: 1-78.<br />
SEKERA, E. (1906): Über die Verbreitung <strong>der</strong> Selbstbefruchtung bei den Rhabdo·<br />
coeliden. - Zool. Anz. 30: 142-153.<br />
SPANDL, H. (1925): Die Tierwelt vorübergehen<strong>der</strong> Gewässer Mitteleuropas. <br />
Arch. Hydrobiol. 16: 74-132.<br />
STEINBÖCK, O. (1926): Zur Ökologie <strong>der</strong> alpinen Turbellarien. - Z. Morph. u.<br />
Ökol. Tiere 5: 424-446.<br />
(1927): Monographie <strong>der</strong> Prorhynchidae. - Z. Morph. u. Ökol. Tiere 8:<br />
538-662.<br />
(1932): Zur Turbellarienfauna <strong>der</strong> Südalpen, zugleich ein Beitrag zur geographischen<br />
Verbreitung <strong>der</strong> Süßwasserturbellarien. - Zoogeogr. 1:<br />
209-262.
538 Rixen, <strong>Kleinturbellarien</strong> a. d. <strong>Litoral</strong> d. <strong>Binnengewässer</strong> <strong>Schleswig</strong>-Holsteins<br />
ZACHARIAS, O. (1902 b): Zur genaueren Charakteristik von Microstonwm inerme.<br />
- Zoo1. Anz. 25: 237-238.<br />
1902 c): Eine neue Turbellarienspecies (Stenostomum turgidum). - Zoo1.<br />
Anz. 26: 41-42.<br />
(1903): Zur Kenntnis <strong>der</strong> nie<strong>der</strong>en Flora und Fauna holsteinischer Moorsümpfe.<br />
- Forschber. Biol. Stat. Plön 10: 237-238, 240-241, 248, 267,<br />
281, 282-284.<br />
ZSCHOKKE, F. (1912): Leben in <strong>der</strong> Tiefe <strong>der</strong> subalpinen Seen Überreste <strong>der</strong> eiszeitlichen<br />
Mischfauna weiter? - Arch. Hydrobiol., 8: 109-138.<br />
Folgende zwei Arbeiten, die erst nach Drucklegung erschienen sind, konnten<br />
nicht mehr zum Vergleich herangezogen werden:<br />
LUTHER, A. (1960): Die Turbellarien Ostfennoskandiens. I. Acoela, Catenulida,<br />
Macrostomida, Lecithoepitheliata, P1"Olecithophora und Proseriata. - Fauna<br />
Fenn. 7: 1-155.<br />
OHLE, W. (1959): Die Seen <strong>Schleswig</strong>-Holsteins, ein Überblick nach regionalen,<br />
zivilisatorischen und produktionsbiologischen Gesichtspunkten. - Vom<br />
Wasser 26: 16-41.<br />
Anschrift des Verfassers:<br />
Dr. ].-U. RIXEN, Kronshagen bei Kiel, Stohbenbrook 11.<br />
\