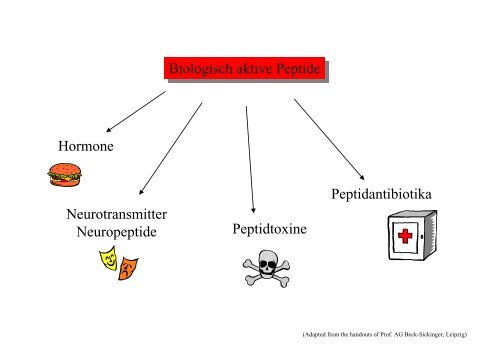
Biologisch aktive Peptide Biologisch aktive Peptide Hormone
Biologisch aktive Peptide Biologisch aktive Peptide Hormone
Biologisch aktive Peptide Biologisch aktive Peptide Hormone
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
<strong>Hormone</strong><br />
Neurotransmitter<br />
Neuropeptide<br />
<strong>Biologisch</strong> <strong>aktive</strong> <strong>Peptide</strong><br />
Peptidtoxine<br />
Peptidantibiotika<br />
(Adapted from the handouts of Prof. AG Beck-Sickinger, Leipzig)
Peptidtoxine<br />
Phallotoxine, (grüner Knollenblätterpilz)<br />
Amatoxine (weisser Knollenblätterpilz )<br />
Viscotoxine (Mistel)<br />
Mellitin (Bienengift)<br />
Mastoparan (Wespengift)<br />
Conotoxine (Kegelschneckengift)<br />
Cobratoxin (Schlangengift)<br />
Anuratoxin (Froschgift)
Hyp<br />
Ala Trp<br />
Cys<br />
Phallotoxin-Familie:<br />
variable Positionen<br />
gleiches Strukturprinzip<br />
Variation an bestimmten Positionen<br />
gleiches Wirkprinzip (Veränderung des Cytoskelettproteins Actin<br />
in den Parenchymzellen der Leber, was zum hämorragischen<br />
Schock und Tod nach 3-4 Std. führt)
Wirkung<br />
� Hemmung der DNA-Transkription (10 -8 M)<br />
� Blockierung der ribosomalen Proteinbiosynthese (Leber)<br />
� Nekrose der Leberzellen, Tod
Tödliche Bisse und Stiche durch Gifttiere in den USA<br />
Tiere Anzahl %<br />
Insekten 86 40<br />
Bienen 52 24,2<br />
Wespen 21 9,8<br />
Sonstige 13 6<br />
Giftschlangen 71 33<br />
Klapperschlangen 55 25,6<br />
Spinnen 39 18,1<br />
Skorpione 5 2,3
Mellitin: 26 Aminosäuren-Peptidamid (hämolytischer Effekt)<br />
hydrophobe Aminosäuren<br />
Bienengift-<strong>Peptide</strong><br />
durch Seifenblasen-Effekt reduziert es die Oberflächenspannung<br />
H-GIGAVLKVLTTGLPALISWIKRKRQE- NH 2<br />
Apamin: 18 Aminosäuren-Peptidamid (Neurotoxischer Effekt)<br />
blockiert spezifisch Ca 2+ und K + Kanäle<br />
H-CNCKAPETALCARRCQQH-NH 2<br />
hydrophile Aminosäuren
MCDP: Mastzellen-degranulierendes Peptid:<br />
22 Aminosäuren-Peptidamid<br />
- Freisetzung von Histamin<br />
S
Peptidische Toxine aus Schlangen, Conus-Schnecken und Skorpionen<br />
Disulfidbrücken-reich (22-50% Cys-Reste)<br />
sehr starr<br />
Wirkung<br />
Cardiotoxine: Herzmuskelgifte, irreversible Depolarisation<br />
Neurotoxine: passen genau in verschiedene Rezeptoren<br />
der Signalübertragung (Rezeptoren, Kanäle), Atemgifte
Toxine der Giftnattern:<br />
60-62 Aminosäuren 71-74 Aminosäuren<br />
α-Bungaratoxin<br />
(α-BGT)<br />
aus Bungarus multicinctus<br />
blockiert Acetylcholinrezeptorkanalöffnung
Sequenz des Cobratoxins
Struktur des Cobratoxins
Peptidtoxine aus Conus-Schnecken<br />
Die Toxine blockieren spannungsabhängige Calciumkanäle an cholinergen<br />
Nervenenden und inhibiren die Freisetzung von Acetylcholin
Conus-Schnecken<br />
(Conidae)<br />
Cys-reich<br />
Hydroxyprolin<br />
H N<br />
H O<br />
COOH
Peptidtoxine in Amphibien<br />
kurze <strong>Peptide</strong>, stark blutdrucksenkend, häufig ähnlich zu<br />
körpereigenen <strong>Peptide</strong>n<br />
Laubfrosch: Caeruelin<br />
pGlu-Glu-Asp-Tyr(SO 3 H)-Thr-Gly-Trp-Met-Asp-Phe-NH 2<br />
Pfeifffrosch: Physalaemin<br />
pGlu-Asp-Pro-Asp-Lys-Phe-Tyr-Gly-Leu-Met-NH 2<br />
Greiffrosch: Phyllokinin<br />
Bradykinyl-Ile-Tyr(SO 3 H)-OH<br />
(Bradykinin: H-RPPGFSPFR-OH. Gefäßerweiternd,<br />
blutdrucksenkend, temperaturregulierend, Schmerzauslösend)
Modifikationen in peptidischen Amphibien-Toxinen<br />
pGlu- HN CH C OH<br />
Glu<br />
C CH2 -H2O CH2 O<br />
Tyr(SO 3 H)<br />
C<br />
H 2<br />
O<br />
H 2N CH C<br />
CH 2<br />
O<br />
OSO 3H<br />
OH<br />
O<br />
H 2N CH C<br />
CH 2<br />
C<br />
OH<br />
O<br />
OH
Me<br />
Me<br />
N<br />
N<br />
O<br />
O<br />
O<br />
N<br />
H<br />
O<br />
Me<br />
H N<br />
N<br />
O<br />
Peptidantibiotika<br />
O<br />
OH<br />
N<br />
Me<br />
O<br />
N<br />
Me<br />
H<br />
N<br />
O<br />
Me<br />
N<br />
Me<br />
O<br />
N<br />
H<br />
N-Methylierung<br />
Cyclisches Undekapeptid, Immunsuppresivum<br />
wichtig bei Organtransplantationen<br />
N<br />
O<br />
O<br />
Cyclosporin
Gramicidine<br />
hochaktiv gegen gram-positive Bakterien<br />
hämolytsich, daher NICHT systemisch anwendbar<br />
Formylgruppe<br />
am am N-Terminus<br />
D-Aminosäuren<br />
Ethanolamin<br />
am am C-Terminus
N-Terminus<br />
-H 2 O<br />
Ile-Cys<br />
Thiazolring<br />
Zur Behandlung von Hautinfektionen.<br />
Das Histidin und der Thiazolring sind<br />
essenziell für die Wirkung. Das<br />
Bacitracin komplexiert das<br />
Undecaprenylpyrophosphat, eine<br />
Biosynthesezwischenstufe der<br />
Bakterienzellwand, und hemmt die<br />
enzymatische Hydrolyse zum<br />
entsprechenden Orthophopshatester.<br />
Bacitracin A<br />
C-Terminus
Mikroheterogenität und große Variabilität
Lac = L-Milchsäure<br />
D-Hyv = D-a-Hydroxy-isovaleriansäure
Valinomycin:<br />
� Depsipeptid<br />
(alternierend Peptidund<br />
Lacton-Bindung)<br />
� Ionophor<br />
komplexiert Kationen<br />
in käfigartiger<br />
Struktur: K + >>> Na +<br />
�Transport durch Membran<br />
�Zerstörung des Potentials<br />
D-Hyv<br />
� aktiv gegen den Tuberkuloseerreger<br />
Lac
Lantibiotika (ribosomale Biosynthese über in<strong>aktive</strong> Präkursoren):<br />
Peptidantibiotika, die Lanthionin und/oder Methyllanthionin<br />
enthalten<br />
Lanthionin<br />
Methyl-Lanthionin<br />
O<br />
NH 2<br />
CH<br />
C C H2<br />
OH<br />
S<br />
H 2<br />
C<br />
H 2N C H C<br />
C H 2<br />
O<br />
NH 2<br />
CH<br />
C<br />
OH<br />
O H<br />
O<br />
Dehydro-Alanin
Peptidantibiotika<br />
� ungewöhnliche Aminosäuren<br />
D-Aminosäuren<br />
N-Methyl-Aminosäuren<br />
Dehydro-Ala, Lanthionin<br />
� ungewöhnliche Bindungen<br />
Lacton-Bindungen<br />
Cyclopeptide<br />
� reduzierter, enzymatischer Abbau<br />
durch modifizierte N- und C-Termini
Neurotransmitter und Neuropeptide<br />
Was sind Neurotransmitter????<br />
Substanzen,<br />
� die das Signal von einer Zelle zur<br />
nächsten durch den synaptischen<br />
Spalt weitergeben.<br />
� von einer Nervenzelle nach Impuls<br />
freigesetzt werden und durch den<br />
synaptischen Spalt diffundieren<br />
� post- oder präsynaptisch an<br />
Erkennungsmoleküle (Rezeptoren)<br />
binden
Was sind <strong>Hormone</strong> ????<br />
Substanzen,<br />
die das Signal von einer Zelle an viele<br />
weitergeben.<br />
von einer Drüsenzelle nach Impuls<br />
freigesetzt werden und in die Umgebung<br />
oder Blutbahn abgegeben werden.<br />
post- oder präsynaptisch an<br />
Erkennungsmoleküle (Rezeptoren)<br />
binden.
<strong>Hormone</strong> und Neurotransmitter:<br />
Kommunikationssystem des Körpers<br />
- Nervensystem: schnell, gezielt, kurz<br />
- Hormonsystem: langsam, breit, langanhaltend
d<br />
Chemische Botenstoffe: Sekretion
Ursprung der<br />
Signale<br />
Ziele der<br />
ersten Stufe<br />
Ziele der<br />
zweiten Stufe<br />
Ziele der<br />
letzten Stufe<br />
Sinneseindrücke aus der Umwelt<br />
Zentralnervensystem<br />
Hypothalamus<br />
CRH TRH GnRH SRH SIH PRH PIH<br />
Corticotropin<br />
(ACTH)<br />
Nebennierenrinde<br />
Cortisol,<br />
Corticosterol,<br />
Aldosteron<br />
Thyreotropin<br />
Schilddrüse<br />
Thyroxin,<br />
Triiodthyroxin<br />
Viele Gewebe Leber,<br />
Muskeln<br />
Adenohypophyse<br />
Follikel-<br />
Stimulierendes<br />
Hormon<br />
Luteinisierendes<br />
Hormon<br />
Eierstöcke/Hoden<br />
Progesteron<br />
Testosteron<br />
Somatotropin<br />
Prolactin<br />
(H.D. Jakubke in <strong>Peptide</strong>, S. 58)<br />
Neurohypophyse<br />
Oxitocin Vasopressin<br />
Fortpflanzungsorgane Leber, Brustdrüsen Glatte<br />
Knochen<br />
Muskulatur,<br />
Brustdrüsen<br />
Arteriolen
Blutdruck regulierende <strong>Peptide</strong>:<br />
Angiotensin<br />
Bradykinin<br />
Substanz P/Tachykinine<br />
ANF<br />
Endothelin<br />
Verdauung reglierende <strong>Peptide</strong><br />
Cholecystokinin<br />
Gastrin<br />
Sekretin<br />
Glucagon<br />
Insulin<br />
Neuropeptide<br />
Neuropeptid Y<br />
Neurotensin<br />
Orexin<br />
MSH<br />
Opioid-Hormon-Familie: Endorphine, Enkephaline
Beispiele für Peptidhormone
Thyroliberin, TRH (Thyrotropin-Releasing-<strong>Hormone</strong>)<br />
N-Terminus:<br />
pyro-Glutamat<br />
pGlu-His-Pro-NH 2<br />
C-Terminus amidiert!<br />
GnRH: pGlu-His-Trp-Ser-Tyr-Gly-Leu-Arg-Pro-Gly-NH 2<br />
Gonadoliberin
Biosynthese von körpereigenen <strong>Peptide</strong>n<br />
PTH: Parathormon<br />
PTH
Biosynthese von körpereigenen <strong>Peptide</strong>n
Biosynthese<br />
von<br />
Insulin
H-Cys-Tyr-Ile-Gln-Asn-Cys-Pro-Leu-Gly-NH 2<br />
Me<br />
Wichtige Peptid-Arzneistoffe<br />
Me<br />
N<br />
N<br />
O<br />
O<br />
O<br />
N<br />
H<br />
O<br />
Me<br />
H N<br />
N<br />
O<br />
O<br />
OH<br />
N<br />
Me<br />
O<br />
N<br />
Me<br />
H<br />
N<br />
O<br />
Oxytocin<br />
Cyclosporin<br />
pGlu-His-Trp-Ser-Tyr-D-Leu-Leu-Arg-Pro-NHEt Leuprolid<br />
Me<br />
N<br />
Me<br />
O<br />
N<br />
H<br />
N<br />
O<br />
O<br />
(Wehenauslösende Wirkung)<br />
(Antibiotikum. Immunosuppressive,<br />
antiparasitäre, fungizide,<br />
entzündungshemmende Wirkung)<br />
(GnRH-Analog; Anwendung im veterinärmedizinischen<br />
Bereich zur Fertilitätssteuerung und Ovulationsinduktion<br />
sowie in der Humanmedizin zur Kontrazeption sowie u.a. bei<br />
den Indikationen Mamma- bzw. Prostata-Karzinom und<br />
Endometriosis)