Acidos carboxílicos y derivados - Grupo de Sintesis Organica ...
Acidos carboxílicos y derivados - Grupo de Sintesis Organica ...
Acidos carboxílicos y derivados - Grupo de Sintesis Organica ...
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
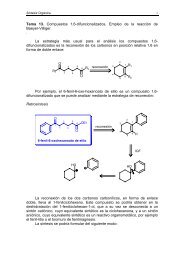
Química Orgánica Tema 11. <strong>Acidos</strong> <strong>carboxílicos</strong> y <strong><strong>de</strong>rivados</strong><br />
www.sinorg.uji.es<br />
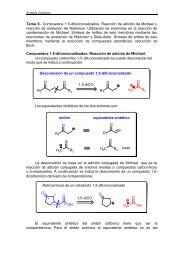
Cuando el acetato <strong>de</strong> metilo se trata con una disolución metanólica <strong>de</strong> metóxido<br />
sódico y la mezcla <strong>de</strong> reacción se acidifica se obtiene el acetilacetato <strong>de</strong> metilo.<br />
CH 3<br />
O<br />
C<br />
OCH 3<br />
acetato <strong>de</strong> metilo<br />
1º NaOMe<br />
2º H 3 O+<br />
CH 3<br />
O<br />
C<br />
O<br />
CH 2 C<br />
OCH 3<br />
acetilacetato <strong>de</strong> metilo<br />
MeOH<br />
Este proceso, que permite la obtención <strong>de</strong> β-cetoésteres, se conoce con el<br />
nombre <strong>de</strong> reacción <strong>de</strong> con<strong>de</strong>nsación <strong>de</strong> Claisen.<br />
El mecanismo que explica la formación <strong>de</strong>l acetilacetato <strong>de</strong> metilo (un βcetoéster)<br />
se inicia con la enolización parcial <strong>de</strong>l acetato <strong>de</strong> metilo por reacción con la<br />
base NaOMe. El ion enolato ataca al carbonilo <strong>de</strong>l éster que queda sin enolizar y<br />
genera un intermedio tetraédrico. Este intermedio elimina el anión metóxido formando<br />
un β-cetoéster.<br />
Paso 1: enolización parcial <strong>de</strong>l éster<br />
CH 3<br />
CH 2<br />
O<br />
C<br />
+<br />
Na<br />
OCH 3<br />
Paso 2: ataque nucleofílico <strong>de</strong>l enolato al éster, seguido <strong>de</strong> eliminación <strong>de</strong> NaOMe<br />
CH 3<br />
Na<br />
CH 3<br />
O<br />
C<br />
O<br />
C<br />
O<br />
C<br />
OCH 3<br />
OCH 3<br />
OCH 3<br />
CH 2<br />
+ NaOMe<br />
O<br />
C<br />
CH 2<br />
OCH 3<br />
O<br />
C<br />
Na<br />
OCH 3<br />
CH 3<br />
MeOH<br />
O<br />
C<br />
+<br />
Na<br />
CH 3<br />
O<br />
C<br />
OCH 3<br />
O<br />
CH 2 C OCH 3<br />
b-cetoéster<br />
CH 2<br />
O<br />
C<br />
OCH 3<br />
+ NaOMe<br />
Los β-cetoésteres son mucho más ácidos que los al<strong>de</strong>hídos, que las cetonas y<br />
que los ésteres porque el anión que se genera cuando reaccionan con una base tiene<br />
la carga negativa <strong>de</strong>slocalizada sobre el grupo carbonilo <strong>de</strong>l éster y sobre el grupo<br />
carbonilo <strong>de</strong> cetona. Los valores <strong>de</strong> pKa <strong>de</strong> los β-cetoésteres son <strong>de</strong>l or<strong>de</strong>n <strong>de</strong> 11, lo<br />
que significa que son incluso ácidos más fuertes que el agua. En una disolución que<br />
contenga el anión metóxido el β-cetoéster, sustancia relativamente ácida, reaccionará<br />
<strong>de</strong>sprotonándose rápida y cuantitativamente:<br />
22