You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
Mise à niveau I de chimie pour soins infirmiers Stéphane Roberge Hiver-2013<br />
Fascicule <strong>#1</strong><br />
Module 1 : <strong>Rappels</strong><br />
Référence : Chimie-option science - Introduction<br />
Numéros suggérés : # 1-2-3-4-5-6-7-8-9-10-11-12-13-16-17-18-19-20-21-22-23<br />
Thématiques :<br />
• Notions fondamentales (Tableau périodique, particules subatomiques (p, n, e - ), isotope, e - de valence et<br />
couche électronique, Notation de Lewis, liaison ionique et covalente, nomenclature, électrolytes, etc.)<br />
o Théorie (p-2 à 12)<br />
o # 1-2-3-4-5-6-7-8-9-10-11-12-13-16<br />
• Quantité de matière (Masse molaire, Nombre de moles)<br />
o Théorie (p-13 et 14)<br />
o # 17-18<br />
• La concentration<br />
o Théorie (p-14 à 16)<br />
o # 19-20-21<br />
• Les transformations (physique, chimiques, équilibrage d’équations)<br />
o Théorie (p-16 à 19 et méthodologie p-441)<br />
o # 22-23<br />
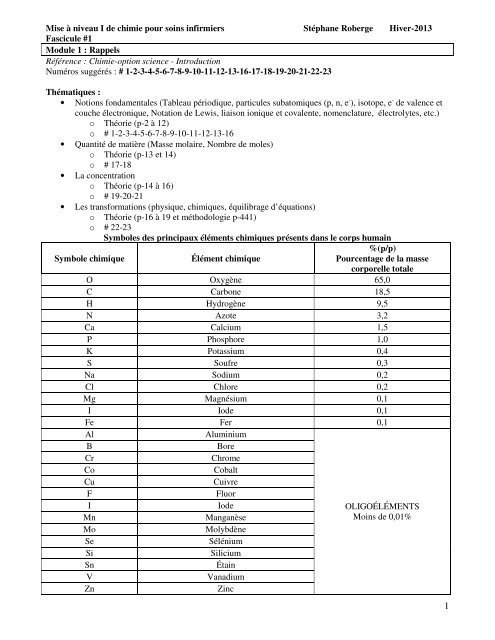
Symboles des principaux éléments chimiques présents dans le corps humain<br />
%(p/p)<br />
Symbole chimique Élément chimique<br />
Pourcentage de la masse<br />
corporelle totale<br />
O Oxygène 65,0<br />
C Carbone 18,5<br />
H Hydrogène 9,5<br />
N Azote 3,2<br />
Ca Calcium 1,5<br />
P Phosphore 1,0<br />
K Potassium 0,4<br />
S Soufre 0,3<br />
Na Sodium 0,2<br />
Cl Chlore 0,2<br />
Mg Magnésium 0,1<br />
I Iode 0,1<br />
Fe Fer 0,1<br />
Al Aluminium<br />
B Bore<br />
Cr Chrome<br />
Co Cobalt<br />
Cu Cuivre<br />
F Fluor<br />
I Iode<br />
OLIGOÉLÉMENTS<br />
Mn Manganèse<br />
Moins de 0,01%<br />
Mo Molybdène<br />
Se Sélénium<br />
Si Silicium<br />
Sn Étain<br />
V Vanadium<br />
Zn Zinc<br />
1
Les particules subatomiques<br />
Informations pertinentes tirées du tableau périodique :<br />
(A) Nombre de masse = Nombre de protons et de neutrons (Chiffre le plus gros)<br />
(Z) Numéro atomique = Nombre de protons<br />
6 12<br />
C => 6 protons, 6 neutrons et 6 électrons.<br />
Charge neutre : (+6) + (-6) = 0<br />
Pourquoi la masse est de 12,011?<br />
Il y a présence de plusieurs isotopes du carbone dans la nature.<br />
Définition : ISOTOPE<br />
Masse Charge<br />
Proton 1 +1<br />
Neutron 1 Neutre (0)<br />
Électron infime -1<br />
Atomes avec le même numéro atomique (Z) mais un nombre de masse (A) différent. DIFFÉRENCE => nbr de<br />
neutrons.<br />
6 12 6 13<br />
C C 13<br />
Différence C a un neutron de plus pour un total de 7 neutrons.<br />
(6p, 6n et 6 e - ) (6p, 7n et 6 e - )<br />
Z<br />
A<br />
C<br />
Carbone<br />
Nbr<br />
d’oxydation<br />
2
Exercice <strong>#1</strong><br />
Le Technétium 99 est l’isotope radioactif le plus utilisé en imagerie médicale nucléaire. Répondre aux questions<br />
suivantes :<br />
A) Pour le<br />
43 99<br />
Tc , faire le décompte des particules subatomiques.<br />
Nombre de neutrons :_____56_<br />
Nombre de protons :____43_<br />
Nombre d’électrons :____43____<br />
B) Nommer un autre isotope possible du technétium et expliquer la différence au niveau des particules<br />
subatomiques.<br />
Autre possibilité d’isotope :_____Tc 100 _________<br />
Nombre de neutrons :_____57___<br />
Nombre de protons :______43_____<br />
Nombre d’électrons :_____43____<br />
Explications<br />
Même nombre de protons et électrons. Changement au niveau du nombre de neutrons. Donc,<br />
changement au niveau du nombre de masse également<br />
3
Tableau périodique et valence des atomes<br />
Groupes<br />
(Colonnes)<br />
Périodes<br />
(Rangées)<br />
Familles 1 à 18<br />
A) Éléments représentatifs<br />
B) Éléments de transition<br />
Propriétés physiques et chimiques similaires.<br />
7 périodes<br />
La première n’a que deux éléments (H et He)<br />
Observe une périodicité des propriétés<br />
IA => Alcalins (1 électron de valence)<br />
IIA => Alcalino-terreux (2 électrons de valence)<br />
VIIA => Halogènes (7 électrons de valence)<br />
VIIIA => Gaz rares (8 électrons de valence)<br />
Tableau périodique des éléments<br />
+1 +2 +3 ±4 -3 -2 -1<br />
IA IIA IIIA IVA VA VIA VIIA VIIIA<br />
Éléments de transition<br />
(Nombre d’oxydation variable sauf les 4 exceptions)<br />
Métaux de transition (Plusieurs possibilités sauf : Ag +1 , Zn +2 , Cd +2 et Al 3+ )<br />
Période Nbr d’e - valence<br />
1 ère<br />
2 e<br />
3 e<br />
4 e<br />
5 e<br />
6 e<br />
7 e<br />
Voir tableau 1.1 (p-8)<br />
He<br />
Ne<br />
Ar<br />
Kr<br />
Xe<br />
Rn<br />
2 e -<br />
8 e -<br />
8 e -<br />
18 e -<br />
18 e -<br />
32 e -<br />
32 e -<br />
4
L’organisation des atomes en molécules et la nature des liaisons<br />
Les atomes sont « contents » s’ils respectent la RÈGLE DE L’OCTET<br />
Noyau<br />
Mg veut se débarrasser de 2 e -<br />
Période Nbr d’e -<br />
Total<br />
1 2 2<br />
2 8 10<br />
3 8 18<br />
Si la dernière couche est pleine => STABILITÉ dons l’atome est « CONTENT »<br />
Mg(s)<br />
Décompte des particules subatomiques :<br />
Protons : 12<br />
Neutrons : 12<br />
Électrons : 10<br />
Charge : (+12)+(-10)= +2<br />
9 F 1 ère => 2e - 2 e => 7 e -<br />
8e -<br />
2e -<br />
perted 'e<br />
−<br />
⎯⎯⎯⎯→ Mg 2+ (aq) + 2 e -<br />
F2(g) + 2 e -<br />
CATION<br />
gaind 'e<br />
−<br />
⎯⎯⎯⎯→ 2 F - (aq)<br />
ANIONS<br />
Décompte des particules subatomiques : 9p, 10n et 10e - Charge (+9)+(-10)=-1<br />
2e -<br />
Dernière couche<br />
(Électrons de valence)<br />
Nbr d’oxydation<br />
Configuration des gaz<br />
rares<br />
5
L’électronégativité (χχχχ)<br />
Définitions :<br />
• Capacité à « aimer » les électrons. (Valeur entre 0,7 et 4,0)<br />
L’électronégativité ___diminue ↓__ dans un groupe.<br />
L’électronégativité ___augmente ↑___ dans une période.<br />
Plus le ∆χ augmente ↑, plus le caractère ionique de la liaison chimique augmente ↑.<br />
Une liaison intramoléculaire est covalente lorsque la ∆E< 1,7 et ionique lorsque la ∆E ≥ 1,7.<br />
IONIQUE => TRANSFERT d’électrons (Majoritairement)<br />
COVALENT => PARTAGE d’électrons<br />
∆χ<br />
(différence d’électronégativité)<br />
% caractère ionique du lien<br />
Liaison ionique<br />
(transfert d’e - )<br />
Liaison covalente<br />
(partage d’e - )<br />
NaCl Cl2<br />
∆χ=3,16-0,93=2,23 ∆χ=3,16-3,16=0,00<br />
71 % 0 %<br />
• Métal / non-métal<br />
• Liaison où % caractère ionique liaison > 50%.<br />
• 2 non-métaux<br />
• Liaison où % caractère covalent liaison > 50%.<br />
Petit atome<br />
de fluor très<br />
vorace<br />
6
Nomenclature traditionnelle *(Différent de la page 10 de votre volume option science)<br />
Nomenclature (Nom -> Formule chimique ou Formule chimique -> Nom)<br />
• Déterminer si le composé est un acide. (Règle différente)<br />
• Déterminer si le composé est ionique ou covalent<br />
o Ionique (Ne pas utiliser de préfixes…. di, tri, tétra)<br />
Chiffre romain (Regarder le cation, s’il se retrouve dans les métaux de transition et<br />
attention, il y a des exceptions)<br />
• Charge +2 donne (II) entre parenthèse. La somme des charges de tous les<br />
cations doit être égale à la somme des charges des anions.<br />
Pas de chiffre romain (Regarder le cation. Il n’y a pas qu’une seule possibilité)<br />
o Covalent (Utiliser les préfixes, di,tri, tétra…)<br />
Composés ioniques : Métal + Non-métal<br />
Métal : donneur d’e -<br />
Non-métal : accepteur d’e -<br />
NOMENCLATURE TRADITIONNELLE<br />
Transfert d’e - Partage d’e -<br />
Nomenclature (Cation avec toujours la même<br />
charge)<br />
1Non-métal en premier Ajouter « ure »<br />
2Nommer le métal<br />
Ionique<br />
Cation : Métal<br />
Anion :Non-métal ou ion polyatomique<br />
Composés covalents ou moléculaires: Deux nonmétaux<br />
Composé chimique<br />
Nomenclature (Cation pouvant avoir des<br />
charges différentes)<br />
1Non-métal en premier Ajouter « ure »<br />
2Nommer le métal en spécifiant sa charge par<br />
un chiffre romain entre parenthèse<br />
covalent<br />
2 non-métaux<br />
Nomenclature covalent<br />
1Utiliser des préfixes pour l’un et l’autre des<br />
deux éléments<br />
2Nommer le 2 e élément en ajoutant « ure »<br />
7
Tableau <strong>#1</strong><br />
Anions monoatomiques<br />
Aide-mémoire (Nomenclature)<br />
Tableau #2<br />
Anions et cations polyatomiques<br />
Tableau #3a<br />
Préfixes<br />
H - Hydrure Hg2 +2<br />
Mercure (I) NCS -<br />
Thiocyanate 1 Mono<br />
F -<br />
Fluorure NH4 +<br />
Ammonium CO3 -2<br />
Carbonate 2 Di<br />
Cl -<br />
Chlorure<br />
NO2 -<br />
Nitrite HCO3 -<br />
Hydrogénocarbonate<br />
bicarbonate<br />
3 Tri<br />
Br -<br />
Bromure NO3 - Nitrate ClO - Hypochlorite 4 Tétra<br />
I - Iodure SO3 -2<br />
Sulfite ClO2 - Chlorite 5 Penta<br />
S -2<br />
Sulfure SO4 -2<br />
Sulfate ClO3 - Chlorate 6 Hexa<br />
N -3<br />
Nitrure HSO4 -<br />
Hydrogénosulfate ClO4 - Perchlorate 7 Hepta<br />
P -3<br />
Phosphure OH -<br />
Hydroxyde CH3COO - Acétate 8 Octa<br />
O -2<br />
Oxyde CN -<br />
Cyanure MnO4 - Permanganate 9 Nona<br />
PO4 -3 Phosphate Cr2O7 -2<br />
Dichromate 10 déca<br />
HPO4 -2 Hydrogénophosphate CrO4 -2 Chromate<br />
Tableau #3b<br />
Cations (Nbr d’oxydation<br />
varie)<br />
Fe +3<br />
Fe +2<br />
Cu +2<br />
Cu +<br />
Sn +4<br />
Sn +2<br />
H2PO4 - Dihydrogénophosphate O2 -2<br />
HSO3 - Hydrogénosulfite C2O4 -2<br />
Tableau #4<br />
Acides (Sans oxygène)<br />
Peroxyde<br />
Oxalate<br />
BrO3 - Bromate<br />
Tableau #4<br />
Acides (Avec oxygène)<br />
Fer(III) HF Acide fluorhydrique HNO3 Acide nitrique<br />
Fer(II) HCl Acide chlorhydrique HNO2 Acide nitreux<br />
Cu(II) HBr Acide bromhydrique H2SO4 Acide sulfurique<br />
Cu(I) HI Acide iodhydrique H2SO3 Acide sulfureux<br />
Sn(IV) HCN Acide cyanhydrique H3PO4 Acide phosphorique<br />
Sn(II) H2S Acide sulfhydrique CH3COOH Acide acétique<br />
8
Exercices :<br />
Formule chimique<br />
Composé ionique (I)<br />
Composé covalent (C)<br />
Nomenclature<br />
NaCl I Chlorure de sodium<br />
CO2 C Dioxyde de carbone<br />
Fe2O3 I Oxyde de fer (III)<br />
N2F4 C Tétrafluorure de diazote<br />
CO C Monoxyde de carbone<br />
Numéro <strong>#1</strong>4 Nommez chacune des substances suivantes :<br />
a) Na2O _____Oxyde de sodium____________________<br />
b) BaS _____Sulfure de baryum_____________________________<br />
c) CaI2 ______Iodure de calcium_____________________________<br />
d) N2O5 ______Pentoxyde de diazote______________________________<br />
e) LiOH ______Hydroxyde de lithium__________________________<br />
f) CaCO3 ______Carbonate de calcium_________________________<br />
g) Al2(SO4)3<br />
______Sulfate d’aluminium_________________________<br />
Numéro <strong>#1</strong>5 Indiquez la formule chimique des substances suivantes<br />
a) Acétate de sodium _______NaCH3COO________<br />
b) Oxyde de potassium ________K2O_________________<br />
c) Nitrate de calcium _______Ca(NO3)2_____________________<br />
d) Tétrabromure de carbone ________CBr4___________________<br />
e) Phosphate de manganèse (II) _______Mn3(PO4)2__________________<br />
f) Hydrogénocarbonate de magnésium ______Mg(HCO3)2_________________<br />
9
Représentation des molécules avec la structure de Lewis<br />
Dessiner les structures de Lewis adéquates pour les formules chimiques suivantes :<br />
Les électrolytes :<br />
H2O N2 CH3OH<br />
••<br />
Substances qui se dissocient à 100% dans l’eau. (Présences d’anions et cations qui permettent le passage d’un<br />
courant électrique)<br />
Catégories :<br />
Acides : H – Non-métal HCl(aq) 2<br />
Bases : Métal – OH NaOH 2<br />
Sel : Métal- Non-métal (Liaison ionique) NaCl 2<br />
H O<br />
⎯⎯⎯→ H + (aq) + Cl - (aq)<br />
H O<br />
⎯⎯⎯→ Na + (aq) + OH - (aq)<br />
H O<br />
⎯⎯⎯→ Na + (aq) + Cl - (aq)<br />
10
Quantité de matière (nombre de moles et masse molaire)<br />
Voir méthodologie de résolution p-438 et 439 au besoin.<br />
Solide<br />
mA g<br />
nA = = = mole<br />
M g<br />
A<br />
mole<br />
Nombre d’avogadro : 6,022X10 23 entités/mole<br />
Liquide<br />
g<br />
VA • ρ mL •<br />
A n mL<br />
A = = = mole<br />
M g<br />
A<br />
mole<br />
Solution<br />
Quantité = C •V<br />
mole<br />
• L = mole<br />
L<br />
g<br />
• L = g<br />
L<br />
<strong>#1</strong> Déterminer le nombre de moles et le nombre de molécules dans 10,45g de carbonate de calcium.<br />
M<br />
CaCO<br />
3<br />
= 100,09<br />
g<br />
mole<br />
m 10,45g<br />
M CaCO3<br />
100,09<br />
g<br />
mole<br />
CaCO3<br />
nCaCO = = = 0,1044moledeCaCO<br />
3<br />
Règle de trois :<br />
1mole = 100,09g<br />
X mole = 10,45 g x = 0,1044 mole de CaCO3<br />
Nombre de molécules<br />
23<br />
6,022 X10 molécules<br />
22<br />
0,1044mole • = 6,287 X10 molécules deCaCO<br />
mole<br />
Règle de trois :<br />
1mole = 6,022 X10 23 molécules<br />
0,1044 mole = x molécules x = 6,287X10 22 molécules de CaCO3<br />
Nbr de moles :____0,1044 mole_<br />
Nbr de molécules :__6,287X10 22 molécules de CaCO3__<br />
#2 Déterminer le nombre de moles d’éthanol (CH3CH2OH) dans 10,0 mL. La masse volumique de l’éthanol pur<br />
est de 0,789 g/mL.<br />
M C2H 6O<br />
= 46,08<br />
g<br />
mole<br />
0,789g<br />
méthanol = véthanol • ρéthanol<br />
= 10,0mL • = 7,89g d 'éthanol<br />
mL<br />
méthanol néthanol =<br />
M éthanol<br />
7,89g<br />
= =<br />
0,171mole<br />
46,08<br />
g<br />
mole<br />
3<br />
3<br />
11
Les unités de concentrations<br />
Noms / symbole Formule Unités de concentrations<br />
g/L<br />
Concentration molaire volumique<br />
(Molarité)<br />
mole<br />
L<br />
ou M ou molaire<br />
% volumique % (v/v)<br />
%(p/v) ou %(m/v)<br />
% massique<br />
% (p/p) ou % (m/m)<br />
ppm<br />
msoluté<br />
V ( L )<br />
solution<br />
nsoluté<br />
V ( L )<br />
solution<br />
Vsoluté<br />
100<br />
Vsolution ( mL) •<br />
msoluté<br />
100<br />
V ( mL) •<br />
solution<br />
m<br />
m<br />
A<br />
totale<br />
• 100<br />
1<br />
1000000<br />
mg<br />
L<br />
g soluté<br />
L solution<br />
molesoluté<br />
L sln<br />
mL soluté<br />
100mL<br />
solution<br />
g soluté<br />
100mL<br />
solution<br />
g soluté<br />
100g<br />
solution<br />
solide/ liquide<br />
L<br />
Attention : M a deux significations 1) M = molarité = concentration molaire volumique = mole L<br />
2) M = masse molaire = g mole<br />
#3 Déterminer la masse de NaCl dans une 500 mL d’une solution saline 9,0 %(m/v).<br />
( )<br />
9,0<br />
9,0% m gramme NaCl<br />
=<br />
v 100mL<br />
solution<br />
9,0 grammes NaCl = 100 mL<br />
X gramme = 500 mL x= 45 grammes NaCL<br />
µ<br />
gaz<br />
L<br />
12
Calcul de dilution<br />
Solution concentrée => solution diluée (DILUTION)<br />
C V = C V<br />
1 1 2 2<br />
Trois valeurs connues et une valeur inconnue<br />
V1 et V2 doivent avoir la même unité (mL ou L)<br />
C1 et C2 doivent avoir la même unité (M, %(p/v), ppm,<br />
%(p/p) etc.)<br />
On veut préparer 1 litre d’une solution de [NaCl]=0,92%(p/v) à partir d’une solution 10%(p/v) en NaCl.<br />
Expliquer la procédure<br />
C = 0,92%( p / v)<br />
1<br />
1<br />
V = 1000mL<br />
C = 10%( p / v)<br />
2<br />
2<br />
V = ____ mL<br />
C •V 1000mL • 0,92%( p / v)<br />
= = = + =<br />
1 1 V2 92mL conc 908mL d 'eau 1000mL<br />
C2 10%( p / v)<br />
Les transformations de la matière (physique, chimiques, équilibrage d’équations)<br />
Transformations<br />
Physique<br />
Chimique<br />
L’identité de la substance est préservée (mêmes propriétés physiques).<br />
Exemples : Changements de phases<br />
Changement de la substance (Rx chimique)<br />
La composition change. Les propriétés physiques sont différentes par la suite.<br />
Indices : dégagement gaz, couleur, lumière, changement couleur, formation d’un<br />
précipité.<br />
Exemples de transformations chimiques :<br />
• Rx de synthèse<br />
• Rx de décomposition<br />
• Rx de précipitation<br />
• Rx de neutralisation acidobasique<br />
• Rx d’oxydation<br />
• Rx de combustion<br />
13
Équation<br />
#<br />
1<br />
2<br />
3<br />
4<br />
Le balancement d’une équation chimique<br />
A + B<br />
100%<br />
⎯⎯⎯→ C + D<br />
Réactifs Produits<br />
- Bien balancer l’équation (Équilibrage) => Bons coefficients stœchiométriques<br />
o Méthode par tâtonnement<br />
o Métho p-441<br />
- Bien identifier l’état des substances (en indice)<br />
o (s) solide<br />
o (l) liquide<br />
o (aq) en solution aqueuse<br />
o (g) gaz<br />
Balancement par la méthode par tâtonnement<br />
1) Repère la formule la plus complexe et l’élément qui ne figure que dans un seul réactif ou un seul produit<br />
2) Assigne coefficient pour la formule plus complexe<br />
3) On complète<br />
4) Vérification<br />
Équations à équilibrer<br />
___1__N2(g) + __3__ H2(g) __2___ NH3(g)<br />
___4___Fe(s) + ___3___ O2(g) ___2____ Fe2O3(s)<br />
___1___C2H5OH(l) + __3__O2(g) __2___CO2(g) + __3__H2O(l)<br />
___2__C2H2(g) + __5___O2(g) __4___CO2(g)<br />
Équilibrage par la méthode (p-441)<br />
+ ___2__H2O(l)<br />
______N2(g) + 3 H2(g) → __2___ NH3(g)<br />
N H<br />
N H<br />
H<br />
H<br />
H<br />
H<br />
Nbr<br />
d’atomes<br />
(Réactifs)<br />
2N<br />
6H<br />
4Fe<br />
6O<br />
7O<br />
2C<br />
6H<br />
4C<br />
4H<br />
10O<br />
Nbr<br />
d’atomes<br />
(Produits)<br />
14<br />
2N<br />
6H<br />
4Fe<br />
6O<br />
7O<br />
2C<br />
6H<br />
4C<br />
4H<br />
10O
COMPLÉMENT D’INFORMATION POUR LES SÉANCES DE LABORATOIRE<br />
Les chiffres significatifs et l’incertitude sur une mesure<br />
ASSIGNATION D’UNE INCERTITUDE<br />
Type d’instrument Exemples<br />
Règle, thermomètre, cylindre<br />
L’incertitude absolue est<br />
égale à …<br />
Instruments à graduations<br />
gradué, balance à plateau<br />
supérieur du labo<br />
± la ½ de la plus petite<br />
division<br />
Instruments à affichage<br />
numérique<br />
Balance analytique du labo, pH<br />
mètre<br />
Affichage balance analytique : 2,965 g<br />
± 1 sur le chiffre le plus précis<br />
(à condition que la lecture soit<br />
stable)<br />
CHIFFRES SIGNIFICATIFS => 3 chiffres certains + 1 chiffre incertain => 4 C.S.<br />
(Chiffres certains + un incertain)<br />
Voir méthodologie p-432 à 434 au besoin.<br />
DONC<br />
Nbr Inc Absolue Unité<br />
2,965 ± 0,001 g<br />
Important : toujours le même nombre de chiffres après la virgule que l’incertitude<br />
Exercice <strong>#1</strong><br />
Exemple de<br />
mesure<br />
Nombre de<br />
chiffres<br />
significatifs<br />
(C.S.)<br />
0,0020 m 1,30 µm 5000 g 5 x 10 3 g<br />
2 3 4 1<br />
PRÉCISION d’une mesure<br />
Plus il y a de chiffres significatifs C.S. plus la mesure est précise. (Même unité)<br />
EXACTITUDE d’une mesure<br />
Évaluation avec un % d’écart (Étalonnage d’un appareil = valeur de référence)<br />
±1 sur le dernier chiffre (peut être un 4 ou un 6)<br />
15
Exercice #2<br />
Deux appareils mesurent la pression à un même endroit. Les mesures de pression sont stables. Voici les deux<br />
affichages :<br />
A) Indiquer le nombre de chiffres significatifs (C.S.) pour chaque appareil.<br />
Appareil <strong>#1</strong><br />
20,543 kPa<br />
Appareil #2<br />
21,0 kPa<br />
Nbr de C.S. 5 C.S. 3 C.S.<br />
Choix de réponse pour B et C (Appareil <strong>#1</strong>, Appareil #2 et impossible de répondre)<br />
B) Indiquer quel appareil est le plus précis et expliquer brièvement pourquoi?<br />
Appareil <strong>#1</strong> (Il y a plus de chiffres significatifs).<br />
Comparaison effectuée avec le même type d’unité (kPa)<br />
C) Indiquer quel appareil est le plus exact et expliquer brièvement pourquoi?<br />
Impossible de répondre.<br />
Il n’y a pas de rapport d’étalonnage ou de % d’écart dans les données. A vérifier.<br />
16
Convention d’arrondissement<br />
Ne s’applique QUE lorsqu’il n’y a qu’une opération associée à un calcul.<br />
NE PAS UTILISER AU LABORATOIRE (toujours 4 C.S. dans les calculs et tableaux)<br />
Addition / soustraction<br />
Multiplication / division<br />
• La réponse a le même nombre de décimale (chiffres après la virgule) que la<br />
donnée la moins précise.<br />
• La réponse doit contenir le même nombre de chiffres significatifs (C.S.) que la<br />
donnée qui en contient le moins.<br />
Exemple avec des calculs de conversion d’échelles de température<br />
⎛ 9 ⎞<br />
° F = ⎜ • ___ ° C ⎟ + 32<br />
⎝ 5 ⎠<br />
Transformer la température du corps de 37°C en Fahrenheit?<br />
⎛ 9 ⎞<br />
⎜37 • ⎟ + 32 = 98,6°<br />
F<br />
⎝ 5 ⎠<br />
devient 99°F<br />
( ) et 5<br />
° C = ° F − 32 •<br />
9<br />
17
Équivalences :<br />
RAPPEL Les unités du système international (SI)<br />
Grandeur Unité de mesure Symbole<br />
Longueur mètre m<br />
Volume litre L<br />
Masse gramme g<br />
Température<br />
Celcius<br />
Kelvin<br />
Quantité de matière mole mole<br />
TKelvin = TCelcius<br />
+<br />
Pression pascal Pa<br />
Énergie joule J<br />
273<br />
Préfixe Symbole Valeur<br />
°C<br />
K<br />
Notation<br />
scientifique<br />
Giga G 1 000 000 000 10 9<br />
Méga M 1 000 000 10 6<br />
Kilo k 1 000 10 3<br />
Hecto h 100 10 2<br />
Déca da 10 10 1<br />
Déci d 0,1 10 -1<br />
Centi c 0,01 10 -2<br />
Milli m 0,001 10 -3<br />
Micro µ 0,000 001 10 -6<br />
Nano n 0,000 000 001 10 -9<br />
Pico p 0,000 000 000 001 10 -12<br />
1<br />
18
SHARP EL-W516<br />
B) L’antilog<br />
Ex : Le calcul de la [H + ] en partant d’un pH<br />
pH log[ H ]<br />
+<br />
= −<br />
10 10<br />
− pH −2,3<br />
Utilisation de la calculatrice - RAPPEL<br />
A) La notation scientifique<br />
Toujours remplacer X10 par la touche<br />
Exemple (Navogadro)<br />
6,022 (touche Exp) 23 = 6,022 X 10 23<br />
Autre possibilité<br />
6,022 X 10 (touche y x ) 23 = 6,022 X 10 23<br />
ERREUR (NE PAS FAIRE)<br />
6,022 (touche y x ) 23 = 8,59 X 10 17 ≠ 6,022 X 10 23<br />
= 10 (touche y x ) 2,3 (touche +/-) (touche =) Rép :5,01 X 10 -3 M<br />
C) Les notations FIX, SCI et ENG<br />
10 2,3<br />
Transformer 0,055 moles en notation<br />
• FIX Notation standard (fixe)<br />
• SCI Notation scientifique<br />
• ENG Notation ingénierie (X10 -3 , X10 -6 , X10 -9 , etc.)<br />
1) Entrer la valeur et la touche ÉGAL<br />
0,055 (touche =)<br />
2) (touche 2ndF - SET UP)<br />
3) (touche FSE)<br />
4) Sélectionner la notation désirée<br />
Fixed Tab Setting Tab (0-9) = Nombre de chiffres<br />
désirés (Choisir un nombre approprié : Ex : 9 le<br />
maximum)<br />
Réponses :<br />
FIX 0,055 moles<br />
SCI 5,5 X 10 -2 moles<br />
ENG 55 X 10 -3 moles = 55 mmoles<br />
19
Exercices<br />
A) LA NOTATION SCIENTIFIQUE<br />
Déterminer le nombre d’atomes dans 0,275 moles d’atomes<br />
Navogadro= 6,022 X10 23<br />
23<br />
6,022 X10 atomes<br />
23<br />
Nombre d’atomes :____ 0,275mole • = 1,66 X10 atomes<br />
mole<br />
B) L’ANTILOG<br />
Soit un pH de 2,3 calculer la [H + ]<br />
pH=-log[H + ] et 10 -pH =[H + ]<br />
[H + ]=10 -2,3 = 5,01X10 -3 M = 5,01 mM<br />
C) Les notations FIX, SCI et ENG<br />
Transformer les quantités suivantes en notation scientifique. Transformer ensuite ces valeurs en utilisant le<br />
préfixe du système international approprié (m, µ ou n)<br />
Notation scientifique Préfixe approprié du SI<br />
0,0000792 Litre 7,92 X 10 -5 L 79,2 µL<br />
0,0027 moles 2,7 X 10 -3 mole 2,7 mmoles<br />
0,000 000 000 254 3 gramme 2,543 X 10 -10 g 0,2543 ng<br />
20