You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
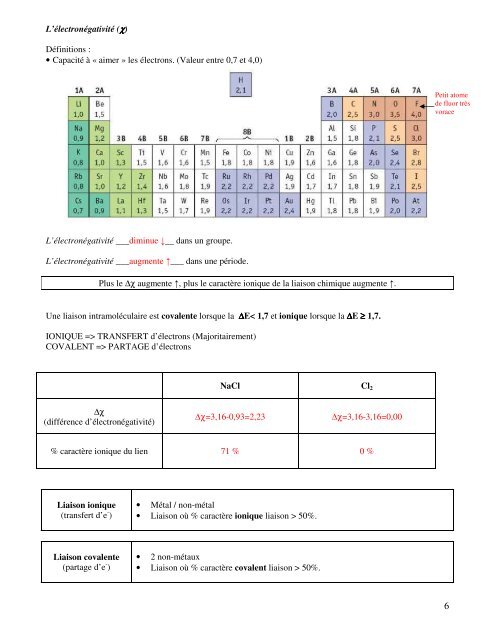
L’électronégativité (χχχχ)<br />
Définitions :<br />
• Capacité à « aimer » les électrons. (Valeur entre 0,7 et 4,0)<br />
L’électronégativité ___diminue ↓__ dans un groupe.<br />
L’électronégativité ___augmente ↑___ dans une période.<br />
Plus le ∆χ augmente ↑, plus le caractère ionique de la liaison chimique augmente ↑.<br />
Une liaison intramoléculaire est covalente lorsque la ∆E< 1,7 et ionique lorsque la ∆E ≥ 1,7.<br />
IONIQUE => TRANSFERT d’électrons (Majoritairement)<br />
COVALENT => PARTAGE d’électrons<br />
∆χ<br />
(différence d’électronégativité)<br />
% caractère ionique du lien<br />
Liaison ionique<br />
(transfert d’e - )<br />
Liaison covalente<br />
(partage d’e - )<br />
NaCl Cl2<br />
∆χ=3,16-0,93=2,23 ∆χ=3,16-3,16=0,00<br />
71 % 0 %<br />
• Métal / non-métal<br />
• Liaison où % caractère ionique liaison > 50%.<br />
• 2 non-métaux<br />
• Liaison où % caractère covalent liaison > 50%.<br />
Petit atome<br />
de fluor très<br />
vorace<br />
6