exoM2 - Chimie PC - Lycée Descartes - Tours
exoM2 - Chimie PC - Lycée Descartes - Tours
exoM2 - Chimie PC - Lycée Descartes - Tours
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
Exercices MathSpé <strong>PC</strong> 2012-2013<br />
Chapitre M.2 et M.3 :<br />
Les diagrammes Intensité-Potentiel<br />
métallurgie et corrosion<br />
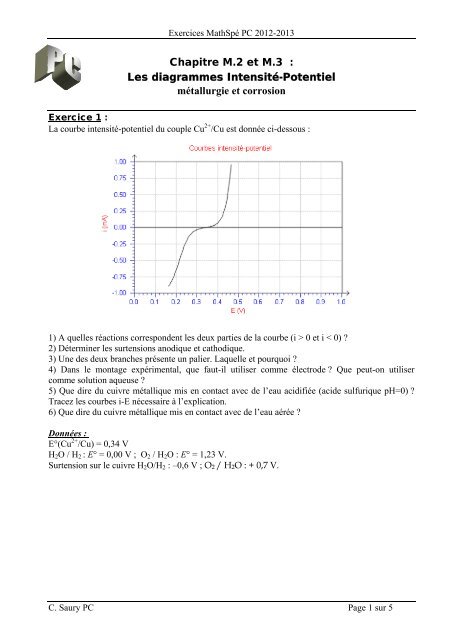
Exercice 1 :<br />
La courbe intensité-potentiel du couple Cu 2+ /Cu est donnée ci-dessous :<br />
1) A quelles réactions correspondent les deux parties de la courbe (i > 0 et i < 0) ?<br />
2) Déterminer les surtensions anodique et cathodique.<br />
3) Une des deux branches présente un palier. Laquelle et pourquoi ?<br />
4) Dans le montage expérimental, que faut-il utiliser comme électrode ? Que peut-on utiliser<br />
comme solution aqueuse ?<br />
5) Que dire du cuivre métallique mis en contact avec de l’eau acidifiée (acide sulfurique pH=0) ?<br />
Tracez les courbes i-E nécessaire à l’explication.<br />
6) Que dire du cuivre métallique mis en contact avec de l’eau aérée ?<br />
Données :<br />
E°(Cu 2+ /Cu) = 0,34 V<br />
H2O / H2 : E° = 0,00 V ; O2 / H2O : E° = 1,23 V.<br />
Surtension sur le cuivre H2O/H2 : –0,6 V ; O2 / H2O : + 0,7 V.<br />
C. Saury <strong>PC</strong> Page 1 sur 5
Exercices MathSpé <strong>PC</strong> 2012-2013<br />
Exercice 2 : Electrolyse E3A <strong>PC</strong> 2008<br />
La solution à électrolyser renferme de l’acide sulfurique (considéré comme un diacide fort),<br />
du sulfate de cobalt et du sulfate de cuivre (qui seront supposés entièrement dissociés).<br />
Avant de réaliser l’électrolyse proprement dite, le cuivre est éliminé par cémentation du<br />
cuivre par le fer (opération durant laquelle la solution est chauffée au contact de la poudre de fer<br />
sous agitation et contrôle du pH).<br />
1*a. Quelle est la signification du mot cémentation ? Dans quel(s) cas est-elle généralement<br />
employée ?<br />
1*b. Ecrire l’équation-bilan de la réaction de cémentation.<br />
Calculer la constante d’équilibre de cette réaction à 298 K. Conclure.<br />
L’électrolyse est réalisée dans une cuve en ciment revêtue de PVC, en maintenant une<br />
température constante entre une anode (A) en graphite et une cathode (C) en aluminium. Le pH de<br />
l’électrolyte est stabilisé à une valeur de 3. Une circulation de l’électrolyte est assurée dans la<br />
cuve.<br />
La solution initiale à électrolyser ne renferme plus d’ions Fe 2+ et contient CoSO4,7H2O à la<br />
concentration massique de 50 g.L -1 .<br />
Pour simplifier, les calculs de potentiels seront réalisés dans les conditions standard à<br />
25°C, excepté pour les concentrations en H3O + et Co 2+ qui seront celles de l’électrolyse (pH = 3).<br />
2*a. Quelles sont les réactions chimiques pouvant apparaître à l’anode et à la cathode, sachant<br />
que l’intervention de l’ion sulfate n’est pas prise en compte ?<br />
Préciser pour chacune d’elles, la valeur théorique des potentiels d’électrodes.<br />
2*b. Quelles sont les réactions les plus favorisées thermodynamiquement à l’anode et à la<br />
cathode ? Quelle tension minimum faut-il appliquer pour obtenir une électrolyse ?<br />
Pour récupérer du cobalt métal, il convient de considérer les aspects cinétiques.<br />
2*c. Représenter schématiquement, en tenant compte des surtensions, l’allure des courbes<br />
intensité-potentiel correspondantes (il est précisé que le couple H3O + /H2 est très lent sur<br />
l’aluminium et que le tracé correspondant possède une pente beaucoup plus faible que celle<br />
des autres couples).<br />
2*d. Ecrire l’équation-bilan de la réaction d’électrolyse permettant de récupérer du cobalt.<br />
La chute ohmique relative aux électrodes et à l’électrolyte s’élève à 1,1 V.<br />
3*a. Déterminer la tension minimale de fonctionnement de la cuve d’électrolyse.<br />
L’électrolyse est réalisée sous une tension de 3,5 V avec une intensité de 10 kA, et une<br />
densité de courant j de 400 A.m -2 .<br />
3*b. Calculer la masse théorique de cobalt métal obtenue à l’issue d’un jour d’électrolyse ?<br />
La masse de cobalt réellement obtenue journellement s’élève seulement à 256 kg.<br />
3*c. Définir puis calculer le rendement faradique. Expliquer, à l’aide des courbes intensitépotentiel<br />
précédemment tracées, pourquoi ce rendement ne peut atteindre 100% .<br />
3*d. Déterminer la consommation massique d’énergie, exprimée en kJ.kg -1 (énergie nécessaire<br />
pour déposer un kilogramme de cobalt).<br />
Données électrochimiques :<br />
Potentiels standard d'oxydoréduction à 298 K classés par ordre croissant :<br />
Couple Fe 2+ /Fe Co 2+ /Co H3O + /H2(g) Cu 2+ /Cu O2(g)/H2O<br />
E°(V) - 0,44 - 0,29 0,00 0,34 1,23<br />
C. Saury <strong>PC</strong> Page 2 sur 5
Exercices MathSpé <strong>PC</strong> 2012-2013<br />
RT ln10<br />
0,060 V (à 298 K)<br />
F<br />
Constante de Faraday : F 96 500 C.mol -1 Surtensions aux électrodes :<br />
.<br />
C(H2) , sur Al : - 0,1 V C(Co) , sur Al : - 0,1 V a(O2) , sur graphite : 0,7 V<br />
Exercice 3 : corrosion humide du cuivre (E3A MP 2009)<br />
Deux électrodes, l'une de fer et l'autre de cuivre sont mises en court-circuit et plongent dans<br />
une solution acide. On ajoute dans cette solution un peu d'orthophénanthroline qui donne un<br />
complexe rose avec les ions Fe 2+.<br />
a- A partir des données thermodynamiques (potentiels redox standards donnés en introduction),<br />
expliquer l'expérience en écrivant les réactions aux électrodes et prévoir si la solution rosit.<br />
b- Quel type de montage électrochimique a-t-on simplement réalisé?<br />
c- Interpréter cette réaction de corrosion à l'aide de courbes intensité-potentiel. Qu'appelle-t-on le<br />
potentiel de corrosion de ce système?<br />
d- Dans le montage précédent, on remplace l'électrode de cuivre par une électrode de zinc. Décrire<br />
les réactions. Quel est le rôle du fer ?<br />
e- Classer les trois métaux cuivre, fer et zinc par ordre d'électropositivité. Conclure sur la nature<br />
générale du métal à allier au fer pour éviter la corrosion de celui-ci. Citer des exemples<br />
d'applications.<br />
-Potentiels standards d'oxydoréduction à T = 298K, P0 = 1,0 bar, pH = 0 :<br />
E°(Cu + / Cu) = 0,52 V ; E°(Cu 2+ / Cu) = 0,34 V ; E°(Cu 2+ / Cu + ) = 0,16 V ;<br />
E°(Fe 2+ / Fe) = - 0,44 V ; E°(Zn 2+ / Zn) = - 0,76 V ;<br />
E°(O2 / H2O) = 1,23 V ; E°(H2O / H2 ) = 0,0 V.<br />
On prendra : RT / F = 0,0257 V et (RT / F) Ln(10) = 0,059 V pour T = 298K<br />
Exercice 4 : Préparation du dichlore (Mines Ponts PSI 2003)<br />
Le dichlore est produit par électrolyse d’une solution aqueuse concentrée de chlorure de sodium (la<br />
saumure). Celle-ci doit être traitée préalablement à l’aide de carbonate ou de chlorure de baryum<br />
afin d’éliminer les ions sulfates, puis à l’aide de soude et de carbonate de sodium pour éliminer les<br />
ions calcium, magnésium et autres ions métalliques gênants.<br />
On étudie ici le procédé des cellules à membranes,<br />
1) D’après les valeurs des potentiels standard, quelles sont les demi-équations<br />
d’oxydoréduction possibles à l’anode ? à la cathode ?<br />
2) A quelle réaction d’oxydoréduction pourrait-on s’attendre au cours de l’électrolyse en<br />
l’absence de surtension au niveau des électrodes ? Calculer la constante d’équilibre de cette<br />
réaction.<br />
Un schéma de principe d’une cellule à membrane, à compléter, est représenté ci-après :<br />
saumure diluée<br />
vers concentration<br />
saumure<br />
saturée<br />
1<br />
membrane<br />
vers circuit de<br />
concentration<br />
C. Saury <strong>PC</strong> Page 3 sur 5<br />
5<br />
7<br />
2 3<br />
6<br />
4<br />
8<br />
H2O
Exercices MathSpé <strong>PC</strong> 2012-2013<br />
Les anodes sont de type DSA (Dimensionally Stables Anodes) en titane recouvert d’oxydes<br />
de titane et de ruthénium, les cathodes sont en nickel. La séparation entre les compartiments<br />
cathodiques et anodiques est constituée de membranes cationiques (perméables aux cations) très<br />
peu conductrices. Ces membranes sont des polymères perfluorosulfoniques ( Nafion ® ) ou<br />
perfluorocarboxyliques (Flemion ® ).<br />
Na<br />
On obtient les courbes densité de courant-potentiel suivantes :<br />
Na +<br />
H2<br />
–1<br />
H2O<br />
0 1<br />
3) Quelle est la réaction qui a effectivement lieu dans ce procédé pour une valeur de densité de<br />
courant n’excédant pas les limites du tracé des courbes ?<br />
4) A l’aide des courbes densité de courant-potentiel, donner un nom à chacune des cases<br />
numérotées de 1 à 8 du schéma de principe.<br />
La densité de courant j utilisée dans ce procédé est égale à 4 kA.m –2 .<br />
5) Pourquoi préfère-t-on utiliser la densité de courant plutôt que l’intensité ? Quelle est la<br />
valeur de la tension appliquée aux bornes de l’électrolyseur pour ce procédé ?<br />
Le dichlore produit sort des cellules à 90 °C. Il est saturé en vapeur d’eau. Il est donc refroidi<br />
(condensation de la majeure partie de la vapeur d’eau) puis séché avec de l’acide sulfurique<br />
concentré dans des tours à garnissage. Le dichlore est transporté liquéfié, comprimé à 3,5 bar.<br />
Potentiels standard E° à 25°C et à pH = 0<br />
E°(O2/H2O) = 1,23 V E°(Cl2/Cl – ) = 1,39 V E°(H + /H2) = 0,00 V E°(Na + /Na) = –2,71 V<br />
E (V)<br />
C. Saury <strong>PC</strong> Page 4 sur 5<br />
5<br />
j (kA.m –2 )<br />
Cl –<br />
Cl2<br />
OH –<br />
O2
Exercices MathSpé <strong>PC</strong> 2012-2013<br />
Exercice 5 : Corrosion uniforme du zinc (Centrale PSI 2003)<br />
1) Donner l’allure de la courbe densité de courant - potentiel (j-E) pour l’oxydation et la réduction<br />
du couple Zn 2+ /Zn. Ce couple est rapide. Le potentiel standard du couple Zn 2+ /Zn est égal à -<br />
0,76 V et on prendra la concentration initiale d’ions zinc II égale à .1 mol/L.<br />
2) La courbe intensité-potentiel du couple H + /H2 dépend-elle du métal de l’électrode utilisée ?<br />
Expliquez succinctement pourquoi.<br />
3) On envisage l’oxydation du zinc par les ions H + . Écrire l’équation de la réaction. Que peut-on<br />
dire de cette oxydation par des considérations thermodynamiques ?<br />
Pour des valeurs suffisamment importantes de la valeur absolue de la densité de courant anodique<br />
│ja│ (respectivement de la valeur absolue de la densité de courant cathodique │jc│), on peut écrire<br />
:<br />
│ja│=Aa exp(baE) et │jc│= -Ac exp(-bc E)<br />
La constante ba (resp. bc) est positive et caractéristique de l’oxydant (resp. du réducteur). Les<br />
constantes Aa et Ac sont positives et dépendent en outre des activités de l’oxydant ou du réducteur.<br />
4) On envisage un phénomène de corrosion uniforme, observée quand une lame de zinc trempe<br />
dans une solution acide. On admet alors que les surfaces d’électrodes sont égales pour l’oxydation<br />
et la réduction.<br />
a) Quelle est la relation entre les intensités anodiques et cathodiques ? Que peut-on en déduire pour<br />
les densités de courant anodiques et cathodiques ?<br />
b) Une étude expérimentale a permis d’obtenir les lois suivantes, reliant la densité de courant (en<br />
A/cm) et le potentiel d’électrode (en V) mesuré par rapport à l’électrode de référence , (log<br />
symbolise le logarithme à base 10) :<br />
- oxydation du zinc : E = 0,0774 log(ja)-0,1956<br />
- réduction H + de sur zinc : E = -0,0780 log(│jc│) -0,778<br />
Calculer la densité de courant de corrosion uniforme jcorr.et le potentiel de corrosion Ecorr.<br />
c) La vitesse de corrosion vcorr. est mesurée en m par année. Exprimer littéralement vcorr.en<br />
fonction de jcorr., de la constante de Faraday F, de la masse molaire atomique du zinc M(Zn) et de sa<br />
masse volumique .<br />
d) Calculer numériquement vcorr..<br />
On donne : M(Zn) = 65,4 g/mol<br />
(Zn) = 7140 kg/m 3 et F = 96490 C/mol<br />
C. Saury <strong>PC</strong> Page 5 sur 5