le journal du réseau cancer de l'université libre de bruxelles le ...
le journal du réseau cancer de l'université libre de bruxelles le ...
le journal du réseau cancer de l'université libre de bruxelles le ...
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
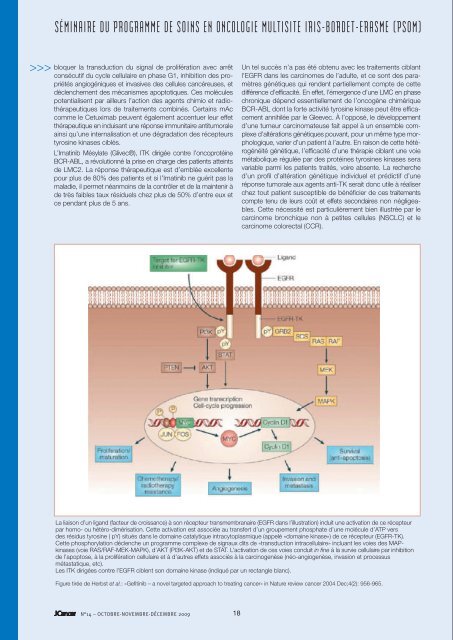
SÉMINAIRE DU PROGRAMME DE SOINS EN ONCOLOGIE MULTISITE IRIS-BORDET-ERASME (PSOM)>>>bloquer la trans<strong>du</strong>ction <strong>du</strong> signal <strong>de</strong> prolifération avec arrêtconsécutif <strong>du</strong> cyc<strong>le</strong> cellulaire en phase G1, inhibition <strong>de</strong>s propriétésangiogéniques et invasives <strong>de</strong>s cellu<strong>le</strong>s cancéreuses, etdéc<strong>le</strong>nchement <strong>de</strong>s mécanismes apoptotiques. Ces molécu<strong>le</strong>spotentialisent par ail<strong>le</strong>urs l’action <strong>de</strong>s agents chimio et radiothérapeutiqueslors <strong>de</strong> traitements combinés. Certains mAccomme <strong>le</strong> Cetuximab peuvent éga<strong>le</strong>ment accentuer <strong>le</strong>ur effetthérapeutique en in<strong>du</strong>isant une réponse immunitaire antitumora<strong>le</strong>ainsi qu’une internalisation et une dégradation <strong>de</strong>s récepteurstyrosine kinases ciblés.L’Imatinib Mésylate (Glivec®), ITK dirigée contre l’oncoprotéineBCR-ABL, a révolutionné la prise en charge <strong>de</strong>s patients atteints<strong>de</strong> LMC2. La réponse thérapeutique est d’emblée excel<strong>le</strong>ntepour plus <strong>de</strong> 80% <strong>de</strong>s patients et si l’Imatinib ne guérit pas lamaladie, il permet néanmoins <strong>de</strong> la contrô<strong>le</strong>r et <strong>de</strong> la maintenir à<strong>de</strong> très faib<strong>le</strong>s taux rési<strong>du</strong>els chez plus <strong>de</strong> 50% d’entre eux etce pendant plus <strong>de</strong> 5 ans.Un tel succès n’a pas été obtenu avec <strong>le</strong>s traitements ciblantl’EGFR dans <strong>le</strong>s carcinomes <strong>de</strong> l’a<strong>du</strong>lte, et ce sont <strong>de</strong>s paramètresgénétiques qui ren<strong>de</strong>nt partiel<strong>le</strong>ment compte <strong>de</strong> cettedifférence d’efficacité. En effet, l’émergence d’une LMC en phasechronique dépend essentiel<strong>le</strong>ment <strong>de</strong> l’oncogène chimériqueBCR-ABL dont la forte activité tyrosine kinase peut être efficacementannihilée par <strong>le</strong> G<strong>le</strong>evec. À l’opposé, <strong>le</strong> développementd’une tumeur carcinomateuse fait appel à un ensemb<strong>le</strong> comp<strong>le</strong>xed’altérations génétiques pouvant, pour un même type morphologique,varier d’un patient à l’autre. En raison <strong>de</strong> cette hétérogénéitégénétique, l’efficacité d’une thérapie ciblant une voiemétabolique régulée par <strong>de</strong>s protéines tyrosines kinases seravariab<strong>le</strong> parmi <strong>le</strong>s patients traités, voire absente. La recherched’un profil d’altération génétique indivi<strong>du</strong>el et prédictif d’uneréponse tumora<strong>le</strong> aux agents anti-TK serait donc uti<strong>le</strong> à réaliserchez tout patient susceptib<strong>le</strong> <strong>de</strong> bénéficier <strong>de</strong> ces traitementscompte tenu <strong>de</strong> <strong>le</strong>urs coût et effets secondaires non négligeab<strong>le</strong>s.Cette nécessité est particulièrement bien illustrée par <strong>le</strong>carcinome bronchique non à petites cellu<strong>le</strong>s (NSCLC) et <strong>le</strong>carcinome colorectal (CCR).La surexpression <strong>de</strong> l’EGFR dans 50% <strong>de</strong>s NSCLC fait <strong>de</strong> cerécepteur une cib<strong>le</strong> thérapeutique idéa<strong>le</strong> chez <strong>le</strong>s patients présentantune tumeur au sta<strong>de</strong> avancé et réfractaire à la chimiothérapie.Des réponses objectives aux ITK ciblant l’EGFR (<strong>le</strong>gefinitib et l’erlotinib) ne surviennent cependant que chez 10%<strong>de</strong>s patients, mais ces réponses s’observent essentiel<strong>le</strong>ment chez<strong>de</strong>s patients non fumeurs, <strong>de</strong> sexe féminin, d’origine asiatique etatteints d’un adénocarcinome <strong>de</strong> sous-type bronchioalvéolaire 3 .L’étu<strong>de</strong> moléculaire <strong>de</strong> ces tumeurs bronchiques a ensuiterévélé que la gran<strong>de</strong> majorité <strong>de</strong>s répon<strong>de</strong>urs exhibent <strong>de</strong>smutations activatrices <strong>du</strong> site catalytique <strong>de</strong> l’EGFR au niveau<strong>de</strong>s exons 18 à 21 (mutation ponctuel<strong>le</strong>, délétion ou insertionnucléotidiques observées chez environ 80% <strong>de</strong>s patients répon<strong>de</strong>urs),faisant <strong>de</strong> ce profil mutationnel un facteur prédictif <strong>de</strong>la réponse aux ITK. Cette bonne réponse peut s’expliquer parune meil<strong>le</strong>ure sensibilité <strong>de</strong> l’EGFR muté aux ITK; l'inhibitionétant atteinte avec <strong>de</strong>s doses thérapeutiques 10 à 100 fois inférieuresà cel<strong>le</strong>s nécessaires pour <strong>le</strong> récepteur normal. El<strong>le</strong> estéga<strong>le</strong>ment liée à la «dépendance oncogénique», phénomène par<strong>le</strong>quel la prolifération, mais surtout la survie d’une cellu<strong>le</strong> tumora<strong>le</strong>vont entièrement dépendre <strong>de</strong> la seu<strong>le</strong> voie activée par la mutationoncogénique, et <strong>le</strong> simp<strong>le</strong> blocage <strong>de</strong> cette voie déc<strong>le</strong>ncheraune apoptose tumora<strong>le</strong> marquée.À l’opposé, l’absence <strong>de</strong> réponse tumora<strong>le</strong> aux ITK est associéeà la présence d’une mutation <strong>du</strong> gène K-RAS observée chezà peu près 20% <strong>de</strong>s patients fumeurs 4 . K-RAS constitue uneprotéine intermédiaire dans la voie <strong>de</strong> signalisation initiée enamont par l’EGFR et agit comme «commutateur moléculaire»dans <strong>le</strong> recrutement et l’activation <strong>de</strong>s protéines MAP kinasesnécessaires à la propagation <strong>de</strong>s signaux <strong>de</strong> prolifération <strong>du</strong>cytoplasme vers <strong>le</strong> noyau. Une mutation activatrice <strong>de</strong> K-RAS(mutation ponctuel<strong>le</strong> au niveau <strong>de</strong>s codons 12, 13 ou plus rarement61 <strong>de</strong> l’exon 2) in<strong>du</strong>ira une stimulation permanente <strong>de</strong>sMAP-kinases, court-circuitant la fonction <strong>de</strong> l’EGFR et rendantinefficace toute thérapie ciblant ce récepteur.Son inci<strong>de</strong>nce é<strong>le</strong>vée dans <strong>le</strong> CCR métastatique (environ 50%<strong>de</strong>s cas) contribue au faib<strong>le</strong> succès <strong>de</strong>s mAC comme <strong>le</strong> Cetuximabou <strong>le</strong> Panitumumab dans <strong>le</strong> traitement d’un <strong>cancer</strong> connupour surexprimer l’EGFR. La mutation K-RAS constitue donc unpuissant paramètre moléculaire prédictif d’une résistance <strong>de</strong>novo à la thérapie anti-EGFR, et son i<strong>de</strong>ntification au sein <strong>de</strong> latumeur est <strong>de</strong>venue une pratique obligatoire chez tout patientpouvant potentiel<strong>le</strong>ment bénéficier <strong>de</strong> cette thérapie 5 .En conclusion, <strong>le</strong>s altérations génétiques <strong>de</strong>s TK dans <strong>le</strong>s <strong>cancer</strong>sconstituent <strong>de</strong>s marqueurs diagnostiques mais éga<strong>le</strong>ment<strong>de</strong>s cib<strong>le</strong>s thérapeutiques privilégiées. Compte tenu <strong>de</strong> <strong>le</strong>urscoût et effets secondaires non négligeab<strong>le</strong>s, l’optimalisation <strong>de</strong>straitements ciblant <strong>le</strong>s TK passe néanmoins par l’étu<strong>de</strong> <strong>du</strong> profild’altération génétique indivi<strong>du</strong>el et prédictif <strong>de</strong> la réponse tumora<strong>le</strong>chez tout patient susceptib<strong>le</strong> d’en bénéficier. ■Références1. Ciar<strong>de</strong>llo F, Tortora G., N Engl J Med 2008;358 (11):1160-74.2. Druker BJ et al., N Engl J Med. 2006; Dec 7;355 (23):2408-17.3. Sharma SV et al., Nat Rev Cancer 2007;7 (3):169-81.4. Linardou H et al., Lancet Oncol. 2008; Oct 9 (10):962-72.5. van Krieken JH et al., Virchows Arch. 2009; Feb;454(2):233-5.La liaison d’un ligand (facteur <strong>de</strong> croissance) à son récepteur transmembranaire (EGFR dans l’illustration) in<strong>du</strong>it une activation <strong>de</strong> ce récepteurpar homo- ou hétéro-dimérisation. Cette activation est associée au transfert d’un groupement phosphate d’une molécu<strong>le</strong> d’ATP vers<strong>de</strong>s rési<strong>du</strong>s tyrosine ( pY) situés dans <strong>le</strong> domaine catalytique intracytoplasmique (appelé «domaine kinase») <strong>de</strong> ce récepteur (EGFR-TK).Cette phosphorylation déc<strong>le</strong>nche un programme comp<strong>le</strong>xe <strong>de</strong> signaux dits <strong>de</strong> «trans<strong>du</strong>ction intracellulaire» incluant <strong>le</strong>s voies <strong>de</strong>s MAPkinases(voie RAS/RAF-MEK-MAPK), d’AKT (PI3K-AKT) et <strong>de</strong> STAT. L’activation <strong>de</strong> ces voies con<strong>du</strong>it in fine à la survie cellulaire par inhibition<strong>de</strong> l’apoptose, à la prolifération cellulaire et à d’autres effets associés à la carcinogenèse (néo-angiogenèse, invasion et processusmétastatique, etc).Les ITK dirigées contre l’EGFR cib<strong>le</strong>nt son domaine kinase (indiqué par un rectang<strong>le</strong> blanc).Figure tirée <strong>de</strong> Herbst et al.: «Gefitinib – a novel targeted approach to treating <strong>cancer</strong>» in Nature review <strong>cancer</strong> 2004 Dec;4(2): 956-965.N°14 – OCTOBRE-NOVEMBRE-DÉCEMBRE 2009 1819N°14 – OCTOBRE-NOVEMBRE-DÉCEMBRE 2009