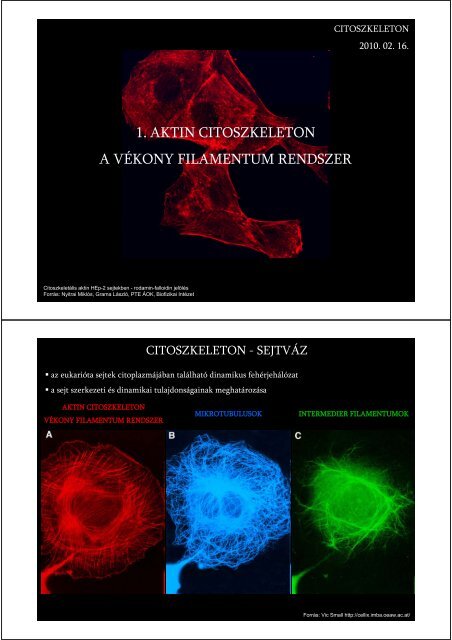
1. aktin citoszkeleton a vékony filamentum rendszer - Biofizikai Intézet
1. aktin citoszkeleton a vékony filamentum rendszer - Biofizikai Intézet
1. aktin citoszkeleton a vékony filamentum rendszer - Biofizikai Intézet
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
<strong>1.</strong> AKTIN CITOSZKELETON<br />
A VÉKONY FILAMENTUM RENDSZER<br />
Citoszkeletális <strong>aktin</strong> HEp-2 sejtekben - rodamin-falloidin jelölés<br />
Forrás: Nyitrai Miklós, Grama László, PTE ÁOK, <strong>Biofizikai</strong> <strong>Intézet</strong><br />
CITOSZKELETON - SEJTVÁZ<br />
az eukarióta sejtek citoplazmájában található dinamikus fehérjehálózat<br />
a sejt szerkezeti és dinamikai tulajdonságainak meghatározása<br />
AKTIN CITOSZKELETON<br />
VÉKONY FILAMENTUM RENDSZER<br />
CITOSZKELETON<br />
2010. 02. 16.<br />
MIKROTUBULUSOK INTERMEDIER FILAMENTUMOK<br />
Forrás: Vic Small http://cellix.imba.oeaw.ac.at/
AKTIN FEHÉRJE – IN VIVO<br />
Fluoreszcencia mikroszkópia - GFP-jelölt <strong>aktin</strong> (green fluorescent protein)<br />
Fibroblaszt<br />
AKTIN FEHÉRJE – IN VITRO<br />
Forrás: Vic Small http://cellix.imba.oeaw.ac.at/<br />
Teljes belső visszaverődésen alapuló fluoreszcencia mikroszkópia – Alexa488 SE-jelölt <strong>aktin</strong><br />
[Mg 2+ -ATP -G-<strong>aktin</strong>] = <strong>1.</strong>2 μM<br />
Egység: 10 μm<br />
v = 12.7 alegység/s<br />
Forrás: Barkó Sz. Bugyi B. és mtsai JBC 2010.
EUKARIÓTA<br />
IZOM SEJTEK<br />
izomösszehúzódás szabályozása<br />
NÖVÉNYEK<br />
organellum-, vezikula transzport<br />
exo-, endocitózis<br />
sejtciklus szabályozása<br />
AZ AKTIN FUNKCIONÁLIS SOKSZÍNŰSÉGE<br />
1887. W.D. Halliburton<br />
NEM-IZOM SEJTEK<br />
polaritás<br />
sejtmozgás<br />
LP<br />
LM<br />
SF<br />
intarcelluláris<br />
pathogének mozgása<br />
Arc<br />
FA<br />
FC<br />
?<br />
SEJTMAG<br />
transzkripció<br />
kromatin remodelling<br />
jelátvitel<br />
PROKARIÓTA<br />
FP<br />
ParM, MreB <strong>aktin</strong> homológ fehérjék<br />
sejtalak<br />
plazmid szegregáció<br />
alak, mechanikai stabilitás<br />
AZ AKTIN KUTATÁS MÉRFÖLDKÖVEI<br />
1942. Straub F. Brúnó<br />
Szent-Györgyi Albert kutatócsoportja,<br />
Szegedi Tudományegyetem<br />
1953. Abercrombie M.<br />
1954. Huxley AF.<br />
1974. Lazarides E., Weber K.<br />
1978. Taylor DL., Wang YL.<br />
1989–1996. Kron J., Spudich JA.<br />
1990. Kabsch, W. Holmes KC.<br />
1992 - 1998.<br />
200<strong>1.</strong> Jones LJ., van den Ent F.<br />
1999. Carlier MF.<br />
első kísérleti megfigyelés<br />
fehérje, mely jelenlétében a miozin koagulál<br />
<strong>aktin</strong> monomer 3D röntgendiffrakciós szerkezete<br />
az <strong>aktin</strong> <strong>filamentum</strong> 3D modellje<br />
prokarióta <strong>citoszkeleton</strong> felfedezése<br />
ParM, MreB <strong>aktin</strong>-homológ fehérjék<br />
az <strong>aktin</strong> alapú mozgás in vitro rekonstrukciója<br />
fagocitózis<br />
endocitózis<br />
endoszómák mozgása<br />
motorfehérjék vizsgálata in vitro motilitás esszével<br />
sejtosztódás<br />
kontraktilis gyűrű<br />
kromoszóma transzport<br />
az akto-miozin komplex felfedezése és leírása izom sejtekben<br />
a komplexben megnövekedett a miozin viszkozitása és<br />
kontraktilitása ACTIvatiNg<br />
nem-izom sejtek sejtmozgáshoz kapcsolódó <strong>aktin</strong> struktúráinak<br />
vizsgálata, a sejtmozgás mechanizmusa<br />
izomkontrakció mechanizmusa (sliding filament modell)<br />
<strong>aktin</strong> <strong>filamentum</strong>ok megjelenítése nem-izom sejtekben<br />
immunofluoreszcencia - stressz szálak<br />
mikroinjektált fluoreszcens jelölővel ellátott <strong>aktin</strong> - dinamika
első<br />
domén<br />
szubdomén 4<br />
szubdomén 3<br />
hegyes (-) vég<br />
*<br />
szöges (+) vég<br />
AKTIN MONOMER…<br />
C<br />
szubdomén 2<br />
N<br />
szubdomén 1<br />
külső<br />
domén<br />
… és FILAMENTUM<br />
hegyes (-) vég<br />
szöges (+) vég<br />
alegység (monomer):<br />
globuláris (G) <strong>aktin</strong><br />
MW: 42.3 kDa<br />
375 aminosav<br />
6.7 x 4 x 3 nm<br />
domén szerkezet<br />
* nagy affinitású kötőhely<br />
1 : 1 adenozin nukleotid (ATP/ADP)<br />
lassú ATPáz aktivitás: k = 0.6 h -1<br />
1 : 1 kétértékű kation<br />
Ca 2+<br />
Mg 2+ (in vivo)<br />
<strong>filamentum</strong>: filamentális (F) <strong>aktin</strong><br />
sz: 7-10 nm, h: μm<br />
szerkezeti polaritás: szöges/hegyes vég<br />
helikális szerkezet:<br />
jobbmenetes nagy/balmenetes kis<br />
menetemelkedésű hélix<br />
(37 nm / 2.75 nm )<br />
megnövekedett ATPáz aktivitás<br />
k hidrolízis = 0.02 s -1 –10 s -1<br />
k Pi kibocsátás = 0.006 s -1<br />
koncentráció:<br />
in vivo: 100 – 200 μM<br />
in vitro: 1 – 10 μM<br />
5.5 nm<br />
37 nm<br />
166 o
G: monomer<br />
POLIMER MENNYISÉG<br />
FILAMENTUM KÉPZŐDÉS - POLIMERIZÁCIÓ<br />
<strong>1.</strong> NUKLEÁCIÓ - LAG FÁZIS 2. ELONGÁCIÓ<br />
G + G ↔ G2<br />
dimer<br />
G2 + G ↔ G3<br />
trimer / nukleusz<br />
3. STEADY STATE / DINAMIKUS EGYENSÚLY<br />
hegyes vég<br />
1: lag fázis<br />
F-<strong>aktin</strong><br />
L = állandó<br />
G-<strong>aktin</strong>:=<br />
szöges vég<br />
G3 + G ↔ F<br />
<strong>filamentum</strong><br />
kritikus koncentráció<br />
…<br />
F N + G ↔ F N+1<br />
A monomerek a <strong>filamentum</strong> mindkét végén<br />
beépülnek (asszociáció) illetve leválnak<br />
(disszociáció)<br />
A <strong>filamentum</strong> hossza nem változik<br />
Kritikus koncentráció: az a szabad G-<strong>aktin</strong><br />
koncentráció, amely alatt a <strong>filamentum</strong> képződés<br />
folyamata nem indul meg<br />
in vitro<br />
in vivo<br />
A POLIMERIZÁCIÓ KINETIKÁJA<br />
3: G-<strong>aktin</strong> : F-<strong>aktin</strong> = állandó<br />
2: dF/dt = állandó<br />
IDŐ<br />
kritikus koncentráció<br />
0.1 – 0.6 μM<br />
~2 μM<br />
<strong>1.</strong> A nukleáció energetikailag kedvezőtlen folyamat az<br />
<strong>aktin</strong> dimerek/trimerek instabilitása miatt LAG<br />
fázis<br />
2. A <strong>filamentum</strong>ok növekedési sebessége:<br />
elongációs sebesség<br />
dF<br />
= k+<br />
Nc − k−N<br />
dt<br />
dF szöges hegyes<br />
szöges<br />
= ( k+<br />
+ k+<br />
) Nc − ( k−<br />
+ k−<br />
dt<br />
k + : asszociációs sebességi állandó<br />
k - : disszociációs sebességi állandó<br />
N : <strong>filamentum</strong> végek koncentrációja<br />
3. Egyensúlyban G-<strong>aktin</strong> : F-<strong>aktin</strong> = állandó<br />
[G-<strong>aktin</strong>] = kritikus koncentráció<br />
hegyes<br />
c : polimerizálható G-<strong>aktin</strong> koncentrációja<br />
c = c összes -c c<br />
asszociáció disszociáció<br />
) N<br />
szöges, hegyes : az F-<strong>aktin</strong> egyes végeire utal
*<br />
*nukleotid kötő zseb<br />
ATP + H 2O ↔ ADP + Pi + H -<br />
AZ AKTIN ATPáz AKTIVITÁSA …<br />
Standard szabad energia változás: ΔG 0’ = -7.3 kcal / mol<br />
ATP ADP<br />
Pi<br />
hidrolízis<br />
foszfát (Pi) kibocsátás<br />
G-<strong>aktin</strong>:<br />
ATPáz aktivitás<br />
sebességi állandó<br />
0.6 h -1<br />
hidrolízis = 0.02 – 10 s-1 Pi kibocsátás = 0.006 s-1 • Az <strong>aktin</strong> ATPáz aktivitása nem esszenciális a <strong>filamentum</strong> képződéshez F-<strong>aktin</strong>:<br />
• A <strong>filamentum</strong>ban az ATPáz aktivitás jelentősen megnövekszik<br />
• A <strong>filamentum</strong>ban az ATP hidrolízis/Pi kibocsátás a irreverzibilis és a <strong>filamentum</strong> destabilizációjához vezet<br />
… ÉS KÖVETKEZMÉNYE: TAPOSÓMALOM EGYENSÚLY<br />
ATP<br />
ADP-Pi<br />
ADP<br />
F-<strong>aktin</strong>: kinetikai polaritás, disszipatív polimer<br />
TAPOSÓMALOM EGYENSÚLY - TREADMILLING : Wegner 1976.<br />
F-<strong>aktin</strong>, μM<br />
Idő, min<br />
hidrolizált ATP, μM
…ÉS KÖVETKEZMÉNYE: TAPOSÓMALOM EGYENSÚLY<br />
ATP<br />
ADP-Pi<br />
ADP<br />
F-<strong>aktin</strong>: kinetikai polaritás, disszipatív polimer<br />
TREADMILLING – TAPOSÓMALOM EGYENSÚLY: Wegner 1976.<br />
k<br />
k<br />
hegyes vég<br />
hegyes<br />
+<br />
hegyes<br />
−<br />
= 2.<br />
9 μM<br />
−1<br />
= 5.<br />
4 s<br />
monomerek<br />
disszociációja<br />
DEPOLIMERIZÁCIÓ<br />
s<br />
−1<br />
−1<br />
ATP ADP<br />
Pi<br />
D T<br />
nukleotid csere<br />
k<br />
k<br />
in vitro<br />
in vivo<br />
szöges vég<br />
szöges<br />
+<br />
szöges<br />
−<br />
= 1<strong>1.</strong><br />
6 μM<br />
= <strong>1.</strong><br />
4 s<br />
−1<br />
monomerek<br />
asszociációja<br />
POLIMERIZÁCIÓ<br />
<strong>filamentum</strong> turnover<br />
1 μm / 30 min<br />
1 μm / 20 s<br />
…ÉS KÖVETKEZMÉNYE: TAPOSÓMALOM EGYENSÚLY<br />
szöges<br />
dF<br />
= k<br />
dt<br />
hegyes<br />
dF<br />
= k<br />
dt<br />
dF<br />
= k+<br />
Nc − k−N<br />
= 0<br />
dt<br />
k Nc = k N<br />
c<br />
+<br />
egyensúly<br />
dF<br />
dt<br />
dF<br />
dt<br />
−<br />
k<br />
=<br />
k<br />
> 0 : c<br />
< 0 : c<br />
szöges<br />
+<br />
hegyes<br />
+<br />
−<br />
+<br />
: = kritikus koncentráció<br />
egyensúly<br />
egyensúly<br />
Nc − k<br />
Egyensúlyban:<br />
Nc − k<br />
k<br />
><br />
k<br />
k<br />
<<br />
k<br />
szöges<br />
−<br />
hegyes<br />
−<br />
−<br />
+<br />
−<br />
+<br />
N<br />
N<br />
elongációs<br />
sebesség<br />
0<br />
c c szöges<br />
c<br />
c<br />
c c hegyes<br />
c egyensúly = c c<br />
szöges<br />
c<br />
hegyes<br />
c<br />
= 0.<br />
1 μM<br />
= 0.<br />
6 μM<br />
szöges vég<br />
hegyes vég<br />
[G-<strong>aktin</strong>]<br />
s<br />
−1<br />
−1
TAPOSÓMALOM EGYENSÚLY IN VIVO:<br />
az <strong>aktin</strong>-alapú mozgás esszenciális feltétele<br />
A perzisztenciahossz:<br />
- statisztikus távolság, amelyen belül a polimerlánc merevnek tekinthető, azaz a polimerlánc irány ezen a szakaszon<br />
állandó<br />
- a polimerlánc hajlítómerevségével áll összefüggésben: minél rövidebb Lp, annál hajlékonyabb a lánc és fordítva<br />
EI = hajlítómerevség<br />
E =Young modulus<br />
I = hajlítási tehetetlenségi nyomaték<br />
(körkeresztmetszetű rúd esetében I=r 4 π/4)<br />
k B =Boltzmann állandó<br />
T = abszolút hőmérséklet<br />
A FILAMENTUMOK MECHANIKÁJA<br />
Termikus (entrópikus) rugalmasság és perzisztencia hossz<br />
A citoszkeletális <strong>filamentum</strong>ok hosszú, láncszerű polimernek tekinthetők, amelyek a környezetükben lévő hőmozgást<br />
végző molekulákkal véletlenszerűen ütköznek. Ez a <strong>filamentum</strong>ok alakjának változását eredményezi.<br />
A polimerlánc alakja a random diffúziós Brown-féle mozgásra emlékeztet random lánc (random coil)<br />
L = kontúrhossz<br />
L p = EI<br />
k BT<br />
L p = perzisztenciahossz<br />
Z = vég-vég távolság<br />
F
típus<br />
merev<br />
szemiflexibilis<br />
flexibilis<br />
L p és L viszonya<br />
L p >> L<br />
L p ~ L<br />
L p













![Microsoft PowerPoint - Intermedier filamentumok [Kompatibilis m\363d]](https://img.yumpu.com/17119137/1/190x135/microsoft-powerpoint-intermedier-filamentumok-kompatibilis-m363d.jpg?quality=85)


