Kémia gyakorlat I. (BMEVESEAKM4)
Kémia gyakorlat I. (BMEVESEAKM4)
Kémia gyakorlat I. (BMEVESEAKM4)
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
<strong>Kémia</strong> <strong>gyakorlat</strong> I. (<strong>BMEVESEAKM4</strong>)<br />
Tantárgyprogram<br />
2009/2010. ıszi félév<br />
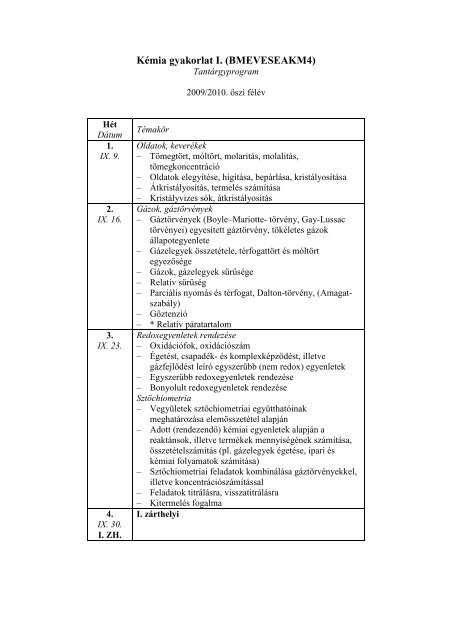
Hét<br />
Dátum<br />
1.<br />
IX. 9.<br />
2.<br />
IX. 16.<br />
3.<br />
IX. 23.<br />
4.<br />
IX. 30.<br />
I. ZH.<br />
Témakör<br />
Oldatok, keverékek<br />
– Tömegtört, móltört, molaritás, molalitás,<br />
tömegkoncentráció<br />
– Oldatok elegyítése, hígítása, bepárlása, kristályosítása<br />
– Átkristályosítás, termelés számítása<br />
– Kristályvizes sók, átkristályosítás<br />
Gázok, gáztörvények<br />
– Gáztörvények (Boyle–Mariotte- törvény, Gay-Lussac<br />
törvényei) egyesített gáztörvény, tökéletes gázok<br />
állapotegyenlete<br />
– Gázelegyek összetétele, térfogattört és móltört<br />
egyezısége<br />
– Gázok, gázelegyek sőrősége<br />
– Relatív sőrőség<br />
– Parciális nyomás és térfogat, Dalton-törvény, (Amagatszabály)<br />
– Gıztenzió<br />
– * Relatív páratartalom<br />
Redoxegyenletek rendezése<br />
– Oxidációfok, oxidációszám<br />
– Égetést, csapadék- és komplexképzıdést, illetve<br />
gázfejlıdést leíró egyszerőbb (nem redox) egyenletek<br />
– Egyszerőbb redoxegyenletek rendezése<br />
– Bonyolult redoxegyenletek rendezése<br />
Sztöchiometria<br />
– Vegyületek sztöchiometriai együtthatóinak<br />
meghatározása elemösszetétel alapján<br />
– Adott (rendezendı) kémiai egyenletek alapján a<br />
reaktánsok, illetve termékek mennyiségének számítása,<br />
összetételszámítás (pl. gázelegyek égetése, ipari és<br />
kémiai folyamatok számítása)<br />
– Sztöchiometriai feladatok kombinálása gáztörvényekkel,<br />
illetve koncentrációszámítással<br />
– Feladatok titrálásra, visszatitrálásra<br />
– Kitermelés fogalma<br />
I. zárthelyi
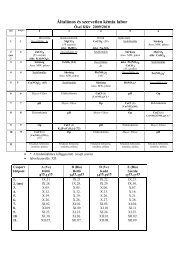
5.<br />
X. 7.<br />
6.<br />
X. 14.<br />
7.<br />
X. 21.<br />
8.<br />
X. 28.<br />
II. ZH<br />
Termokémia<br />
– Hı, (térfogati) munka, belsı energia<br />
– Feladatok a hıkapacitás, fajlagos és moláris hıkapacitás<br />
fogalmának megismerésére<br />
– Látens hı<br />
– Összetett számítások halmazállapot-változással<br />
(pl. jég és gız összekeverése)<br />
– Reakcióentalpia, égési entalpia (pl. égetés, gázelegy<br />
összetételének meghatározása)<br />
– Képzıdési entalpia<br />
– Hess tétele<br />
Gáz- és folyadékegyensúlyok<br />
– Egyensúlyi állandó fogalma<br />
– Folyadékfázisú egyensúlyok (pl. észteresítés)<br />
– Kiindulási anyagok és termékek mennyigének,<br />
koncentrációjának meghatározása<br />
– Le Chatelier–Braun elv szemléltetése egyszerő<br />
feladatokkal (egyensúly eltolása a kiindulási anyag(ok)<br />
vagy termék(ek) mennyiségének változtatásával)<br />
pH-számítás (I)<br />
– Vízionszorzat<br />
– Erıs savak és bázisok pH-ja<br />
– Erıs savak és bázisok nagyon híg oldatának pH-ja (pl.<br />
10 −7 M HCl)<br />
– Gyenge savak és bázisok pH-ja (töményebb, illetve<br />
hígabb oldatok, egyszerősített képlet (K·c 0 ) 1/2<br />
bemutatása, alkalmazhatóságának ismertetése<br />
II. zárthelyi
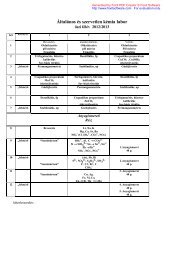
9.<br />
XI. 4.<br />
10.<br />
XI. 11.<br />
11.<br />
(XI. 18.)<br />
12.<br />
XI. 25.<br />
13.<br />
XII. 2.<br />
III. ZH.<br />
14.<br />
XII. 9.<br />
PótZH<br />
pH-számítás (II)<br />
– Hidrolizáló sók pH-ja<br />
– Pufferelegyek pH-ja<br />
– Pufferkapacitás számítása<br />
– Savak, bázisok és sók keverékeinek számítása<br />
Rosszul oldódó sók oldhatóságának számítása<br />
– Oldhatósági szorzat (L), oldhatóság (S) fogalma, ezek<br />
összefüggései<br />
– Oldhatóság számítása oldhatósági szorzatból<br />
– Sajátion-hatás (oldhatóság elektrolitokban)<br />
– Rosszul oldódó fém-hidroxidok oldhatósága (pl. telített<br />
oldat pH-ja)<br />
– * Oldhatóság pH-függése (anion protonálódásának<br />
eltolása, pl. CaF 2 oldhatósága)<br />
Az óra elmarad.<br />
Elektródpotenciálok<br />
– Standard elektródpotenciál fogalma<br />
– Egyszerő fémelektródok<br />
– Redoxelektródok (pl. Sn 2+ /Sn 4+ , stb.)<br />
– * pH-függı redoxelektródok (pl. Mn 2+ /MnO − 4 ,<br />
Cr 3+ /Cr 2 O 2− 7 )<br />
– * Másodfajú elektródok<br />
– * Gázelektródok (elsısorban H 2 /2H + , 2OH − /O 2 , 2Cl − /Cl 2 )<br />
Galvánelemek<br />
– Elektromotoros erı számítása<br />
– Cellafolyamatok felírása, rendezése, bruttó folyamat<br />
fogalma<br />
– Koncentrációs elemek<br />
– Redoxreakciók irányának megállapítása<br />
elektródpotenciálok segítségével<br />
Elektrolízis számítása<br />
– Faraday törvénye<br />
– Elektródfolyamatok megállapítása, bruttó folyamat<br />
III. zárthelyi<br />
Pótzárthelyi