Le Celle a Combustibile
Le Celle a Combustibile
Le Celle a Combustibile
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
V1.1 2005 gpm<br />
<strong>Le</strong> <strong>Celle</strong> a <strong>Combustibile</strong><br />
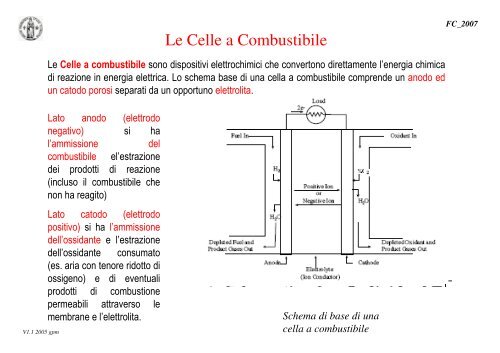
<strong>Le</strong> <strong>Celle</strong> a combustibile sono dispositivi elettrochimici che convertono direttamente l’energia chimica<br />
di reazione in energia elettrica. Lo schema base di una cella a combustibile comprende un anodo ed<br />
un catodo porosi separati da un opportuno elettrolita.<br />
Lato anodo (elettrodo<br />
negativo) si ha<br />
l’ammissione del<br />
combustibile el’estrazione<br />
dei prodotti di reazione<br />
(incluso il combustibile che<br />
non ha reagito)<br />
Lato catodo (elettrodo<br />
positivo) si ha l’ammissione<br />
dell’ossidante e l’estrazione<br />
dell’ossidante consumato<br />
(es. aria con tenore ridotto di<br />
ossigeno) e di eventuali<br />
prodotti di combustione<br />
permeabili attraverso le<br />
membrane e l’elettrolita.<br />
Schema di base di una<br />
cella a combustibile<br />
FC_2007
V1.1 2005 gpm<br />
La Cella a combustibile differisce da una batteria, in quanto quest’ultima contiene già al suo interno i<br />
reagenti e li consuma nel corso della sua vita; la cella a combustibile contuinua invece in principio a<br />
funzionare fintanto che si assicura un flusso corretto di combustibile ed ossidante, producendo<br />
energia elettrica con continuità.<br />
Qualsiasi cella oltre a produrre elettricità<br />
produce in uscita flussi secondari:<br />
Acqua, CO2 (nei prodotti di reazione),<br />
calore.<br />
Questi flussi devono essere rimossi con<br />
continuità ma possono trovare una loro<br />
propria applicazione recuperativa.<br />
FC_2007
V1.1 2005 gpm<br />
FC_2007<br />
In principio una cella a combustibile può operare con qualsiasi combustibile ossidabile, e con qualsiasi<br />
agente ossidante; in pratica, motivi di purezza e convenienza portano a scegliere come combustibile<br />
di elezione l’Idrogeno (che si presta anche allo stoccaggio sotto forma criogenica); e come ossidante<br />
l’Ossigeno puro.<br />
L’elettrodo poroso (anodo e catodo) é un<br />
elemento critico del sistema; esso rappresenta<br />
un’interfaccia di tipo trifase, tra reagenti,<br />
elettrolita e catalizzatore.<br />
Il catalizzatore risulta in particolare necessario<br />
per le celle operanti a bassa temperatura, in<br />
modo da favorire la ionizzazione, che invece<br />
avviene naturalmente a temperature più elevate.<br />
L’interfaccia trifasica rappresenta un fattore<br />
limitativo progettuale, in particolare per le celle<br />
che utilizzano un elettrolita liquido; in tal caso<br />
sulla superficie porosa d’interfaccia si crea un<br />
sottile film di elettrolita, con la sua conducibilità<br />
elettrica, attraverso il quale i reagenti devono<br />
diffondere con continuità. Se il film assume<br />
spessore eccessivo la cella viene “allagata<br />
(“Flooding”) ” e cessa di funzionare.<br />
N.B. La necessità di evitare flooding richiede che le portate di<br />
reagenti siano accuratamente bilanciate ed adattate alle<br />
condizioni di carico elettrico, e che i prodotti vengano rimossi<br />
con continuità. Ciò spiega perché le Fuel cells si prestano male<br />
a soddisfare condizioni variabili nel tempo, come sono richieste<br />
ad esempio dai sistemi per autotrazione. Ciò porta<br />
necessariamente a prevedere sistemi di accumulo (batterie)
V1.1 2005 gpm<br />
Gran parte della ricerca sulle celle si é finora focalizzata sulle prestazioni dell’interfaccia trifasica,<br />
portando a sviluppare soluzioni molto sottili pur garantendo buone prestazioni degli elettrodi e<br />
dell’elettrolita.<br />
<strong>Le</strong> funzioni dell’elettrodo poroso (e catalitico) sono:<br />
1. realizzare una superficie dove hanno luogo le<br />
reazioni di ionizzazione/deionizzazione<br />
dell’elettrolita<br />
2. trasferire gli ioni dall’interfaccia trifasica lungo<br />
l’elettrodo (che deve quindi essere conduttivo)<br />
una volta che si sono formati<br />
3. separare efficacemente le due fasi gassose<br />
dall’elettrolita<br />
FC_2007
V1.1 2005 gpm<br />
Tipi di <strong>Celle</strong> a <strong>Combustibile</strong><br />
<strong>Le</strong> <strong>Celle</strong> a combustibile possono essere classificate con diversi criteri. Tra le più comuni é la<br />
classificazione in base all’elettrolita, ed in ordine crescente di temperatura operativa, che viene<br />
seguita nel seguito.<br />
1. <strong>Celle</strong> a Elettrolita Polimerico (PEFC o PEM)<br />
2. <strong>Celle</strong> ad Elettrolita Alcalino (AFC)<br />
3. <strong>Celle</strong> ad Acido Fosforico (PAFC)<br />
4. <strong>Celle</strong> a Carbonati Fusi (MCFC)<br />
5. <strong>Celle</strong> ad Ossidi Solidi a Media Temperatura (ITSOFC)<br />
6. <strong>Celle</strong> ad Ossidi Solidi ad Alta Temperatura (HTSOFC o<br />
TSOFC per “Tubolari” )<br />
≅ 80 °C<br />
≅ 1000 °C<br />
Il livello operativo di temperatura determina la scelta dell’elettrolita. Elettroliti in soluzione acquosa<br />
sono limitati a T< 200°C. Operare a T così basse richiede l’uso di Idrogeno come combustibile, per le<br />
sue caratteristiche di elevata reattività. Procedendo a T più elevate, diviene possibile l’alimentazione<br />
con CO o CH4, poiché la cinetica delle reazioni migliora. Ma a temperature elevate il calore generato<br />
dalla cella può essere utilizzato per promuovere internamente il “reforming” del combustibile, ovvero la<br />
conversione degli idrocarburi in Idrogeno.<br />
FC_2007
V1.1 2005 gpm<br />
Tipi di <strong>Celle</strong> a <strong>Combustibile</strong> – Caratteristiche Operative<br />
FC_2007
V1.1 2005 gpm<br />
<strong>Celle</strong> a <strong>Combustibile</strong> – Compatibilità con i combustibili<br />
FC_2007
V1.1 2005 gpm<br />
<strong>Celle</strong> a Elettrolita Polimerico – PEFC<br />
<strong>Le</strong> PEFC utilizzano come elettrolita una membrana polimerica. Questa membrana deve avere la caratteristica<br />
di essere permeabile agli ioni di idrogeno ( o Protoni; perciò si parla di Proton Exchange Membrane Fuel Cell,<br />
PEMFC o PEM in breve), ma impermeabile agli elettroni (altrimenti si avrebbe il “corto circuito” della cella).<br />
FC_2007<br />
Inoltre la membrana deve essere<br />
impermeabile ai gas, ed essere resistente<br />
alla corrosione per riduzione al catodo e per<br />
ossidazione all’anodo. <strong>Le</strong> membrane più<br />
comuni sono a base di acido sulfonico con<br />
aggiunta di fluoro (Nafion® DuPont).<br />
Il catalizzatore migliore é il platino, che viene<br />
deposto in film ultrasottile sulla membrana.<br />
Anche questa deve essere molto sottile per<br />
non ostacolare il passaggio degli ioni.<br />
Formula chimica del<br />
Nafion® DuPont<br />
Formula<br />
chimica<br />
dell’Acido<br />
Sulfonico
V1.1 2005 gpm<br />
FC_2007<br />
<strong>Le</strong> PEFC operano in modo ottimale a bassa temperatura (circa 80°C); gli elettrodi sono capaci di sostenere<br />
densità di corrente molto elevate. Ciò si traduce in un avviamento rapido ed in caratteristiche di ingombro<br />
ridotto e peso contenuto, che le rendono particolarmente adatte alle applicazioni per autotrazione.<br />
Nelle applicazioni per autotrazione, le PEFC sono alimentabili:<br />
- con idrogeno puro, fortemente pressurizzato in forma gassosa in appositi serbatoi (p ≈ 700 bar).<br />
- da un combustibile liquido, previo “Reforming” dello stesso (centralizzato, alla stazione di servizio o “on board” sul<br />
veicolo). Normalmente si considera di utilizzare Metanolo, che presenta un elevato contenuto di idrogeno e può<br />
essere prodotto dalla biomassa. E’ anche possibile l’utilizzo di benzina normale.<br />
Nelle applicazioni stazionarie, si utilizza in genere gas naturale con produzione di H2 mediante reforming.<br />
L’ossidante risulta in genere Aria, non risultando conveniente l’utilizzo dell’ossigeno. Ciò comporta che oltre<br />
all’H2O al catodo si dovrà estrarre Azoto N2.<br />
Poiché la cella opera a bassa temperatura, per ottenere un’adeguata<br />
attività gli elettrodi richiedono un utilizzo importante di catalizzatori<br />
(Platino). Il catalizzatore viene avvelenato permanentemente da Zolfo<br />
nel combustibile; temporaneamente da CO e CO2.<br />
Per essere conduttiva la membrana polimerica deve essere<br />
umidificata; esiste quindi il problema della gestione dell’H2O che si<br />
forma dalla reazione, che deve bagnare la membrana senza allagarla.<br />
Esiste anche un problema di asportazione di calore; in genere il<br />
raffreddamento della cella è ad acqua, distribuita mediante piastre<br />
intermedie che aumentano lo spessore della cella elementare. L’acqua<br />
deve essere pura (non conduttiva).
Nelle PEFC l’unico liquido é acqua, di formazione al catodo. Non si hanno problemi di corrosione, ma la<br />
gestione del flusso di acqua al catodo risulta un punto critico. L’acqua deve bagnare con continuità la<br />
membrana, e non evaporare per temperatura eccessiva (T
V1.1 2005 gpm<br />
Sviluppi delle <strong>Celle</strong> a Elettrolita Polimerico<br />
<strong>Le</strong> PEFC hanno avuto un grande sviluppo negli ultimi 20 anni; l’attrattività per usi automotive, con un<br />
mercato potenzialmente molto grande, ha determinato un abbassamento progressivo dei costi ed un<br />
migliormento sia delle tecnologie produttive che delle prestazioni.<br />
Il dosaggio di Platino sugli elettrodi è sceso da oltre 4<br />
mg/cm 2 a livelli molto bassi (fino a 0,1 mg/cm 2 ).<br />
Produttori di membrane: Du Pont (Nafion); Dow (XUS-XXX).<br />
Gli elettrodi in grafite sono prodotti in film sottile, arricchiti con platino ed incollati alle membrane.<br />
Il raffreddamento è effettuato con acqua demineralizzata (Ballard, Nuvera,…), con aria o con tecnologie ad aria<br />
umidificata a spray (Intelligent Energy Systems). Il raffreddamento a liquido comporta problemi nelle applicazioni<br />
automotive per le partenze con T
V1.1 2005 gpm<br />
Sviluppi delle <strong>Celle</strong> a Elettrolita Polimerico<br />
FC_2007<br />
<strong>Le</strong> PEFC presentano gravi problemi di avvelenamento da CO; questo è normalmente contenuto in piccole<br />
percentuali (circa 1%) nell’idrogeno prodotto per reforming, se non si adottano costosi sistemi di<br />
purificazione. Per avvelenare temporaneamente un catalizzatore sono sufficienti concentrazioni di CO di 10<br />
ppm (parti per milione in volume).<br />
Per risolvere i problemi di avvelenamento da CO si<br />
sono sviluppati elettrodi arricchiti in Rutenio oltre al<br />
Plaitino, con tolleranza oltre 200 ppm CO.<br />
La soluzione più radicale, anche se costosa in esercizio,<br />
è di alimentare piccole quantità di ossigeno all’anodo,<br />
con effetto di preossidare il CO a CO2. Esistono però<br />
evidenti problemi di sicurezza, in quanto localmente la<br />
miscela H2-O2 può assumere concentrazioni entro il<br />
limite di infiammabilità; l’energia di attivazione della<br />
combustione per l’idrogeno è molto bassa (è sufficiente<br />
una minima fonte di energia).<br />
L’avvelenamento da CO2 all’anodo costituisce un problema minore; la CO2 si lega ad idruri metallici legati al<br />
Platino che si formano marginalmente all’anodo, diminuendo progressivamente il voltaggio della cella.<br />
Per il futuro si tende a sviluppare celle PEFC che possano operare direttamente con metanolo liquido, senza<br />
necessità di un reforming prima dell’ingresso nella cella.
Sviluppi delle <strong>Celle</strong> a Elettrolita Polimerico<br />
V1.1 2005 gpm<br />
Sensibilità alla pressione ed alla temperatura.<br />
FC_2007
V1.1 2005 gpm<br />
<strong>Celle</strong> a Elettrolita Polimerico – Soluzioni realizzative<br />
FC_2007
V1.1 2005 gpm<br />
<strong>Celle</strong> a Elettrolita Polimerico – Packages commerciali<br />
FC_2007
V1.1 2005 gpm<br />
<strong>Celle</strong> a Elettrolita Polimerico –<br />
Costi e Sfide tecniche (courtesy Bertin, 2007)<br />
FC_2007
V1.1 2005 gpm<br />
<strong>Celle</strong> a Elettrolita Alcalino – AFC - 1<br />
<strong>Le</strong> AFC utilizzano come elettrolita una soluzione alcalina, ad es idrossido di potassio KOH; in concentrazione<br />
elevata (>85%) se operanti a T ≈ 250°C; più bassa (35-45%) se a T T ≈ 120°C.<br />
FC_2007<br />
L’elettrolita é disperso su di una matrice<br />
porosa di supporto, e si utilizzano anche<br />
catalizzatori di basso costo (Ni, Ag, ossidi<br />
metallici,...) oltre a metalli nobili.<br />
Anche per le AFC la presenza di Carbonio nel<br />
combustibile porta alla produzione di CO che<br />
avvelena la cella formando irreversibilmente<br />
carbonato di potassio K2CO3. Lo stesso<br />
avviene per l’aria dal lato ossidante, che non<br />
deve contenere CO2 neppure in traccia.<br />
<strong>Le</strong> AFC sono dette anche celle di Bacon dal<br />
nome dell’inventore (1960). Sono state<br />
ampiamente sperimentate nelle missioni<br />
spaziali, dimostrando affidabilità e rendimenti<br />
molto elevati, fino al 70%.
V1.1 2005 gpm<br />
<strong>Celle</strong> a Elettrolita Alcalino – AFC - 2<br />
Molte celle (Es. Siemens) prevedono<br />
l’asportazione del calore mediante la<br />
circolazione all’esterno dell’elettrolita<br />
liquido!<br />
Anodo<br />
Catodo<br />
Nelle applicazioni spaziali si usa idrogeno<br />
puro – prodotto passando il gas prodotto<br />
da reforming attraverso una sottile<br />
membrana di argento e Palladio.<br />
L’ossidante è ossigeno puro (senza tracce<br />
di CO2 come nell’aria atmosferica) e quindi<br />
non esistono problemi di contaminazione<br />
da Carbonio.<br />
N.B: la produzione di acqua avviene all’Anodo!<br />
Lo ione di trasporto nell’elettrolita è OH - !<br />
Reazione complessiva<br />
FC_2007
V1.1 2005 gpm<br />
<strong>Celle</strong> a Elettrolita Alcalino – AFC - 3<br />
<strong>Le</strong> AFC hanno avuto un considerevole<br />
sviluppo nelle applicazioni spaziali, dai tempi<br />
delle missioni Apollo fino all’introduzione dello<br />
Space Shuttle.<br />
Comunque le densità di corrente ottenibili sono<br />
minori rispetto alle PEFC, ed i voltaggi (e di<br />
conseguenza i rendimenti) più bassi.<br />
La ricerca si è concentrata nella realizzazione<br />
di unità compatte e leggere.<br />
L’aumento dei livelli di temperatura migliora la<br />
reattività delle celle AFC, aumentando il<br />
potenziale elettrico.<br />
FC_2007
V1.1 2005 gpm<br />
<strong>Celle</strong> ad Acido Fosforico – PAFC - 1<br />
<strong>Le</strong> PAFC utilizzano come elettrolita acido fosforico puro, a T ≈ 150-<br />
220°C; a temperature più basse l’Acido Fosforico non risulta un buon<br />
conduttore di ioni, e l’avvelenamento da CO sull’anodo, con<br />
distruzione del catalizzatore (Platino), diventa rilevante.<br />
<strong>Le</strong> reazioni elettrochimiche sono le stesse viste per le PEFC (ciclo<br />
H2-O2). Gli ioni circolanti nell’elettrolita liquido sono H + .<br />
L’elettrolita é disperso su di una matrice porosa di silice (SiO2).<br />
Anche le PAFC richiedono come combustibile idrogeno ad elevata<br />
purezza: l’elettrolita viene avvelenato dalla presenza di carbonio.<br />
Gli elettrodi sono realizzati in carbonio poroso, con uno strato<br />
superficiale in carbonio puro (carbon black) che migliora le<br />
prestazioni.<br />
La produzione di acqua, nonostante l’elevata temperatura, non<br />
risulta un problema utilizzando acido fosforico puro come elettrolita.<br />
Rendimento 37- 42%.<br />
<strong>Le</strong> PAFC sono le celle più diffuse, con potenza complessiva<br />
installata a livello mondiale superiore a 100 MW.<br />
FC_2007
V1.1 2005 gpm<br />
<strong>Celle</strong> ad Acido Fosforico<br />
– PAFC - 2<br />
Evoluzione tecnologica delle PAFC.<br />
Evoluzione delle prestazioni delle PAFC.<br />
a – 1977; 190°C<br />
b – 1981; 190°C; 3, 4 bar<br />
c – 1981; 205°C; 6,3 bar<br />
d – 1984; 205°C; 8 bar<br />
e, f – prototipi 1992<br />
International Fuel Cells Corporation<br />
FC_2007
<strong>Le</strong> MCFC utilizzano come elettrolita una miscela di<br />
carbonati fusi, depositati su di una matrice ceramica (in<br />
genere, LiAlO2). La temperatura operativa è di circa 600-<br />
700°C; a queste temperature i sali (carbonati) sono allo<br />
stato fuso e risultano ottimi conduttori per la<br />
dissociazione dello ione CO3 = , che risulta il vettore di ioni<br />
al catodo.<br />
E’ possibile a queste temperature usare elettrodi<br />
metallici, in Ni all’anodo e NiO al catodo.<br />
Non sono necessari catalizzatori.<br />
Rendimento fino a 60%; possibile ulteriore miglioramento<br />
con recupero termico ad alta temperatura.<br />
Costruttori:<br />
V1.1 2005 gpm<br />
<strong>Celle</strong> a Carbonati Fusi - MCFC -1<br />
Fuel Cell Energy (USA), Ansaldo (IT), Siemens (ex<br />
MTU), Hitachi, Mitsubishi, Tpshiba (J),….<br />
FC_2007
V1.1 2005 gpm<br />
<strong>Celle</strong> a Carbonati Fusi - MCFC -2<br />
Reazioni elettrochimiche:<br />
Anodo<br />
Catodo<br />
<strong>Le</strong> temperature elevate e l’aggressività chimica<br />
dell’elettrolita pongono notevoli problemi di<br />
materiali nelle MCFC rispetto alle FC operanti a<br />
temperature più basse.<br />
Complessiva<br />
FC_2007<br />
La Figura mostra che la CO2 che si forma<br />
all’Anodo viene ricircolata al Catodo dove si<br />
consuma. La CO2 permea attraverso gli elettrodi<br />
insieme ad O2, e forma lo ione carbonato.
V1.1 2005 gpm<br />
<strong>Celle</strong> a Carbonati Fusi<br />
- MCFC – 3 -<br />
Evoluzione<br />
Evoluzione tecnologica delle MCFC.<br />
1992 – 1 bar<br />
1984 – 8 bar<br />
1984 – 1 bar<br />
Evoluzione delle prestazioni delle MCFC.<br />
La durata delle celle è oltre 40,000 h per MCFC a<br />
pressione atmosferica.<br />
Aumentando la pressione la vita diminuisce<br />
considerevolmente.<br />
FC_2007
V1.1 2005 gpm<br />
<strong>Celle</strong> a Carbonati Fusi - MCFC – 4 - Prestazioni<br />
Effetto della pressurizzazione e del contenuto<br />
di carbonio del combustibile.<br />
N.B. : densità di corrente piuttosto basse!<br />
(Elettrodi metallici, non porosi)<br />
<strong>Le</strong> MCFC si prestano ad essere utilizzate con<br />
gas di sintesi (syngas) prodotto da gassificatori<br />
di carbone o residui petrolchimici. Infatti<br />
possono funzionare con combustibili diversi<br />
dall’idrogeno: gas con CO, CO2, CH4.<br />
Alle temperature di esercizio delle MCFC (600-<br />
700°C) gli equilibri chimici della combustione<br />
iniziano ad essere favorevoli alle reazioni di<br />
gassificazione (Methane Shift; Boudouard;…)<br />
FC_2007<br />
I problemi nell’utilizzo delle MCFC con gas di sintesi da<br />
gassificatori nascono a seguito della presenza di impurità<br />
nel gas di sintesi: in particolare, H2S, COS, alogeni,<br />
idrocarburi pesanti, ammoniaca, metalli pesanti, …<br />
Lo stato dell’arte attuale richiede la pulizia del gas con<br />
rimozione efficace di queste specie, prima di alimentare la<br />
cella.
V1.1 2005 gpm<br />
<strong>Celle</strong> a Carbonati Fusi - MCFC – 5 – Reforming Interno<br />
Particolarmente interessante è l’accoppiamento di una<br />
MCFC con un Reformer (Internal Reformer IC); questo può<br />
essere indiretto (IIR – adiacente alla cella ed accoppiato a<br />
questa termicamente, ma separato) o diretto (DIR –<br />
completamente accoppiato alla cella). Sono possibili e<br />
consigliabili soluzioni a due stadi.<br />
La soluzione IIR consente un controllo dell’ambiente<br />
chimico del reformer separato dalle condizioni operative<br />
della cella; peraltro la conversione diretta di metano in<br />
idrogeno risulta favorita nella soluzione DIR.<br />
In ogni caso, l’introduzione del Reformer (a questi livelli di<br />
temperatura) richiede l’utilizzo di catalizzatori (Ni su base<br />
MgO, ad esempio).<br />
Reazione di Steam Reforming. La reazione è endotermica,<br />
richiede 225,5 kJ/mol di CH4. Questo calore viene fornito<br />
dalla cella, che opera invece producendo calore.<br />
FC_2007
V1.1 2005 gpm<br />
<strong>Celle</strong> ad Ossidi solidi – SOFC – 1<br />
<strong>Le</strong> SOFC utilizzano come elettrolita ossidi solidi, in genere ossido di Zirconio<br />
stabilizzato con Yttrio: ZrO2+Y2O3.<br />
Il vettore di ioni è costituito da ioni ossigeno.<br />
Nella versione ad alta temperatura<br />
(1000°C, TSOFC), gli elettrodi<br />
sono in materiali ceramici del tipo<br />
Co-ZrO2 o Ni-ZrO2 (Anodo) e per il<br />
Catodo in LaMnO3 drogato con Sr.<br />
La costruzione risulta<br />
necessariamente tubolare (TSOFC)<br />
per motivi di resistenza alle elevate<br />
temperature.<br />
Versioni a temperatura più bassa (T = 600-800 °C, ITSOFC) possono<br />
essere costruite nella forma classica di pile (“Stacks”) di lastre piane,<br />
ed utilizzano elettroliti adatti a temperature più basse.<br />
<strong>Le</strong> SOFC possono essere utilizzate direttamente con idrocarburi; non<br />
utilizzano catalizzatori; in sistemi ibridi (ad es. in accoppiamento con<br />
turbine a gas) possono raggiungere rendimenti superiori al 70%.<br />
FC_2007
V1.1 2005 gpm<br />
<strong>Celle</strong> ad Ossidi solidi – SOFC – 2<br />
Reazioni elettrochimiche:<br />
Anodo<br />
Catodo<br />
Complessiva<br />
FC_2007
V1.1 2005 gpm<br />
<strong>Celle</strong> ad Ossidi solidi –<br />
SOFC – 3<br />
<strong>Le</strong> TSOFC (in misura minore le ITSOFC)<br />
operano a temperature molto elevate.<br />
(1000°C, TSOFC).<br />
L’elettrolita e gli elettrodi sono costruiti<br />
con tecnologie molto avanzate (EVD,<br />
Electrochemical Vacuum Deposition; e<br />
Plasma-Spray), adatte per produrre film<br />
sottili per alte temperature.<br />
I materiali utilizzati sono accuratamente<br />
accoppiati in termini di coefficienti di<br />
dilatazione termica.<br />
Resta comunque molto importante<br />
l’avviamento lento e l’operatività a carico<br />
costante per prolungare la vita dei<br />
componenti, come in tutti i sistemi che<br />
operano ad elevata temperatura.<br />
FC_2007
V1.1 2005 gpm<br />
<strong>Celle</strong> ad Ossidi solidi – SOFC – 4<br />
La soluzione TSOFC Siemens-<br />
Westinghouse è tra le più avanzate.<br />
L’elettrolita viene depositato con EVD e<br />
successivamente lo strato di elettrodo<br />
anodico. Il catodo è il tubo di base,<br />
prodotto per estrusione.<br />
La distribuzione dell’aria avviene con un<br />
manicotto all’interno dei tubi.<br />
Il combustibile è distribuito inferiormente<br />
all’esterno dei tubi.<br />
I gas di scarico sono estratti nella parte<br />
alta all’esterno dei tubi.<br />
I tubi sono sospesi, in<br />
modo da essere liberi di<br />
dilatarsi.<br />
FC_2007
V1.1 2005 gpm<br />
<strong>Celle</strong> ad Ossidi solidi – SOFC – 5<br />
<strong>Le</strong> celle SOFC hanno prestazioni inferiori alle<br />
PAFC o MCFC, a livello di comportamento ideale.<br />
<strong>Le</strong> SOFC, operando ad alta temperatura, risentono<br />
meno delle perdite per polarizzazione ai bassi<br />
carichi.<br />
<strong>Le</strong> densità di corrente sono intermedie rispetto ad<br />
altre celle.<br />
<strong>Le</strong> SOFC, operando ad alta temperatura, possono<br />
effettuare internamente il reforming di combustibili<br />
diversi dall’idrogeno, senza l’uso di catalizzatori.<br />
Aria<br />
<strong>Le</strong> prestazioni risultano naturalmente migliori utilizzando O2<br />
come ossidante in luogo dell’aria.<br />
O 2<br />
<strong>Le</strong> SOFC, nel funzionamento con alimentazione da syngas,<br />
risentono delle impurità, con particolare riferimento ad H2S.<br />
Sono relativamente tolleranti alla presenza di NH3 e HCl.<br />
FC_2007
V1.1 2005 gpm<br />
Soluzioni per il Reforming<br />
Per le celle che operano a temperature elevate – a partire dalle MCFC – é interessante considerare la<br />
possibilità di produrre dentro alla cella l’idrogeno, partendo da combustibili convenzionali. Infatti, la reazione<br />
endotermica di Reforming dell’idrogeno (ad esempio a partire dal Metano CH4) risulta complementare con la<br />
necessità di asportare calore dalla cella.<br />
La reazione di Reforming richiede temperature<br />
superiori a 760°C; il consumo di Idrogeno<br />
all’anodo favorisce la riduzione del combustibile<br />
ad idrogeno.<br />
Schema di MCFC con Reforming interno<br />
E’ richiesto un apposito catalizzatore all’anodo<br />
per il Reforming.<br />
<strong>Le</strong> MCFC possono operare il reforming all’anodo<br />
solo se non pressurizzate. Pertanto, se si vuole<br />
considerare l’operazione pressurizzata della cella<br />
(che ne aumenta la densità di potenza) occorre<br />
effettuare il reforming in un reattore esterno, in<br />
accordo allo schema utilizzato anche per FC<br />
operanti a più bassa temperatura.<br />
Schema di FC con Reforming esterno<br />
FC_2007
V1.1 2005 gpm<br />
Reazioni elettrochimiche nelle diverse tipologie di celle<br />
FC_2007
V1.1 2005 gpm<br />
Andamento del potenziale elettrochimico con la temperatura<br />
<strong>Le</strong> equazioni di Nernst consentono ad<br />
esempio di calcolare l’andamento teorico<br />
del potenziale E con la temperatura,<br />
mostrato in figura per una cella H2-O2 (ad<br />
es. una PEFC).<br />
Il potenziale elettrochimico della singola<br />
cella risulta basso, anche per altri tipi di<br />
celle (cfr. tabella). Di conseguenza sono<br />
necessari flussi elevati di corrente per unità<br />
di sezione di elettrodo; anche per questo si<br />
ricorre ad elettrodi porosi, che presentano<br />
un rapporto superficie/volume molto<br />
favorevole.<br />
La tabella fa riferimento ad H2O come vapore nei prodotti<br />
FC_2007
V1.1 2005 gpm<br />
Il funzionamento reale delle celle – Effetto reale della temperatura<br />
Nella realtà l’effetto della temperatura<br />
è – quando si considerano le perdite<br />
effettive, di natura principalmente<br />
elettrica – ancora più rilevante.<br />
La Figura mostra quali siano le<br />
prestazioni reali delle celle rispetto alla<br />
situazione reversibile, calcolabile<br />
mediante le equazioni di Nernst.<br />
FC_2007
Il funzionamento reale delle celle – Curva caratteristica<br />
<strong>Le</strong> prestazioni reali di una cella sono descritte<br />
dalla sua curva caratteristica: Voltaggio in<br />
uscita (potenziale elettrico) in funzione della<br />
densità di corrente.<br />
La curva caratteristica può essere di natura<br />
sperimentale, o calcolata con modelli<br />
elettrochimici più o meno complessi, che<br />
attuano la modellistica delle diverse tipologie<br />
di perdite.<br />
Il prodotto Voltaggio * Corrente dà la potenza<br />
eettrica; aumentando la corrente, diminuisce<br />
il potenziale per tre effetti principali:<br />
• Polarizzazione per attivazione a bassi carichi<br />
• Perdite resistive attraverso l’elettrolita (ioni) e<br />
gli elettrodi (elettroni) ai carichi intermedi<br />
• Perdite per limiti alla diffusione del gas<br />
(distribuzione agli elettrodi) ai carichi elevati<br />
V1.1 2005 gpm<br />
FC_2007
V1.1 2005 gpm<br />
Il funzionamento reale delle celle – Punto operativo<br />
Punto Operativo<br />
Il punto Operativo della cella risulta in pratica dal<br />
compromesso tra costi di impianto (che spingono verso<br />
densità di corrente elevate – celle + piccole) e costi di<br />
gestione (che spingono verso rendimenti migliori, che si<br />
verificano a densità di corrente più basse).<br />
FC_2007<br />
Effettuando il prodotto V * I si ottiene la<br />
caratteristica di potenza della cella. In genere<br />
questa presenta un massimo in condizioni di<br />
elevata corrente (a destra nel diagramma), e<br />
pertanto questo sembrerebbe il punto operativo<br />
ottimale della cella, anche se risulta evidente<br />
che il voltaggio di uscita è penalizzato; lo stesso<br />
si potrebbe dire del rendimento.<br />
In realtà operare la cella in condizioni di massima<br />
potenza pone seri problemi di controllo: infatti, il<br />
sistema cella ha tendenza ad oscillare attorno<br />
alle condizioni di densità di corrente prossime<br />
alla massima potenza; pertanto si sceglie<br />
sempre di operare a sinistra di tale punto,<br />
sacrificando la potenza per ottenere:<br />
• Migliore stabilità<br />
• Voltaggio più elevato<br />
• Rendimento più elevato
V1.1 2005 gpm<br />
Il rendimento reale delle celle a combustibile -1<br />
La definizione del rendimento è in genere quella di energia utile (elettrica) ottenuta / energia spesa.<br />
L’energia spesa, per un combustibile, è rappresentata per unità di massa dal suo potere calorifico<br />
(inferiore, se i prodotti escono allo stato gassoso; superiore, se l’H2O esce allo stato liquido); o, in<br />
termini di reazioni chimiche ( con riferimento ad 1 mol di reagente), dall’entalpia di reazione - la<br />
differenza di entalpia fisica tra prodotti e reagenti.<br />
Se una cella opera reversibilmente, l’energia utile in uscita risulta massima e pari (operando in<br />
equilibrio con l’ambiente, a 101,325 kPa e 25°C) alla variazione dell’energia libera di Gibbs:<br />
Per la reazione di riferimento di una cella operante con idrogeno:<br />
H 2 + ½ O 2 -> H 2 O (l)<br />
G = H – T S<br />
Pertanto η = ∆G 0 /∆H 0 = 0,83 (valore massimo!)<br />
= 237,1 kJ/mol ∆H 0 = 285,8 kJ/kmol<br />
FC_2007
V1.1 2005 gpm<br />
Il rendimento reale delle celle a combustibile - 2<br />
Si è visto come per la reazione elementare:<br />
H 2 + ½ O 2 -> H 2 O (l)<br />
η max = ∆G 0 /∆H 0 = 0,83<br />
η = Potenza elettrica /∆H = (V * I ) / (0,83 * ∆G) = (V real * I ) / (0,83 * V ideal * I)<br />
η = V real / (0,83 * 1,229) = 0,675 V real<br />
η = V real / (0,83 * V ideal)<br />
FC_2007<br />
V ideal = 1,229 V; mentre in realtà V real < V ideal ; sostituendo V ideal = 1,229 V:<br />
<strong>Le</strong> curve caratteristiche della cella mostrano che operando a<br />
basse densità di corrente si ottengono valori di voltaggio<br />
superiori, e più prossimi a quelli ideali. Invece, aumentando la<br />
corrente cala il voltaggio e quindi il rendimento della cella.
V1.1 2005 gpm<br />
FC_2007<br />
Approfondimento sulle reazioni elettrochimiche – Equazioni di Nernst - 1<br />
<strong>Le</strong> relazioni di Gibbs-Faraday stabiliscono che la variazione dell’energia libera<br />
di Gibbs è anche esprimibile per via elettrica:<br />
W El_rev = ∆G = - n F E<br />
F = Costante di Faraday =<br />
96,487 Coulomb/g-mole elettrone<br />
Allo stato standard: W 0 El_rev = ∆G 0 = - n F E 0<br />
In generale, con riferimento ad una reazione: αA + βB ↔ γC + δD<br />
Reagenti Prodotti<br />
∆G = ∆G 0 + RT ln(C γ D δ )/(A α B β )<br />
e sostituendo: E = E 0 + (RT)/(nF) ln(C γ D δ )/(A α B β )<br />
(Equazione di Nernst)<br />
Invece che alle moli A, B, C, D si fa riferimento, nei sistemi aperti, alle pressioni parziali (prodotto<br />
della concentrazione volumetrica della specie per la pressione della miscela).
V1.1 2005 gpm<br />
FC_2007<br />
Approfondimento sulle reazioni elettrochimiche – Equazioni di Nernst - 2<br />
<strong>Le</strong> equazioni di Nernst stabiliscono il legame tra il potenziale della singola cella e le condizioni operative di<br />
funzionamento, in termini di pressioni parziali di reagenti e prodotti e di temperatura. E’ possibile aumentare le<br />
prestazioni di una cella aumentandone la pressurizzazione. L’aumento di temperatura diminuisce sempre il<br />
potenziale rispetto al valore di riferimento E 0 .
V1.1 2005 gpm<br />
Sistemi di celle a combustibile - 1<br />
La cella elementare viene allestita sotto forma di “Stack”, disponendo molti elementi in serie. In modo da<br />
elevare il voltaggio in uscita.<br />
Che lo scopo sia per autotrazione o per usi stazionari, lo stack costituisce il cuore del sistema; questo però<br />
presenta una serie di sezioni:<br />
•La sezione di gestione termica (raffreddamento,<br />
•La sezione di preparazione del combustibile<br />
recupero termico cogenerativo od eventuale<br />
•L’elettronica di potenza<br />
accoppiamento a ciclo termodinamico)<br />
•Il sistema di alimentazione dell’ossidante<br />
•Il sistema di evacuazione degli effluenti<br />
•Il sistema di sicurezza<br />
FC_2007
V1.1 2005 gpm<br />
Sistemi di celle a combustibile - 2<br />
Tra i sistemi più complessi è il sistema di preparazione combustibile.<br />
Il suo cuore è il reattore di reforming, che opera a temperatura + o – elevata (a seconda dell’impiego di<br />
catalizzatori o meno).<br />
Il combustibile deve in seguito essere purificato (rimozione dello zolfo e del CO, a seconda del tipo di cella).<br />
Sempre a seconda del tipo di cella può convenire promuovere le reazioni di shift, ovvero convertire CO e CH4<br />
in idrogeno con apporto di vapor d’acqua.<br />
FC_2007
V1.1 2005 gpm<br />
Preparazione del combustibile<br />
FC_2007
V1.1 2005 gpm<br />
Esempio di sezione di preparazione combustibile per un cella PEFC<br />
(Ballard)<br />
FC_2007
V1.1 2005 gpm<br />
Esempio di sezione di preparazione combustibile per un cella PAFC<br />
da 200 kW (IFC)<br />
FC_2007
V1.1 2005 gpm<br />
Sistema completo con TSOFC proposto da Siemens-Westinghouse<br />
FC_2007<br />
Nel caso delle SOFC alimentate a gas o syngas la sezione di preparazione del combustibile è<br />
molto più semplice (limitata ad un preriscaldamento recuperativo nell’esempio). E’ però molto forte<br />
l’integrazione tra SIFC e macchinari di potenza (compressori, turbine).
Il DOE americano propone soluzioni con gassificatore, SOFC e ciclo combinato gas-vapore per<br />
l’utilizzo pulito del carbone con elevata efficienza.<br />
Il gassificatore è<br />
alimentato con<br />
ossigeno; la SOFC<br />
con aria.<br />
La sezione di<br />
pulizia del syngas<br />
risulta importante.<br />
La taglia di<br />
riferimento è 500<br />
MW.<br />
V1.1 2005 gpm<br />
FC_2007
V1.1 2005 gpm<br />
Integrazione tra SOFC e cicli di potenza - 1<br />
Sono possibili diversi schemi<br />
realizzativi.<br />
La soluzione qui presentata prevede<br />
l’utilizzo di un ciclo turbogas<br />
rigenerato integrato ad una SOFC.<br />
Il rendimento calcolato arriva<br />
all’82%, rispetto al 60% ipotizzato<br />
per la cella isolata.<br />
Il rendimento così elevato prevede<br />
un forte investimento nello<br />
scambiatore rigenerativo, che<br />
presenta una differenza terminale di<br />
temperatura DT=16°C. Con DT =<br />
45°C il rendimento calerebbe al<br />
76%.<br />
FC_2007
V1.1 2005 gpm<br />
Integrazione tra SOFC e cicli di potenza - 2<br />
La soluzione proposta prevede<br />
l’utilizzo di un ciclo turbogas<br />
accoppiato a ciclo combinato<br />
monopressione integrato ad una<br />
SOFC.<br />
L’aria alla mandata del<br />
compressore raffredda la SOFC<br />
con effetto rigenerativo.<br />
Il rendimento calcolato arriva al<br />
75%, rispetto al 57% della cella<br />
isolata.<br />
FC_2007
V1.1 2005 gpm<br />
Sistema di controllo per PEFC per autotrazione<br />
FC_2007
V1.1 2005 gpm<br />
Volume di controllo sistema PEFC per autotrazione<br />
Il volume di controllo comprende macchine<br />
(compressore), componenti di scambio<br />
termico/umidificatori, la cella, valvole, e<br />
“plenum” di distribuzione di combustibile ed<br />
ossidante.<br />
Il comportamento dinamico del sistema<br />
dipende da un complesso insieme di variabili<br />
termofluidodinamiche ed elettrochimiche.<br />
Il problema del comportamento dinamico del<br />
sistema diventa rilevante nelle applicazioni<br />
PEFC “Full Power”, ovvero in quelle non di<br />
tipo ibrido (in queste, i transitori vengono<br />
fortemente attenuati dal pacco batterie, che<br />
costituisce però un peso aggiuntivo per il<br />
veicolo).<br />
FC_2007
V1.1 2005 gpm<br />
FC_2007<br />
E’ riconosciuto che i sistemi con FC presentano – sia nel caso di utilizzo di<br />
gas naturale che di olio combustibile come fonte primaria – un’efficienza<br />
nell’uso finale superiore rispetto agli attuali MCI volumetrici.