ARENAVIRUS - Sezione di Microbiologia
ARENAVIRUS - Sezione di Microbiologia
ARENAVIRUS - Sezione di Microbiologia
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
Microbiology Upgrade<br />
O.E. Varnier<br />
<strong>ARENAVIRUS</strong><br />
GENERALITÀ<br />
Gli arenavirus sono stati scoperti recentemente, causano<br />
infezioni croniche nei ro<strong>di</strong>tori e l’uomo si infetta venendo a<br />
contatto con gli escrementi e presenta una forma grave <strong>di</strong><br />
febbre emorragica. Almeno sei arenavirus causano malattia<br />
nell’uomo: Lassa, Junin, Machupo, Guanarito, Sabia e il virus<br />
della coriomeningite linfocitaria (LCMV).<br />
DISTRIBUZIONE GEOGRAFICA<br />
Gli arenavirus sono classificati in due gruppi principali:<br />
vecchio mondo e nuovo mondo.<br />
Virus<br />
LCMV<br />
Lassa<br />
Mopiea<br />
Mobala<br />
Ippy<br />
Vecchio Mondo<br />
Paese<br />
Europa Asia Americhe<br />
Africa Occidentale<br />
Sud Africa<br />
Africa centrale<br />
Africa centrale<br />
2. Goccioline. Ci sono poche evidenze che suppor-tano<br />
quest’idea, ma è possibile che l’arenavirus nelle<br />
goccioline, entrando in contatto con le membrane mucose,<br />
sia infettivo.<br />
3. Contatto con il sangue dei ro<strong>di</strong>tori. Il sangue può essere<br />
un meccanismo <strong>di</strong> trasmissione più efficace dell’aerosol e<br />
delle goccioline.<br />
CORIOMENENGITE LINFOCITARIA<br />
Il virus LCMV negli umani ha un’incubazione tra una e tre<br />
settimane. Le infezioni includono uno spettro dall’asintomatico,<br />
al mite o al moderatamente severo con manifestazioni del<br />
SNC includendo la menengite asettica. La severità della<br />
infezione <strong>di</strong>pende dalla dose e dalla <strong>di</strong>rezione del virus, la<br />
fatalità è rara. Inoltre, non è stato riportato nessun caso in cui<br />
la trasmissione avvenisse tra persona e persona.<br />
Un’infezione tipica inizia con febbre, malessere, debolezza e<br />
forte mal <strong>di</strong> testa. L’anoressia, la nausea e lo stor<strong>di</strong>mento sono<br />
molto comuni. Circa il 50% dei pazienti possono esibire una<br />
combinazione <strong>di</strong> mal <strong>di</strong> gola e vomito.<br />
Junin<br />
Machupo<br />
Guanarito<br />
Tacaribe<br />
Amapari<br />
Flexal<br />
Pichinde<br />
Latino<br />
Parana<br />
Tamiami<br />
Nuovo Mondo<br />
Argentina<br />
Bolivia<br />
Venezuela<br />
Trinidad<br />
Brasile<br />
Brasile<br />
Columbia<br />
Bolivia, Brasile<br />
Paraguay<br />
Florida<br />
MALATTIE E PATOGENESI<br />
Infezione e Trasmissione. Una caratteristica degli arenavirus<br />
è la loro abilità a causare infezioni persistenti e acute nei<br />
loro naturali ospiti: i ro<strong>di</strong>tori.<br />
La sintesi dei componenti virali avviene senza alterazioni delle<br />
cellule essenziali dell’ospite; le macro-molecole e la crescita<br />
del virione avviene senza nessun effetto citopatico, la<br />
replicazione e il processo <strong>di</strong> assemblaggio degli arenavirus<br />
sembra agevolare l’inse<strong>di</strong>amento dell’infezione permanente. Si<br />
crede che l’introduzione dell’infezione da parte <strong>di</strong> molti virus<br />
avvenga sulla superficie delle cellule epiteliali come quelle che<br />
rivestono il tratto respiratorio e gastro-intestinale. Non si sa se<br />
l’ingresso e il rilascio dell’are-navirus dalle cellule epiteliali<br />
avvenga o sulla superficie apicale o su quella basolaterale<br />
della cellula. La modalità e il rilascio <strong>di</strong> questi virus in termini <strong>di</strong><br />
patogenesi dell’infezione virale non è ancora nota.<br />
MECCANISMO DI TRASMISSIONE<br />
Le modalità <strong>di</strong> trasmissione degli arenavirus all’uomo non sono<br />
ben note, finora sono state esplorate tre possibilità:<br />
1. Aerosol. Gli aerosol derivanti dall’emissione <strong>di</strong> urina<br />
infetta da parte <strong>di</strong> ro<strong>di</strong>tori infettati sono considerati la via<br />
più importante <strong>di</strong> trasmissione degli arenavirus.<br />
Quest’ipotesi è supportata sia da evidenze <strong>di</strong>rette sia<br />
in<strong>di</strong>rette. Stu<strong>di</strong> sull’infezione da arenavirus hanno<br />
<strong>di</strong>mostrato che l’infezione può essere indotta esponendo<br />
potenziali ospiti a particelle <strong>di</strong> aerosol. Alcune persone<br />
sono state colpite dall’infezione entrando in stanze<br />
contaminate .<br />
Fig. 1 Epidemiologia degli arenavirus nel mondo<br />
FEBBRE DI LASSA<br />
Il virus della febbre <strong>di</strong> Lassa normalmente infetta le vie mucose<br />
umane, i tagli e le abrasioni. Un’incubazione da 1 a 3<br />
settimane precede l’infezione. La manifesta-zione<br />
dell’infezione virale è caratterizzata da sintomi generalizzati<br />
includenti febbre alta, dolore alle artico-lazioni, dolore alla<br />
schiena e mal <strong>di</strong> testa acuto. All’ammissione in ospedale, i casi<br />
più gravi progre<strong>di</strong>-scono con vomito e <strong>di</strong>arrea. Alcuni pazienti<br />
sviluppano gravi edemi polmonari, la sindrome da stress<br />
respira-torio nell’adulto e lo shock ipodermico. Le manifestazioni<br />
neurologiche acute hanno un range compreso tra la<br />
sor<strong>di</strong>tà e l’encefalopatia moderata o severa. Altre<br />
manifestazioni neurologiche includono confusione lieve e<br />
tremori o coma. Il 15-20% dei pazienti esibiscono gravi<br />
emorragie manifestate con gengive sangui-nolente, emorragie<br />
gastrointestinali e congiuntivite emorragica. I casi <strong>di</strong> morte in<br />
pazienti ricoverati in ospedale sono pari al 16%.<br />
FEBBRE EMORRAGICA ARGENTINA E BOLIVIANA<br />
A seguito <strong>di</strong> un’incubazione <strong>di</strong> 20 giorni si sviluppa una<br />
malattia non specifica consistente <strong>di</strong> malessere, febbre alta,<br />
dolore lombare e debolezza addominale. In casi gravi<br />
l’interessamento del SN e gastrointestinale è manifestato con<br />
nausea, vomito, tremori e convulsioni. Infatti il 50% dei pazienti<br />
ha sintomi neurologici acuti come tremori alle mani e alla<br />
lingua. In contrasto con la febbre <strong>di</strong> Lassa, la febbre<br />
emorragica è frequente. C’è il 15% <strong>di</strong> morte in AHF e il 60% in<br />
BHF. I casi <strong>di</strong> morte <strong>di</strong>mostrano collassi vascolari e shock<br />
ipotensivo.<br />
1
Microbiology Upgrade<br />
O.E. Varnier<br />
ha attività polimerasica. Poichè le estremità 5’ <strong>di</strong> entrambi i<br />
segmenti L ed S contengono RNA+, sono considerati virus ad<br />
RNA con polarità bi-valente, tuttavia non hanno attività <strong>di</strong><br />
traduzioneproteica, in quanto le estremità 5’ sono strettamente<br />
legate alla proteina N e non hanno il Cap. Le sequenze<br />
co<strong>di</strong>ficanti presenti in queste rregioni sono espresse da RNAm<br />
trascritti dall’estremità 3’ del filamento complemen-tare, che è<br />
un interme<strong>di</strong>o replicativo. Mentre le sequenze co<strong>di</strong>ficanti delle<br />
regioni senso sono espresse da RNAm trascritti <strong>di</strong>rettamente<br />
dalla estremità 3’ del genoma.<br />
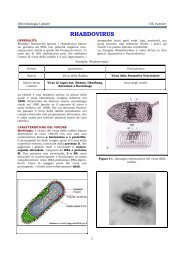
Fig.2 Schema <strong>di</strong> un arenavirus<br />
MORFOLOGIA<br />
I virioni sono provvisti <strong>di</strong> pericap-side ed hanno forme<br />
pleiomorfe frequentemente sferiche, con <strong>di</strong>ametri <strong>di</strong> 50-300<br />
nm. Le spine, che sono costituite da 2 glicoproteine (G1 e G2),<br />
sono irregolari nella forma e nella <strong>di</strong>stibuzione. All’interno si<br />
osservano due strutture circolari (nucleocapsi<strong>di</strong>) <strong>di</strong> <strong>di</strong>mensioni<br />
<strong>di</strong>verse e contenenti una singola molecola <strong>di</strong> RNA.<br />
Caratteristica è la presenza <strong>di</strong> ribosomi, inglobati nel virione<br />
durante la maturazione, che conferiscono un aspetto<br />
sabbioso (dal latino arenaceus = sabbioso).<br />
Le principali proteine maggiori del nucleocapside, che sono<br />
simili nella forma e nella funzione in tutti gli arenavirus, sono<br />
tre: la nucleoproteina N costituisce circa il 70% delle proteine<br />
totali, possiede <strong>di</strong>versi determinati antigenici ed ha una attività<br />
protein-chinasica nel LCMV. Il virione contiene il 20% <strong>di</strong> lipi<strong>di</strong> e<br />
il 2% <strong>di</strong> aci<strong>di</strong> nucleici.<br />
Fig 4. Genoma degli arenavirus<br />
NUCLEOCAPSIDE<br />
Il Nucleocapside è costituito da due strutture circolari chiuse <strong>di</strong><br />
<strong>di</strong>verse <strong>di</strong>mensioni (640-1300 nm). Ognuna <strong>di</strong> queste classi a<br />
sua volta corrisponde ad una <strong>di</strong>versa classe <strong>di</strong>mensionale del<br />
genoma ad RNA. I nucleo-capsi<strong>di</strong> sono <strong>di</strong> 3 o 4 nm <strong>di</strong> <strong>di</strong>ametro<br />
e mostrano un aspetto a filo <strong>di</strong> perle che suggerisce la<br />
presenza <strong>di</strong> una serie <strong>di</strong> subunità globulari<br />
Fig. 3. Virione al microscopio elettronico<br />
GENOMA.<br />
Il genoma degli arenavirus è ad RNA a polarità negativa,<br />
presente in due segmenti subgenomici designati L (large<br />
2,4x10 bp) e S (small 1,3x10 bp). Ogni segmento è composto<br />
da due moduli <strong>di</strong> lettura non-sovrapposti <strong>di</strong> <strong>di</strong>versa polarità.<br />
L’estremità 5’ del segmento S co<strong>di</strong>fica il precursore della<br />
glicoproteina, mentre quella <strong>di</strong> L la proteina Z. L’estremità 3’ <strong>di</strong><br />
S co<strong>di</strong>fica la proteina N, mentre quella <strong>di</strong> L la proteina L, che<br />
Fig 5. Schema della trascrizione e traduzione degli<br />
arenavirus.<br />
2
Microbiology Upgrade<br />
RIBOSOMI<br />
Una caratteristica <strong>di</strong>stintiva degli arenavirus è la presenza <strong>di</strong><br />
strutture interne <strong>di</strong> tipo granulare <strong>di</strong> 20-25 nm <strong>di</strong> <strong>di</strong>ametro. Da<br />
questo aspetto granulare deriva il nome del virus. Si ritiene che<br />
questi componenti interni siano ribosomi derivati da cellule<br />
ospiti. I ribosomi virali sono in<strong>di</strong>stinguibili da quelli delle cellule<br />
non infettate, contengono le subunità ribosomiali 60, 40, 28 e<br />
18S e sono capaci <strong>di</strong> effettuare la sintesi proteica. Non sono<br />
un componente essenziale delle particelle infettive. Si ritiene<br />
che i ribosomi possano essere incorporati nei virioni durante il<br />
processo <strong>di</strong> replicazione come il risultato <strong>di</strong> una mancanza <strong>di</strong><br />
specificità nel processo <strong>di</strong> assemblaggio.<br />
REPLICAZIONE<br />
Gli arenavirus producono progenie virale con una minima<br />
perturbazione della cellula ospite. Il ciclo <strong>di</strong> replicazione è<br />
lento e spesso sono necessari 2/3 giorni per avere la massima<br />
produzione del virus. La bassa velocità <strong>di</strong> replicazione e<br />
l’incapacità <strong>di</strong> utilizzare parte delle sintesi macromolecolari<br />
dell’ospite (in genere non danno effetto citopatico) hanno<br />
ostacolato la compren-sione dei dettagli molecolari della<br />
riproduzione. L’adsorbimento alla cellula ospite avviene<br />
probabil-mente tra una glicoproteina del pericapside ed un<br />
recettore cellulare, ma non è noto quale glicoproteina del virus<br />
sia coinvolta nei fenomeni <strong>di</strong> fusione delle membrane. Sono<br />
stati ipotizzati due possibili mecca-nismi tramite i quali avviene<br />
l’ingresso della ribonu-cleoproteina nel citoplasma, che sono:<br />
1. la fusione del pericapside virale con la membrana<br />
plasmatica, fenomeno me<strong>di</strong>ato da una glicoproteina virale.<br />
2. fagocitosi del virione seguita dalle fusioni delle membrane<br />
del pericapside virale e del fago-soma.<br />
La trascrizione inizia al terminale 3’ dei due RNA (S e L), che<br />
sono a polarità negativa, e si ottengono rispettivamente le<br />
proteine N e L, previa formazione <strong>di</strong> mRNA corrispondenti<br />
(trascrizione primaria). Tali proteine determinano aumentati<br />
livelli <strong>di</strong> trascrizione dell’RNA. Quin<strong>di</strong> sono trascritti e tradotti i<br />
geni delle glicoproteine (RNA S) e del gene S (RNA L).<br />
Utilizzan-do i filamenti positivi quali stampi si formano gli RNA<br />
negativi, insieme alle proteine strutturali, ed il tutto viene<br />
assemblato nel virione. La latenza tra assorbi-mento e<br />
penetrazione e la produzione <strong>di</strong> una progenie virale è <strong>di</strong> 3/8<br />
ore, il tempo <strong>di</strong> massima produzione virale <strong>di</strong>pende dalla<br />
temperatura (36°C) e dalla quanti-tà infettante (molteplicità<br />
d’infezione), con un picco dopo 36 ore dall’infezione.<br />
In esperimenti condotti con inibitori della sintesi proteica, solo<br />
l’mRNA per la nucleoproteina è stato trovato acumulato nella<br />
cellula infetta. Si è visto che per molti arenavirus stu<strong>di</strong>ati, la<br />
sintesi delle glicopro-teine non è necessaria all’inizio<br />
dell’infezione, quando vengono sintetizzate le proteine N e L.<br />
La sintesi dell’mRNA per le glicoproteine avviene usando<br />
come stampo l’interme<strong>di</strong>o replicativo dell’RNA (RNA+).<br />
Nell’instaurarsi <strong>di</strong> una infezione persistente pare importante un<br />
rallentamento o ad<strong>di</strong>rittura un arresto della sintesi delle<br />
O.E. Varnier<br />
glicoproteine e dei loro mRNA. In vitro è stato osservato che le<br />
cellule con infezione persistente presentano scarse<br />
glicoproteine e una bassa produzione <strong>di</strong> particelle virali, ma<br />
una elevata quantità <strong>di</strong> nucleocapsi<strong>di</strong> nel plasma<br />
.<br />
NH 2 ------------GPC---------------COOH<br />
CLIVAGGIO<br />
NH 2 ---G1---COOH NH 2 -----G2----COOH<br />
In vivo invece questo non è confermato. La mancata sintesi <strong>di</strong><br />
glicoproteine può essere un meccanismo per eludere il<br />
sistema immunitario, tuttavia la proteina N è espressa sulla<br />
superficie delle cellule ed è antigenica. La massima<br />
produzione <strong>di</strong> nucleoproteine si ha 48-72 ore dopo l’infezione<br />
mentre la massima produzione <strong>di</strong> glicoproteine si ha 60 ore<br />
dopo, dopo<strong>di</strong>chè la produzione inizia a declinare.<br />
Viene prodotto un unico polipeptide (la glicoproteina GPC),<br />
successivamente clivato per dare origine alle glicoproteine G1<br />
e G2, entrambe espresse sulla superficie del virione maturo.<br />
G1 e G2 derivano rispettivamente dalla porzione<br />
amminoterminale e da quella carbossiterminale <strong>di</strong> GPC.<br />
Non è noto cosa induca il passaggio dalla trascrizione primaria<br />
(cioè produzione <strong>di</strong> mRNA, N e L) alla trascrizione secondaria<br />
(produzione <strong>di</strong> RNA negativo e delle glicoproteine). Gli inibitori<br />
della sintesi del DNA non hanno effetto sulla replicazione<br />
virale. L’actinomicina e l’alfa-amantina sembrano impe<strong>di</strong>re le<br />
fasi finali dello assemblaggio, ma non la sintesi proteica virale.<br />
È noto che il virus gemma attraverso la membrana plasmatica<br />
ma nulla è noto su tali processi maturativi.<br />
DIAGNOSI<br />
Diagnosi precoce. Una <strong>di</strong>agnosi precoce è essenziale per il<br />
trat-tamento <strong>di</strong> malattie come la Febbre <strong>di</strong> Lassa perchè prima<br />
inizia il trattamento dopo l’infezione, migliori sono le probabilità<br />
<strong>di</strong> sopravvivenza. Uno stu<strong>di</strong>o del 1986 sul trattamento della<br />
febbre <strong>di</strong> Lassa con ribavirina mostrò che se il livello <strong>di</strong> AST<br />
nel siero del paziente era oltre un valore soglia e/o se c’era<br />
viremia, il paziente aveva maggiori probabilità <strong>di</strong> decesso. È<br />
pure importante la <strong>di</strong>agnosi conclusiva, poichè i primi sintomi<br />
<strong>di</strong> febbre emorragica possono coincidere con quelli della<br />
malaria, tifo e influen-za, per le quali le cure <strong>di</strong>fferiscono<br />
totalmente. I meto<strong>di</strong> tra<strong>di</strong>zio-nali <strong>di</strong> <strong>di</strong>agnosi sono:<br />
1. Isolamento del virus: è il modo <strong>di</strong>retto per la<br />
determinazione del virus. Viene prelevato un campione <strong>di</strong><br />
siero, probabilmente conte-nente il virus che viene fatto<br />
crescere in coltura. Vengono impiegati anticorpi fluorescenti<br />
per l’identificazione del virus. Poichè<br />
frequentemente i virus isolati sono letali, le prove <strong>di</strong><br />
isolamento virale devono essere effettuate in laboratori<br />
attrezzati in quanto è elevato il rischio <strong>di</strong> <strong>di</strong> infezioni<br />
accidentali. Esso richiede circa una settimana per il<br />
completamento.<br />
2. Rilevamento <strong>di</strong> anticorpi specifici: Si ricerca la presenza<br />
<strong>di</strong> anticorpi specifici per il virus me<strong>di</strong>ante prove <strong>di</strong><br />
immunofluorescenza o <strong>di</strong> neutralizzazione.<br />
PREVENZIONE E TRATTAMENTO<br />
Due sono le vie seguite:<br />
A. Controllo dei ro<strong>di</strong>tori: gli ospiti naturali della maggior<br />
parte degli arenavirus sono i ro<strong>di</strong>tori (ratti, topi, ecc.).<br />
Infatti in una epidemia più del 30% dei ro<strong>di</strong>tori può essere<br />
infettato da arenavirus. Una volta infettati i ro<strong>di</strong>tori, che<br />
<strong>di</strong>ffondono l’infezione tramite le urine. Il meto-do migliore<br />
per porre limitare la <strong>di</strong>ffusione della infezione da<br />
arenavirus, è <strong>di</strong> eliminare la presenza <strong>di</strong> ro<strong>di</strong>tori nelle<br />
abitazioni.<br />
3
Microbiology Upgrade<br />
O.E. Varnier<br />
Fig. 7 Ciclo vitale degli arenavirus<br />
B) Vaccinazione: produrre vaccini in grado <strong>di</strong> attenuare la<br />
virulenza degli arenavirus o <strong>di</strong> proteggere dall’infezione è<br />
attualmente quasi impossibile. La biologia molecolare<br />
degli are-navirus è poco nota ed inoltre solo in alcuni<br />
laboratori sono attrezzati con livelli <strong>di</strong> sicurez-za tali da<br />
consentire <strong>di</strong> effettuare esperimenti. Un potenziale<br />
vaccino, preparato con il virus vaccinico mo<strong>di</strong>ficato per<br />
esprimere il gene co<strong>di</strong>ficante la glicoprot eina del virus <strong>di</strong><br />
Lassa, ha indotto protezione nelle cavie e nelle scimmie.<br />
TERAPIA<br />
Il farmaco <strong>di</strong> scelta è la ribavirina, che ha una maggior<br />
efficacia se somministrato precocemente.<br />
Aggiornato il 7 gennaio 2007<br />
4