VIROLOGIA: PATOGENESI - Sezione di Microbiologia
VIROLOGIA: PATOGENESI - Sezione di Microbiologia
VIROLOGIA: PATOGENESI - Sezione di Microbiologia
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
Schede <strong>di</strong> <strong>Microbiologia</strong><br />
OE Varnier<br />
L'azione patogena dei virus, cioè la loro capacità <strong>di</strong><br />
determinare “in vivo” malattia, deve essere valutata in<br />
relazione a due eventi ugualmente importanti e<br />
caratterizzanti: la realizzazione della infezione, da una<br />
parte, e la produzione e l’estrinsecazione delle lesioni<br />
dall'altra.<br />
Ambedue gli eventi sono con<strong>di</strong>zionati in larga misura<br />
non solo dal virus, ma anche dalle caratteristiche e dalle<br />
modalità <strong>di</strong> risposta dell'ospite.<br />
L’INFEZIONE<br />
La realizzazione dell’infezione (fig.1) prevede la<br />
penetrazione del virus nell’ospite e la sua repli-cazione in<br />
organi e tessuti specificamente definiti.<br />
<strong>VIROLOGIA</strong>: <strong>PATOGENESI</strong><br />
Penetrazione<br />
La penetrazione è talora passiva (rabbia, AIDS,<br />
epatite B, togavirus, bunyavirus, flavivirus) e consiste in<br />
una immissione <strong>di</strong>retta del virus nel circolo linfoematico<br />
quasi sempre per via transcu-tanea tramite morsicature,<br />
eventi traumatici, uso <strong>di</strong> siringhe o aghi infetti, inoculazioni<br />
realizzate da artropo<strong>di</strong> vettori. Più frequen-temente<br />
avviene per inalazione o ingestione, quin<strong>di</strong> per<br />
superamento <strong>di</strong> barriere mucose rispettivamente<br />
delimitanti le vie aeree o il lume intestinale.<br />
In questo caso, per potere penetrare, il virus deve<br />
possedere adeguati caratteri <strong>di</strong> resistenza (virulenza)<br />
che gli consentano <strong>di</strong> sfuggire ad una inattivazione<br />
altrimenti inevitabile ad opera <strong>di</strong> <strong>di</strong>versi fattori <strong>di</strong> <strong>di</strong>fesa<br />
aspecifici presenti in corrispondenza delle mucose stesse<br />
(muco, pH acido, sali biliari, enzimi proteolitici, ecc.).<br />
In alcuni virus è <strong>di</strong>mostrato che la resistenza<br />
all’inattivazione è legata alla presenza, nel virione, <strong>di</strong><br />
singoli polipepti<strong>di</strong> adeguatamente configurati: nel virus<br />
influenzale, ad esempio, la neuraminidasi è deputata ad<br />
evitare il blocco degli antirecettori virali altrimenti operato<br />
dagli aci<strong>di</strong> sialici presenti nel muco delle vie aeree.<br />
L’effettiva penetrazione del virus attraverso le mucose<br />
avviene in genere per effetto <strong>di</strong> una sua <strong>di</strong>retta replicazione<br />
nelle cellule con cui è venuto inizialmente a<br />
contatto. In alternativa (reovirus, forse poliovirus) vi è<br />
anche la possibilità <strong>di</strong> un attraversamento passivo<br />
me<strong>di</strong>ato dalle cellule epiteliali “specializzate” (le cosiddette<br />
cellule M o cellule “microfold”), che ricoprono<br />
accumuli <strong>di</strong> cellule linfoi<strong>di</strong> in imme<strong>di</strong>ato contatto con<br />
l’epitelio mucoso (placche <strong>di</strong> Peyer dell’intestino, tessuto<br />
linfoide tonsillare, tessuto linfoide bronchiale) e che sono<br />
dotate <strong>di</strong> attiva capacità fagocitaria nei confronti <strong>di</strong> vari<br />
materiali particolati o macromolecolari estranei che esse<br />
trasferiscono al tessuto linfoide sottostante, con il quale<br />
sono intimamente associate attraverso una serie <strong>di</strong><br />
processi citoplasmatici. In tal caso il virus, inglobato in<br />
vacuoli, viene trasferito al tessuto linfoide sottostante il<br />
quale, oltre ad attivare la risposta immunitaria, può<br />
<strong>di</strong>venire a sua volta sede <strong>di</strong> replicazione virale o area <strong>di</strong><br />
ulteriore transito verso il circolo linfoematico.<br />
pagina 1 <strong>di</strong> 5<br />
Replicazione<br />
Avvenuta la penetrazione o in coincidenza con essa, il<br />
virus va incontro ad una replicazione primaria nelle<br />
cellule permissive <strong>di</strong>slocate in corrispondenza o in<br />
prossimità del sito <strong>di</strong> ingresso.<br />
Nel corso <strong>di</strong> alcune infezioni (da virus influenzale,<br />
rotavirus ed altri agenti <strong>di</strong> enterite acuta) la replicazione<br />
primaria può assumere estensione tale da <strong>di</strong>venire essa<br />
stessa causa <strong>di</strong> malattia; in questi casi il processo<br />
infettivo può rimanere localizzato sia per peculiari<br />
caratteristiche del virus, sia per una pronta attivazione<br />
delle risposte immunitarie.<br />
In altre situazioni (malattie esantematiche, infezioni da<br />
virus parotitico, poliovirus, coxsackievirus, ecc.) la<br />
replicazione primaria è invece limitata e comunque<br />
quasi sempre asintomatica o paucisintomatica (manifestazioni<br />
della fase prodromica della malattia). II virus ha<br />
così il tempo <strong>di</strong> <strong>di</strong>ffondersi in aree <strong>di</strong>stanti dal sito <strong>di</strong><br />
ingresso e <strong>di</strong> andare incontro, in tali aree, a cicli <strong>di</strong><br />
replicazione secondaria. L’infezione si estende ad<br />
organi <strong>di</strong>versi; ad una prima viremia ne segue<br />
eventualmente una seconda viremia, sostenuta dalla<br />
nuova localizzazione virale e perdurante fino alla definitiva<br />
attivazione delle risposte immunitarie dell’ospite.<br />
Nelle infezioni <strong>di</strong>sseminate così instauratesi la<br />
<strong>di</strong>ffusione virale può avvenire per vie <strong>di</strong>fferenti (linfatica,<br />
ematica, neuronale) e con <strong>di</strong>fferenti modalità (sotto<br />
forma <strong>di</strong> virioni liberi – entero-virus-, o <strong>di</strong> virioni<br />
associati ad elementi lin-fomonocitari circolanti - virus<br />
del morbillo, herpesvirus-). Come la penetrazione, anche<br />
la <strong>di</strong>ffu-sione è spesso con<strong>di</strong>zionata dalla capacità del<br />
virus <strong>di</strong> esprimere caratteri <strong>di</strong> virulenza che gli consentano<br />
<strong>di</strong> superare i meccanismi <strong>di</strong> <strong>di</strong>fesa del-l’ospite,<br />
questa volta sia aspecifici che specifici e particolarmente<br />
efficienti, a livello linfo-ematico, in ambedue le componenti<br />
umorale e cellulare.<br />
In tal senso ha certamente una grande rilevanza la<br />
proprietà esibita da alcuni virus <strong>di</strong> infettare i linfociti B e<br />
T e gli elementi circolanti della serie monocitomacrofagica.<br />
Tale è ad esempio, fra i virus umani, il caso<br />
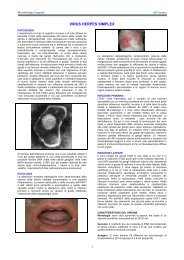
del virus <strong>di</strong> Epstein-Barr (linfociti B), del virus dell'herpes<br />
simplex, del cito-megalovirus, del virus della rosolia, degli<br />
agenti della febbre gialla, della dengue e delle altre febbri<br />
emorragiche virali (macrofagi). L'infezione dei linfomonociti<br />
da parte del virus non solo consente allo<br />
stesso <strong>di</strong> realizzare un sistema <strong>di</strong> <strong>di</strong>ffusione protetta<br />
(all’interno delle cellule infatti il virus non può essere<br />
raggiunto nè dagli anticorpi, nè dai <strong>di</strong>versi fattori del
Schede <strong>di</strong> <strong>Microbiologia</strong><br />
OE Varnier<br />
complemento), ma anche con<strong>di</strong>ziona, deprimendole, le<br />
importanti azioni <strong>di</strong>fensive esercitate dai macrofagi, e, per<br />
quanto concerne i linfociti, ne mo<strong>di</strong>fica le modalità <strong>di</strong><br />
risposta.<br />
Con particolare riferimento ai macrofagi è stato<br />
possibile documentare nel corso <strong>di</strong> <strong>di</strong>verse infezioni (ad<br />
esempio da herpesvirus) una stretta inter<strong>di</strong>pendenza fra<br />
permissività macrofagica in vitro e grado <strong>di</strong> espressione in<br />
vivo della potenzialità patogena virale. È stato osservato<br />
altresì che in macrofagi provenienti da uno stesso<br />
in<strong>di</strong>viduo il livello <strong>di</strong> permissività può variare grandemente<br />
in relazione a <strong>di</strong>versi fattori quali l'età dell’in<strong>di</strong>viduo (in<br />
genere <strong>di</strong>minuisce con il procedere dell’in-vecchiamento),<br />
le fasi del ciclo mitotico, lo sta<strong>di</strong>o <strong>di</strong> <strong>di</strong>fferenziazione delle<br />
cellule macrofagiche, l’organo da cui tali cellule erano<br />
state prelevate; parallelamente variano molto spesso la<br />
suscettibilità dell’ospite o degli organi al virus, ed il grado<br />
<strong>di</strong> virulenza che quest'ultimo riesce a realizzare.<br />
Con l’attivazione delle risposte immunitarie viene<br />
senza dubbio incrementata la funzione <strong>di</strong>fensiva macrofagica<br />
nei confronti <strong>di</strong> numerose infezioni anche virali.<br />
Alcuni virus (citomegalovirus, virus delle febbri<br />
emorragiche) possono tuttavia conti-nuare a moltiplicarsi<br />
anche nei macrofagi attivati riuscendo alla fine,<br />
eventualmente, ad instaurare in essi infezioni persistenti.<br />
Occasionalmente, in corso <strong>di</strong> dengue o <strong>di</strong> altre infezioni<br />
sostenute da Ribovirus, sono stati osservati aggravamenti<br />
sintomatologici conseguenti alla comparsa in<br />
circolo <strong>di</strong> anticorpi antivirali. Infatti la formazione <strong>di</strong><br />
complessi virus-anticorpi, prima che possa avvenire la<br />
neutralizzazione extra-cellu-lare del virus, causa, per<br />
effetto della presenza <strong>di</strong> recettori Fc sulla superficie<br />
macrofagica, una più efficiente captazione dei complessi<br />
stessi ad opera <strong>di</strong> tali cellule, quin<strong>di</strong> una più estesa<br />
capacità infettante virale; infine i complessi virus-anticorpo<br />
possono influenzare l’accentuazione delle manifestazioni<br />
cliniche, la possibile comparsa <strong>di</strong> sindrome da<br />
shock e la più frequente evoluzione letale del processo<br />
infettivo.<br />
Questi aggravamenti, solo in parte riferibili a fenomeni<br />
<strong>di</strong> ipersensibilità, sono stati principalmente ricondotti alla<br />
citata capacità degli agenti <strong>di</strong> moltiplicarsi all’interno dei<br />
macrofagi.<br />
Organi bersaglio<br />
Il coinvolgimento d'organo, in corso <strong>di</strong> infezioni sia<br />
localizzate che <strong>di</strong>sseminate, può anche <strong>di</strong>pen-dere dalle<br />
modalità <strong>di</strong> penetrazione del virus e dalle sue capacità<br />
<strong>di</strong>ffusive; certamente è con<strong>di</strong>zionato dal tropismo cellulare<br />
del virus stesso e dalla per-missività dell’organo alla<br />
completa e produttiva re-plicazione virale.<br />
II tropismo cellulare e tissutale (tropismo <strong>di</strong> organo)<br />
del virus è in effetti un ulteriore fattore <strong>di</strong> grande rilevanza<br />
nella caratterizzazione del processo infettivo. Esso è in<br />
stretta <strong>di</strong>pendenza della presenza <strong>di</strong> strutture<br />
complementari sulla superficie del virus e sulla superficie<br />
delle cellule bersaglio.<br />
LE LESIONI<br />
Realizzatasi l’infezione, negli organi interessati<br />
possono venirsi a determinare <strong>di</strong>fferenti tipi <strong>di</strong> lesioni<br />
anatorno-funzionali. Tali lesioni possono <strong>di</strong>rettamente<br />
derivare dall'azione citopatogena del virus o possono<br />
essere conseguenze della attiva-zione delle risposte<br />
immunitarie dell’ospite; que-ste possono anche agire<br />
mo<strong>di</strong>ficando il tipo <strong>di</strong> rapporto instaurato dal virus con le<br />
cellule infette; talora le risposte immunitarie vengono<br />
invece depresse e la malattia si manifesta per effetto delle<br />
conseguenti gravi compromissioni delle <strong>di</strong>fese del-l’ospite.<br />
pagina 2 <strong>di</strong> 5
Schede <strong>di</strong> <strong>Microbiologia</strong><br />
OE Varnier<br />
In alcune con<strong>di</strong>zioni i <strong>di</strong>versi meccanismi pato-genetici<br />
intervengono singolarmente; in altre, più <strong>di</strong> un<br />
meccanismo è coinvolto nell'effettivo determini-smo della<br />
malattia (fig. 2).<br />
Lesioni <strong>di</strong>rettamente provocate dal virus<br />
Gli organi sede del processo replicativo virale vanno<br />
spesso incontro ad alterazioni clinicamente manifeste per<br />
effetto <strong>di</strong> danni <strong>di</strong>rettamente provo-cati dal virus, in stretta<br />
correlazione con il peculiare tipo <strong>di</strong> rapporto instaurato dal<br />
virus stesso con le cellule infette. Tale rapporto può<br />
essere quello dell'infezione citocida, dell’infezione latente,<br />
dell’in-fezione persistente produttiva, della trasformazione<br />
oncogena, e le espressioni conseguenti possono<br />
configurarsi rispettivamente in malattie acute, reci<strong>di</strong>vanti,<br />
croniche, lente e neoplastiche.<br />
Infezioni citocide<br />
Nelle infezioni citocide il virus si replica produttivamente<br />
nelle cellule infette e determina in esse<br />
mo<strong>di</strong>ficazioni irreversibili e <strong>di</strong> entità tale da provocare la<br />
morte cellulare in un arco <strong>di</strong> tempo variabile da alcune ore<br />
a pochi giorni. Le malattie sono quasi sempre acute e<br />
caratterizzate da brevi perio<strong>di</strong> <strong>di</strong> incubazione (influenza,<br />
poliomielite, ente-riti, encefaliti erpetiche, encefaliti da<br />
togavirus, ecc); l’immunità esercita un ruolo in genere<br />
protettivo.<br />
A livello cellulare gli eventi degenerativi possono<br />
realizzarsi già in conseguenza del semplice, iniziale<br />
adsorbimento del virus alla cellula; più spesso si<br />
manifestano in fasi successive del ciclo moltiplica-tivo<br />
virale, o si amplificano durante la sua evolu-zione.<br />
“In vitro”, l’espressione morfologica del danno prodotto<br />
dall’infezione con virus citoci<strong>di</strong>, o effetto citopatico,<br />
può essere ricondotto, sia pur schema-ticamente, a tre<br />
modelli fondamentali:<br />
1) lesioni <strong>di</strong> tipo degenerativo, ingravescenti con il<br />
progre<strong>di</strong>re del ciclo moltiplicativo virale, le quali raggiungono<br />
la massima intensità al mo-mento della<br />
formazione della progenie virale ma-tura: questo tipo<br />
<strong>di</strong> effetto citopatico è in genere caratteristico dei virus<br />
con capside isometrico, sprovvisti <strong>di</strong> pericapside,<br />
che si accumulano all’interno delle cellule e si liberano<br />
per lisi <strong>di</strong> quest'ultime;<br />
2) formazione <strong>di</strong> estesi sincizi o policariociti, derivati<br />
dalla fusione <strong>di</strong> cellule infette contigue, seguita tar<strong>di</strong>vamente<br />
dalla comparsa <strong>di</strong> lesioni <strong>di</strong> tipo degenerativo,<br />
caratteristica dei Paramy-xovirus e <strong>di</strong> alcuni ceppi<br />
<strong>di</strong> Herpesvirus e Pox-virus, <strong>di</strong> virus costantemente<br />
provvisti <strong>di</strong> peri-capside derivato dalla membrana<br />
cellulare;<br />
3) comparsa <strong>di</strong> lesioni degenerative, tar<strong>di</strong>ve ri-spetto<br />
all’inizio della liberazione del virus neo-prodotto, caratteristica<br />
<strong>di</strong> ribovirus forniti <strong>di</strong> pericapside, ma non<br />
sinciziogeni (in particolare Orthomyxovirus).<br />
“In vivo”, negli organi interessati possono corrispondentemente<br />
osservarsi immagini citoplasmati-che <strong>di</strong><br />
degenerazione balloniforme, vacuolizzazione, poichilocitosi,<br />
degenerazione spongiforme, e nuclea-ri <strong>di</strong><br />
picnosi, aggregazioni o marginazione cromati-nica, o può<br />
aversi evidenza <strong>di</strong> fusione cellulare con comparsa <strong>di</strong><br />
cellule giganti.<br />
In tutti i casi, sia in vivo che in vitro, può associarsi la<br />
formazione <strong>di</strong> inclusioni cellulari visibili nei preparati<br />
colorati come accumuli, in determi-nate zone cellulari, <strong>di</strong><br />
materiale neo-prodotto che respinge alla periferia, o<br />
sostituisce, il materiale cellulare circostante. Gli inclusi<br />
sono spesso carat-teristici per morfologia e <strong>di</strong>slocazione e<br />
come tali utilizzabili a fini <strong>di</strong>agnostici. Di norma rappresen-tano<br />
aggregazioni <strong>di</strong> virioni neoprodotti o accumuli<br />
<strong>di</strong> subunità virali non assemblate (corpi del Negri, da<br />
virus della rabbia; corpi <strong>di</strong> Guarnieri, da Poxvirus del<br />
gruppo vaiolo-vaccino; corpi <strong>di</strong> Torres, da virus della<br />
febbre gialla). Nel nucleo gli inclusi possono presentarsi <strong>di</strong><br />
piccole <strong>di</strong>mensioni ed in numero variabile (tipo B <strong>di</strong><br />
Cowdry), ovvero possono lentamente crescere e<br />
confluire fino ad occupare quasi tutto lo spazio<br />
<strong>di</strong>sponibile spin-gendo il nucleolo e la cromatina verso la<br />
membrana nucleare apparente-mente integra (tipo A <strong>di</strong><br />
Cowdry); in quest'ultimo caso concorrono ad altera-re<br />
strutture e funzioni vitali delle cellule infette.<br />
Le vere cause della citoci<strong>di</strong>a vanno comunque<br />
ricercate in eventi più o meno precoci, capaci, in primo<br />
luogo, <strong>di</strong> vanificare l’importante meccanismo <strong>di</strong> <strong>di</strong>fesa<br />
cellulare costituito dalla produzione <strong>di</strong> interferon, quin<strong>di</strong>,<br />
<strong>di</strong> favorire l’utilizzazione <strong>di</strong> una larga parte del macchinario<br />
proteino-sintetico cellulare per la realizzazione delle<br />
sintesi virus-specifiche. Questi eventi consistono essenzialmente<br />
in blocchi delle sintesi macromolecolari<br />
cellulari, in alterazioni della membrana citoplasmatica, in<br />
alterazioni delle membrane lisosomiali.<br />
L’inibizione delle sintesi macromolecolari cellu-lari può<br />
verificarsi a vari livelli nel corso delle <strong>di</strong>ver-se infezioni<br />
sostenute da virus citoci<strong>di</strong>. Le inibizioni sono talora<br />
provocate da proteine “precoci” virus-indotte: in tali casi<br />
possono manifestarsi danni irreversibili anche in assenza<br />
<strong>di</strong> produzione <strong>di</strong> pro-genie infettante, per effetto cioè <strong>di</strong><br />
cicli replicativi virali incompleti o “abortivi”.<br />
In alcuni sistemi, le singole tappe metaboliche<br />
coinvolte nel processo <strong>di</strong> danneggiamento provocato dal<br />
virus a carico delle cellule infette, e le modalità stesse del<br />
danno, sono state identificate con precisione. Ad esempio<br />
è stato <strong>di</strong>mostrato che i polio-virus sono responsabili della<br />
inattivazione <strong>di</strong> una proteina cellulare (cap-bin<strong>di</strong>ng<br />
protein) deputata all’inserimento della struttura mGpppN<br />
in corrispondenza dell'estremità 5' degli mRNA cellulari;<br />
l’assenza <strong>di</strong> tale struttura negli mRNA virali, e il fatto che<br />
essa è necessaria per la traduzione dei messaggeri<br />
cellulari ma non <strong>di</strong> quelli virali, spiega l’inibizione selettiva<br />
delle sintesi proteiche cellulari.<br />
Per quanto concerne il virus influenzale, è stato analogamente<br />
osservato che un enzima virus- specifico determina<br />
il trasferimento dei residui guaninici metilati e <strong>di</strong><br />
alcuni nucleoti<strong>di</strong> terminali dall'estremità 5' degli mRNA<br />
cellulari all'estremità 5' degli mRNA virali; i messaggeri<br />
cellulari sono così inibiti, quelli virali attivati.<br />
Anche le mo<strong>di</strong>ficuzioni della membrana citoplasmatica,<br />
iniziando già al momento del primo adsorbimento<br />
del virus alla cellula infetta, possono deter-minare<br />
in essa precoci turbe metaboliche ed alterazioni<br />
irreversibilmente evolutive.<br />
In seguito a contatto con virus sia “nu<strong>di</strong>” che<br />
inviluppati, la membrana va infatti incontro ad un pronto,<br />
svelabile incremento del suo grado <strong>di</strong> flui<strong>di</strong>tà; seguono<br />
transitorie depolarizzazioni ed alterazioni nelle proprietà<br />
<strong>di</strong> trasporto responsabili <strong>di</strong> liberazione <strong>di</strong><br />
metaboliti nel mezzo <strong>di</strong> coltura, fuoriuscita <strong>di</strong> potassio<br />
intracellulare, aumentato influsso <strong>di</strong> altri ioni, principalmente<br />
so<strong>di</strong>o, ma in un secondo tempo anche dello stesso<br />
potassio, nonchè <strong>di</strong> composti <strong>di</strong>versi quali colina e deossiglucoso.<br />
Nel corso <strong>di</strong> alcune infezioni, ad esempio con<br />
poliovirus, l’elevata concentrazione intracel-lulare <strong>di</strong> Na+<br />
può agire favorendo le traduzioni virali a scapito <strong>di</strong> quelle<br />
cellulari.<br />
A <strong>di</strong>fferenza delle lesioni precedentemente de-scritte,<br />
che iniziano e si manifestano già nelle pri-missime fasi del<br />
processo moltiplicativo virale, le alterazioni lisosomiali<br />
appaiono successivamente ma sono ugualmente, se non<br />
ancor più rilevanti nell'evoluzione del processo<br />
degenerativo cellulare. Proteine virali tar<strong>di</strong>ve sembrano<br />
responsabili delle alterazioni, prima reversibili, quin<strong>di</strong><br />
irreversibili, <strong>di</strong> questi organelli cellulari; ad esse<br />
conseguono la liberazione degli enzimi idrolitici contenuti<br />
negli organelli stessi, ed il definitivo danneggiamento delle<br />
strutture cellulari.<br />
Nel periodo del danno reversibile si accentua la già<br />
aumentata permeabilità <strong>di</strong> membrana; le cellule possono<br />
incorporare maggiori quantità <strong>di</strong> coloranti vitali (ad<br />
esempio rosso neutro) ed in colture mantenute sotto<br />
strato <strong>di</strong> agar (tecnica delle placche) si formano placche<br />
rosse. Durante il periodo del dan-no irreversibile si ha invece<br />
la massima liberazione degli enzimi idrolitici nel<br />
citoplasma cellulare e la <strong>di</strong>struzione della cellula, che<br />
perde definitiva-mente la capacità <strong>di</strong> assumere il colorante<br />
vitale; nelle colture “in vitro” si sviluppa l’effetto citopatico;<br />
sotto strato <strong>di</strong> agar si formano le placche chiare.<br />
Infezioni latenti<br />
Non sempre i virus animali, inclusi quelli potenzialmente<br />
dotati <strong>di</strong> elevata virulenza, uccidono le<br />
cellule in cui si sono moltiplicati; in talune con<strong>di</strong>zioni essi<br />
possono realizzare un rapporto <strong>di</strong> parassitismo controllato<br />
pagina 3 <strong>di</strong> 5
Schede <strong>di</strong> <strong>Microbiologia</strong><br />
OE Varnier<br />
che consente alle cellule stesse non solo <strong>di</strong> sopravvivere,<br />
ma anche <strong>di</strong> duplicarsi secondo modalità, almeno in<br />
apparenza, del tutto normali.<br />
Nella latenza vi è spesso integrazione del genoma<br />
virale in quello dell’ospite. II virus permane nella cellula in<br />
forma criptica senza neoproduzione <strong>di</strong> virioni infettanti e<br />
senza formazione <strong>di</strong> larghe quantità <strong>di</strong> antigeni<br />
virus-specifici. In vivo si instaurano infezioni asintomatiche<br />
in grado <strong>di</strong> decorrere per tutta la vita senza <strong>di</strong>venire mai<br />
clinicamente manifeste.<br />
Perio<strong>di</strong>camente, od occasionalmente, sono tuttavia<br />
possibili riprese moltiplicative virali (riattivazioni); a queste<br />
si possono accompagnare cicli produttivi <strong>di</strong> infezione<br />
citocida e, clinicamente, episo<strong>di</strong> <strong>di</strong> malattie reci<strong>di</strong>vanti<br />
(esempio tipico Herpete labiale) o forme morbose anche<br />
gravi quale la malattia citomegalica in soggetti<br />
immunocompromessi.<br />
Le cause della latenza sono ancora sostanzialmente<br />
oscure; le se<strong>di</strong> variano in relazione al virus infettante (ad<br />
esempio: i gangli sensoriali, per quanto concerne il virus<br />
dell'herpes simplex ed il virus della varicella-zoster; i<br />
linfomonociti, per citomegalovirus e virus <strong>di</strong> EpsteinBarr).<br />
Infezioni persistenti<br />
Anche le infezioni persistenti, come quelle latenti,<br />
rappresentano una con<strong>di</strong>zione <strong>di</strong> parassitismo virale<br />
controllato. A <strong>di</strong>fferenza della latenza, nella persistenza vi<br />
è però continua produzione <strong>di</strong> notevoli quantità <strong>di</strong><br />
antigeni virali e, spesso, anche <strong>di</strong> virus infettante. Le cellule<br />
non subiscono danni letali <strong>di</strong>rettamente ad opera del<br />
virus, ma, in vivo, sono esposte, per la presenza <strong>di</strong><br />
antigeni virus-specifici sulla loro superficie, ad azioni<br />
lesive esercitate in tempi più o meno lunghi dalle risposte<br />
immunitarie dell’ospite. Ne possono conseguire malattie<br />
cronicamente evolutive (epatite cronica attiva da virus<br />
dell'epatite B) o malattie lente caratterizzate da lunghi<br />
perio<strong>di</strong> <strong>di</strong> incubazione asintomatica e da prognosi infausta<br />
(panencefalite sub-acuta sclerosante da virus del<br />
morbillo).<br />
Talora, per effetto degli impegni metabolici derivanti<br />
dalla replicazione virale, le cellule persi-stentemente<br />
infettate vanno incontro a mo<strong>di</strong>ficazioni capaci <strong>di</strong><br />
determinare inibizioni <strong>di</strong> funzioni <strong>di</strong> lusso (cioè<br />
specificamente deputate alla formazione <strong>di</strong> prodotti<br />
specializzati quali ormoni, mielina, ecc.). Ne possono<br />
derivare forme morbose, in questo caso <strong>di</strong>sfunzionali, del<br />
tipo ad esempio <strong>di</strong> quelle <strong>di</strong>sendocrine in origine<br />
osservate nei topi in seguito ad infezione con virus della<br />
coriomeningite linfocitaria.<br />
Trasformazione<br />
Con il termine trasformazione si in<strong>di</strong>cano le<br />
mo<strong>di</strong>ficazioni cui vanno incontro alcune cellule in vitro in<br />
seguito ad infezioni ad opera <strong>di</strong> virus oncogeni.Tali virus,<br />
con modalità che verranno analizzate in dettaglio nel<br />
capitolo ad essi de<strong>di</strong>cato, sono <strong>di</strong>rettamente responsabili,<br />
in sistemi specificamente suscettibili, <strong>di</strong> alterazioni non<br />
degenerative, ma anzi con<strong>di</strong>zionanti la proliferazione<br />
anomala ed incontrollata delle cellule infette (trasformate).<br />
Le cellule trasformate perdono la capacità <strong>di</strong> controllo dei<br />
loro processi moltiplicativi ed acquisiscono<br />
caratteristiche peculiari quali: irregolare morfologia,<br />
anomalie cromosomiche, elevata attivi-tà glicolitica,<br />
<strong>di</strong>fetti nel trasporto <strong>di</strong> membrana, elevata agglutinabilità<br />
da lectine, assenza <strong>di</strong> ini-bizione da contatto,<br />
capacità <strong>di</strong> dare origine a colonie in strato <strong>di</strong> agar.<br />
Nelle cellule trasformate si evidenziano inoltre nuove<br />
specificità antigeniche capaci <strong>di</strong> determinare il rigetto in<br />
seguito a trapianto in animali immunocompetenti<br />
consaguinei. La loro inocula-zione in animali neonati o<br />
sottoposti a trattamenti immunosoppressivi provoca invece<br />
spesso formazione <strong>di</strong> tumori.<br />
La trasformazione cellulare viene considerata<br />
l’equivalente in vitro dell'oncogenicità virale in vivo. Le<br />
<strong>di</strong>fese immunitarie dell'ospite sembrano esercitare un<br />
ruolo, almeno per qualche tempo, efficientemente<br />
protettivo.<br />
Lesioni <strong>di</strong>pendenti dal coinvolgimento del sistema<br />
immunitario dell’ospite<br />
Se è indubbio che le risposte immunitarie dell’ospite<br />
contribuiscono in larga misura alla guarigione e/o alla<br />
limitazione <strong>di</strong> molte infezioni virali, con<strong>di</strong>zionando inoltre<br />
l’instaurarsi <strong>di</strong> perio<strong>di</strong> più o meno duraturi <strong>di</strong> immunità alle<br />
reinfezioni, è altrettanto vero che in alcune situazioni esse<br />
parte-cipano in misura rilevante al processo patologico<br />
instaurato dal virus ed alle manifestazioni cliniche a tale<br />
processo conseguenti.<br />
Le modalità <strong>di</strong> coinvolgimento del sistema immunitario<br />
sono in queste situazioni riconducibili: a) alla<br />
stimolazione antigenica costantemente esercitata dai<br />
virus infettanti, e b) alla capacità <strong>di</strong> alcuni <strong>di</strong> essi <strong>di</strong> infettare<br />
specificamente le cellule immunocompetenti (macrofagi<br />
e/o linfociti). Nel primo caso possono essere<br />
attivati <strong>di</strong>versi meccanismi patogenetici responsabili <strong>di</strong><br />
lesioni a carico sia delle cellule infette che <strong>di</strong> organi<br />
non <strong>di</strong>rettamente interessati dal processo replicativo<br />
virale e possono verificarsi fenomeni apparentemente<br />
para-dossali <strong>di</strong> aumentata replicazione <strong>di</strong> virus (quale<br />
quello della dengue) capaci <strong>di</strong> moltiplicarsi in cellule<br />
macrofagiche.<br />
Nel secondo caso, in particolare per danni specificamente<br />
apportati a singole sottopopolazioni linfo-citarie,<br />
possono manifestarsi alterazioni anche gravi ed<br />
irreversibili dei sistemi <strong>di</strong> controllo e <strong>di</strong> espressione della<br />
stessa risposta immunitaria.<br />
Lisi immunitaria <strong>di</strong> cellule infette<br />
In molte infezioni virali, particolarmente da virus con<br />
pericapside, ma anche da virus nu<strong>di</strong> (papovavirus, virus<br />
Coxsackie), si assiste alla comparsa <strong>di</strong> antigeni virus<br />
co<strong>di</strong>ficati sulla membrana citopla-smatica delle cellule<br />
infette; in altre situazioni si può avere lo smascheramento,<br />
per effetto dell'infezione virale, <strong>di</strong> antigeni cellulari<br />
pre-esistenti allo stato criptico; in altre situazioni ancora<br />
l’infezione virale può indurre la sintesi <strong>di</strong> neo-antigeni<br />
cellulari (ad esempio, recettori per il frammento<br />
immunoglobulinico Fc in cellule infettate con il virus<br />
dell'herpes simplex).<br />
Nei confronti <strong>di</strong> tutti questi antigeni può intervenire il<br />
sistema immunitario dell’ospite determinando, con vari<br />
meccanismi, la lisi delle cellule infette. Spesso tale citolisi<br />
contribuisce a delimitare la <strong>di</strong>ffusione del virus nell'organismo<br />
infetto; a volte essa è particolarmente protettiva<br />
quando si realizza in fasi precoci del processo replicativo<br />
virale, prima ancora cioè che virus infettante venga<br />
prodotto.<br />
Per la sua peculiare natura, la citolisi immunitaria è<br />
però anche, inevitabilmente, momento <strong>di</strong> patogenicità<br />
talora <strong>di</strong> grande rilevanza nel determinismo delle<br />
manifestazioni cliniche. Il suo ruolo patogeno può <strong>di</strong>venire<br />
ad<strong>di</strong>rittura predominante ed è più evidente in quei casi <strong>di</strong><br />
infezione persistente in cui il virus non è in grado <strong>di</strong><br />
esercitare esso stesso azione lesiva <strong>di</strong>retta.<br />
Tabella. Meccanismi patogenetici immuno-<strong>di</strong>pendenti attivabili in corso <strong>di</strong> infezioni virali.<br />
MECCANISMI PATOGENETICI<br />
MEDIATORI<br />
Lisi <strong>di</strong> cellule infette<br />
Linfociti citolitici (CTL) (azione <strong>di</strong>retta)<br />
Linfociti NK e macrofagi (azione <strong>di</strong>retta,<br />
potenziata da interferon e linfochine)<br />
Linfociti NK, macrofagi e neutrofili polimorfonucleati,<br />
in presenza <strong>di</strong> anticorpi specifici (citolisi<br />
anticorpo <strong>di</strong>pendente)<br />
pagina 4 <strong>di</strong> 5
Schede <strong>di</strong> <strong>Microbiologia</strong><br />
OE Varnier<br />
Fenomeni <strong>di</strong> ipersensibilità<br />
Incremento anticorpo-<strong>di</strong>pendente della<br />
replicazione <strong>di</strong> virus capaci <strong>di</strong> infettare i<br />
macrofagi<br />
Anticorpi anti-igeni virali <strong>di</strong> membrana, in<br />
presenza <strong>di</strong> complemento<br />
Ige (reazioni anafilattiche)<br />
Autoanticorpi<br />
Complessi antigene-anticorpo<br />
Fenomeni <strong>di</strong> ipersensibilità ritardata<br />
Macrofagi, recettori Fc, complessi virus-anticorpi<br />
Aggiornato 15 ottobre 2007<br />
pagina 5 <strong>di</strong> 5