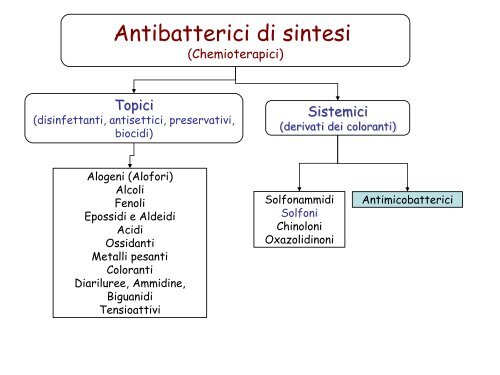
Antibatterici di sintesi
Antibatterici di sintesi
Antibatterici di sintesi
- No tags were found...
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
Topici: Alogeni (Alofori)Cloro Cl 2 Cl 2 +2NaClO→So<strong>di</strong>o clorito; So<strong>di</strong>o ipoclorito; Calcioipoclorito <strong>di</strong><strong>di</strong>drato; Litio ipoclorito;So<strong>di</strong>o ipoclorito triso<strong>di</strong>ofosfatoNaClO 2 ; NaClO;Ca(ClO) 2 . 2H 2 O; LiClO;NaOCl.4Na 3 P0 42ClO 2 +2NaClCl 2 +H 2 O→HClO+HClN-clorosolfonammi<strong>di</strong>Clorammina T; AlazoneOO S NNaClClOO S N ClRCONCl 2 +H 2 O→RCONHCl+HClOCH 3CH 3Diclorometilidantoina (Halane)N,N’-<strong>di</strong>cloroazo<strong>di</strong>carbonammi<strong>di</strong>naClorazo<strong>di</strong>nAcido Diclorocianurico;Acido Tricloroisocianurico(igienizzante piscine)Io<strong>di</strong>o; Polivinilpirrolidone-I 2(tintura <strong>di</strong> io<strong>di</strong>o, soluz. <strong>di</strong> Lugol,povidone)OOClNClNNClHNOI 2 (I 3- );NOOClClH 2 N N N NH 2ClNNONOClClNONNnOClMeccanismocomune:1. ossidazione deigruppi sulfidriliciproteici;2. alogenazione <strong>di</strong> Nammi<strong>di</strong>ci(amminici):3.Ad<strong>di</strong>zione a doppilegami <strong>di</strong> aci<strong>di</strong>grassi insat.
Topici: alcoli, fenolifenetil alcol; 1,1,1-tricloro-2-metil- 2-propanolo(clorobutanolo); glicoli,octilfenossi polietossietanolo[Octoxinolo, Octinolo-9 (n=8)]Monofenolifenolo (ctn 10% H 2 O);Cresoli (p>m,o; C 6 );4-allil-2-metossifenolo(Eugenolo);2-benzil-4-clorofenolo(clorofene, tirclosan)Parabeni (preservativi, 0.1-0.3%)ROH: C n >C n-1 >..C 1 (I i >I ii >III i );OHClClClOHO OHOnOHOHOHH 3 COHOH RO OHRClEtOH, Pr i OH (soluz. 60-90%),denaturazione grosseproteine.BzOH (soluz. 1-4%).Fenetil alcol G+/- (inibiz.<strong>sintesi</strong> mRNA e rip. DNA)Lister <strong>di</strong>l. 1:40 : denat.proteine, veleni cellulari>conc; inatt. enzim.
Topici: epossi<strong>di</strong>, aldei<strong>di</strong>, aci<strong>di</strong>Ossirano (ossido <strong>di</strong> etilene)OAttivo vs tutti i microorg at.a., tossico, cancerogeno,esplosivo (3-80% aria), mixCO 2 o CFC.R-Nu + HCOH → R-Nu-CH 2 OHFormaldeide (formalina, 37%H 2 O+ 10-15% MeOH);1,5-pentane<strong>di</strong>ale (glutaraldeide,2% pH 7.5-8)HOOHHOHOOHOOHHHPotente azione germicida,alchilazione <strong>di</strong> Nu <strong>di</strong> proteine,allergenica, cancerogena.OHOAcido acetico (1% H 2 O)Acido benzoicoPseudomonas, G-;Preservativo farmaci edalimenti
Topici: coloranti, <strong>di</strong>ariluree, biguani<strong>di</strong>N-(4-{bis[4-(<strong>di</strong>metilamino)fenil]metilene}cicloexa-2,5-<strong>di</strong>en-1-ilidene)-Nmetilmetanaminiocloruro(esametil-p-rosanilina cloruro,violetto <strong>di</strong> genziana);N-[7-(<strong>di</strong>metilamino)-3Hfenotiazin-3-ilidene]-Nmetilmetanamminiocloruro(blu <strong>di</strong> metilene)NNClNNOHHNSNNNClOHN<strong>Antibatterici</strong>(batteriostatici cistiti,uretriti), antimicotici,antidoti avvelen. CNN-(4-clorofenil)-N'-(3,4-<strong>di</strong>clorofenil)urea(triclocarban)4,4'-[propan-1,3-<strong>di</strong>ilbis(oxi)]bis(3-bromobenzencarboximmidammide) (<strong>di</strong>bromopropami<strong>di</strong>na)N',N'''''-etan-1,2-<strong>di</strong>ilbis[N-(4-clorofenil)-(immido<strong>di</strong>carbonimmido<strong>di</strong>ammide)] (clorexi<strong>di</strong>na, lenticontatto)ClClH 2 NHNNHHNOHNRNHHNClONHHNClN3HORNHNHNHNHNHNH 2ClAttivi vs G+; cfrantimalarici
Topici: tensioattiviTensioattivi cationici (G+),<strong>di</strong>struz membrana cellulareBenzalconio cloruro (C 12 H 25 ,C 14 H 29 , C 16 H 33 )Metilbenzetonio cloruro(<strong>di</strong>aperene)Esadecilpiri<strong>di</strong>nio clururo(cetilpiri<strong>di</strong>nio cloruro);SAR: ER>, log(l/C)=a+blog P +c(1ogP) 2DECIQUAM, Onamer M (lenticontatto)OCH 3ONClCH 315NTensioattivi cationici<strong>di</strong>struz membrana cellulare,denaturaz. enzimi e proteine,inib. trasp. cell.Acido dodecilbenzensolfonico(Oxiclorosene+HClO)H 3 C11O OS ONaTensioattivi amfoteriAlchil<strong>di</strong>(amminoetil)glicine
SistemiciSulfonammi<strong>di</strong> e Solfoni
ANTIBATTERICI CHINOLONICIHanno in comune un anello 3-carbossipiri<strong>di</strong>n-4-onico N-alchilato fusocon un secondo anello aromatico o eteroaromaticoIl primo AbC in commercio (1965) èl’acido nali<strong>di</strong>ssico (1,8-naftiri<strong>di</strong>na): usoclinico riservato al trattamento per viaorale <strong>di</strong> infezioni non complicate deltratto urinario (es. E. coli)NONOOHNon avendo elevata potenza antibatterica, usati ad alte dosi conincidenza elevata <strong>di</strong> effetti collaterali (rash e <strong>di</strong>sturbi GI e visivi)HNFNONOOHUsati <strong>di</strong> rado fino alla scoperta deiFUOROCHINOLONI, tra i quali siimpone la norfloxacina (1986): ampiospettro, attiva quanto molti AB
193919621958
OSSACINE DI PRIMA GENERAZIONEAttive verso i Gram negativi (non verso Ps. Aer.). Praticamente inattiveverso i Gram positivi. Prive <strong>di</strong> effetto sistemico.OOOOOHOOHNNONAcido nali<strong>di</strong>xico (Nali<strong>di</strong>xin)(1, 8- naftiri<strong>di</strong>na)Acido oxolinico(chinolina)OOOOOON NOHNNNNOHCinoxacina (Cinobac)(cinnolina)Acido piromi<strong>di</strong>co (Enteromix)(pirido[2, 3-d] pirimi<strong>di</strong>na)
OXACINE DI SECONDA GENERAZIONEAttive verso i Gram negativi (incluso Pseudomonas aer. e Proteus).Praticamente inattive verso i Gram positivi. Prive <strong>di</strong> effetto sistemico.OOOOHNOOOHONONNNMiloxacinaNAcido pipemi<strong>di</strong>co(Urotractin)OOOHNNRosoxacina
OXACINE DI TERZA GENERAZIONEAmpio spettro. Attive anche verso Pseudomonas e Proteus. Effetto sistemico.a ) FLUOROCHINOLONIOOOOOOFOHFOHFOHNNNNNNNHNNHNNorfloxacina(Noroxim)Pefloxacina(Peflacin)Enoxacina(Enoxen)FOOOHFOOOHFOOOHHNNNNNNNNCiprofloxacina(Ciproxin)AmifloxacinaFlumechina(benzo[ij]chinolizina)
) FLUOROCHINOLONI TRICICLICIFOOOHFOOOHHONNNNONNa<strong>di</strong>floxacina(benzochinolizina)Ofloxacina (Oflocin)(pirido [1, 2, 3-d, e]1, 4-benzossazina)FOOOHFOOOHNNSNNNONRufloxacina (Monos)(pirido [1, 2, 3-d, e] 1, 4-benzotiazina)Levofloxacina (Levoxacin)(pirido [1, 2, 3-d, e]1, 4-benzossazina)
c ) DIFLUOROCHINOLONIFOOOHFOOOHHNNFNNNFNCH 2 FLomefloxacina (Chimono)Fleroxacinad ) TRIFLUOROCHINOLONIH 2 NFOOOHFOOOHNNFHNNNFTosufloxacina (tosilato)FFTerafloxacina
FLUOROCHINOLONI CON ELEVATA ATTIVITA’ANTIBATTERICA CONTRO GRAM POSITIVIH 2 NFNClONOOHH 2 NHHFNONOFOHClinafloxacinaFTrovafloxacinaFOOOHH 2 NNClNFDU - 6859
FLUOROCHINOLONI DI RECENTE SVILUPPOFOOOHFOOOHHNNONHClHNNONHClGatifloxacina cloridrato(Tequin, in USA)Moxifloxacina cloridrato(Avalox)Efficaci per il trattamento quoti<strong>di</strong>ano <strong>di</strong> pazienti con polmonite contratta in comunità,riacutizzazioni batteriche <strong>di</strong> bronchite cronica o sinusite acuta. La gatifloxacina èstata approvata dalla FDA anche per il trattamento delle infezioni del tratto urinario eper la gonorrea.Gatifloxacina <strong>di</strong>sponibile sia per uso orale che evMoxifloxacina commercializzata solo per uso orale
Equilibrio acido-baseOHOOHO-OONC 2 H 5N +C 2 H 5Protone fortemente chelato
Proprietà <strong>di</strong> chelazione <strong>di</strong> ioni metallici polivalenti, formando complessipoco solubili (perdono efficacia)C 2 H 5NOOONC 2 H 5M + C 2 H 5OOOMOOONCu++ > Co ++ > Ni ++ > Zn ++ > Mn ++ > Mg ++ > Ca ++ > Ba ++La somministrazione <strong>di</strong> antiaci<strong>di</strong> e consumo <strong>di</strong> prodotticaseari subito dopo il farmaco è da evitare
Inibizione della DNA-girasi battericaOM +OOMOOMONC 2 H 5ON +C 2 H 5ON+C 2 H 5ONu(DNA)- H +Drug Drug - + Cu ++ Drug-Cu + + DNA Drug-DNA + Cu ++
SAR
Relazioni Struttura-Attività1. Attività Gram (-)NH 2R 5OOR 7FXNOHR 8R 1HNNGruppo ingombranteMIC ⇩
MECCANISMO D’AZIONEChinoloniFluorochinoloniDNASTOPDNA girasi(topoisomerasi II)DNA polimerasiREPLICAZIONETRASCRIZIONEDNARNARNA polimerasiIl bersaglio dei chinoloni e dei fluorochinoloni è laDNA-girasi batterica (topoisomerasi)
DNA-TOPOISOMERASI• Enzimi che trasformano il DNA dauna forma topologica in un’altraIAgiscono introducendorotture transitorie inuno dei due filamenti• Controllano eventi fondamentali:duplicazione, trascrizione,ricombinazione• I topoisomeri (= molecole <strong>di</strong> DNAidentiche che <strong>di</strong>fferiscono solo peril grado <strong>di</strong> superavvolgimento)sono caratterizzati dal “Numero <strong>di</strong>Legame” (DL)DL = DW + DT“Writhing” (= rotazioni)“Twisting” (= torsioni)IIAgiscono me<strong>di</strong>antetagli sui due filamentiDNA-girasi batterica è unaTOPOISOMERASI II, capace <strong>di</strong>introdurre superavvolgimentinegativi in una molecola <strong>di</strong> DNAchiusa, circolare, rilassata. Puòindurre circa 100superavvolgimenti/min
DNA-GIRASI BATTERICADue subunità che costituiscono il bersaglio per<strong>di</strong>versi antibioticiSubunità ASubunità BDimensione(dalton)105 000 95 000Locusgyr A (nal)gyr B (cou)Antibiotici cheagiscono sullasubunitàAc. nali<strong>di</strong>ssicoe ossolinicoCoumermicina A1e Novobiocina
MECCANISMO D’AZIONE DELLE OSSACINEInibizione della DNA girasi, enzima batterico che regola laconformazione del DNA in modo che esso sia opportunamenteconservato, svolto, replicato o trascritto, a seconda delle necessità.L’inibizione della DNA girasi rende inaccessibile l’acido nucleico delbatterio, e porta alla sua morte.L’uomo usa, per dare forma al suo DNA, la topoisomerasi II, unenzima analogo alla girasi che però non lega i chinoloni, almeno alledosi terapeutiche (il farmaco perciò non danneggia le celluledell’ospite).
Formazione della sovrapposizione a spirale negativa delDNA ad opera della DNA girasi (topoisomerasi II)Idrolisi <strong>di</strong> legami fosfo<strong>di</strong>estereiIntreccio in <strong>di</strong>rezione oppostadell’elica: superavvolgimento elicoidalenegativoIn<strong>di</strong>spensabile per l’avvio dei processi<strong>di</strong> replicazione e trascrizione
Modello per la formazione del legame fosfotirosinico tratopoisomerasi e DNAa) l’enzima rimane legato covalentemente in 3’ al DNAb) l’enzima rimane legato covalentemente in 5’ al DNAOOBOOBOO P OOOHOBOO P OOOOOBOOOOO POO OOBOBLe topoisomerasi si leganocovalentemente al DNAattraverso una tirosina.Questo legame èfacilmente scin<strong>di</strong>bile.Sostanzeantitopoisomerasistabilizzano questocomplesso nonpermettendo all’enzima <strong>di</strong>completare il suo ciclocatalitico.
DNA-girasi puòintrodurresuperavvolgimentinegativi nel DNAduplex invertendounsuperavvolgimentopositivoMg ++
Modello del legame tra chinolone e DNA proposto per ilmeccanismo <strong>di</strong> inibizione dell’enzima DNA girasiComplesso ternario: DNA-Girasi - DNA - Fluorochinolone
Norfloxacina
Nakamura model as illustrated by Heddleand Maxwell. (A(i)) and (A(ii)) illustrateintercalation of quinolonesin the bubbleregion of DNA followed by outwardrotation of the DNA bases, which are thenreplaced by the quinolone molecules. (B)illustrates the putative quinolone-bin<strong>di</strong>ngpocket at or near the junction of the GyrAand GyrB interface.Ciprofloxacina
FARMACOCINETICAAssorbiti bene per via oraleSi legano saldamente alle proteine plasmatiche:prolungamento dell’emivita; uso ristretto aicompartimenti privi <strong>di</strong> proteineTOSSICITA’ (effetti indesiderati)‣ Proconvulsivanti (specialmente quelli <strong>di</strong> prima generazione)‣ Diarrea, nausea, vomito in alcuni pazienti (quelli <strong>di</strong> secondagenerazione meglio tollerati)‣ Potenzialmente rischiosi nei primi mesi <strong>di</strong> gravidanza (acidosimetabolica e anemia emolitica)
FNH 2OOOHPhotochemistryO OFOHFOOOHHNNFNHNNFNNNFNFSparfloxacinlomefloxacinfleroxacin
SINTESIAcido ossolinicoOHNO 3OH 2 , PtO 2OOO NO 2O NH 2C 2 H 5 O-CH=CHC(COOC 2 H 5 ) 2OC 2 H 5 OOCCOOC 2 H 5D- C 2 H 5 OHONHOOHCOOC 2 H 5NaOH, DMFOOHCOOHOOCOOHONONONHC 2 H 5 IOOCOOH- HION
SINTESINorfloxacinaFCl NH 2+C 2 H 5 OCHCOOC 2 H 5COOC 2 H 5FClCOOC 2 H 5NH COOC 2 H 5OD , OFCOOC 2 H1. C 2 H 5 Br/NEt 352. NaOHFOCOOHClNHClNHNNH/ DFOCOOHHNNN
NITROFURANIIdrazoni del 5-nitrofurfuraleO 2 NOCH N R Spettro d’azione: gram+ e gram-, protozoi, alcuni miceti. Elevataefficacia antisettica. Meccanismo d’azione: Riduzione del gruppo NO 2 a NH 2 e/oNHOH da parte delle riduttasi batteriche e conseguente inibizionedella <strong>sintesi</strong> degli aci<strong>di</strong> nucleici Effetti tossici: intolleranza gastrica, fenomeni <strong>di</strong> sensibilizzazione,reazioni allergiche cutanee, depressione del midollo osseo
O 2 NOCH N RRUsoNitrofurossimaNitrofurazoneNifuraldazoneFuradrossileNitrofuradeneNitrofurantoina(Neo Furadantin)FurazolidoneFurmetossazoneOHNH CO NH 2NH CO CO NH 2CO NH 2NCH 2 CH 2 OHNOON NHNNOOOONHOFungicida nelle moniliasiBatteriostatico, batteric. per uso topicoVeterinarioAntibatterico intestinale veterinarioAntibatterico urinario (toss. renale)Antibatterico intestinale antitrichomonas(uso veter.)FuraltadoneNCH 3OONOAntibatterico sistemico ma tossico sulfegato (uso veter.)
SINTESI NITROFURANIInterme<strong>di</strong>o chiave: 5-nitrofurfurale <strong>di</strong>acetatoOCHO(CH 3 CO) 2 OOH 3 C COO NO 2HO 2 NOCH(OCOCH 3 ) 2OCOCH 3- CH 3 COOHO 2 NOCH(OCOCH 3 ) 2
NITROFURANTOINAFuradantin ® , Nitrex ® , Ivanta<strong>di</strong>n ® , Ceduran ® , ecc.(1) Sintesi <strong>di</strong> 1-amminoidantoina, per ciclocondensazione della semicarbazide dell’ac. aceticoH 2 N NH 2KNCO+ClCH 2 COOHH 2 N- HClCH 2 COOHN CO NH 2H 2 N NH CH 2 COOHH +H 2 N N- H 2 OOONH(2) Formazione dell’idrazone del 5-nitrofurfuraleOO 2 NOCH(OCOCH 3 ) 2 + H 2 N N NHO- 2 CH 3 COOHOO 2 NOCH N N NHO
NITROFURANTOINA Attiva contro gram+ e gram- Chemioterapico per il trattamento <strong>di</strong> infezioni dellevie urinarie, quando i reni non siano compromessi. Effetti collaterali più comuni: nausea e vomito. Perridurre i rischi <strong>di</strong> irritazione allo stomaco deve essereassunta durante i pasti. Effetti collaterali più gravi(come <strong>di</strong>fficoltà <strong>di</strong> respirazione, stor<strong>di</strong>mento e ancheittero) sono rari.
NIFURATELClOCH 3 SHCl S CH 3OHH 2 N-NH 2- HClH 2 N NHOHS CH 3OC(OC 2 H 5 ) 2- 2 C 2 H 5 OHH 2 NNOCH 2 S CH 3OO 2 NOCH(OCOCH 3 ) 2- 2 CH 3 COOHO 2 NOCHNNOCH 2 S CH 3O